β-葡萄糖转移酶的荧光生物传感器及检测方法与应用与流程
 2021-02-02 18:02:05|
2021-02-02 18:02:05| 352|
352| 起点商标网
起点商标网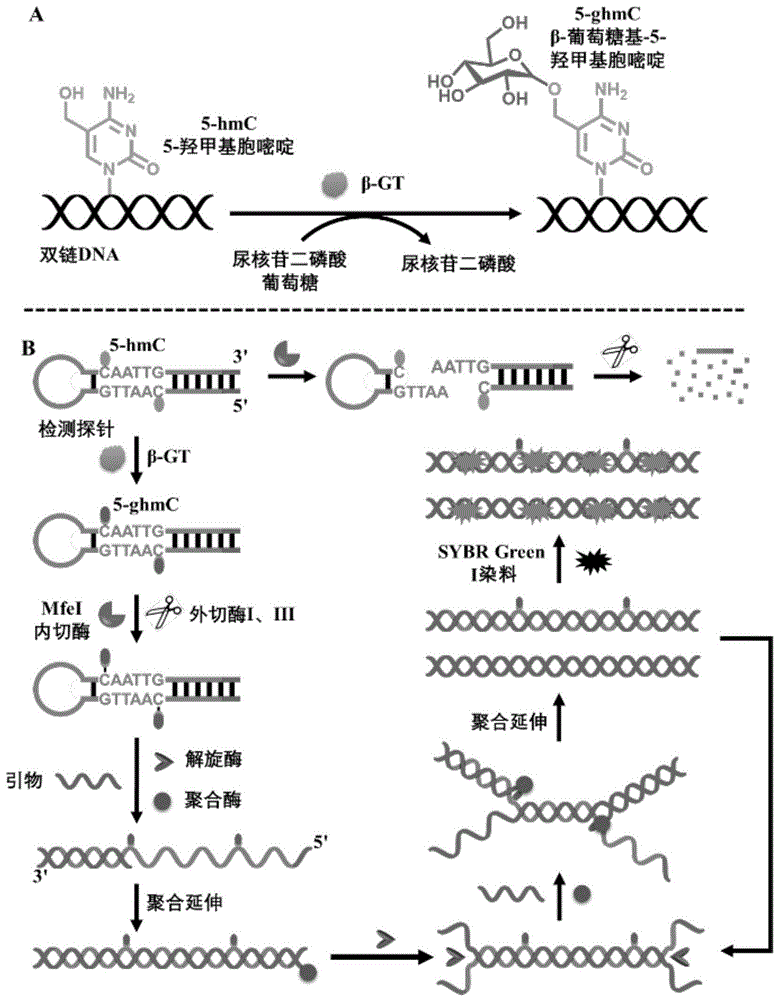
本发明属于生物分析技术领域,涉及β-葡萄糖转移酶的荧光生物传感器及检测方法与应用。
背景技术:
公开该背景技术部分的信息仅仅旨在增加对本发明的总体背景的理解,而不必然被视为承认或以任何形式暗示该信息构成已经成为本领域一般技术人员所公知的现有技术。
β-葡萄糖转移酶(β-gt)是一种dna修饰酶,它催化尿核苷二磷酸葡萄糖(udp-葡萄糖)转移到5-羟甲基胞嘧啶(5-hmc)的羟基上,从而形成β-葡萄糖基-5-羟甲基胞嘧啶(5-ghmc)。在噬菌体中,经由β-gt催化的5-hmc糖基化是阻止噬菌体dna被宿主细菌体内核酸酶消化的关键保护机制,此外,5-hmc糖基化还与噬菌体特异性转录和基因表达的控制密切相关。在布氏锥虫中,β-gt可通过调节不同的表面糖蛋白的表达,阻止宿主细胞对其进行免疫识别和中和。除了以上基本的生物学功能外,β-gt现已成为哺乳动物细胞中5-hmc表观遗传分析的关键性辅助酶。5-hmc被认为是继腺嘌呤(a),胸腺嘧啶(t)、鸟嘌呤(g)、胞嘧啶(c)和5-甲基胞嘧啶(5-mc)之外的“第六碱基”,在dna去甲基化、体细胞重编程、胚胎发育和疾病发生等方面具有潜在的作用。然而,目前5-hmc的全部生物学功能还未被完全揭示,其中一个重要的原因是5-hmc在细胞内的丰度极低(比5-mc低10-100倍),因此很难被准确地捕获和检测。β-gt通过针对5-hmc进行的高选择性糖基化反应,可将带有放射性标记、生物素标记、荧光基团标记等的功能性分子引入到5-hmc上,极大地促进了5-hmc鉴定检测方法的发展。因此,有效检测和评价β-gt的活性对于进一步揭示其生物学功能、推动5-hmc相关的表观遗传学研究具有重要意义。
传统的β-gt检测方法包括基于毛细管区带电泳和基于放射性同位素标记(udp-[14c]-葡萄糖或udp-[3h]-葡萄糖)的方法,它们通过直接监测β-gt酶的反应产物udp或5-ghmc用于β-gt活性的检测,但程序繁多、仪器相对昂贵、底物具有放射性危险等缺点极大地限制了它们的广泛应用。近来,基于电化学、光电化学和电化学发光检测的新型β-gt生物传感器已经发展起来,具有检测成本低、重现性好、选择性高的优点;然而,经过发明人研究发现,这些生物传感器大多需要相对复杂的固定、洗涤和分离步骤,制备和功能化纳米材料(包括磁性颗粒、二硫化钨纳米片、金纳米颗粒和金纳米团簇等)的过程也比较繁琐;此外,由于这些方法本身原因所造成的高背景,同时缺乏适当的信号放大策略,导致这些生物传感器的灵敏度相对较低。因此,开发简单灵敏的β-gt生物传感器仍然是迫切需要的。
技术实现要素:
为了解决现有技术的不足,本发明的目的是提供β-葡萄糖转移酶的荧光生物传感器及检测方法与应用,本发明提供的荧光生物传感器对β-葡萄糖转移酶的灵敏度高、特异性好、检测时间短。
为了实现上述目的,本发明的技术方案为:
一方面,一种β-葡萄糖转移酶的荧光生物传感器,包括检测探针、内切酶、外切酶、解旋酶、聚合酶、引物dna、sybr染料;
所述检测探针为单链dna形成的发夹结构,检测探针具有能够被内切酶识别并切割的识别位点,所述识别位点含有5-羟甲基胞嘧啶,所述单链dna的两端采用硫代磷酸酯修饰;
所述检测探针被内切酶识别并切割后,能够被外切酶进一步切割;
所述解旋酶能够将发夹结构的茎部解旋;
所述引物dna与所述单链dna互补后,在聚合酶的作用下形成双链dna;
所述sybr染料能够与所述双链dna进行特异性结合。
本发明提供的荧光生物传感器,在β-gt存在时,催化发夹结构的检测探针的5-hmc糖基化转化为β-葡萄糖基-5-羟甲基胞嘧啶(5-ghmc),这可以保护发夹结构的检测探针免受内切酶的切割,进而阻止随后外切酶的消化;接下来,留存下来的发夹结构的检测探针可作为指数依赖解旋酶恒温扩增反应(hda)扩增的模板,通过引物dna和聚合酶的作用就可以生成大量双链dna产物,而利用sybr染料可以实时、免标记地检测到这些产物。此外,通过使用单一引物消除了引物二聚体引发的非特异性扩增;同时,核酸酶对未糖基化的发夹结构的检测探针的彻底消化能够使检测过程中的背景信号接近于零。因而本发明构建的传感器具有良好的特异性和较高的灵敏度。
另一方面,一种上述β-葡萄糖转移酶的荧光生物传感器在检测β-葡萄糖转移酶活性的应用。
第三方面,一种β-葡萄糖转移酶的检测方法,提供上述β-葡萄糖转移酶的荧光生物传感器;
将检测探针与含有β-葡萄糖转移酶的待测溶液进行糖基化反应,向糖基化反应体系中添加内切酶进行孵育处理,再添加外切酶进行消化处理,将消化后的产物与解旋酶、聚合酶、引物dna进行依赖解旋酶恒温扩增反应,采用sybr染料进行染色,进行荧光检测。
第四方面,一种上述β-葡萄糖转移酶的荧光生物传感器在筛选β-葡萄糖转移酶抑制剂中的应用。
第五方面,一种β-葡萄糖转移酶的检测试剂盒,包括上述β-葡萄糖转移酶的荧光生物传感器、缓冲液。
本发明的有益效果为:
1.本发明构建的荧光生物传感器无需引入纳米材料,因此避免了复杂的材料制备和功能化过程,也无需任何固定、洗涤和分离步骤,操作简单,且反应条件恒温均相;同时,荧光信号由sybrgreeni染料以免标记的方式获得,也避免了荧光标记探针的合成。
2.本发明利用构建荧光生物传感器的检测方法在30分钟内即可达到较好的信号扩增效果,此外,该荧光生物传感器还通过使用单一引物消除了引物二聚体引发的非特异性扩增;核酸酶对未糖基化的检测探针的彻底消化能够使背景信号接近于零。
3.本发明构建的荧光生物传感器结合了hda的高效信号放大和接近于零的背景信号,获得了2.79×10-5单位每毫升的检测限,灵敏度相比其他β-gt活性检测的方法提高了三个数量级以上。同时,该荧光生物传感器还可进一步应用于β-gt抑制剂的筛选,为深入了解β-gt的生物学功能、促进β-gt相关的表观遗传学研究提供了有力的工具。
4.本发明构建的荧光生物传感器具有较高的检测特异性,由于只有5-hmc可被β-gt特异性糖基化,而其他相似碱基如c碱基、5-mc等均不会发生糖基化,因此带有5-hmc的检测探针可将β-gt的活性信号进行特异性地识别和转换;此外,内切酶和外切酶可以彻底消化未糖基化的检测探针,产生接近于零的背景信号。
附图说明
构成本发明的一部分的说明书附图用来提供对本发明的进一步理解,本发明的示意性实施例及其说明用于解释本发明,并不构成对本发明的不当限定。
图1为本发明实施例用于β-gt酶活性分析的生物传感器示意图。
图2为本发明实施例用12%非变性聚丙烯酰胺凝胶电泳(page)分析酶切消化的产物表征图。泳道m:dna标准分子量对照物;泳道1:100纳摩尔每升的检测探针+10个单位每毫升的β-gt+60个单位的mfei内切酶+10个单位的外切酶i+10个单位的外切酶ⅲ;泳道2:100纳摩尔每升的检测探针+60个单位的mfei内切酶+10个单位的外切酶i+10个单位的外切酶ⅲ。
图3为本发明实施例验证依赖解旋酶恒温扩增反应的产物表征图。(a)分别在存在1个单位每毫升的β-gt(泳道1)和不含β-gt(泳道2)的条件下用2%的琼脂糖凝胶对hda反应的扩增产物进行电泳分析。泳道m是dna标准分子量对照物。(b)分别在存在1个单位的β-gt(实线)和不含β-gt(点线)的条件下对hda反应进行实时荧光测量。
图4为本发明实施例灵敏度实验的结果表征图。(a)不同浓度的β-gt对应的实时荧光曲线(从a到i分别为0,1×10-4,5×10-4,1×10-3,0.005,0.01,0.05,0.1,1个单位每毫升)。(b)在1×10-4~1个单位每毫升的浓度范围内,荧光强度与β-gt浓度的对数之间的线性关系。误差棒表示三次重复实验的标准偏差。
图5为本发明实施例特异性实验的结果表征图。(a)用于β-gt酶活性分析的生物传感器对不同种类的酶的荧光响应。酶的浓度均为1个单位每毫升。(b)用于β-gt酶活性分析的生物传感器对不同探针的荧光响应。所有探针的浓度均为200纳摩尔每升。误差棒表示三次重复实验的标准偏差。
图6本发明实施例不同浓度的尿苷5'-二磷酸(a)和4-苯基咪唑(b)对β-gt活性的抑制效果表征图。误差棒表示三次重复实验的标准偏差。
具体实施方式
应该指出,以下详细说明都是示例性的,旨在对本发明提供进一步的说明。除非另有指明,本文使用的所有技术和科学术语具有与本发明所属技术领域的普通技术人员通常理解的相同含义。
需要注意的是,这里所使用的术语仅是为了描述具体实施方式,而非意图限制根据本发明的示例性实施方式。如在这里所使用的,除非上下文另外明确指出,否则单数形式也意图包括复数形式,此外,还应当理解的是,当在本说明书中使用术语“包含”和/或“包括”时,其指明存在特征、步骤、操作、器件、组件和/或它们的组合。
鉴于现有检测β-gt活性的方法存在高背景、灵敏度低、时间长等缺陷,本发明提出了β-葡萄糖转移酶的荧光生物传感器及检测方法与应用。
本发明的一种典型实施方式,提供了一种β-葡萄糖转移酶的荧光生物传感器,包括检测探针、内切酶、外切酶、解旋酶、聚合酶、引物dna、sybr染料;
所述检测探针为单链dna形成的发夹结构,检测探针具有能够被内切酶识别并切割的识别位点,所述识别位点含有5-羟甲基胞嘧啶,所述单链dna的两端采用硫代磷酸酯修饰;
所述检测探针被内切酶识别并切割后,能够被外切酶进一步切割;
所述解旋酶能够将发夹结构的茎部解旋;
所述引物dna与所述单链dna互补后,在聚合酶的作用下形成双链dna;
所述sybr染料能够与所述双链dna进行特异性结合。
本发明提供的荧光生物传感器,在β-gt存在时,催化发夹结构的检测探针的5-hmc糖基化转化为5-ghmc,这可以保护发夹结构的检测探针免受内切酶的切割,进而阻止随后外切酶的消化;接下来,留存下来的发夹结构的检测探针可作为指数hda扩增的模板,通过引物dna和聚合酶的作用就可以生成大量双链dna产物,而利用sybr染料可以实时、免标记地检测到这些产物。此外,通过使用单一引物消除了引物二聚体引发的非特异性扩增;同时,核酸酶对未糖基化的发夹结构的检测探针的彻底消化能够使检测过程中的背景信号接近于零。因而本发明构建的传感器具有良好的特异性和较高的灵敏度。
该实施方式的一些实施例中,发夹结构的5'端与3'端平齐。
该实施方式的一些实施例中,所述内切酶为mfei内切酶,识别位点为hmcaattg,hmc为5-羟甲基胞嘧啶。mfei内切酶的识别位点为5'-caattg-3',其中的c碱基是胞嘧啶、5-甲基胞嘧啶、5-羟甲基胞嘧啶时,该酶均可以切割序列,只有糖基化后的5-羟甲基胞嘧啶5-ghmc可以阻止该酶的切割。
该实施方式的一些实施例中,识别位点位于发夹结构的茎部。
该实施方式的一些实施例中,所述外切酶为外切酶i和外切酶iii。
该实施方式的一些实施例中,所述sybr染料为sybrgreeni染料。
该实施方式的一些实施例中,检测探针的序列为agtatgggactttccgtctccaattgactacagagacagatacttaatactagtcaattggagacggaaagtcccatact;
引物dna的序列为agtatgggactttccgtctccaattgacta。
本发明的另一种实施方式,提供了一种上述β-葡萄糖转移酶的荧光生物传感器在检测β-葡萄糖转移酶活性的应用。
本发明的第三种实施方式,提供了一种β-葡萄糖转移酶的检测方法,提供上述β-葡萄糖转移酶的荧光生物传感器;
将检测探针与含有β-葡萄糖转移酶的待测溶液进行糖基化反应,向糖基化反应体系中添加内切酶进行孵育处理,再添加外切酶进行消化处理,将消化后的产物与解旋酶、聚合酶、引物dna进行依赖解旋酶恒温扩增反应,采用sybr染料进行染色,进行荧光检测。
该实施方式的一些实施例中,糖基化反应的温度为35~40℃。糖基化反应的时间为50~70分钟。
该实施方式的一些实施例中,孵育处理的温度为35~40℃。孵育处理的时间为3.5~4.5小时。
该实施方式的一些实施例中,消化处理的温度为35~40℃。消化处理的时间为1.5~2.5小时。
该实施方式的一些实施例中,消化处理后加热至75~85℃处理,然后进行依赖解旋酶恒温扩增反应。
本发明的第四种实施方式,提供了一种上述β-葡萄糖转移酶的荧光生物传感器在筛选β-葡萄糖转移酶抑制剂中的应用。
本发明的第五种实施方式,提供了一种β-葡萄糖转移酶的检测试剂盒,包括上述β-葡萄糖转移酶的荧光生物传感器、缓冲液。
为了使得本领域技术人员能够更加清楚地了解本发明的技术方案,以下将结合具体的实施例详细说明本发明的技术方案。
实施例
β-gt活性检测:为了发生检测探针内5-hmc的糖基化反应,将1微升不同浓度的β-gt在含有80微摩尔每升的尿核苷二磷酸葡萄糖(udp-葡萄糖)、50毫摩尔每升的醋酸钾、20毫摩尔每升的三羟甲基氨基甲烷-醋酸、10毫摩尔每升的醋酸镁和100微克每毫升bsa的反应缓冲液中与200纳摩尔每升的发夹结构的检测探针混合,于37℃恒温孵育1个小时。随后,添加60个单位的mfei内切酶,并将反应体系调整至15微升,在37℃恒温条件下孵育4个小时。然后在37℃下用10个单位的外切酶i和10个单位的外切酶iii消化30分钟,将未被糖基化的探针完全消化。在80℃加热20分钟终止外切酶活性后,根据制造商提供的说明书,使用
检测探针由5'端至3'端的序列为a*g*tatgggactttccgtctchmcaattgactacagagacagatacttaatactagthmcaattggagacggaaagtcccata*c*t,其中*代表硫代磷酸酯修饰,见seqidno.1。
引物dna由5'端至3'端的序列为agtatgggactttccgtctccaattgacta,见seqidno.2。
凝胶电泳:使用12%的非变性聚丙烯酰胺凝胶电泳(page)分析消化产物,在1×的tbe缓冲液(含9毫摩尔每升的三羟甲基氨基甲烷-盐酸、9毫摩尔每升的硼酸和0.2毫摩尔每升的edta,ph=7.9)中、室温、110v的恒定电压下电泳50分钟,使用sybrgold染料对dna条带进行染色。使用2%的琼脂糖凝胶电泳分析hda扩增反应的产物,在1×的tae缓冲液(含40毫摩尔每升的三羟甲基氨基甲烷-醋酸和2毫摩尔每升的edta,ph=8.0)中、室温、110v的恒定电压下电泳80分钟,用sybrgreeni染料进行染色。
β-gt活性抑制实验:为了评估β-gt活性抑制剂(尿苷5'-二磷酸和4-苯基咪唑)对β-gt活性的影响,将不同浓度的抑制剂分别与10个单位每毫升的β-gt在室温下预孵育10分钟制成预混液;然后将1微升的预混液加入到含有200纳摩尔每升的发夹结构的检测探针、80微摩尔每升的尿核苷二磷酸葡萄糖、50毫摩尔每升的醋酸钾、20毫摩尔每升的三羟甲基氨基甲烷-醋酸、10毫摩尔每升的醋酸镁和100微克每毫升bsa的10微升反应混合液中。接下来的检测流程与上述β-gt活性检测程序相同。
实验原理:如图1所示,发夹结构的检测探针既是β-gt的识别探针,也是hda扩增反应的模板dna。当β-gt存在时,它可以将尿核苷二磷酸葡萄糖上的β-d-葡萄糖残基催化转移到位于发夹结构的检测探针茎部的mfei内切酶识别位点(5'-hmcaattg-3')处的5-羟甲基胞嘧啶(5-hmc)上,形成β-葡萄糖基-5-羟甲基胞嘧啶(5-ghmc),这能有效地保护探针不被mfei内切酶切割;而由于发夹结构的检测探针的3'末端和5'末端均采用了硫代磷酸酯修饰,因此完整的发夹结构的检测探针在外切酶i和外切酶iii存在时可免于被消化。此后加入解旋酶将发夹结构的检测探针的茎部解旋,使其能与引物dna进行杂交;最后dna聚合酶延伸引物dna形成完整的双链dna,双链dna的每一条链又可以作为新的扩增模板来引发新一轮的探针延伸反应,最终实现指数式的信号放大,产生大量的双链dna,通过特异性结合双链dna的染料sybrgreeni就能以免标记的方式对此过程实现实时监测。相反,没有β-gt存在时,发夹结构的检测探针茎部mfei内切酶识别位点处的5-hmc不会发生糖基化,加入mfei内切酶后检测探针将被切割而暴露出新的末端,从而被外切酶i和外切酶iii完全消化,hda扩增反应因缺乏模版dna而无法启动,输出接近于零的背景信号。值得注意的是,该生物传感器检测灵敏度高、无需复杂的固定化、洗涤和分离步骤,也无需制备功能性纳米材料,可以实现简单、恒温、均相的β-gt活性检测。
1.原理的可行性验证
5-hmc糖基化介导的酶切保护是本实施例设计的生物传感器准确识别检测β-gt的基础。因此本实施例首先使用12%的非变性聚丙烯酰胺凝胶电泳(page)验证了这一步。如图2所示,在β-gt存在的情况下,经mfei内切酶、外切酶i和外切酶ⅲ处理后仍然可以观察到一条明显的检测探针的条带(图2,泳道1),这说明β-gt催化的5-hmc糖基化可以有效地保护探针不被酶切消化。相反,当没有β-gt存在时,经mfei内切酶、外切酶i和外切酶ⅲ处理后的对照组中未观察到检测探针的条带(图2,泳道2),这说明在没有β-gt的情况下,没有5-ghmc保护的探针会被核酸酶完全消化。
本实施例还使用2%的琼脂糖凝胶电泳验证了由β-gt催化的5-hmc糖基化触发的依赖解旋酶恒温扩增反应(hda)的产物。如图3a所示,在β-gt存在时(图3a,泳道1)观察到明显的hda扩增反应产物条带,这说明发生了β-gt催化的5-hmc糖基化触发的hda扩增反应。相比之下,在没有β-gt存在的情况下,没有明显的条带产生(图3a,泳道2),这表明没有β-gt时就不会发生hda扩增反应。与此同时,本实施例对hda扩增反应的荧光信号也进行了实时监测,如图3b所示,在β-gt存在时,荧光强度迅速增加,并在25分钟内达到稳定(图3b,实线)。相反,在没有β-gt存在的对照组中没有明显的荧光信号产生,也没有观察到明显的背景信号(图3b,点线)。接近于零的背景信号可归结于以下两个原因:(1)非糖基化的检测探针被核酸酶完全消化;(2)仅使用了一种引物,消除了因形成引物二聚体而引发的非特异性扩增。以上这些结果表明,本实施例设计的生物传感器可用于β-gt活性的定量检测。
2.灵敏度实验
为了研究本实施例所构建的生物传感器的检测灵敏度,本实施例在优化的实验条件下测量了不同浓度β-gt对应的实时荧光信号。如图4a所示,随着β-gt的浓度从0增加到1个单位每毫升,实时荧光强度也单调增加,这表明β-gt浓度与hda扩增反应产生的信号呈正相关。同时,荧光强度在1×10-4至1单位每毫升的浓度范围内与β-gt浓度的对数呈现线性相关(图4b),线性相关系数r2为0.9879,线性回归方程为f=469.03+102.25log10c,其中f为实时荧光强度,c为β-gt的浓度(单位每毫升)。检测限(lod)为2.79×10-5单位每毫升,与基于电化学检测(0.27单位每毫升)和基于电化学发光检测(0.04单位每毫升)的传感器相比,本实施例所构建的生物传感器的灵敏度分别提高了9677倍和1434倍。该生物传感器的高灵敏度主要是由于:(1)通过β-gt催化的5-hmc糖基化反应将β-gt的活性信号特异性转换为了可扩增的核酸信号;(2)在接近于零的背景信号下进行的hda扩增反应实现了高效的信号放大。
3.特异性实验
为了探讨本实施例构建的生物传感器的特异性,本实施例测量了不同的干扰酶(hhai限制性核酸酶hhai、尿嘧啶dna糖基化酶udg和碱性磷酸酶alp)对应的实时荧光信号。hhai酶可识别并切割序列为5'-gcgc-3'的双链dna;udg是一种从dna中切除尿嘧啶碱基的dna糖基化酶;alp可催化去除多种磷酸化底物中的磷酸基团。理论上,hhai、udg、alp或经过热失活的β-gt都无法催化检测探针内5-hmc的糖基化,因此探针会被切割和消化,故而无法发生hda扩增反应,检测不到明显的荧光信号。如图5a所示,在hhai、udg、alp存在时均未检测到明显的荧光信号,信号值与仅添加反应缓冲液的对照组相似。当存在β-gt时,检测到显著增高的荧光信号。此外,当使用经过热处理而失活的β-gt时,荧光信号与对照组相似。因此,本实施例构建的生物传感器对β-gt具有良好的特异性响应。
为了评估该生物传感器对底物的特异性,本实施例测量了c-探针和5-mc探针对应的实时荧光信号,在c-探针和5-mc探针中,检测探针上的5-hmc碱基分别被胞嘧啶(c碱基)和5-甲基胞嘧啶(5-mc碱基)所取代。如图5b所示,仅检测探针检测到了较高的荧光信号。这可以解释为:由于缺乏5-hmc碱基,c-探针和5-mc探针均不能被β-gt糖基化,因此这两种探针将被核酸酶完全切割和消化,无法产生hda扩增反应产物,没有明显的荧光信号。
4.抑制剂实验
本实施例使用尿苷5'-二磷酸和4-苯基咪唑作为抑制剂模型研究了该生物传感器在抑制剂筛选方面的性能。如图6a所示,随着尿苷5'-二磷酸的浓度从1微摩尔每升增加到50微摩尔每升,β-gt的相对活性逐渐降低,半抑制浓度ic50(使β-gt活性降低50%时所需的抑制剂浓度)为10.12微摩尔每升,这与基于金纳米团簇的电化学发光分析得到的结果(13.54微摩尔每升)相一致。类似地,随着4-苯基咪唑的浓度从1微摩尔每升增加到10微摩尔每升,β-gt的相对活性也呈现剂量依赖性降低(图6b)。半抑制浓度ic50计算为3.51微摩尔每升,与基于金纳米颗粒的电化学发光分析得到的结果(4.75微摩尔每升)相当。这些结果表明本实施例所构建的生物传感器可用于β-gt抑制剂的筛选,在靶向β-gt的抗病毒药物和抗寄生虫药物的研发方面具有巨大潜力。
以上所述仅为本发明的优选实施例而已,并不用于限制本发明,对于本领域的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
sequencelisting
<110>山东师范大学
<120>β-葡萄糖转移酶的荧光生物传感器及检测方法与应用
<130>
<160>2
<170>patentinversion3.3
<210>1
<211>80
<212>dna
<213>人工序列
<400>1
agtatgggactttccgtctccaattgactacagagacagatacttaatactagtcaattg60
gagacggaaagtcccatact80
<210>2
<211>30
<212>dna
<213>人工序列
<400>2
agtatgggactttccgtctccaattgacta30
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询



 商标分类
商标分类  商标转让
商标转让 



