一种TaqMan探针荧光定量PCR检测伯氏考克斯体的方法与应用与流程
 2021-02-02 17:02:00|
2021-02-02 17:02:00| 398|
398| 起点商标网
起点商标网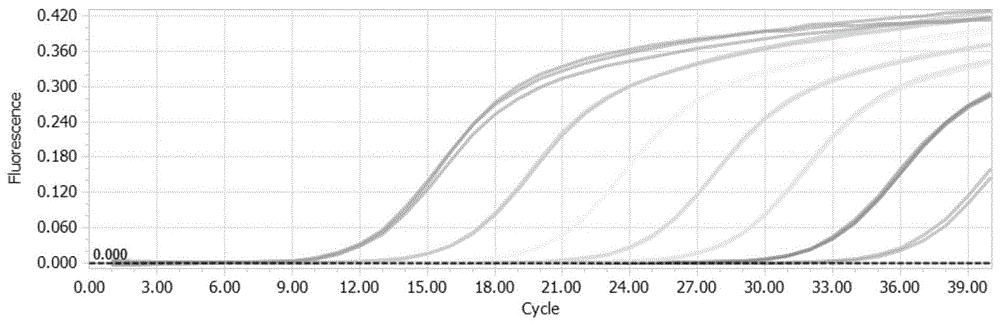
本发明涉及生物检测
技术领域:
,尤其涉及一种伯氏考克斯体的实时荧光定量pcr检测试剂盒与检测方法。
背景技术:
:伯氏考克斯体(coxiellaburnetii)是导致免疫抑制个体发病率和死亡率的主要诱因。伯氏考克斯体是一种无外壳的双链dna病原体,伯氏考克斯体对呼吸道、胃肠道、尿道和膀胱、眼、肝脏等均可感染,人伯氏考克斯体约1/3的已知血清型通常与人类疾病相关,但一种血清型可引起不同的临床疾患;相反,不同血清型也可引起同一种疾患。伯氏考克斯体(coxiellaburnetii)为专性吞噬细胞内寄生的革兰阴性小杆菌。该菌对外界环境抵抗力强,对人和动物有极强的感染力,可通过气溶胶扩散经呼吸道进入体内导致人及动物发生感染并导致q热。q热是一种呈世界性分布的人兽共患病,在我国分布广泛。人类q热分为急性和慢性两种类型,急性q热以发热、头痛、肌肉酸痛为主要症状,并常伴有肺炎发生,部分患者还可发生肝炎、心肌炎甚至脑膜炎。如果急性q热未得到及时或彻底治疗可转变为慢性,引起慢性肝炎、心内膜炎、骨髓炎等。此病原体分离与鉴定的方法主要为:病原体的分离培养,标本应尽早从感染部位采集。采集患者咽喉分泌物、脑脊液、肺灌洗液等,加抗生素处理过夜,离心取上清接种敏感细胞(293、hep-2或hela细胞等),37℃孵育后可观察到典型cpe,即细胞变圆、团聚、有拉丝现象,最突出的表现是许多病变细胞聚在一起呈葡萄串状。病原体抗原抗体鉴定,用荧光标记的抗六邻体抗体与分离培养细胞作用来鉴定伯氏考克斯体,也可用血凝抑制(hemoagglutinationinhibition,hi)试验或中和试验(neutralizationtest,nt)检测属和组特异性抗原并鉴定病原体的血清型。然而常规的检测特异性不强,灵敏度也不高。目前还没有伯氏考克斯体的检测试剂盒的相关报道。技术实现要素:本发明的目的在于克服现有技术的缺陷,提供了一种伯氏考克斯体的实时荧光定量pcr检测试剂盒与检测方法,试剂盒特异性良好,灵敏度高,最低检测极限达到1拷贝/ul。本发明是这样实现的:本发明的目的之一在于提供一种伯氏考克斯体的实时荧光定量pcr检测引物对和探针,所述引物对包括:上游引物的序列如seqidno.1所示;下游引物的序列如seqidno.2所示;所述探针的序列如seqidno.3所示,所述探针5’端标记荧光基团,3’端标记荧光淬灭基团。优选地,所述探针的5’端标记的荧光基团为有机荧光染料或量子点无机染料中的任一种,所述探针3’端标记猝灭基团为有机染料的任一种或者金纳米粒子。更为优选地,所述荧光基团包括为fam、vic、hex、trt、cy3、cy5、rox、joe和texasred中的一种,所述猝灭基团包括tamra、dabcyl、mgb、bhq-1、bhq-2和bhq-3中的一种。本发明的目的之二在于提供一种伯氏考克斯体的实时荧光pcr检测试剂盒,所述试剂盒包括所述的实时荧光pcr检测引物对和探针。优选地,所述试剂盒还包括:阳性对照品:阳性标准的dna;阴性对照品。本发明的目的之三在于提供所述的实时荧光pcr引物对和探针、以及所述的试剂盒在伯氏考克斯体上的用途。本发明的目的之四在于提供一种伯氏考克斯体的实时荧光pcr检测方法,利用所述的伯氏考克斯体的实时荧光pcr检测引物对和探针进行实时荧光pcr扩增。具体地,包括如下步骤:步骤1、从样品中提取dna为模板;步骤2、配制扩增反应体系进行实时荧光pcr扩增得到扩增曲线,所述扩增反应体系包括所述模板、以及所述的伯氏考克斯体的实时荧光pcr检测引物对和探针;步骤3、对所述扩增曲线进行分析,并作出判断。优选地,所述步骤2中扩增反应体系具体包括:权利要求1所述的伯氏考克斯体的实时荧光pcr检测引物对和探针、enzymemix、5×pcrbuffer;扩增程序为:95℃预变性2min;95℃变性15s,64℃退火30s,60℃1min,共40个循环。优选地,所述步骤3中具体判断规则为:当ct≤35时,判断样品为伯氏考克斯体阳性;当35<ct≤40时,重复一次实验,如果ct还是在此范围之内或小于35就判断样品为伯氏考克斯体阳性,否则判断样品为伯氏考克斯体阴性;当ct>40时,判断样品为伯氏考克斯体阴性。与现有技术相比,本发明具有如下优点和效果:1、本发明提供的伯氏考克斯体的实时荧光pcr检测引物对、探针、试剂盒及检测方法,在对核酸序列分析的基础上,利用生物信息学方法筛选伯氏考克斯体区别于其他病毒所特有的核酸序列区域,设计了一套特异性pcr引物和taqman探针,建立了伯氏考克斯体的实时荧光定量pcr鉴别检测试剂盒,试剂盒特异性良好,仅能检测伯氏考克斯体,而不能检测其他病毒病原。2、本发明提供的伯氏考克斯体的实时荧光pcr检测试剂盒,灵敏度高,最低检测极限达到1拷贝/ul;快速、高效扩增,检测时间仅50min左右;结果判定简便,通过扩增曲线有无即可进行结果的判定。附图说明图1为本发明中荧光定量检测阳性标准品的扩增曲线;图中的曲线从左到右分别表示倍比稀释后的标准品浓度,依次分别为1×107拷贝/ul、1×106拷贝/ul、1×105拷贝/ul、1×104拷贝/ul、1×103拷贝/ul、1×102拷贝/ul、1×101拷贝/ul;图2为本发明中荧光定量检测阳性标准品的标准曲线;图中横坐标对应标准品起始浓度的对数值,即从左到右依次分别对应标准品浓度1×101拷贝/ul~1×107拷贝/ul;纵坐标为其对应的ct值;图3为本发明中荧光定量检测方法的特异性试验结果;图4为本发明中荧光定量检测方法的灵敏度试验结果;图5为本发明应用例中30份伯氏考克斯体阳性标本荧光定量pcr扩增曲线;图6是本发明应用例中18份伯氏考克斯体阳性标本荧光定量pcr扩增曲线。具体实施方式实施例1伯氏考克斯体的实时荧光定量pcr检测引物对和探针的设计及筛选1、利用blastn本地比对软件,将伯氏考克斯体的核酸序列进行分析并与其他病毒核酸进行比对,找到可作为伯氏考克斯体特异性的诊断靶标,采用primerexpress3.0设计软件,设计了荧光定量引物和探针,由北京擎科新业生物技术有限公司合成。利用罗氏lightcycler96实时荧光定量pcr仪对定量pcr进程中的实时情况进行监控,对不同引物和探针试验组扩增的熔解曲线、起跳时间、扩增效率、达到平台期所需时间等进行分析,筛选出扩增效率最高、特异性最好的一组荧光定量pcr引物对和探针,序列如表1所示所示。表1实施例2伯氏考克斯体的实时荧光pcr试剂盒及检测方法1、试剂盒的组成本试剂盒包括伯氏考克斯体的一对特异性引物(如表1所示)、一条特异性荧光探针(如表1所示)、阳性对照、阴性对照、5×pcrbuffer和enzymemix;(1)伯氏考克斯体的一对特异性引物(上游引物和下游引物如表1所示)(2)伯氏考克斯体的一条特异性荧光探针(如表1所示)本实施例中荧光探针5’端标记荧光报告基团fam,3’端标记荧光淬灭基团bq1;在其他实施例中也可以选择其他荧光报告基团,其他荧光淬灭基团。具体地,所述荧光报告基团也可替换为vic、hex、trt、cy3、cy5、rox、joe和texasred,所述荧光淬灭基团也可替换为tamra、dabcyl、mgb、bhq-2和bhq-3。(3)阳性对照品采用1×103拷贝/ul的阳性伯氏考克斯体标准品作为阳性对照品。(4)阴性对照品的制备用rnasefreeh2o作为阴性对照品。(5)2×premixextaq缓冲液或者采用enzymemix与5×pcrbuffer。所述5×pcrbuffer配:tris·cl20mmkcl80mm;(nh4)2so480mm;dtt1.5mm;mgcl212mm;dntp10mm;配置混合后于冰箱-20℃保存;所述enzymemix配制:tris·cl20mm;kcl80mm;dtt1mm;edta0.1mm;nonidetp-400.5%;tween200.5%;甘油50%;taq酶2.5u/ul;配置混合后于冰箱-20℃保存。2、伯氏考克斯体的实时荧光pcr检测方法(1)病毒核酸的提取:a、首先在缓冲液1、2中加入无水乙醇,分别加入25ml和30ml无水乙醇;在漂洗液中加入30μg/mlcarrierrna;b、取30μl蛋白酶放入1.5ml离心管中;c、将标本(如咽拭子等)取200μl加入此管中,充分混匀;d、再在每管分别加入200μl漂洗液(含30μg/mlcarrierrna),混匀振荡30s,70℃温育10min;e、加入250μl无水乙醇,充分混匀振荡30s,室温裂解5min;f、将上述裂解液加入离心柱中,8000rpm,离心1min,弃收集管中的离心液。滤柱仍放回收集管上,将步骤③剩余的混合液全部吸入滤柱中,离心后弃离心液;g、滤柱中加入500μl缓冲液1,12000rpm,离心1min,弃收集管中的离心液;h、另取一支干净的2ml收集管,将离心后的滤柱移到新的收集管上,于滤柱中加入500μl缓冲液2,12000rpm,离心1min,重复步骤⑧一次;i、将滤柱移到一个干净的收集管中,12000rpm,离心3min,后将滤柱放在37℃15min以干燥滤膜;j、将滤柱放在1.5mleppendorf管上,向滤柱中加入50ulrnase-freeh2o,室温静置2min。12000rpm,离心2min,收集离心液即为提取的核酸。(2)实时荧光定量pcr扩增(每份20ul体系)表22、实时荧光定量pcr反应程序为:95℃预变性2min;95℃变性15s,64℃退火30s,60℃1min,共40个循环;每个循环退火结束时,通过终点模式收集荧光信号并进行检测。仪器自动获得扩增产物的熔解曲线。本发明使用lightcycle480ii荧光定量pcr仪在fam通道进行检测。3、得到实时荧光定量pcr扩增结果,对扩增曲线进行分析,并根据如下的判断原则作出判断。当ct≤35时,判断样品为伯氏考克斯体阳性;当35<ct≤40时,重复一次实验,如果ct还是在此范围之内或小于35就判断样品为伯氏考克斯体阳性,否则判断样品为伯氏考克斯体阴性;当ct>40时,判断样品为伯氏考克斯体阴性。4、伯氏考克斯体荧光定量pcr扩增标准曲线的构建将阳性标准品进行10倍倍比稀释,稀释7个梯度,从1×101拷贝/ul~1×107拷贝/ul,使用所建立的实时荧光定量pcr方法分别进行扩增(图1),以ct值为横坐标,拷贝数的对数值为纵坐标作散点图,建立了实时荧光定量pcr的标准曲线(图2)。方程式为y=-4.063x+41.38,r=0.999。结果显示所建立检测体系的荧光曲线与靶基因浓度之间相关性好,准确性高。实施例3伯氏考克斯体荧光定量pcr扩增的特异性试验伯氏考克斯体实时荧光定量pcr检测方法的特异性试验所使用的样本有:肠道病毒71型(ev71)、柯萨奇b3(cvb3)、脊髓灰质炎病毒……等。经过荧光定量pcr扩增后,结果仅伯氏考克斯体和阳性标准品有扩增曲线,其余均没有扩增曲线(图3),表明该检测方法特异性良好。实施例4伯氏考克斯体荧光定量pcr扩增的灵敏性试验将阳性标准品进行10倍倍比稀释,选取低拷贝数样品1×100拷贝/ul~1×103拷贝/ul进行实时荧光定量pcr扩增,评估检测方法的灵敏性。图4为本发明中荧光定量检测方法的灵敏度试验结果。由图5可知,伯氏考克斯体实时荧光定量pcr检测方法的灵敏度为1拷贝/ul,证明方法具有较高的敏感性。应用例1、用上述方法用上述方法对另外30份已确认伯氏考克斯体阳性的标本进行检测,其中,30份阳性标本均被检出,病毒荧光定量pcr扩增曲线见图5所示,根据这阳性结果的ct值结合扩增曲线,由rochelightcycler480分析软件自动分析得到这病毒阳性标本的病毒浓度,具体结果见表。表3样品编号ct值伯氏考克斯体(拷贝数/ml)样品123.051.99×105样品226.771.54×104样品322.482.96×105样品425.773.05×104样品524.119.62×1042、用上述方法用上述方法对另外18份已确认伯氏考克斯体阳性的标本进行检测,其中,18份阳性标本均被检出,病毒荧光定量pcr扩增曲线见图6所示,根据这阳性结果的ct值结合扩增曲线,由rochelightcycler480分析软件自动分析得到这病毒阳性标本的病毒浓度,具体结果见表。所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包括在本发明的保护范围之内。序列表<110>武汉大学<120>一种taqman探针荧光定量pcr检测伯氏考克斯体的方法与应用<160>3<170>siposequencelisting1.0<210>1<211>25<212>dna<213>人工序列(artificialsequence)<400>1ttagtcatggtttcgtcctgaagaa25<210>2<211>25<212>dna<213>人工序列(artificialsequence)<400>2agtgcggctgttaggagtaggtgtt25<210>3<211>32<212>dna<213>人工序列(artificialsequence)<400>3gataatatttaattcctaatttgacaacccct32当前第1页1 2 3
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询

tips


 商标分类
商标分类  商标转让
商标转让 



