在微流体通道中的从溶液中分离后的细胞测量的制作方法
 2021-02-02 17:02:44|
2021-02-02 17:02:44| 291|
291| 起点商标网
起点商标网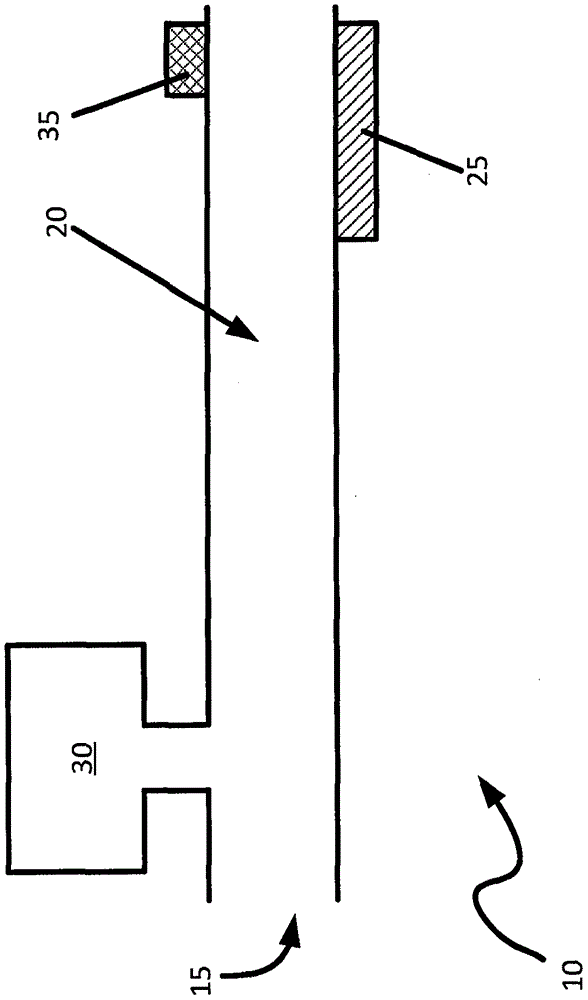
背景
分离细胞用于测量可用于各种工业,如生物学和医学。例如,可以计数细胞或可以测量浊度以测定给定体积中的细胞密度。这可在几种不同应用中提供作出评估的能力。例如,细胞测量可应用于抗菌药敏试验,如用于测定最低抑菌浓度。
附图说明
现在仅以举例的方式参考附图,其中:
图1是从混合物中分离细胞并测量特性的一种示例性装置的示意图;
图2是从混合物中分离细胞并测量特性的另一示例性装置的示意图;
图3是正在接收混合物的图2中所示的装置的示意图;
图4是正在分离细胞和培养细胞的图2中所示的装置的示意图;
图5是正在测量特性的图2中所示的装置的示意图;
图6是分离细胞的捕集器(trap)的另一实例的示意图;
图7是从混合物中分离细胞的另一示例性装置的示意图;和
图8是从混合物中分离细胞并测量特性的一种示例性方法的流程图。
详细说明
细胞测量可具有许多应用并可涉及许多技术。例如,细胞测量的一种应用可为在抗菌药敏试验的过程中测定细菌细胞健康,如在抗生素的测试阶段期间测定抗生素的最低抑菌浓度。测定最低抑菌浓度的一种方法涉及将不同浓度的抗生素分配到分开的含细菌的孔中。然后可监测各个孔,如通过观察孔中的浊度。要认识到,通过使用这种方法,可在经过足够的时间(以在孔中生长对可靠的阳性浊度测量而言足够的细胞)后测定最低抑菌浓度,该时间可为大约24至48小时。在另一些实例中,可通过使用光谱技术,如表面增强拉曼光谱法或表面增强红外吸收光谱法直接测量指示细胞健康的生物标志物来进行快速最低抑菌浓度测定。
此外,通过使用光谱技术,如表面增强拉曼光谱法或表面增强红外吸收光谱法,可在微流体或纳流体平台而非常规孔中进行测量。微流体和纳流体平台可用于操作和取样少量胶体、惰性粒子和生物微粒,如红血球、白血球、血小板、癌细胞、细菌、酵母、微生物、蛋白质、dna等。相应地,在培养出足够样本量方面牵涉的时间较少。此外,用于进行测量的装置可较小。
参考图1,在10处显示从溶液中分离细胞并测量分离的细胞的特性的装置。装置10将接收在溶液中的多个细胞用于分离和测量。在本实例中,装置10包括入口15、微流体通道20、捕集器25、缓冲液供给源30和传感器35。
入口15将接收包括悬浮在溶液中的多个细胞的混合物。所述多个细胞不受限制并可包括几种不同类型的细胞。在本实例中,多个细胞包括多个细菌。特别地,本实例中的细菌可以基本都为相同类型,如在细菌培养物中。在另一些实例中,多个细胞可为其它类型的细胞,如来自动物或人类的细胞。例如,所述多个细胞可包括红血球、白血球、血小板、癌细胞和/或酵母。在进一步实例中,多个细胞也可被其它生物材料取代,所述其它生物材料可为细胞的一部分,如蛋白质、dna、rna、外来体和其它生物微粒,或细胞的小集合,如小微生物。
多个细胞的来源不受特别限制。例如,多个细胞可悬浮在溶液中,所述溶液储存在外部孔(externalwell)或储器(未显示)中。入口15可随后借助毛细作用或借助泵(未显示)或其它手段将流体吸入装置10。在另一些实例中,多个细胞可获自外部分配机构或直接获自采集自细菌培养物或采集自患者的样本。在溶液中流动的多个细胞的样本量不受特别限制。在本实例中,样本量为大约10至100个细胞。在另一些实例中,样本量可增加到大约1000个细胞或减少到单个细胞。要认识到,具有不同配置的其它实例可允许在该范围外的更大或更小样本量。
多个细胞所混合在的溶液不受特别限制。在本实例中,溶液可包含一剂的抗生素、药物或另一药物组分。相应地,溶液可用于在到达入口15前向细胞施用药物组分,如抗生素。多个细胞在到达入口15前与药物组分进行相互作用的方式不受限制,并可涉及在单独容器中混合细胞和溶液一段时间。在另一些实例中,溶液可含有化疗药物或独特的营养物混合物。在进一步实例中,在入口15处接收的混合物可为直接组织样本,如血液。
在本实例中,微流体通道20将输送悬浮在溶液中的多个细胞。在本实例中,微流体通道20为大约10μm至100μm宽x大约100μm高。在另一些实例中,要认识到,微流体通道20可被纳流体通道替代以吸取更小样本量的细胞和溶液。
沿微流体通道20设置捕集器25。在本实例中,捕集器25将分离悬浮在溶液中的多个细胞。特别地,捕集器25将从溶液(其中悬浮着多个细胞)中有效分离多个细胞。要认识到,当多个细胞和溶液的混合物行经微流体通道20时,捕集器可通过在允许溶液继续流过的同时吸引细胞或以其它方式阻止细胞穿过微流体通道来分离所述多个细胞。
在一个实例中多个细胞和溶液的混合物也可包括均匀散布在混合物中的磁性材料,如磁珠。磁珠不受特别限制,并可包括任何铁磁性或超顺磁性材料,如铁、氧化铁、氧化铬、镍和钴。此外,磁珠的尺寸不受限制。例如,磁珠可尺寸基本一致或可包括尺寸分布。此外,可基于应用,如多个细胞中的平均细胞尺寸来选择磁珠的尺寸。在一些实例中,磁珠也可具有不同形状,或可包括粗糙表面以促进与多个细胞的相互作用。
在本实例中,磁珠也可被保护层涂布以减少磁珠与多个细胞或溶液之间的潜在反应。保护层的一些实例可为二氧化硅、塑料或聚对二甲苯材料。在这一实例中,捕集器25可包括磁体,可控制该磁体以将磁珠吸引到微流体通道20的一侧。由于磁珠分散在多个细胞之中,磁珠可助于将来自多个细胞的细胞保持抵在微流体通道20的壁上。相应地,磁珠可包括表面特征,如粗糙或粘着性,以促进磁珠与细胞之间的相互作用或结合。此外,磁体可设计为与磁珠相互作用以提供足以将磁珠和多个细胞保持在捕集器25附近的力。要认识到,溶液不受磁珠运动的影响,并且一旦捕集器25截获磁珠,所述溶液可继续从细胞和磁珠周围流过。
缓冲液供给源30将分配缓冲液到微流体通道20中。在本实例中,缓冲液供给源30将连接到微流体通道20并受控在洗涤阶段的过程中分配缓冲液。由缓冲液供给源分配的缓冲液不受特别限制并可包括水、磷酸盐缓冲盐水、氯化胆胺或三(羟甲基)氨基甲烷。缓冲液可从原始混合物中除去溶液以除去可能影响传感器35的附加分子或生物标志物。例如,原始溶液可包含可向传感器35提供单独响应以致可掩盖要监测的特异性生物标志物的信号的抗生素。
在另一实例中,可选择缓冲液以诱发来自多个细胞的应激反应,从而提高生物标志物的突出性。在要测量细胞健康的实例中,可选择缓冲液以诱发取决于细胞健康的来自细胞的不同响应。例如,缓冲液可为诱发来自健康细胞的应激反应的溶液,如不含营养素和/或具有低重量摩尔浓度的去离子水以提供生物标志物,如腺嘌呤、黄嘌呤和次黄嘌呤的增加。在这一实例中,截留在微流体通道20中的死细胞或病细胞可能不提供显著响应。因此,可随后测量由生物标志物提供的信号以测定多个细胞的健康。例如,与生物标志物相关的信号强度可提供样本中的健康细胞量的指征。
传感器35将测量多个细胞的特性。在本实例中,传感器将在从原始溶液中分离细胞后,如在缓冲液已洗涤通过捕集器25分离和保留的细胞后对特性进行测量。要认识到,传感器35不受特别限制并可基于要测量的细胞的特性选择。在本实例中,要测量的特性可与细胞计数或与细胞样本的健康的其它指征相关。这种特性可用于测定药物组分(如抗生物)在到达入口15前的原始溶液中的作用。然后可使用多个细胞的健康测定药用组分的有效剂量或抗生素的最低抑菌浓度。
传感器35不受限制并且可为能够测量多个细胞的所需特性的任何类型的传感器。在本实例中,传感器35可为用于检测来自光源的信号以检测可被反射或透射穿过多个细胞的光谱信号的光谱仪。例如,传感器35可以是拉曼光谱仪以在单色光源如激光器将光发射在多个细胞上之后进行表面增强拉曼光谱法。这种技术可用于检测由健康细胞产生的生物标志物的存在以提供关于细胞健康的指征。如上文论述,也可选择可诱发健康细胞产生额外的生物标志物以提高在特性检测过程中的响应强度的缓冲液。作为另一实例,传感器35可为红外光谱仪以在使细胞暴露于红外辐射之后进行表面增强红外吸收光谱法。这种技术也可用于检测由健康细胞产生的生物标志物的存在,以提供关于细胞健康的指征。在再另一实例中,传感器35可为拉曼光谱仪和红外检测器二者的组合,从而可使用多种方法检测细胞的特性。
尽管图1显示在微流体通道20上邻近捕集器25安置传感器35,但传感器35的位置不受特别限制。在本实例中,传感器35邻近捕集器25以使传感器35可在通过缓冲液从原始溶液中分离细胞后通过捕集器25保留细胞的同时测量细胞的特性。要认识到,在使用磁珠的这种实例中(其中通过捕集器25留住保留多个细胞)磁珠将在测量过程中与细胞混合。磁珠可在通过传感器35检测到的信号中引入伪影。在另一些实例中,传感器35可远离捕集器25安置从而在测量细胞特性前可从细胞中分离和除去磁珠。释放磁珠的方式不受限制并可涉及通过切断磁体而从捕集器25释放磁珠。随后,可使用机械方法,如过滤器或其它分离技术将磁珠与细胞分离,并输送到传感器35。
在另一实例中,传感器35可用于测量缓冲液而非细胞的特性。在这一实例中,细胞可保持被捕集器25所保留并且用于洗涤细胞的缓冲液可被收集并使用传感器35分析。由于磁珠和细胞保持被捕集器25所保留,所以可提供细胞健康的指征的生物标志物和其它分子可分离并被缓冲液所携带。因此,这种分析方式可提供没有可能由细胞的其它部分、磁珠和/或捕集器25引入的伪影的更好样本。
参考图2,在10a处显示从溶液中分离细胞并测量分离的细胞的特性的装置的另一实例。装置10a的类似组件具有与它们在装置10中的对应物类似的附图标记,只是跟有后缀“a”。装置10a包括入口15a、微流体通道20a、捕集器25a、缓冲液供给源30a、传感器35a和加热元件40a。
在本实例中,装置10a包括加热元件40a以向微流体通道20a中的多个细胞提供热。在这一实例中,加热元件40a意在培养细胞以促进细胞与缓冲液之间的相互作用,以提高材料(如生物标志物)转移到缓冲液中的速率。在另一些实例中,加热元件40a也可用于提高由缓冲液诱发的应激反应的速率。在本实例中,加热元件40a邻近捕集器25a并且意在培养被捕集器25a保留的细胞。在另一些实例中,加热元件40a可加热整个装置10a从而可在分离和洗涤前培养细胞以提供细胞与原始溶液之间的额外相互作用。
参考图3,显示运行中的装置10a。在本实例中,将细菌100和磁珠105在溶液110中的混合物送入微流体通道20a。在这一实例中,细菌100和磁珠105在均匀混合物中。在另一些实例中,磁珠105可结合至细菌100上。在进一步实例中,可在引入细菌100后将磁珠105引入微流体通道20a中。
接着参考图4,启动捕集器25a以建立磁场。该磁场将吸引混合物中的磁珠105。当磁珠105被吸引到捕集器25a时,磁珠105可将细菌100推向捕集器25a并将细菌100抵在微流体通道20a的壁上。然后可使缓冲液115经过细菌100,以将细菌100与留在细菌100的表面上的任何残余溶液110分离。此外,加热元件40a可用于培养被捕集器25a保留的细胞。
图5显示运行中的传感器35a以测量细胞特性。在本实例中,光源(未显示)将光射向捕集器25处的多个细胞。传感器35a可接收从细胞上反射或从基底材料上反射回的光。在这一实例中,传感器35a是拉曼光谱仪,以在单色光源如激光器将光发射在多个细胞上之后进行表面增强拉曼光谱法。这种技术可用于检测由健康细胞产生的生物标志物的存在以提供关于细胞健康的指征。如上文论述,也可选择可诱发健康细胞产生额外的生物标志物以提高在特性检测过程中的响应强度的缓冲液。
在另一些实例中,传感器35a可使用附加和/或替代性的传感技术以测量特性。例如,附加测量可基于对尺寸、形状、数量变化的实时显微图像检查、阻抗变化以指示细胞健康、流式细胞术荧光标记或微悬臂式称量法。
参考图6,使用惯性微流体通道的捕集器25b的另一实例可用于增强磁体26b的捕集效率。例如,在微流体通道20中的大约20μm至大约70μm的阶梯特征27b可在微流体通道20b中建立涡流。相应地,在流体流过阶梯特征27b时,具有较高惯性的粒子容易在阶梯特征27b处流通到漩涡中。要认识到,基于尺寸的物理分选使得细菌100能在磁体附近停留更多时间。在另一些实例中,可省略磁体26b以使捕集器25b仅包括阶梯特征27b。
参考图7,在10c处显示从溶液中分离细胞并测量分离的细胞的特性的装置的另一实例。装置10c的类似组件具有与它们在装置10中的对应物类似的附图标记,只是跟有后缀“c”。装置10c包括微流体通道20c和磁体25c。
在本实例中,微流体通道20c将接收悬浮在溶液中的细菌和磁珠的混合物。在本实例中,溶液包含抗生素剂量。因此,溶液可用于向混合物中的细菌施用抗生素以测试抗生素的效果。在进入微流体通道20c前细菌与抗生素相互作用的方式不受限制并可涉及将溶液添加到细菌培养物中。也可在进入微流体通道20c之前或在混合物在微流体通道20c中的同时培养混合物。
沿微流体通道20c设置磁体25c。在本实例中,磁体25c将与悬浮在溶液中的磁珠相互作用。磁体25c不受特别限制并可为永磁体,如铁磁材料,或电磁体。特别地,磁体25c将从溶液(其中悬浮着细菌)中有效分离细菌。要认识到,当细菌和溶液的混合物行经微流体通道20c时,磁体25c可吸引磁珠以使它们保持靠近微流体通道20c的壁。在这一实例中,磁珠将被用于捕获由于磁体25c施加的磁力而被抵在壁上的细菌。
一旦通过磁体25c与磁珠的相互作用而将细菌抵在微流体通道20的壁上分离,即可使用缓冲液洗涤细菌以除去微流体通道20c中以及细菌表面上的任何残余溶液。如果抗生素剂量涉及受控制的时间区间以停止抗生素和细菌之间的相互作用,这可能是有用的。然后可在洗涤细菌后测量细菌的特性。在本实例中,在使细菌暴露于光源后使用光谱仪测量特性。要认识到,可在磁体25c处通过磁珠将细菌保持被抵在微流体通道20c的壁上的同时进行这种测量。因此,可将带有微流体通道20c的整个平台置于光谱仪内。在另一些实例中,磁体25c可在洗涤后释放细菌以输送到光谱仪。光谱仪可用于测量细菌的特异性生物标志物以评估细菌的健康和测定施用的抗生素剂量是否满足最低抑菌浓度阈值。
参考图8,在200处显示从溶液中分离细胞并测量分离的细胞的特性的方法的流程图。为了有助于解释方法200,假设方法200可用上述装置10、10a或10c中的任一种进行。方法200确实可能是可配置有装置10、10a或10c以从溶液中分离细胞并测量细胞特性的一种方式。此外,方法200的以下论述可带来对装置10、10a或10c和它们的各种组件的进一步理解。为了以下论述的目的,假设方法200在装置10上进行。此外,要强调的是,方法200可不以如所示的确切顺序进行,并且各个方块可能平行而非依序进行,或以完全不同的顺序进行。
以方框210开始,在装置中经由微流体通道20接收悬浮在溶液中的细菌的混合物。细菌所混合在的溶液不受特别限制。在本实例中,溶液意在提供对细菌的处理。例如,处理可包括施用抗生素以杀死细菌细胞。要认识到,溶液可在到达微流体通道20前已被施加对细菌的处理。在另一些实例中,可在微流体通道20中的同时施加处理。
方框220涉及在微流体通道20中使用捕集机构,如图1中所示的捕集器25分离细菌。在一个实例中,悬浮在溶液中的细菌的混合物也可包括散布在混合物中的磁性材料。磁性材料不受特别限制并可包括铁磁性或超顺磁性材料。此外,磁性材料的尺寸不受限制。在一些实例中,磁性材料可被细菌吸收。在一些实例中,磁性材料可具有各种形状或可包括粗糙表面或特征以促进与多个细胞的相互作用。
方框230用缓冲液洗涤细菌以除去溶液。洗涤细菌的方式不受限制并可涉及使缓冲液流过被捕集器25保留的细菌。在本实例中,所提供的缓冲液可包括可用于诱发来自健康细菌细胞的响应的物质。例如,该响应可以是产生额外的生物标志物以供检测。
接着,方框240涉及测量细菌的特性。在本实例中,要测量的特性可以是细菌健康的指标。在这一实例中,特性可用于测定处理的效果。例如,如果用抗生素处理细菌,特性可以是来自光谱技术的与细菌生成的生物标志物相关的信号。相应地,如果信号强度弱,其可提供细菌数低和/或细菌不再存活的指征。相反,如果信号强度强,其可提供细菌数高和/或细菌仍存活的指征。测量不受特别限制。例如,测量可涉及对细菌进行表面增强拉曼光谱法以寻找生物标志物,或对细菌进行表面增强红外吸收光谱法以寻找生物标志物。
应该认识到,上文提供的各种实例的特征和方面可组合成进一步的实例,它们也落在本公开的范围内。
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询



 商标分类
商标分类  商标转让
商标转让 



