一种库尔勒香梨酸性多糖的提取方法及其应用与流程
 2021-02-02 17:02:29|
2021-02-02 17:02:29| 512|
512| 起点商标网
起点商标网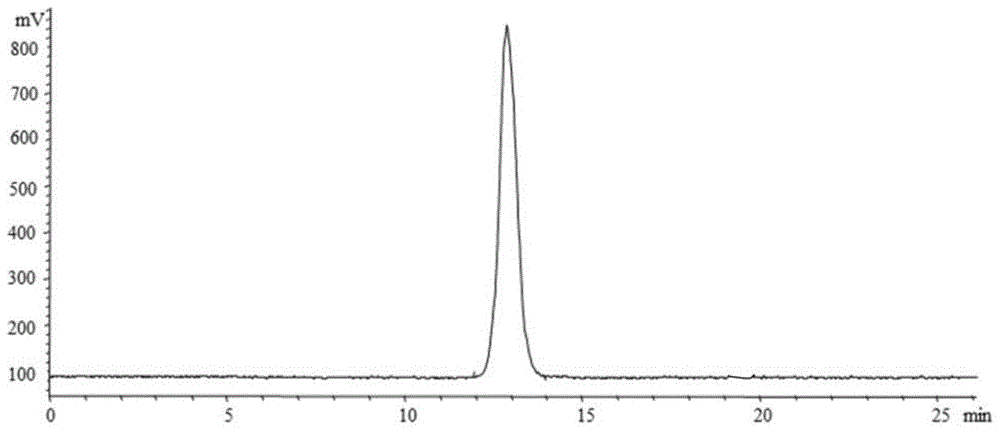
本发明属于库尔勒香梨酸性多糖
技术领域:
,具体涉及一种库尔勒香梨酸性多糖的提取方法及其应用。
背景技术:
:植物多糖的提取方法主要有酸碱提取法、生物酶提取法、超高压提取法和微波提取等方法。酸碱提取法易使糖苷键断裂、生物酶提取法成本较高、超高压提取法易使多糖的内部结构破坏、微波提取法对设备的要求较高。植物多糖的分离方法主要有:分级沉淀法、季铵盐沉淀法、电泳法和金属离子沉淀法等方法。分级沉淀法只能用于多糖的粗分;季铵盐沉淀法仅适用于中性多糖的分离;电泳法限于实验室小规模的使用;金属离子沉淀法多用于树胶类多糖的分离。目前修复肺损伤的方法主要依靠激素类药物的维持,例如地塞米松,倍氯米松、布地奈德和氟替卡松等,这类药物通常需要规律的吸入一周以上才能起效,且副作用大。传统的提高巨噬细胞介导的免疫调节活性的方法主要是应用脂多糖进行干预,但是脂多糖长期大量的使用易诱发炎症反应。技术实现要素:本发明所要解决的技术问题在于针对上述现有技术的不足,提供一种库尔勒香梨酸性多糖的提取方法及其应用,该库尔勒香梨酸性多糖用于修复肺组织的损伤,提高巨噬细胞介导的免疫调节活性。为解决上述技术问题,本发明采用的技术方案是:一种库尔勒香梨酸性多糖的提取方法,该方法为:s1、将库尔勒香梨果实去核后切成丝,在阴凉通风处放置1个月晾干,得到晾干后的果肉,将晾干后的果肉浸泡于质量分数为95%的乙醇水溶液中脱脂8h后取出,得到脱脂后的果肉,向脱脂后的果肉中加入蒸馏水a,然后在温度为90℃的条件下回流提取后过滤,得到滤液a,向过滤后的果肉残渣a中加入蒸馏水b,在温度为90℃的条件下回流提取后过滤,得到滤液b,向过滤后的果肉残渣b中加入蒸馏水c,在温度为90℃的条件下回流提取后过滤,得到滤液c,合并滤液a、滤液b和滤液c,得到提取液;s2、将s1中得到的提取液在旋转蒸发仪浓缩后,向浓缩后得到的浓缩液中加入4倍体积的质量分数为80%的乙醇水溶液,在温度为4℃的条件下静置12h,收集沉淀物,将所述沉积物用1倍体积的蒸馏水溶解,得到溶解液,将所述溶解液放入透析袋中,在100倍体积的蒸馏水中透析48h,期间每隔12h换一次蒸馏水,收集透析袋中的溶液进行浓缩和真空冷冻干燥,得到库尔勒香梨多糖;s3、将s2中得到的库尔勒香梨多糖溶解液5倍体积的蒸馏水中,在温度为4℃的条件下搅拌溶解8h后,在温度为4℃、转速为3000r/min的条件下离心15min,取上清液于deae-650m柱上样,依次用去离子水和浓度为0.5m的nacl水溶液洗脱,收集含多糖馏分的洗脱液,然后经过浓缩、透析和冻干,得到nacl洗脱馏分;s4、将s3中得到的nacl洗脱馏分溶解于5倍体积的蒸馏水中,在温度为4℃的条件下搅拌溶解8h后,在温度为4℃、转速为3000r/min的条件下离心15min,取上清液于deae-650m柱上样,依次用去离子水和浓度为2m的nacl水溶液洗脱,收集含多糖馏分的洗脱液,然后经过浓缩、透析和冻干,得到nacl二次洗脱馏分;s5、将s4中得到的nacl二次洗脱馏分溶解于5倍体积的蒸馏水中,在温度为4℃的条件下搅拌溶解8h后,在温度为4℃、转速为3000r/min的条件下离心15min,取上清液于sepharose6b柱上样,用浓度为0.1m的nacl水溶液洗脱,收集含多糖馏分的洗脱液,然后经过浓缩、透析和冻干,得到nacl三次洗脱馏分;s6、将s5中得到的nacl三次洗脱馏分溶解于5倍体积的蒸馏水中,在温度为4℃的条件下搅拌溶解8h后,在温度为4℃、转速为3000r/min的条件下离心15min,取上清液于sephacryls-300hr柱上样,用浓度为0.1m的nacl水溶液洗脱,分别收集含多糖馏分的两部分洗脱液,然后经过浓缩、透析和冻干,得到两种库尔勒香梨酸性多糖,分别命名为psap-1和psap-2。优选地,s1中回流提取时间均为2h。优选地,s1中脱脂后的果肉中和蒸馏水a的用量比为1g:4ml;过滤后的果肉残渣a和蒸馏水b的用量比为1g:4ml;过滤后的果肉残渣b和蒸馏水c的用量比为1g:4ml。优选地,s2中所述透析袋的截留分子量为7000da。本发明还提供了一种上述的库尔勒香梨酸性多糖的应用,所述库尔勒香梨酸性多糖psap-1和psap-2用于降低气道炎的巨噬细胞、中性粒细胞、嗜酸性粒细胞和淋巴细胞的数量,降低il-4、il-5、il-13的含量,修复肺组织的损伤。本发明还提供了一种上述的库尔勒香梨酸性多糖的应用,所述库尔勒香梨酸性多糖psap-1和psap-2用于提高raw264.7巨噬细胞的增殖活性,促进raw264.7巨噬细胞的no释放,促进raw264.7巨噬细胞分泌细胞因子il-6和细胞因子tnf-α,提高巨噬细胞介导的免疫调节活性。本发明与现有技术相比具有以下优点:1、本发明使用的水提法条件温和、操作简便、成本低、提取率高且引入的杂质少、试剂绿色环保,本发明使用多种色谱柱结合的分离方法,得到两种库尔勒香梨酸性多糖,所得多糖组分均一性好。2、本发明的库尔勒香梨酸性多糖psap-1和psap-2用于降低气道炎的巨噬细胞、中性粒细胞、嗜酸性粒细胞和淋巴细胞的数量,降低il-4、il-5、il-13的含量,修复肺组织的损伤。还可以用于提高raw264.7巨噬细胞的增殖活性,促进raw264.7巨噬细胞的no释放,促进raw264.7巨噬细胞分泌细胞因子il-6和细胞因子tnf-α,提高巨噬细胞介导的免疫调节活性。本发明所使用的库尔勒香梨酸性多糖psap-1和psap-2安全无毒,无副作用,且疗效显著、活性良好。下面结合附图和实施例对本发明作进一步详细说明。附图说明图1是本发明实施例1的库尔勒香梨酸性多糖psap-1的表观分子量测定色谱图。图2是本发明实施例1的库尔勒香梨酸性多糖psap-2的表观分子量测定色谱图。图3是本发明实施例2的正常对照组、支气管哮喘模型组和地塞米松阳性对照组的肺组织的he染色图。图4是本发明实施例2的库尔勒香梨酸性多糖psap-1各剂量组处理的肺组织的he染色图。图5是本发明实施例2的库尔勒香梨酸性多糖psap-2各剂量组的肺组织的he染色图。图6是本发明实施例3的库尔勒香梨酸性多糖psap-1和psap-2对raw264.7细胞上的细胞增殖活性结果。图7是本发明实施例3的库尔勒香梨酸性多糖psap-1和psap-2作用下raw264.7细胞释放no的结果。图8是本发明实施例3的库尔勒香梨酸性多糖psap-1和psap-2对raw264.7细胞因子tnf-α分泌的影响图。图9是本发明实施例3的库尔勒香梨酸性多糖psap-1和psap-2对raw264.7细胞因子il-6分泌的影响图。具体实施方式实施例1本实施例的库尔勒香梨酸性多糖的提取方法,该方法为:s1、将库尔勒香梨果实去核后切成丝,在阴凉通风处放置1个月晾干,得到晾干后的果肉,将晾干后的果肉浸泡于质量分数为95%的乙醇水溶液中脱脂8h后取出,得到脱脂后的果肉,向脱脂后的果肉中加入蒸馏水a,然后在温度为90℃的条件下回流提取后过滤,得到滤液a,向过滤后的果肉残渣a中加入蒸馏水b,在温度为90℃的条件下回流提取后过滤,得到滤液b,向过滤后的果肉残渣b中加入蒸馏水c,在温度为90℃的条件下回流提取后过滤,得到滤液c,合并滤液a、滤液b和滤液c,得到提取液;回流提取时间均为2h;脱脂后的果肉中和蒸馏水a的用量比为1g:4ml;过滤后的果肉残渣a和蒸馏水b的用量比为1g:4ml;过滤后的果肉残渣b和蒸馏水c的用量比为1g:4ml;s2、将s1中得到的提取液在旋转蒸发仪浓缩后,向浓缩后得到的浓缩液中加入4倍体积的质量分数为80%的乙醇水溶液,在温度为4℃的条件下静置12h,收集沉淀物,将所述沉积物用1倍体积的蒸馏水溶解,得到溶解液,将所述溶解液放入截留分子量为7000da的透析袋中,在100倍体积的蒸馏水中透析48h,期间每隔12h换一次蒸馏水,收集透析袋中的溶液进行浓缩和真空冷冻干燥,得到库尔勒香梨多糖;s3、将s2中得到的库尔勒香梨多糖溶解液5倍体积的蒸馏水中,在温度为4℃的条件下搅拌溶解8h后,在温度为4℃、转速为3000r/min的条件下离心15min,取上清液于deae-650m柱上样,依次用去离子水和浓度为0.5m的nacl水溶液洗脱,收集含多糖馏分的洗脱液,然后经过浓缩、透析和冻干,得到nacl洗脱馏分;s4、将s3中得到的nacl洗脱馏分溶解于5倍体积的蒸馏水中,在温度为4℃的条件下搅拌溶解8h后,在温度为4℃、转速为3000r/min的条件下离心15min,取上清液于deae-650m柱上样,依次用去离子水和浓度为2m的nacl水溶液洗脱,收集含多糖馏分的洗脱液,然后经过浓缩、透析和冻干,得到nacl二次洗脱馏分;s5、将s4中得到的nacl二次洗脱馏分溶解于5倍体积的蒸馏水中,在温度为4℃的条件下搅拌溶解8h后,在温度为4℃、转速为3000r/min的条件下离心15min,取上清液于sepharose6b柱上样,用浓度为0.1m的nacl水溶液洗脱,收集含多糖馏分的洗脱液,然后经过浓缩、透析和冻干,得到nacl三次洗脱馏分;s6、将s5中得到的nacl三次洗脱馏分溶解于5倍体积的蒸馏水中,在温度为4℃的条件下搅拌溶解8h后,在温度为4℃、转速为3000r/min的条件下离心15min,取上清液于sephacryls-300hr柱上样,用浓度为0.1m的nacl水溶液洗脱,分别收集含多糖馏分的两部分洗脱液,然后经过浓缩、透析和冻干,得到两种库尔勒香梨酸性多糖,分别命名为psap-1和psap-2。将提取的两种库尔勒香梨酸性多糖psap-1和psap-2采用hpgpc进行均一性分析和分子量测定。系统:安捷伦1200系统,示差折光检测器;色谱柱:色谱柱为plaquagel-ohmixed-h(7.5mm×300mm,8μm);色谱条件:流动相为0.1mnano3,流速0.6ml/min,柱温控制在35℃;标准品:t-seriesdextrans为分子量检测用标准品。库尔勒香梨酸性多糖的两个组分psap-1和psap-2为白色粉末,水溶性好。如图1-2所示,两个样品都呈均一、对称的尖峰,说明psap-1和psap-2的均一性较好。将峰面积分别带入标准曲线y=-1.449x+19.868,r2=0.997,得到psap-1和psap-2的表观分子量分别为64565da和38905da。实施例2本实施例提供了实施例1制备的两种库尔勒香梨酸性多糖的应用,所述库尔勒香梨酸性多糖psap-1和psap-2用于降低气道炎的巨噬细胞、中性粒细胞、嗜酸性粒细胞和淋巴细胞的数量,降低il-4、il-5、il-13的含量,修复肺组织的损伤。取正常雌性balb/c小鼠72只,体重18±5g,随机分为9组,每组8只,正常对照组、哮喘模型组、psap-1低剂量组(10mg/kg)、psap-1中剂量组(20mg/kg)、psap-1高剂量组(40mg/kg)、psap-2低剂量组(10mg/kg)、psap-2中剂量组(20mg/kg)、psap-2高剂量组(40mg/kg)、地塞米松阳性对照组。除正常对照组外,其余8组于第1天、第7天和第14天分3次腹腔注射抗原液0.2ml(含ova100μg,氢氧化铝干粉200μg)致敏,正常对照组用等量的生理盐水进行致敏。致敏结束7天后将小鼠放入自制的不完全封闭的箱内,给予1%ova(鸡卵清白蛋白)溶液用雾化器吸入激发,每天1次,每次30分钟,连续7天。正常对照组用等量的生理盐水进行激发。每次雾化吸入激发前1小时给予库尔勒香梨酸性多糖和地塞米松干预,库尔勒香梨酸性多糖低剂量组给予10mg/kg灌胃、库尔勒香梨酸性多糖中剂量组给予20mg/kg灌胃、库尔勒香梨酸性多糖高剂量组给予40mg/kg灌胃、地塞米松组给予1mg/kg灌胃,正常对照组和哮喘模型组灌胃等量的生理盐水,每天1次,共7天。末次激发结束后24小时内,各组小鼠均以水合氯醛麻醉后,按要求取标本。于气管正中处剪一小口,插入气管套管,以磷酸盐缓冲液4ml行支气管肺泡灌洗,来回冲洗3次,收集支气管肺泡灌洗液(balf)和肺组织标本。通过酶联免疫吸附法(elisa)检测balf中il-4、il-5、il-13含量,用瑞氏染色观察balf中炎症细胞分类和数目变化。通过he染色法观察小鼠肺组织炎性细胞浸润等病理变化。(1)各实验组小鼠balf(支气管肺泡灌洗液)中的炎症细胞分类及计数通过瑞氏染色,在光学电子显微镜视野下将balf中的炎症细胞分类并且计算不同炎症细胞的数目变化,包括嗜酸性粒细胞、中性粒细胞、淋巴细胞、巨噬细胞。实验结果表明:哮喘模型组balf中四种细胞计数和细胞总数均比正常对照组显著增多(p<0.05);而库尔勒香梨酸性多糖psap-1给药的三组、库尔勒香梨酸性多糖psap-2给药的三组与哮喘模型组相比较,这四种细胞计数及细胞总数均明显减少,且有显著差异(p<0.05);高剂量组比低、中剂量组数量减少更明显一些。结果见表1。表1balf中的炎症细胞数目(×105·ml-1)项目嗜酸性粒细胞巨噬细胞淋巴细胞中性粒细胞正常对照组0.71±0.123.09±0.275.37±0.452.09±0.13哮喘模型组5.89±0.71*13.44±1.22*15.42±1.53*17.31±1.55*psap-1低剂量组3.64±0.51*,#11.33±1.05*,#14.07±1.33*,#14.65±1.37*,#psap-1中剂量组3.31±0.29*,#9.84±0.77*,#12.88±1.04*,#13.99±1.03*,#psap-1高剂量组2.77±0.38*,#9.01±0.85*,#12.19±1.11*,#10.76±0.87*,#psap-2低剂量组4.64±0.35*,#12.63±1.29*,#13.26±1.14*,#12.65±0.95*,#psap-2中剂量组4.21±0.39*,#11.49±1.21*,#12.09±1.35*,#9.88±0.79*,#psap-2高剂量组3.73±0.28*,#9.66±0.78*,#11.98±1.07*,#8.23±0.68*,#地塞米松阳性对照组1.68±0.23#6.38±0.55#10.37±0.69#6.78±0.63#注:*p<0.01,与正常对照组比较;#p<0.05,与哮喘模型组比较。由表1可知,与正常对照组相比较,哮喘模型组小鼠balf中巨噬细胞、中性粒细胞、嗜酸性粒细胞和淋巴细胞计数较明显升高,差异显著(p<0.05)。库尔勒香梨酸性多糖psap-1和psap-2的各低、中、高剂量组四种细胞计数较模型组比较均有不同程度的降低,差异显著(p<0.05)。(2)各实验组小鼠balf中炎症细胞因子il-4、il-5、il-13的含量变化结果经elisa法检测结果示:支气管哮喘模型组与正常对照组相比较,il-4、il-5、il-13含量水平升高,有显著差异(p<0.05);库尔勒香梨酸性多糖psap-1和psap-2高、中、低干预组与哮喘模型组比较,il-4、il-5、il-13含量水平降低,有显著差异(p<0.05)。结果见表2。表2balf中的il-4,il-5和il-13水平项目il-4(pg·l-1)il-5(ng·l-1)il-13(pg·l-1)正常对照组39.01±4.0221.32±2.2113.48±1.53哮喘模型组77.62±7.31*96.34±8.26*55.89±5.13*地塞米松阳性对照组57.45±5.11*,#90.72±8.03*,#51.38±4.69*,#psap-1低剂量组54.33±5.79*,#84.79±8.53*,#49.72±5.11*′#psap-1中剂量组53.87±5.08*,#70.22±6.43*,#47.03±4.24*,#psap-1高剂量组55.77±5.55*,#87.38±7.78*,#49.44±5.13*,#psap-2低剂量组54.31±5.23*,#79.93±7.44*,#47.36±4.21*,#psap-2中剂量组54.53±5.61*,#72.76±6.68*,#44.74±4.18*,#psap-2高剂量组47.36±3.45#37.41±3.55#40.06±4.11#注:*p<0.05,与正常对照组比较;#p<0.05,与哮喘模型组比较。由表2可知,各实验组小鼠balf中炎症细胞因子il-4、il-5、il-13的含量变化结果经elisa法检测结果示:支气管哮喘模型组与正常对照组相比较,il-4、il-5、il-13含量水平升高,有显著差异(p<0.05);库尔勒香梨酸性多糖高、中、低干预组与哮喘模型组比较,il-4、il-5、il-13含量水平降低,有显著差异(p<0.05)。(3)he染色光学显微镜观察,结果如图3-4所示:图3中a和b为常规对照组,支气管上皮结构完整,上皮细胞形态结构正常、排列紧密,肺泡结构清晰,肺泡壁未见明显增厚,未见明显炎症。图3中c和d为支气管哮喘模型组可见较大量的中性粒细胞、巨噬细胞、淋巴细胞与少量多核巨细胞浸润,多见血管周围有炎性细胞浸润成环,形成血管套袖,组织中可见较多肺泡壁增厚,可见较多肺泡壁上皮细胞增生,胞核增大,并可见核分裂象。图3中e和f为地塞米松阳性对照组,支气管上皮结构完整,上皮细胞形态结构正常、排列紧密;多见肺泡壁上有较多淋巴细胞与中性粒细胞浸润,局部可见肺泡壁增厚。图4中g和h为库尔勒香梨酸性多糖psap-1低剂量组,图5中m和n为库尔勒香梨酸性多糖psap-2低剂量组,两种库尔勒香梨酸性多糖低剂量组的支气管上皮结构完整,上皮细胞形态结构正常、排列紧密;组织中可见较多肺泡壁增厚,伴有较多淋巴细胞、中性粒细胞与少量巨噬细胞浸润。图4中i和j为库尔勒香梨酸性多糖psap-1中剂量组,图5中o和p为库尔勒香梨酸性多糖psap-2中剂量组,两种库尔勒香梨酸性多糖中剂量组的支气管上皮结构完整,上皮细胞形态结构正常、排列紧密;多见血管周围有炎性细胞浸润成环,形成血管套袖;局部可见肺泡壁增厚,伴有较多淋巴细胞与中性粒细胞浸润。图4中k和l为库尔勒香梨酸性多糖psap-1高剂量组,图5中q和s为库尔勒香梨酸性多糖psap-2高剂量组,两种库尔勒香梨酸性多糖高剂量组的支气管上皮结构完整,上皮细胞形态结构正常、排列紧密,局部可见肺泡壁增厚,伴有少量淋巴细胞浸润;局部可见出血。通过观察肺组织he染色可见,哮喘模型组组织中可见较大量的中性粒细胞、巨噬细胞、淋巴细胞与少量多核巨细胞浸润,多见血管周围有炎性细胞浸润成环,形成血管套袖,组织中可见较多肺泡壁增厚,可见较多肺泡壁上皮细胞增生,胞核增大,并可见核分裂象。库尔勒香梨酸性多糖psap-1和psap-2的各低、中、高剂量组小鼠肺组织病理学改变较哮喘模型组显著减轻。正常组小鼠肺组织无明显病理改变。库尔勒香梨酸性多糖psap-1低、中、高剂量组之间比较,有显著差异(p<0.05),库尔勒香梨酸性多糖psap-2低、中、高剂量组之间比较,有显著差异(p<0.05)。实施例3本实施例提供了实施例1制备的两种库尔勒香梨酸性多糖的应用,所述库尔勒香梨酸性多糖psap-1和psap-2用于提高raw264.7巨噬细胞的增殖活性,促进raw264.7巨噬细胞的no释放,促进raw264.7巨噬细胞分泌细胞因子il-6和细胞因子tnf-α,提高巨噬细胞介导的免疫调节活性。(1)细胞增殖活性取对数生长期的raw264.7巨噬细胞,以1×105细胞/ml的密度接种于96孔板,在二氧化碳培养箱中培养24h直至细胞贴壁。弃上清液后,分别以psap-1、psap-2各浓度(3.9、7.8、15.6、31.3、62.5、125、250、500、1000、2000μg·ml-1)的完整细胞培养液进行细胞干预,并设置脂多糖阳性对照组(lps,浓度为250μg·ml-1)。每个浓度分别设置6复孔。细胞在培养24h后,每孔加入cck-8试剂盒测定试剂,在37℃的二氧化碳培养箱中反应2h,用酶标仪在450nm处测定各孔od值。根据od值和细胞增殖率的计算公式计算细胞增殖率。巨噬细胞增殖率=((od-od空白)/od空白)×100%所有数据使用spss统计软件判断是否具有统计学意义。psap-1和psap-2对raw264.7细胞上的细胞增殖活性结果如图6所示。psap-1和psap-2对巨噬细胞的细胞增殖率随着多糖浓度的增加而增加,且浓度范围为3.9μg·ml-1~2000μg·ml-1,且呈剂量依赖性。psap-1在3.9μg·ml-1~250μg·ml-1对巨噬细胞的增殖活性影响小。但当浓度大于62.5时,巨噬细胞的细胞增殖活性明显升高,在500μg·ml-1时,巨噬细胞的增殖活性最高。因此,在接下来的实验中,我们选择psap-1的浓度分别为62.5、250和1000μg·ml-1。psap-2在3.9μg·ml-1~231.3μg·ml-1的范围内对巨噬细胞的增殖活性影响低。但当浓度大于62.5μg·ml-1时,巨噬细胞的细胞增殖率明显提高,在250μg·ml-1时,细胞增殖率最高。因此,在接下来的实验中,选择psap-2的浓度分别为62.5、250和1000μg·ml-1。(2)no释放活性取对数生长期的raw264.7巨噬细胞,以5×105个/ml铺板于96孔板中,置于37℃二氧化碳培养箱中培养24h。分别加入含有脂多糖(lps阳性对照组,浓度为250μg·ml-1)、psap-1、psap-2的培养液,均一多糖组分分别设置高中低剂量组(各为62.5、250和1000μg·ml-1),每孔细胞加入0.2ml上述浓度梯度的培养液,分别在培养24、48、72和96小时后取细胞上清液,在离心机中1000r/min离心20min,收集上清,用于检测no,剩余的待检测放入-20℃冰箱保存。按照no检测试剂盒的说明,首先绘制标准曲线,以no标准品配制0、5、10、20、40、80、160、320、640、1280、2560μg/ml的浓度梯度,按照试剂盒的操作步骤测定各浓度梯度下的吸光度值,重复操作3次,绘制标准曲线。后根据标准曲线计算各个od值下的样品上清液中的no含量以判断不同处理条件下的巨噬细胞的no释放量。在psap-1和psap-2的作用下,raw264.7细胞释放no的结果如图7所示。与空白对照组相比,lps阳性对照组(250μg·ml-1)no含量显著高于空白对照组(p<0.05)。psap-1各浓度(62.5、250、1000μg·ml-1)组no含量均显著高于空白对照组(p<0.05)。psap-2组在62.5、250、1000μg·ml-1三种浓度下的no含量均显著高于空白对照组(p<0.05)。与lps阳性对照组相比,各浓度的psap-1和psap-2组no含量均显著降低(p<0.05)。一般情况下,psap-1和psap-2在62.5、250和1000μg·ml-1浓度下都能刺激no在raw264.7细胞上的释放。(3)psap-1和psap-2对raw264.7细胞因子分泌的影响取对数生长期的raw264.7巨噬细胞,以1×105个/ml铺板于96孔板中,置于37℃二氧化碳培养箱中培养24h。分别加入含有脂多糖(lps阳性对照组,浓度为250μg·ml-1)、psap-1、psap-2的培养液,均一多糖组分分别设置高、中、低剂量组(各为62.5、250、1000μg·ml-1),每孔细胞加入0.2ml上述浓度梯度的培养液,分别在培养24、48、72和96h后取细胞上清液,在离心机中1000r/min离心20min,收集上清,用于检测tnf-α和il-6,剩余的待检测放入-20℃冰箱保存。按照tnf-α和il-6检测试剂盒的说明,首先绘制标准曲线,按照试剂盒的操作步骤测定各浓度梯度下的吸光度值,重复操作3次,绘制标准曲线。生物素标记的抗体工作液、辣根过氧化物酶标记的亲和素工作液、底物溶液、终止溶液的添加顺序依次按照说明书步骤进行。后根据标准曲线计算各个od值下的样品上清液中的tnf-α和il-6含量以判断不同处理条件下的巨噬细胞的tnf-α和il-6释放量。tnf-α的分泌如图8所示。与空白对照组相比,lps阳性对照组(250μg·ml-1)tnf-α细胞分泌量明显高于空白对照组(p<0.05)。psap-1组在各浓度(62.5、250、1000μg·ml-1)下tnf-α的分泌量均显著高于空白对照组(p<0.05)。psap-2组在62.5、250、1000μg·ml-1三种浓度下的tnf-α分泌量均显著高于空白对照组(p<0.05)。与lps阳性对照组相比,各浓度的psap-1和psap-2组tnf-α细胞的分泌均显著降低(p<0.05)。总的来说,psap-1和psap-2组在62.5、250和1000μg·ml-1浓度下都能刺激raw264.7细胞分泌tnf-α。il-6分泌见图9。与空白对照组相比,lps阳性对照组(250μg·ml-1)il-6分泌量明显高于空白对照组(p<0.05)。psap-1各浓度(62.5、250、1000μg·ml-1)组il-6分泌量均显著高于空白对照组(p<0.05)。psap-2组的il-6分泌浓度为62.5、250/1000μg·ml-1,显著高于空白对照组(p<0.05)。与lps阳性对照组相比,各浓度psap-1和psap-2组il-6分泌均显著降低(p<0.05)。总的来说,psap-1和psap-2在62.5、250、1000μg·ml-1的浓度下都能刺激raw264.7细胞il-6的分泌。综上所述,psap-1和psap-2在250μg/ml时均能提高raw264.7巨噬细胞的增殖、no释放和细胞因子(il-6和tnf-α)分泌。对于细胞因子的产生,高浓度(1000μg/ml)和中浓度(250μg/ml)相比均有一定程度的抑制。这种现象可能是由于细胞活力较高,在某种程度上抑制了细胞因子的产生。psap-1和psap-2在raw264.7巨噬细胞中,提高了细胞增殖活性、no释放和细胞因子(il-6和tnf-α)的分泌,提示可能促进巨噬细胞介导的先天免疫应答。以上所述,仅是本发明的较佳实施例,并非对本发明作任何限制。凡是根据发明技术实质对以上实施例所作的任何简单修改、变更以及等效变化,均仍属于本发明技术方案的保护范围内。当前第1页1 2 3
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询

tips


 商标分类
商标分类  商标转让
商标转让 



