一种抗丙型肝炎病毒抗体的制作方法
 2021-02-02 16:02:19|
2021-02-02 16:02:19| 405|
405| 起点商标网
起点商标网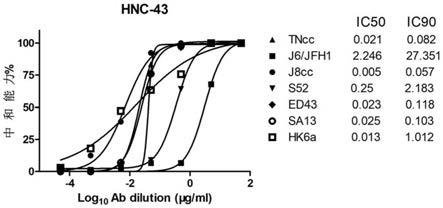
[0001]
本发明涉及抗体技术领域,具体涉及一种抗丙型肝炎病毒(hcv)抗体。
背景技术:
[0002]
丙型肝炎病毒(hepatitis c virus,hcv),单股正链rna病毒,属于黄病毒科丙型肝炎病毒属,被认定为非甲非乙型肝炎的主要致病病毒。hcv基因组编码十种病毒蛋白,包括核心蛋白、e1、e2三种结构蛋白,以及p7、ns2、ns3、ns4a、ns4b、ns5a、ns5b七种非结构蛋白。在病毒包装过程中,非结构蛋白不会被包装至病毒粒子中,所以hcv病毒颗粒仅包含由核心蛋白和rna组成的核衣壳,以及包膜蛋白e1、e2组成的病毒外壳。hcv包膜糖蛋白e1和e2所形成的异二聚体,是病毒与宿主细胞结合和侵入的关键结构,也是中和抗体作用的主要靶点。由于hcv rna聚合酶的高效性与低校正性,在同一患者体内每天可产生约1012的病毒,所以也会存在大量的不同准种。根据基因组的异质性,hcv可分为7个基因型,100种亚种,世界主要流行的亚型为1a、1b、2a、2b、3a型,中国主要流行的亚型为1b、2a、3a、3b、6a型。该病毒主要经过血液和血液制品传播。hcv感染人体后,约80%的感染者会发展成慢性肝炎,10%-20%的感染者会发展成肝硬化、肝癌,全球有大概1亿7千万丙肝感染者,who估计全球以每年300-400万的速度增长,严重影响人类的健康。
[0003]
目前hcv感染的治疗主要使用聚乙二醇干扰素联合利巴韦林(ribavirin,一种核苷类似物,干扰病毒基因组复制)的抗病毒方案,但治疗成本较高,副作用强。一直以来科研工作者在尝试分离对抗hcv感染者血清中包膜蛋白的抗体方面做出不懈的努力。
[0004]
虽然病毒在不断产生变异,但是仍应该存在一些病毒无法改变或相当保守的位点,如其受体结合位点等,如果过度变异即可能导致病毒生命周期的终止。2001年ania owsianka首次发现hcv各亚型的包膜蛋白e2的n端(aa412-423)高度保守,该保守表位是与肝细胞表面cd81受体特异性结合。随后人们发现了与该表位特异性结合的具有广谱中和活性的抗体-ap33(鼠源)、3/11(鼠源)、hcv1(人源)、hc33.1(人源)等,另外也有同时作用于cd81和sr-bi等其他受体结合位点而获得交叉中和能力的抗体,如鼠源单克隆抗体h77.39等。这类广谱中和抗体为疫苗的研究奠定了基础,具有重大现实意义。另外有研究显示,结合e2aa412-426的人源多克隆抗体具有广谱中和活性,但是这一活性可被识别aa436-446表位的多克隆抗体所抑制。这些研究一方面证明了hcv广谱中和抗体的存在,另一方面也说明真正有效的广谱中和抗体,除能结合hcv保守区外,其作用还受更多包膜糖蛋白的抗原特性的影响。
[0005]
最近有研究通过利用广谱中和抗体ar3c(law m,maruyama t,lewis j,et al.broadly neutralizing antibodies protect against hepatitis c virus quasispecies challenge[j].nature medicine,2008,14(1):25.)对hcv e2蛋白的核心区域成功进行了结构解析。由于目前hcv中和抗体的筛选很大程度上得益于env蛋白结构的明确,因此e2构象的获得将推动hcv的疫苗设计以及药物(抗体)的研发进程,但同时也提示进行相关抗体筛选工作的前沿性和紧迫性。
技术实现要素:
[0006]
为克服现有技术的不足,本发明提供一种抗hcv抗体或其抗原结合片段、其突变体、编码核酸、制备方法及应用等。
[0007]
本发明第一方面提供一种抗体或其抗原结合片段,该抗体包含:选自由如seq id no:6、8和10所示的氨基酸序列组成的组中的一种或多种氨基酸序列。
[0008]
在本发明的一个实施方式中,该抗体还包含:选自由如seq id no:12、14和16所示的氨基酸序列组成的组中的一种或多种氨基酸序列。
[0009]
在本发明的一个实施方式中,该抗体包含:分别具有如seq id no:6、seq id no:8和seq id no:10所示的氨基酸序列的三个重链cdr;具体地,该抗体包含:如seq id no:6所示的重链cdr1、seq id no:8所示的重链cdr2和seq id no:10所示的重链cdr3。
[0010]
在本发明的一个实施方式中,该抗体还包含:分别具有如seq id no:12、seq id no:14和seq id no:16所示的氨基酸序列的三个轻链cdr;具体地,该抗体包含:如seq id no:12所示的轻链cdr1、seq id no:14所示的轻链cdr2和seq id no:16所示的轻链cdr3。
[0011]
在本发明的一个具体实施方式中,该抗体包含:具有如seq id no:3所示的氨基酸序列的重链可变区。
[0012]
在本发明的一个具体实施方式中,该抗体还包含:具有如seq id no:4所示的氨基酸序列的轻链可变区。
[0013]
在本发明的一个具体实施方式中,该抗体包含:具有如seq id no:3所示的氨基酸序列的重链可变区和具有如seq id no:4所示的氨基酸序列的轻链可变区。
[0014]
在本发明的一个实施例中,该抗体为全人源单克隆抗体。
[0015]
在本发明的一个实施方式中,上述抗原结合片段选自:fab、fab'、f(ab)2、单链fv(scfv)、fv、dsfv、双抗体、fd和fd'片段。
[0016]
本发明第二方面提供一种上述抗体的突变体或其抗原结合片段,其为将上述抗体的重链和/或轻链的氨基酸序列经过一个或几个氨基酸残基的替换和/或缺失和/或添加且具有相同功能的由其衍生的抗体突变体。
[0017]
在本发明的一个实施方式中,上述抗体包含:分别具有如seq id no:6、seq id no:8和seq id no:10所示的氨基酸序列的三个重链cdr;和,分别具有如seq id no:12、seq id no:14和seq id no:16所示的氨基酸序列的三个轻链cdr;上述抗体突变体包含上述三个重链cdr和三个轻链cdr中的一个或多个cdr的突变序列,所述突变序列为:将选自如seq id no:6、8、10、12、14和16所示的氨基酸序列组成的组的一种或多种氨基酸序列经过一个或几个氨基酸残基的替换和/或缺失和/或添加且具有相同功能(例如,特异性结合hcv抗原的功能)的由其衍生的氨基酸序列。
[0018]
在本发明的一个具体实施方式中,上述突变序列为:将选自如seq id no:6、8、10、12、14和16所示的氨基酸序列组成的组的一种或多种氨基酸序列经过一个或几个氨基酸残基的替换且具有相同功能的由其衍生的氨基酸序列。
[0019]
在本发明的一个具体实施方式中,上述氨基酸残基的替换包括将选自以下氨基酸残基中的一个或多个氨基酸残基替换为其他氨基酸残基:
[0020]
(1)如seq id no:6所示的氨基酸序列的第1位氨基酸残基;
[0021]
(2)如seq id no:8所示的氨基酸序列的第1、2、6、8、10、11、13、14、15、16、17位氨
基酸残基;
[0022]
(3)如seq id no:10所示的氨基酸序列的第2、7、16位氨基酸残基;
[0023]
(4)如seq id no:12所示的氨基酸序列的第1、3、4、5、7、8、9位氨基酸残基;
[0024]
(5)如seq id no:14所示的氨基酸序列的第1、3、4、5、7位氨基酸残基;及
[0025]
(6)如seq id no:16所示的氨基酸序列的第1、2、3、4、5、6、7位氨基酸残基。
[0026]
在本发明的一个更具体实施方式中,上述氨基酸残基的替换包括将选自以下氨基酸残基中的一个或多个氨基酸残基替换为其他氨基酸残基:
[0027]
(1)如seq id no:6所示的氨基酸序列的第1位氨基酸残基;
[0028]
(2)如seq id no:8所示的氨基酸序列的第6、13、16、17位氨基酸残基;
[0029]
(3)如seq id no:10所示的氨基酸序列的第2位氨基酸残基;
[0030]
(4)如seq id no:12所示的氨基酸序列的第1、3、4、8位氨基酸残基;
[0031]
(5)如seq id no:14所示的氨基酸序列的第3、4、5、7位氨基酸残基;及
[0032]
(6)如seq id no:16所示的氨基酸序列的第2、4、5、7位氨基酸残基。
[0033]
在本发明的一个更具体实施方式中,上述氨基酸残基的替换包括将选自以下氨基酸残基中的一个或多个氨基酸残基替换为其他氨基酸残基:
[0034]
(1)如seq id no:6所示的氨基酸序列的第1位氨基酸残基;
[0035]
(2)如seq id no:8所示的氨基酸序列的第6、13、17位氨基酸残基;
[0036]
(3)如seq id no:10所示的氨基酸序列的第2位氨基酸残基;
[0037]
(4)如seq id no:12所示的氨基酸序列的第1、3、8位氨基酸残基;
[0038]
(5)如seq id no:14所示的氨基酸序列的第3、4、7位氨基酸残基;及
[0039]
(6)如seq id no:16所示的氨基酸序列的第2、5位氨基酸残基。
[0040]
在本发明的一个实施例中,上述其他氨基酸残基为丙氨酸残基。
[0041]
在本发明的一个实施方式中,上述抗原结合片段选自:fab、fab'、f(ab)2、单链fv(scfv)、fv、dsfv、双抗体、fd和fd'片段。
[0042]
本发明第三方面提供一种编码上述抗体或其抗原结合片段、上述突变体或其抗原结合片段的核酸。
[0043]
在本发明的一个实施方式中,该核酸包含:选自如seq id no:5、7和9所示的核苷酸序列组成的组中的一种或多种核苷酸序列。
[0044]
在本发明的一个实施方式中,该核酸还包含:选自如seq id no:11、13和15所示的核苷酸序列组成的组中的一种或多种核苷酸序列。
[0045]
在本发明的一个实施方式中,该核酸包含:分别具有如seq id no:5、7和9所示的核苷酸序列的编码重链cdr的核酸;具体地,该核酸包含:如seq id no:5所示的编码重链cdr1的核苷酸序列、如seq id no:7所示的编码重链cdr2的核苷酸序列和如seq id no:9所示的编码重链cdr3的核苷酸序列。
[0046]
在本发明的一个实施方式中,该核酸还包含:分别具有如seq id no:11、13和15所示的核苷酸序列的编码轻链cdr的核酸;具体地,该核酸包含:如seq id no:11所示的编码轻链cdr1的核苷酸序列、如seq id no:13所示的编码轻链cdr2的核苷酸序列和如seq id no:13所示的编码轻链cdr3的核苷酸序列。
[0047]
在本发明的一个具体实施方式中,该核酸包含:具有如seq id no:1所示的核苷酸
序列的编码重链可变区的核酸。
[0048]
在本发明的一个具体实施方式中,该核酸还包含:具有如seq id no:2所示的核苷酸序列的编码轻链可变区的核酸。
[0049]
在本发明的一个实施例中,该核酸包含:具有如seq id no:1所示的核苷酸序列的编码重链可变区的核酸和具有如seq id no:2所示的核苷酸序列的编码轻链可变区的核酸。
[0050]
本发明第四方面提供了一种制备上述抗体或上述突变体的方法,包括如下步骤:
[0051]
(1)提供表达载体,所述表达载体含有编码本发明的上述抗体的dna分子(例如本发明上述核苷酸),以及与所述dna分子可操作相连的表达调控序列;
[0052]
(2)将所述表达载体转化宿主细胞;
[0053]
(3)在适合所述抗体表达的条件下培养所述宿主细胞;
[0054]
(4)分离纯化获得所述抗体。
[0055]
在本发明的一个实施方式中,上述载体为重组表达载体。
[0056]
在本发明的一个实施方式中,上述宿主细胞为293t细胞、中国仓鼠卵巢(cho)细胞、ns0、sp2细胞、hela细胞、幼仓鼠肾(bhk)细胞、猴肾细胞(cos)、人肝癌细胞、549a细胞、3t3细胞或其他细胞系。
[0057]
本发明第五方面提供了一种与上述抗体及其突变体相关的生物材料,例如,含有编码上述抗体及其突变体的核酸的表达载体、表达盒、重组细胞、重组菌、重组病毒,等。
[0058]
在本发明的一个实施方式中,上述重组载体为重组表达载体或重组克隆载体。
[0059]
本发明第六方面提供一种药物组合物,其包含本发明上述抗体或其抗原结合片段、上述突变体或其抗原结合片段,及一种或多种药学上可接受的辅料。
[0060]
在本发明的一个实施方式中,上述药物组合物为注射剂,例如,液体注射剂、注射用粉剂、注射用片剂等。
[0061]
在本发明的一个实施例中,上述药物组合物为溶液型注射剂,所述药学上可接受的辅料为药学上可接受的注射剂辅料,例如,等渗的无菌盐溶液(磷酸二氢钠、磷酸氢二钠、氯化钠、氯化钾、氯化钙、氯化镁等,或上述盐的混合物)。
[0062]
在本发明的一个实施例中,上述药物组合物为注射用冻干制剂,上述药学上可接受的辅料可包含冻干赋形剂等。
[0063]
本发明所述药学上可接受的辅料还可包含少量的辅助物质,如,润湿剂、乳化剂、ph缓冲剂、抗氧化剂、增溶剂等,例如:柠檬酸、脱水山梨醇单月桂酸酯、三乙醇胺油酸酯、丁基化羟基甲苯等。
[0064]
本发明第七方面提供一种本发明上述抗体或其抗原结合片段、上述突变体或其抗原结合片段、上述生物材料(例如,重组载体、表达盒、重组细胞、重组菌、重组病毒,等)、以及上述药物组合物在制备用于预防和/或治疗hcv相关疾病的药物中的应用。
[0065]
在本发明的一个实施方式中,上述hcv相关疾病为丙型肝炎。
[0066]
本发明第八方面提供一种试剂盒,可用于检测hcv,其包含本发明上述抗体或上述突变体或其抗原结合片段。
[0067]
本发明第九方面提供一种本发明上述抗体或其抗原结合片段、上述突变体或其抗原结合片段、及上述试剂盒在检测hcv中的应用。
[0068]
本发明第十方面提供一种预防和/或治疗hcv相关疾病的方法,其包括对有此需要的患者给与治疗有效量的本发明上述抗体或其抗原结合片段、上述突变体或其抗原结合片段或上述药物组合物的步骤。
[0069]
本发明第十一方面提供一种检测hcv的方法,其包括利用本发明上述抗体或其抗原结合片段、上述突变体或其抗原结合片段或上述试剂盒与待测样品接触,获得hcv的存在情况以及存在量的步骤。
[0070]
本发明还涉及含有上述抗体及其突变体的单个重链和/或单个轻链的单域抗体、嵌合抗体、抗体融合蛋白抗体、抗体/抗体片段-因子融合蛋白或抗体/抗体片段-化学偶联物。
[0071]
本发明提供的抗hcv抗体优选为全人源的,与其它动物源性(如鼠源性)的抗hcv抗体相比,因物种差异导致的免疫原性大大减少,且特异性好、亲和力高,如果用于临床将大大降低副作用。并且,发明人将上述抗体进行点突变,得到一系列与该抗体的灵敏度相似、相同甚至提高达约50%的突变体。本发明提供的抗hcv抗体为更适合中国流行亚型的广谱中和抗体,可以为我国的hcv诊断、治疗和疫苗事业提供重要的技术支持。
附图说明
[0072]
图1所示为抗体hnc-43纯化后的电泳图。
[0073]
图2所示为通过elisa实验检测抗体hnc-43与e2c(1b)的结合的结果。
[0074]
图3所示为通过elisa实验检测抗体hnc-43与e2c(7种亚型)的结合的结果。
[0075]
图4所示为抗体hnc-43与hcvcc(7种亚型)的中和能力。
[0076]
图5所示为抗体hnc-43的cdr分析结果,其中hnc-43-h为抗体hnc-43的重链,hnc-43-k为抗体hnc-43的轻链。
[0077]
图6所示为抗体hnc-43的重链的丙氨酸扫描实验结果。
[0078]
图7所示为抗体hnc-43的轻链的丙氨酸扫描实验结果。
具体实施方式
[0079]
除非另有定义,本发明中所使用的所有科学和技术术语具有与本发明涉及技术领域的技术人员通常理解的相同的含义。
[0080]
下面将结合本发明实施例,对本发明的技术方案进行清楚、完整地描述,显然,所描述的实施例仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
[0081]
实施例1抗体hnc-43的制备
[0082]
1、人工合成hnc-43的重链可变区和轻链可变区
[0083]
按照序列如seq id no:1所示的单克隆抗体hnc-43的重链可变区、序列如seq id no:2所示的单克隆抗体hnc-43的轻链可变区的核酸序列送genewiz公司人工合成。
[0084]
将人工合成得到的抗体hnc-43的重链可变区、轻链可变区作为模板,分别加入taq酶和dntps,以及引物,进行pcr,得到pcr产物。
[0085]
2、重组抗体的表达载体的构建
[0086]
利用快速dna产物纯化试剂盒(购自康为世纪)回收pcr产物,得到40μl pcr产物待用。
[0087]
分别对抗体hnc-43的重链可变区、轻链可变区目的片段进行双酶切,双酶切体系为:nhe-/not-各0.5μl、10*x fast digest green reaction buffer 3μl以及pcr产物26μl,37℃恒温5h。
[0088]
对改造好的表达载体(表达载体为pcdna3.1-zeo(+)(invitrogen公司),由genewiz公司预先将人抗体重链/轻链的恒定区改造到此表达载体中)进行双酶切,双酶切体系为:nhe-/not-各0.5μl、10*x fast digest green reaction buffer 3μl、载体1μg、用h
2
o补齐30μl,37℃恒温30min。然后加入2μl碱性磷酸酶和3.5μl 10*x buffer(neb)混匀,37℃恒温水浴2h。
[0089]
上述目的片段和载体的双酶切体系中所使用的nhe-、not-、10*x fast digest green reaction buffer均购自thermo scientific。
[0090]
对将酶切后的抗体hnc-43的重链可变区、轻链可变区目的片段分别进行1%琼脂糖凝胶电泳,并通过紫外仪观察结果。将目的条带切下放入一个称量好重量的ep管中,利用快速琼脂糖凝胶dna回收试剂盒(购自康为世纪)回收各个目的片段。
[0091]
将各个目的片段分别和载体进行连接,连接体系为:载体2μl、目的片段15μl、t4dna ligase(购自neb)1μl、缓冲液2μl,混匀后16℃恒温水浴保持2h。
[0092]
将每个目的片段的所有连接产物加入到e.coli dh5α感受态细胞中,轻轻混匀,冰浴30min。42℃热激90s后,迅速置于冰浴5min。然后加入800μl lb培养基,37℃振荡(100rpm)温育1h。将培养菌液10000rpm离心15s,去除800μl上清,重悬沉淀,全部涂布于含氨苄青霉素钠(100μg/ml)的lb固体培养基上,37℃培养过夜至菌落清晰。挑取单菌落接种到5ml含氨苄青霉素钠(100μg/ml)的lb培养基中,37℃振荡培养15h。利用高纯度质粒小提试剂盒(购自康为世纪)提取质粒,获得分别含有hnc-43的重链、hnc-43的轻链的质粒,并送样测序。
[0093]
测序结果显示单克隆抗体hnc-43的重链可变区、轻链可变区的核酸序列分别如seq id no:1和seq id no:2所示,其相应的重链可变区、轻链可变区的氨基酸序列分别如seq id no:3和seq id no:4所示。
[0094]
实施例2抗体hnc-43的表达和纯化
[0095]
用实施例1中获得的含有hnc-43的重链的质粒和含有hnc-43的轻链的质粒分别转染293t细胞。先用opti-mem(1x)buffer分别稀释质粒和pei,然后将pei-opti-mem混合物缓慢加入到质粒-opti-mem混合物管中,室温静置20分钟后,再将pei和质粒混合物加入到细胞悬液中。转染时细胞浓度为0.25~0.5
×
10
6
个细胞/ml,每孔细胞的转染使用2.5μg含有hnc-43重链的质粒+2.5μg含有hnc-43轻链的质粒+10μg pei。转染结束后在37℃培养48h后收获上清,用elisa检测上清。
[0096]
使用rprotein a sepharose fast flow(ge)纯化表达的抗体蛋白。分别收集表达hnc-43的293t细胞培养物上清,10000rpm,4℃离心10min,取上清,将该上清加入到已用pbs缓冲液(20mm磷酸盐缓冲液,150mm氯化钠,ph7.4)平衡好的rprotein a sepharose fast flow柱上,用同样的平衡缓冲液洗10个床体积,再用洗脱缓冲液(0.1m gly-hcl缓冲液,ph2.5)流洗5个床体积,收集前3个床体积,向收集的洗脱液中加入其体积的1/10的中和液
(1m tris-hcl缓冲液,ph9.0)混匀,加入到amicon ultra-15centrifugal filters(merck millipore)中,5000g、4℃离心20min,浓缩蛋白,再向amicon ultra-15centrifugal filters中加入上述平衡缓冲液,5000g、4℃离心20min,更换新的平衡缓冲液,重复3次,分别获得浓缩后的hnc-43抗体蛋白,将其分别转到1.5ml离心管中,取样测定蛋白质含量,然后置于4℃保存。
[0097]
分别取纯化的hnc-43抗体进行电泳,结果如图1所示,其中泳道m是标准蛋白;泳道hnc-43是纯化的抗体hnc-43,其中有两个明显条带,分别是约48kda的重链和约22kda的轻链。
[0098]
实施例3抗体hnc-43的elisa检测
[0099]
所用试剂包括:
[0100]
pbs(1x):用pbs(10x)和去离子水配置。
[0101]
pbst:pbs(1x)加tween-20至终浓度为0.05%。
[0102]
封闭液:pbs(1x)+2%bsa+2%新生小牛血清,现用现配。
[0103]
稀释液:pbst+1%bsa,稀释抗体用。
[0104]
终止液:将6ml 95%-98%的浓硫酸慢慢加入180ml水中,冷却后备用。
[0105]
一抗:本发明制备得到的抗体hnc-43,稀释成工作浓度为10μg/ml。
[0106]
perperoxidase-conjugated affinipure goat anti-human igg(h+l)(购自jackson immuno research),取1.5ml的无rnase水完全溶解后,备用。
[0107]
用pbs(1x)(ph7.4)缓冲液稀释e2c亚型(1ae2c、1be2c、2ae2c、3ae2c、4ae2c、5ae2c、6ae2c)作为包被抗原,使包被抗原溶液的终浓度为2ng/μl,吸取100μl包被抗原溶液加入到96孔板的每孔中,2-8℃包被过夜,用pbst清洗5次,然后每孔加入200μl封闭液,37℃封闭2h,封闭结束后用pbst清洗5次,每次停留1分钟。
[0108]
用抗体稀释液(pbst+1%bsa)将一抗做10倍稀释:即取7个高压灭菌的1.5ml离心管,每一管加入270μl的抗体稀释液,从工作溶液中取30μl一抗溶液,涡旋震荡混匀后,标记为1:10稀释,从1:10稀释的溶液中取30μl放入下一管中,以此类推,分别为:1:10、1:100、1:1000、1:10000、1:100000、1:1000000、1:10000000,分别加到相应的孔中,每孔100μl,做两个平行,并设立两个空白孔用pbst代替一抗,37℃孵育90min,然后用pbst清洗5遍。
[0109]
用抗体稀释液(pbst+1%bsa)将二抗做5000倍稀释,每孔加入100μl,37℃孵育1h,然后用pbst清洗5遍,加入tmb显色液,100μl/孔,室温孵育15min,孵育结束后加入h
2
so
4
终止液终止反应。在酶标仪上读取od
450
读数。
[0110]
通过graphpad prism软件分析上述elisa结果,获得抗体hnc-43以及抗体ar3a(law m,maruyama t,lewis j,et al.broadly neutralizing antibodies protect against hepatitis c virus quasispecies challenge[j].nature medicine,2008,14(1):25.)的ec
50
值。实验结果分别如图2和3所示。
[0111]
结果显示,表达和纯化的抗体hnc-43与7种亚型e2c的结合具有剂量依赖性,说明抗体hnc-43与e2c的结合是特异性的。
[0112]
从附图2可以看出,抗体hnc-43与1be2c的ec
50
值为0.04718μg/ml,略低于ar3a的ec
50
值0.01994μg/ml(用ar3a以相同条件进行elisa并用graphpad prism软件分析获得)。但从附图3可以看出,抗体hnc-43与1ae2c、2ae2c、4ae2c、5ae2c、6ae2c的ec
50
值在0.001646至
0.006662μg/ml之间,均远低于与1be2c的ec
50
值0.04718μg/ml,仅与3ae2c的ec
50
值为3.1μg/ml,偏高于1be2c。综上所述,虽然本发明的抗体hnc-43对1be2c的结合比ar3a具有稍弱的灵敏度,但是在各亚型e2c之间的结合具有非常强的广谱性。
[0113]
实施例4抗体hnc-43的中和活性检测
[0114]
检测抗体hnc-43对hcv病毒7种亚型(1a:tncc、1b:j6/jfh1、2a:j8cc、3a:s52、4a:ed43、5a:sa13、6a:hk6a)的中和活性。
[0115]
实验方法:
[0116]
将培养好的huh7.5细胞分别加入到96孔板中,控制细胞密度6
×
10
3
细胞/孔,24小时后,梯度加入受检抗体和孵育1h的特定体积病毒颗粒,继续在37℃下培养48h。
[0117]
以hep c cag(c7-50)(santa cruz biotechnology)用作hcv核心蛋白免疫荧光的一抗,alexa fluor 488(santa cruz biotechnology)用作第二抗体。使用荧光显微镜计数hcv抗原阳性细胞的数量,将其数量表示抗体中和活性的能力。
[0118]
在抗体浓度50μg/ml下,未中和超过50%或90%病毒感染性的抗体被认为是阴性。结果如图4所示。
[0119]
结果显示,抗体hnc-43可以中和全部7种亚型。如图4中所示,hnc-43的ic
50
滴度范围为0.005至2.246μg/ml;在90%中和水平(ic
90
),hnc-43滴度范围为0.057至27.351μg/ml。有趣的是,即使在结合力方面较弱,hnc-43和3ahcvcc的ic
50
滴度(0.25μg/ml)却优于1bhcvcc的ic
50
滴度(2.246μg/ml)。总之,从结果可以明显看出抗体hnc-43具有良好的广谱中和活性。
[0120]
实施例5抗体hnc-43的cdr的测定
[0121]
将抗体hnc-43的可变区域序列信息导入igblast程序(version 1.6.1)中与人类可变区域原始序列文库进行对比分析,抗体的可变区域被进一步划分出4个构架区(fr)和3个互补性决定区(cdr)。然后将抗体序列导入imgt high v-quest系统中使用之前相同的文库进行比对确定出cdr3和fr。所有抗体序列的数字标定都是基于kabat系统。分析对比结果如图5所示。
[0122]
结果表明,该抗体的重链cdr1、cdr2和cdr3的氨基酸序列分别为seq id no:6、seq id no:8和seq id no:10,其对应的核苷酸序列分别为seq id no:5、seq id no:7和seq id no:9;轻链cdr1、cdr2和cdr3的氨基酸序列分别为seq id no:12、seq id no:14和seq id no:16,其对应的核苷酸序列分别为seq id no:11、seq id no:13和seq id no:15。
[0123]
实施例6抗体hnc-43的丙氨酸扫描
[0124]
分别将抗体hnc-43的重链和轻链提交kabat数据库,用kabat编号表示重链cdr区和轻链cdr区各氨基酸的排列顺序。分别将cdr区非丙氨酸的氨基酸逐个点突变为丙氨酸,将构建成功的表达载体送genewiz公司按要求做点突变。所得突变抗体的突变位点和编号如下表1和2所示。
[0125]
表1突变抗体的突变位点和编号
[0126][0127]
表2突变抗体的突变位点和编号
[0128][0129]
分别用含有hnc-43重链(或者轻链)的cdr区点突变质粒和对应的hnc-43轻链(或者重链)野生型质粒共转染293t细胞,并同时用野生型hnc-43重链和野生型hnc-43轻链质粒共转染293t细胞做对照。先用opti-mem(1x)buffer分别稀释质粒和pei,然后将pei-opti-mem混合物缓慢加入到质粒-opti-mem混合物管中,室温静置20分钟后,再将pei和质粒混合物缓慢滴入到细胞培养上清中。转染时细胞浓度为0.25~0.5
×
10
6
个细胞/ml,每孔
细胞的转染使用1.25μg hnc-43重链(或者轻链)的cdr区突变质粒(或者野生型质粒)+1.25μg hnc-43轻链(或者重链)野生型质粒+5μg pei,转染结束后在37℃培养48h后收获上清,用elisa检测上清。
[0130]
所用试剂包括:
[0131]
pbs(1x):用pbs(10x)和去离子水配置。
[0132]
pbst:pbs(1x)加tween-20至终浓度为0.05%。
[0133]
封闭液:pbs(1x)+2%bsa+2%新生小牛血清,现用现配。
[0134]
稀释液:pbst+1%bsa,稀释抗体用。
[0135]
终止液:将6ml 95%-98%的浓硫酸慢慢加入180ml水中,冷却后备用。
[0136]
一抗:本实施例中获取的hnc-43丙氨酸扫描表达上清。
[0137]
二抗:a0293-1ml,lot086m4775v,anti-human igg(fab specific-peroxidase antibody produced in goat.
[0138]
igg(fc),sigma,sab3701275-5mg,lot:ri34115。
[0139]
用pbs(1x)(ph7.4)缓冲液稀释包被1be2c和igg(fc),使包被1be2c抗原溶液和igg(fc)抗体的终浓度为2ng/μl,吸取100μl溶液加入到96孔板的每孔中,2-8℃包被过夜,即抗原溶液和igg(fc)抗体各自包被一块96孔板,用pbst清洗5次,然后每孔加入200μl封闭液,37℃封闭2h,封闭结束后用pbst清洗5次,每次停留1分钟。
[0140]
用抗体稀释液(pbst+1%bsa)将一抗做合适的稀释1:125和1:625,分别加到相应的孔中,每孔100μl,做两个平行,并设立两个空白孔用pbst代替一抗,37℃孵育90min,然后用pbst清洗5遍。
[0141]
用抗体稀释液(pbst+1%bsa)将二抗做5000倍稀释,每孔加入100μl,37℃孵育1h,然后用pbst清洗5遍,加入tmb显色液,100μl/孔,室温孵育15min,孵育结束后加入h
2
so4终止液终止反应。在酶标仪上读取od450nm读数,通过graphpad prism软件分析上述elisa结果获取每个点突变对抗体结合力的影响。实验结果如图6和7所示,其中hnc-43wt表示抗体hnc-43,其作为对照,实验样品为相应位点突变为丙氨酸的抗体。
[0142]
如图6所示,在相对结合力(倍数变化)在0.5以上的前提下,抗体hnc-43中,如seq id no:6所示的重链cdr1的氨基酸序列中,第1位的氨基酸可以被替换为其他氨基酸(例如丙氨酸),且替换后抗体灵敏度可提高约50%;如seq id no:8所示的重链cdr2的氨基酸序列中,选自第1、2、6、8、10、11、13-17位的氨基酸可以被替换为其他氨基酸(例如丙氨酸),特别是第6、13、16、17位氨基酸被替换为其他氨基酸(例如丙氨酸)时,替换后抗体灵敏度可提高;如seq id no:10所示的重链cdr3的氨基酸序列中,选自第2、7、16位的氨基酸可以被替换为其他氨基酸(例如丙氨酸),特别是第2位氨基酸被替换为其他氨基酸(例如丙氨酸)时,替换后抗体灵敏度可提高约50%。
[0143]
如图7所示,抗体hnc-43中,如seq id no:12所示的轻链cdr1的氨基酸序列中,选自第1、3-5、7-9位的氨基酸都可以被替换为其他氨基酸(例如丙氨酸),特别是第1、3、4、8位氨基酸被替换为其他氨基酸(例如丙氨酸)时,替换后抗体灵敏度可提高;如seq id no:14所示的轻链cdr2的氨基酸序列中,选自第1、3-5、7位的氨基酸可以被替换为其他氨基酸(例如丙氨酸),特别是第3-5、7位氨基酸被替换为其他氨基酸(例如丙氨酸)时,替换后抗体灵敏度可提高;如seq id no:16所示的轻链cdr3的氨基酸序列中,选自第1-7位的氨基酸可以
被替换为其他氨基酸(例如丙氨酸),特别是第2、4、5位氨基酸被替换为其他氨基酸(例如丙氨酸)时,替换后抗体灵敏度可提高,第7位氨基酸被替换为其他氨基酸(例如丙氨酸)时,替换后抗体灵敏度与替换前几乎相同。
[0144]
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换等,均应包含在本发明的保护范围之内。
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询

tips


 商标分类
商标分类  商标转让
商标转让 



