一个控制植物器官大小关键元器件SLB1的发掘与应用的制作方法
 2021-02-02 16:02:32|
2021-02-02 16:02:32| 401|
401| 起点商标网
起点商标网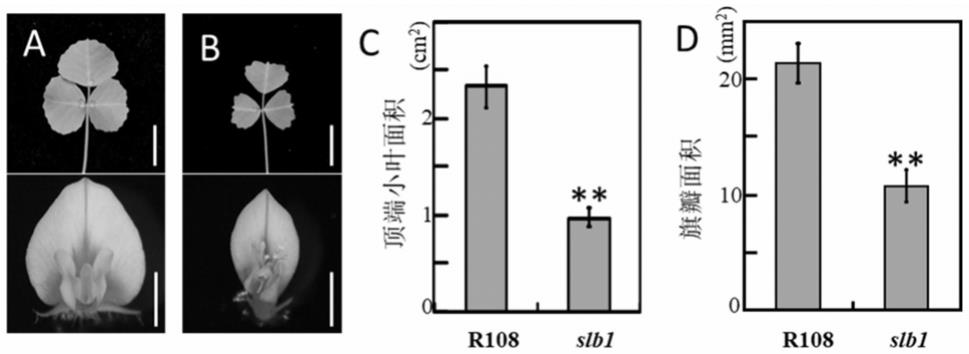
一个控制植物器官大小关键元器件slb1的发掘与应用
技术领域
[0001]
本发明涉及生物技术领域,具体涉及一个控制植物器官大小关键元器件slb1的发掘与应用。
背景技术:
[0002]
植物器官大小的调控是发育生物学的基本问题之一,植物器官的大小直接影响到作物产量及生物量。研究植物器官大小调控机制对于解析植物器官发育过程具有重要理论意义,同时对提高作物产量及生物量具有现实意义。
[0003]
蒺藜苜蓿medicago truncatula作为一年生放牧型牧草和重要的豆科模式植物,与大豆和紫花苜蓿等重要豆科作物和牧草具有良好的共线性,在蒺藜苜蓿中器官大小的研究成果能够直接应用于大豆、紫花苜蓿等豆科作物和牧草的产量和生物量遗传改良。
技术实现要素:
[0004]
本发明的目的是如何调控植物器官的大小。
[0005]
为了实现上述目的,本发明首先保护一种蛋白质。
[0006]
本发明提供的蛋白质来源于蒺藜苜蓿medicago truncatula,名称为slb1蛋白质,是如下a)或b)或c)或d)的蛋白质:
[0007]
a)氨基酸序列是序列2所示的蛋白质;
[0008]
b)在序列2所示的蛋白质的n端和/或c端连接标签得到的融合蛋白质;
[0009]
c)将序列2所示的氨基酸序列经过一个或几个氨基酸残基的取代和/或缺失和/或添加得到的具有相同功能的蛋白质;
[0010]
d)与序列2所示的氨基酸序列具有75%或75%以上的同源性且具有相同功能的蛋白质。
[0011]
为了使a)中的蛋白质便于纯化,可在序列表中序列2所示的蛋白质的氨基末端或羧基末端连接上如表1所示的标签。
[0012]
表1、标签的序列
[0013]
标签残基序列poly-arg5-6(通常为5个)rrrrrpoly-his2-10(通常为6个)hhhhhhflag8dykddddkstrep-tag ii8wshpqfekc-myc10eqkliseedl
[0014]
上述c)中的蛋白质slb1,所述一个或几个氨基酸残基的取代和/或缺失和/或添加为不超过10个氨基酸残基的取代和/或缺失和/或添加。
[0015]
上述c)中的蛋白质slb1可人工合成,也可先合成其编码基因,再进行生物表达得
到。
[0016]
上述c)中的蛋白质slb1的编码基因可通过将序列1所示的dna序列中缺失一个或几个氨基酸残基的密码子,和/或进行一个或几个碱基对的错义突变,和/或在其5
′
端和/或3
′
端连上表1所示的标签的编码序列得到。
[0017]
为了实现上述目的,本发明又提供了与slb1蛋白质相关的生物材料。
[0018]
本发明提供的与slb1蛋白质相关的生物材料为下述a1)至a12)中的任一种:
[0019]
a1)编码slb1蛋白质的核酸分子;
[0020]
a2)含有a1)所述核酸分子的表达盒;
[0021]
a3)含有a1)所述核酸分子的重组载体;
[0022]
a4)含有a2)所述表达盒的重组载体;
[0023]
a5)含有a1)所述核酸分子的重组微生物;
[0024]
a6)含有a2)所述表达盒的重组微生物;
[0025]
a7)含有a3)所述重组载体的重组微生物;
[0026]
a8)含有a4)所述重组载体的重组微生物;
[0027]
a9)含有a1)所述核酸分子的转基因植物细胞系;
[0028]
a10)含有a2)所述表达盒的转基因植物细胞系;
[0029]
a11)含有a3)所述重组载体的转基因植物细胞系;
[0030]
a12)含有a4)所述重组载体的转基因植物细胞系。
[0031]
上述生物材料中,a1)所述核酸分子为如下1)或2)或3)所示的基因:
[0032]
1)其编码序列是序列1所示的cdna分子或序列3第2401-7228位所示的基因组dna分子;
[0033]
2)与1)限定的核苷酸序列具有75%或75%以上同一性,且编码slb1蛋白质的cdna分子或基因组dna分子;
[0034]
3)在严格条件下与1)或2)限定的核苷酸序列杂交,且编码slb1蛋白质的cdna分子或基因组dna分子。
[0035]
其中,所述核酸分子可以是dna,如cdna、基因组dna或重组dna;所述核酸分子也可以是rna,如mrna或hnrna等。
[0036]
本领域普通技术人员可以很容易地采用已知的方法,例如定向进化和点突变的方法,对本发明的编码slb1蛋白质的核苷酸序列进行突变。那些经过人工修饰的,具有与本发明分离得到的slb1的核苷酸序列75%或者更高同一性的核苷酸,只要编码slb1且具有相同功能,均是衍生于本发明的核苷酸序列并且等同于本发明的序列。
[0037]
这里使用的术语“同一性”指与天然核酸序列的序列相似性。“同一性”包括与本发明的编码序列2所示的氨基酸序列组成的蛋白质的核苷酸序列具有75%或更高,或80%或更高,或85%或更高,或90%或更高,或95%或更高同一性的核苷酸序列。同一性可以用肉眼或计算机软件进行评价。使用计算机软件,两个或多个序列之间的同一性可以用百分比(%)表示,其可以用来评价相关序列之间的同一性。
[0038]
上述生物材料中,a2)所述的含有编码slb1蛋白质的核酸分子的表达盒(slb1基因表达盒),是指能够在宿主细胞中表达slb1的dna,该dna不但可包括启动slb1转录的启动子,还可包括终止slb1转录的终止子。进一步的,所述表达盒还可包括增强子序列。可用于
本发明的启动子包括但不限于:组成型启动子;组织、器官和发育特异的启动子及诱导型启动子。合适的转录终止子包括但不限于:农杆菌胭脂碱合成酶终止子(nos终止子)、花椰菜花叶病毒camv 35s终止子、tml终止子及豌豆rbcs e9终止子。
[0039]
可用现有的表达载体构建含有所述slb1基因表达盒的重组载体。所述植物表达载体包括双元农杆菌载体和可用于植物微弹轰击的载体等。如pahc25、pbin438、pcambia1302、pcambia2300、pcambia2301、pcambia1301、pcambia1300、pbi121、pcambia1391-xa或pcambia1391-xb(cambia公司)等。所述植物表达载体还可包含外源基因的3
′
端非翻译区域,即包含聚腺苷酸信号和任何其它参与mrna加工或基因表达的dna片段。所述聚腺苷酸信号可引导聚腺苷酸加入到mrna前体的3
′
端,如农杆菌冠瘿瘤诱导(ti)质粒基因(如胭脂碱合成酶基因nos)、植物基因(如大豆贮存蛋白基因)3
′
端转录的非翻译区均具有类似功能。使用本发明的基因构建植物表达载体时,还可使用增强子,包括翻译增强子或转录增强子,这些增强子区域可以是atg起始密码子或邻接区域起始密码子等,但必需与编码序列的阅读框相同,以保证整个序列的正确翻译。所述翻译控制信号和起始密码子的来源是广泛的,可以是天然的,也可以是合成的。翻译起始区域可以来自转录起始区域或结构基因。为了便于对转基因植物细胞或植物进行鉴定及筛选,可对所用植物表达载体进行加工,如加入可在植物中表达的编码可产生颜色变化的酶或发光化合物的基因(gus基因、萤光素酶基因等)、抗生素的标记基因(如赋予对卡那霉素和相关抗生素抗性的nptii基因,赋予对除草剂膦丝菌素抗性的bar基因,赋予对抗生素潮霉素抗性的hph基因,和赋予对氨甲喋呤抗性的dhfr基因,赋予对草甘磷抗性的epsps基因)或是抗化学试剂标记基因等(如抗除莠剂基因)、提供代谢甘露糖能力的甘露糖-6-磷酸异构酶基因。从转基因植物的安全性考虑,可不加任何选择性标记基因,直接以逆境筛选转化植株。
[0040]
上述生物材料中,所述载体可为质粒、黏粒、噬菌体或病毒载体。在本发明中,所述重组表达载体为将上述slb1基因或slb1基因表达盒插入pearleygate203载体或pcambia2300载体中得到的重组载体。
[0041]
上述生物材料中,所述微生物可为酵母、细菌、藻或真菌;所述细菌可为农杆菌;所述农杆菌具体可为agl1菌株或eha105菌株。
[0042]
上述生物材料中,所述转基因植物细胞系均不包括繁殖材料。
[0043]
为了实现上述目的,本发明还提供了上述slb1蛋白质或相关生物材料的新用途。
[0044]
本发明提供了上述slb1蛋白质或相关生物材料在如下m1)-m5)中任一种中的应用:
[0045]
m1)调控植物器官大小和/或植物器官发育;
[0046]
m2)调控植物产量和/或生物量;
[0047]
m3)培育植物器官增大的转基因植物;
[0048]
m4)培育植物器官减小的转基因植物;
[0049]
m5)植物育种。
[0050]
上述应用中,所述植物器官可为种子和/或叶片和/或花。
[0051]
所述调控植物器官大小为调控植物种子大小和/或调控植物叶片面积和/或调控植物花面积。
[0052]
所述种子大小具体为种子百粒重或十粒重。
[0053]
所述叶片面积具体为小叶面积,更具体为从植株顶端往下第五个可见叶顶端的小叶面积。
[0054]
所述花面积具体为花旗瓣面积。
[0055]
所述调控具体为增大或减少。
[0056]
所述植物育种的目的为增大植物器官和/或提高植物产量和/或生物量。
[0057]
为了实现上述目的,本发明还提供了一种培育植物器官减小的转基因植物的方法。
[0058]
本发明提供的培育植物器官减小的转基因植物的方法包括降低受体植物中slb1蛋白质的表达量和/或活性,得到转基因植物的步骤;所述转基因植物的植物器官小于所述受体植物。
[0059]
进一步的,所述转基因植物的植物器官小于所述受体植物体现在所述转基因植物的叶片面积和/或花面积小于所述受体植物;
[0060]
所述降低受体植物中slb1蛋白质的表达量和/或活性的方法是通过沉默或抑制受体植物基因组中slb1蛋白质的编码基因的表达和/或活性或敲除slb1蛋白质的编码基因来实现;
[0061]
所述沉默或抑制受体植物基因组中slb1蛋白质的编码基因的表达和/或活性或敲除slb1蛋白质的编码基因为突变受体植物基因组中slb1蛋白质的编码基因使受体植物基因组中slb1蛋白质的编码基因表达量降低或使受体植物基因组中slb1蛋白质的编码基因发生缺失突变或插入突变或碱基替换。
[0062]
更进一步的,所述使受体植物基因组中slb1蛋白质的编码基因发生缺失突变或插入突变或碱基替换的方法可为tnt1插入。
[0063]
为了实现上述目的,本发明最后还提供了一种培育植物器官增大的转基因植物的方法。
[0064]
本发明提供的培育植物器官增大的转基因植物的方法包括提高受体植物中slb1蛋白质的表达量和/或活性,得到转基因植物的步骤;所述转基因植物的植物器官大于所述受体植物。
[0065]
进一步的,所述转基因植物的植物器官大于所述受体植物体现在所述转基因植物的种子大小和/或叶片面积和/或花面积大于所述受体植物。
[0066]
所述种子大小具体为种子百粒重或十粒重。
[0067]
所述叶片面积具体为小叶面积,更具体为从植株顶端往下第五个可见叶顶端的小叶面积。
[0068]
所述花面积具体为花旗瓣面积。
[0069]
所述提高受体植物中slb1蛋白质的表达量和/或活性的方法为在受体植物中过表达slb1蛋白质;
[0070]
所述过表达的方法为将slb1蛋白质的编码基因导入受体植物。
[0071]
在本发明的一个具体实施例中,所述slb1蛋白质的编码基因通过过表达载体35s:gfp-slb1导入受体植物。所述过表达载体35s:gfp-slb1为将序列4所示的gfp-slb1片段(序列4第805-2247位为slb1cds片段)重组到pearleygate203载体的attb1位点和attb2位点之间得到的载体。
[0072]
在本发明的另一个具体实施例中,所述slb1蛋白质的编码基因通过gslb1互补载体导入受体植物。所述gslb1互补载体为将pcambia2300载体的ecori和smai酶切位点间的dna片段替换为序列3所示的dna片段(序列3第2401-7228位为slb1gdna)后得到的载体。
[0073]
上述任一所述的应用或方法中,所述slb1蛋白质的编码基因的核苷酸序列为序列1所示的dna分子或序列3第2401-7228位所示的dna分子。
[0074]
上述任一所述的应用或方法中,所述转基因植物理解为不仅包含将所述slb1基因转化受体植物得到的第一代转基因植物,也包括其子代。对于转基因植物,可以在该物种中繁殖该基因,也可用常规育种技术将该基因转移进入相同物种的其它品种,特别包括商业品种中。所述转基因植物包括种子、愈伤组织、完整植株和细胞。
[0075]
上述任一所述的应用或方法中,所述植物为单子叶植物或双子叶植物;进一步的,所述双子叶植物可为苜蓿、大豆等豆科植物;更进一步的,所述苜蓿可为蒺藜苜蓿或紫花苜蓿。在本发明的具体实施例中,所述蒺藜苜蓿具体可为野生型蒺藜苜蓿r108或slb1突变体;所述大豆具体可为大豆栽培种(glycine max)williams 82。
[0076]
本发明提供了一种与植物器官大小相关的slb1基因,通过将slb1基因导入叶片及花器官变小的slb1突变体中发现,突变体互补植株叶片和花大小恢复到野生型水平,通过将slb1基因导入野生型蒺藜苜蓿和大豆中发现,slb1基因过表达可以增大蒺藜苜蓿和大豆的种子大小及叶片、花面积。本发明提供的slb1基因为人为控制植物器官大小提供了基础,将在培育生物量或产量提高的植物中发挥重要的作用。
附图说明
[0077]
图1为野生型蒺藜苜蓿r108及slb1突变体的叶片和花面积比较。a和b为野生型蒺藜苜蓿r108及slb1突变体的叶片和花面积的表型。标尺分别为1cm、2mm(从上往下)。c为野生型蒺藜苜蓿r108及slb1突变体复叶顶端小叶面积统计。数据以平均值
±
sd表示,n=15,student
’
s t-test,**p<0.01。d为野生型蒺藜苜蓿r108及slb1突变体旗瓣面积统计。数据以平均值
±
sd表示,n=15,student
’
s t-test,**p<0.01。
[0078]
图2为野生型蒺藜苜蓿r108、slb1突变体及突变体互补植株gslb1/slb1的叶片和花面积比较。a为野生型蒺藜苜蓿r108、slb1突变体及突变体互补植株gslb1/slb1的叶片及花表型。标尺分别为1cm、2mm(从上往下)。b为野生型蒺藜苜蓿r108、slb1突变体及突变体互补植株gslb1/slb1中的slb1表达量检测。c为野生型蒺藜苜蓿r108、slb1突变体及突变体互补植株gslb1/slb1的叶片面积统计。数据以平均值
±
sd表示,n=15,student
’
s t-test,**p<0.01。d为野生型蒺藜苜蓿r108、slb1突变体及突变体互补植株gslb1/slb1的旗瓣面积统计。数据以平均值
±
sd表示,n=15,student
’
s t-test,**p<0.01。
[0079]
图3为slb1过表达能够使蒺藜苜蓿器官增大。a为野生型蒺藜苜蓿r108和转slb1蒺藜苜蓿的叶片、花和种子表型。标尺分别为1cm、2mm、2mm(从上往下)。b为野生型蒺藜苜蓿r108和转slb1蒺藜苜蓿中的slb1表达量检测。c为野生型蒺藜苜蓿r108和转slb1蒺藜苜蓿的叶片面积统计。数据以平均值
±
sd表示,n=15,student
’
s t-test,**p<0.01。d为野生型蒺藜苜蓿r108和转slb1蒺藜苜蓿的旗瓣面积统计。数据以平均值
±
sd表示,n=15,student
’
s t-test,**p<0.01。e为野生型蒺藜苜蓿r108和转slb1蒺藜苜蓿的百粒重统计。数据以平均值
±
sd表示,n=3,student
’
s t-test,**p<0.01。
[0080]
图4为大豆中异源过表达slb1能够使叶片和种子增大。a为野生型大豆williams 82和转slb1大豆的叶片和种子表型。标尺分别为5cm、1cm(从上往下)。b为野生型大豆williams 82和转slb1大豆中的slb1表达量检测。c为野生型大豆williams 82和转slb1大豆的叶片面积统计。数据以平均值
±
sd表示,n=5,student
’
s t-test,**p<0.01。d为野生型大豆williams 82和转slb1大豆的百粒重统计。数据以平均值
±
sd表示,n=6,student
’
s t-test,**p<0.01。
具体实施方式
[0081]
以下的实施例便于更好地理解本发明,但并不限定本发明。下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的试验材料,如无特殊说明,均为自常规生化试剂商店购买得到的。以下实施例中的定量试验,均设置三次重复实验,结果取平均值。
[0082]
下述实施例中的野生型蒺藜苜蓿r108记载于文献:tadege m,wen j,he j,et al.large-scale insertional mutagenesis using the tnt1 retrotransposon in the model legume medicago truncatula[j].the plant journal,2008,54(2):335-347中,公众可从申请人处获得,该生物材料只为重复本发明的相关实验所用,不可作为其它用途使用。
[0083]
下述实施例中的大豆栽培种(glycine max)williams 82记载于文献:chen l,cai y,liu x,et al.improvement of soybean agrobacterium-mediated transformation efficiency by adding glutamine and asparagine into the culture media[j].international journal of molecular sciences,2018,19(10):3039中,公众可从申请人处获得,该生物材料只为重复本发明的相关实验所用,不可作为其它用途使用。
[0084]
下述实施例中的slb1突变体:在the samuel roberts noble foundation通过筛选蒺藜苜蓿tnt1插入突变体库,分离获得一个叶片变小的突变体small leaf and bushy 1(slb1),在tnt1 database(https://medicago-mutant.noble.org/mutant/index.php)中该突变体编号为nf11180,公众可从the samuel roberts noble foundation购买获得,该突变体主要表现为叶片及花器官变小。
[0085]
下述实施例中的pcambia2300载体是ybscience的产品,货号yb0300。
[0086]
下述实施例中的pearleygate203载体是ybscience的产品,货号yb-10210。
[0087]
下述实施例中的农杆菌agl1菌株是ybscience的产品,货号yb140382-10。
[0088]
下述实施例中的农杆菌eha105菌株是ybscience的产品,货号yb12-153。
[0089]
下述实施例中的培养基配方具体如下:
[0090]
yep固体培养基:蛋白胨10g、酵母提取物10g、氯化钠5g、琼脂粉10g,蒸馏水定容至1l。
[0091]
yep液体培养基:蛋白胨10g、酵母提取物10g、氯化钠5g,蒸馏水定容至1l。
[0092]
愈伤诱导液体培养基(ph 5.8):大量元素母液100ml、微量元素母液1ml、有机元素母液1ml、铁盐母液20ml、肌醇100mg、蔗糖30g、生长素4mg、细胞分裂素0.5mg、头孢200mg、特美汀250mg,定容至1l。
[0093]
愈伤诱导固体培养基(ph 5.8):大量元素母液100ml、微量元素母液1ml、有机元素
母液1ml、铁盐母液20ml、肌醇100mg、蔗糖30g、生长素4mg、细胞分裂素0.5mg、头孢200mg、特美汀250mg、phytagel 3.2g,定容至1l。
[0094]
分化培养基(ph 5.8):大量元素母液100ml、微量元素母液1ml、有机元素母液1ml、铁盐母液20ml、肌醇100mg、蔗糖20g、头孢200mg、特美汀250mg、phytagel3.2g,定容至1l。
[0095]
生根培养基(ph 5.8):murashige&skoog basal medium with vitamins 2.215g/l(公司:phyto technology laboratories,货号:16b0519138a),琼脂粉7g/l。
[0096]
铁盐母液:乙二胺四乙酸二钠37.3mg、七水合硫酸亚铁27.8mg,定容至1l。
[0097]
大量元素母液:七水合硫酸镁1.85g、硝酸钾28.3g、硫酸铵4.63g、二水合氯化钙1.66g、磷酸二氢钾4g,蒸馏水定容至1l。
[0098]
微量元素母液:一水合硫酸锰1g、硼酸500mg、七水合硫酸锌100mg、碘化钾100mg、二水合钼酸纳10mg、五水合硫酸铜20mg、六水合氯化钴10mg,蒸馏水定容至1l。
[0099]
有机元素母液:烟酸500mg、盐酸硫胺素500mg、盐酸吡哆醇500mg,蒸馏水定容至1l。
[0100]
实施例1、slb1基因的获得
[0101]
一、slb1突变体的获得及其表型分析
[0102]
1、slb1突变体的获得
[0103]
在the samuel roberts noble foundation通过筛选蒺藜苜蓿tnt1插入突变体库,分离获得一个叶片和花器官变小的突变体,该突变体在tnt1database中的编号为nf11180,将该突变体命名为small leaf and bushy 1(slb1),在slb1突变体中tnt1(genbank:x13777.1)插入在slb1基因终止密码子上游632bp处。将slb1突变体与野生型蒺藜苜蓿r108回交得到f
1
,f
1
表现为野生型表型;将f
1
自交得到f
2
群体,f
2
群体分离出野生型和突变体两种表型植株(162:47),χ2检验表明野生型和突变体株数符合3:1的分离比(p=0.238>0.05),表明slb1突变体的性状受隐性单基因控制。
[0104]
2、slb1突变体的表型分析
[0105]
待测植物材料为野生型蒺藜苜蓿r108和slb1突变体的叶片和花。观察待测植物材料的叶片和花的表型。
[0106]
野生型蒺藜苜蓿r108和slb1突变体的叶片和花表型的观察结果见图1a和图1b。图1a为野生型蒺藜苜蓿r108的叶片和花,图1b为slb1突变体的叶片和花,表型统计结果表明slb1突变体中叶片和花面积显著减小。
[0107]
3、slb1突变体的叶片及花面积检测
[0108]
待测植物材料为野生型蒺藜苜蓿r108和slb1突变体的叶片和花。测量待测植物材料的叶片及花的面积,每种类型待测植物材料检测15株植株。具体步骤如下:
[0109]
(1)取材:选取生长状态一致的野生型蒺藜苜蓿r108和slb1突变体植株,从植株顶端往下选取第五个可见叶,取该复叶顶端的小叶,平铺于平整的培养基表面;选取野生型蒺藜苜蓿r108和slb1突变体植株完全展开的花,解剖得到其旗瓣,将旗瓣从中间切开,平铺于平整的培养基表面。
[0110]
(2)叶片和花面积测量:用高分辨率数码相机拍照得到高质量叶片和花图片,使用imagej(https://imagej.nih.gov/ij/)软件测量叶片和花面积大小。
[0111]
野生型蒺藜苜蓿r108小叶面积测量结果(cm
2
):2.5、2.3、2.2、2.1、2.2、2.3、1.9、
2.4、2.1、2.4、2.0、2.2、2.3、2.3、2.8,平均为2.2;slb1突变体小叶面积测量结果(cm
2
):0.9、1.0、1.0、0.8、1.0、1.0、0.9、0.8、0.8、0.9、0.9、0.8、0.9、0.9、1.1,平均为0.9。与野生型蒺藜苜蓿r108相比,slb1突变体小叶面积明显减小(图1c)。
[0112]
野生型蒺藜苜蓿r108旗瓣面积测量结果(mm
2
):20.9、21.0、23.4、20.1、20.2、22.7、22.2、23.3、19、23.3、18.9、21.6、19.2、20.3、21.7,平均为21.1;slb1突变体旗瓣面积测量结果(mm
2
):8.3、11.4、9.6、9.1、7.8、9.3、11.7、10.5、12.1、11.9、11.8、10.7、8.8、10.4、12.4,平均为10.3。与野生型蒺藜苜蓿r108相比,slb1突变体旗瓣面积明显减小(图1d)。
[0113]
二、slb1及其编码基因slb1的获得
[0114]
1、提取野生型蒺藜苜蓿r108幼苗的总rna,并反转录为cdna。
[0115]
2、以步骤1得到的cdna为模板,采用引物slb1-cds-f和引物slb1-cds-r对目的基因进行扩增,得到pcr扩增产物。
[0116]
slb1-cds-f:5
’-
caccatgtcttcttcttcctcctcct-3
’
(cacc为接头序列);
[0117]
slb1-cds-r:5
’-
ttactgtacactaaaatccaata-3
’
。
[0118]
3、将步骤2得到的pcr扩增产物进行测序,得到目标基因的编码区序列,其核苷酸序列为序列表中序列1,编码序列表中序列2所示的蛋白质。将序列表中序列2所示的蛋白质命名为slb1,slb1由480个氨基酸残基组成。将序列表中序列1所示的基因命名为slb1基因。
[0119]
实施例2、突变体互补植株的构建及其基因型与表型分析
[0120]
一、互补载体的构建
[0121]
以野生型蒺藜苜蓿r108的基因组dna为模板,采用引物gslb1-f和gslb1-r扩增得到slb1基因组序列(序列3),该序列依次包括slb1基因上游2400bp启动子区段(序列3第1-2400位)、slb1 4828bp gdna区段(序列3第2401-7228位)、slb1基因650bp下游非编码区段(序列3第7229-7878位);将pcambia2300载体的ecori和smai酶切位点间的dna片段替换为序列3所示的dna片段,得到gslb1互补载体。引物序列如下:
[0122]
gslb1-f:5
’-
ccatgattacgaattccaaccgtcaacatgaaatgaatcca-3
’
;
[0123]
gslb1-r:5
’-
gtcgacagatccccgggactaatatgtggtcttgctagcca-3
’
。
[0124]
二、突变体互补植株的获得
[0125]
1、将步骤一得到的gslb1互补载体转化农杆菌agl1,得到重组菌agl1/gslb1。
[0126]
2、完成步骤1后,将步骤1得到的重组菌agl1/gslb1接种于含有50mg/ml的利福平抗生素和50mg/ml的卡那抗生素的yep固体培养基上,28℃培养至长出单菌落,挑取单菌落至含有50mg/l的利福平抗生素和50mg/l的卡那抗生素的yep液体培养基中,28℃、200rpm振荡培养过夜。
[0127]
3、完成步骤2后,取500μl菌液接种于5ml含有25mg/l的利福平抗生素和50mg/l的卡那抗生素的yep液体培养基中,加入5μl 100mg/ml的乙酰丁香酮,28℃、200rpm振荡培养至od600nm=0.8,3800rpm离心菌液15min,收集菌体。
[0128]
4、完成步骤3后,采用含有100mg/l的乙酰丁香酮的愈伤诱导液体培养基重悬步骤3得到的菌体,调节菌液浓度至od 600nm=0.2,得到侵染液。
[0129]
5、完成步骤4后,取生长4周左右slb1突变体第一片复叶,用75%乙醇水溶液漂洗约10s,再用5%次氯酸钠消毒5min,在超净台用无菌水至少洗5次,将叶片切碎后放到步骤4
得到的侵染液中,侵染15min。
[0130]
6、完成步骤5后,将侵染后的叶片转移到愈伤诱导固体培养基上,每1l培养基中加入草胺磷2mg进行抗生素筛选,培养四周至出现白色胚性愈伤组织(两周更换一次培养基)。
[0131]
7、完成步骤6后,将白色胚性愈伤组织转移到分化培养基上,每1l培养基中加入草胺磷2mg进行抗生素筛选,培养四周至分化出绿色胚状体(两周更换一次培养基)。
[0132]
8、完成步骤7后,将绿色胚状体转移到生根培养基上,两周更换一次培养基,生根长叶后移至蛭石中,直至成苗,得到突变体互补植株(gslb1/slb1)。
[0133]
三、突变体互补植株的基因型及表型分析
[0134]
待测植株:野生型蒺藜苜蓿r108、slb1突变体、t
2
代突变体互补植株(gslb1/slb1),每种类型待测植物材料检测15株植株。
[0135]
1、叶片和花表型分析
[0136]
观察并测量待测植株的叶片和花表型。
[0137]
结果如图2a所示。结果表明:突变体互补植株叶片和花大小均恢复到野生型水平。说明slb1可增大植物叶片和花器官的大小。
[0138]
2、基因型分析
[0139]
将步骤二得到的突变体互补植株在rna水平上进行鉴定,利用野生型蒺藜苜蓿r108和slb1突变体作为对照,具体方法如下:
[0140]
提取野生型蒺藜苜蓿r108、slb1突变体、突变体互补植株(gslb1/slb1)的总rna,反转录为cdna,采用qslb1-f和qslb1-r引物检测slb1表达量,以蒺藜苜蓿actin为内参基因。
[0141]
qslb1-f:5
’-
ggccactcaagttgccattg-3
’
;
[0142]
qslb1-r:5
’-
atccgaacgtgacacttccc-3
’
;
[0143]
qmtactin-f:5
’-
tcaatgtgcctgccatgtatgt-3
’
;
[0144]
qmtactin-r:5
’-
actcacaccgtcaccagaatcc-3
’
;
[0145]
结果如图2b所示。结果表明:相比于野生型蒺藜苜蓿r108,slb1突变体中slb1表达缺失,而在突变体互补植株(gslb1/slb1)中slb1表达量恢复到野生型水平。
[0146]
3、叶片和花面积检测
[0147]
按照实施例1步骤一的3中的方法检测待测植株的叶片和花面积大小。
[0148]
野生型蒺藜苜蓿r108小叶面积测量结果(cm
2
):1.7、1.8、2.1、1.9、1.8、2.0、1.8、2.2、2.1、2.2、2.0、1.9、2.0、1.9、1.8,平均为1.9;slb1突变体小叶面积测量结果(cm
2
):1.3、1.2、1.3、1.1、1.1、1.1、1.1、1.0、1.1、1、1.0、1.0、1.0、0.9、0.9,平均为1.0;突变体互补植株gslb1/slb1小叶面积测量结果(cm
2
):2.1、1.9、2.3、2.0、1.9、2.2、2.1、2.2、2.2、2.2、1.9、1.9、2.0、1.7、2.0,平均为2.0。
[0149]
野生型蒺藜苜蓿r108旗瓣面积测量结果(mm
2
):21.0、19.5、17.9、22.1、17.0、16.9、19.6、17.7、19.7、16.4、20.0、20.3、20.8、16.3、20.5,平均为19.0;slb1突变体旗瓣面积测量结果(mm
2
):8.1、7.9、7.9、8.8、7.0、8.7、6.5、7.5、7.7、8.3、6.7、7.6、8.4、7.5、7.3,平均为7.7;突变体互补植株gslb1/slb1旗瓣面积测量结果(mm
2
):19.8、17.2、21.7、18.4、15.8、21.3、22.5、22.9、19.2、20.3、18.1、17.3、18.2、18.9、21.3,平均为19.5。
[0150]
结果如图2c和图2d所示。结果表明:突变体互补植株叶片和花大小均恢复到野生
型水平。说明slb1可增大植物叶片和花器官的大小。
[0151]
实施例3、转slb1蒺藜苜蓿的构建及其基因型与表型分析
[0152]
本实施例通过向野生型蒺藜苜蓿r108中导入slb1基因,以进一步说明slb1基因在控制蒺藜苜蓿叶片和花器官大小中的作用。
[0153]
一、过表达载体的构建
[0154]
以pcambia2300空载体为模板,采用引物gfp-attb1-f和6*gly-gfp-r扩增得到gfp片段;以野生型蒺藜苜蓿r108cdna为模板,采用引物6*gly-slb1-f和slb1-attb2-r扩增得到slb1 cds片段。以gfp片段和slb1cds片段为模板,采用引物gfp-attb1-f和slb1-attb2-r扩增得到gfp-slb1片段(序列4),将序列4所示的gfp-slb1片段(序列4第805-2247位为slb1cds片段)重组到pearleygate203载体的attb1位点和attb2位点之间,得到过表达载体35s:gfp-slb1。引物序列如下:
[0155]
gfp-attb1-f:
[0156]
5
’-
ggggacaagtttgtacaaaaaagcaggcttcatgggtaaaggagaacttttc a-3
’
;
[0157]
6*gly-gfp-r:
[0158]
5
’-
gccaccccctccgccaccggcataatcaggcacatcg-3
’
;
[0159]
6*gly-slb1-f:
[0160]
5
’-
ggtggcggagggggtggcatgtcttcttcttcctcctcct-3
’
;
[0161]
slb1-attb2-r:
[0162]
5
’-
ggggaccactttgtacaagaaagctgggtcttactgtacactaaaatccaata-3
’
。
[0163]
二、转slb1蒺藜苜蓿的构建
[0164]
按照实施例2步骤二中的方法,将gslb1互补载体替换为35s:gfp-slb1过表达载体,且将slb1突变体替换为野生型蒺藜苜蓿r108,其他步骤均不变,制备过表达slb1蒺藜苜蓿,即为转slb1蒺藜苜蓿。
[0165]
三、转slb1蒺藜苜蓿的基因型与表型分析
[0166]
1、表型分析
[0167]
观察野生型蒺藜苜蓿r108和转slb1蒺藜苜蓿株系(35s:gfp-slb1#5和35s:gfp-slb1#7)的叶片、花和种子大小。
[0168]
结果如图3a所示。结果表明:转slb1蒺藜苜蓿株系的叶片、花和种子均显著大于野生型蒺藜苜蓿r108。说明slb1基因过表达可以增大蒺藜苜蓿叶片、花和种子大小。
[0169]
2、基因型分析
[0170]
将转slb1蒺藜苜蓿株系(35s:gfp-slb1#5和35s:gfp-slb1#7)在rna水平上进行鉴定,以野生型蒺藜苜蓿r108作为对照,具体方法如下:
[0171]
提取野生型蒺藜苜蓿r108、转slb1蒺藜苜蓿的总rna,反转录为cdna,采用qslb1-f和qslb1-r引物检测slb1表达量。
[0172]
结果如图3b所示。结果表明:与野生型蒺藜苜蓿r108中slb1基因的表达量相比,转slb1蒺藜苜蓿中slb1基因的表达量显著增加。
[0173]
3、叶片、花面积及种子百粒重检测
[0174]
按照实施例1步骤一的3中的叶片和花面积大小的测定方法,分别检测经步骤2鉴定为阳性的转slb1蒺藜苜蓿株系35s:gfp-slb1#5和35s:gfp-slb1#7的叶片面积(每个株系
选取15个植株)、花面积(每个株系选取15个植株)和种子百粒重(每个株系选取3个植株),以野生型蒺藜苜蓿r108作为对照。
[0175]
野生型蒺藜苜蓿r108小叶面积测量结果(cm
2
):2.1、2.3、2.2、2.1、2.0、2.1、2.0、2.0、2.5、2.1、2.1、2.2、2.1、2.0、2.4,平均为2.1;转slb1蒺藜苜蓿35s:gfp-slb1#5小叶面积测量结果(cm
2
):3.4、3.3、3.2、3.2、3.1、3.1、3.0、3.0、3.0、3.9、3.9、3.5、3.4、3.4、3.4,平均为3.3;转slb1蒺藜苜蓿35s:gfp-slb1#7小叶面积测量结果(cm
2
):3.4、2.9、3.4、3.4、3.2、3.7、3.1、2.6、3.0、3.1、2.9、3.4、3.6、2.9、3.0,平均为3.1。
[0176]
野生型蒺藜苜蓿r108旗瓣面积测量结果(mm
2
):20.0、21.9、21.3、21.9、19.7、21.6、23.2、22.5、23.8、21.4、21.9、20.6、19.7、24.6、24.1,平均为21.8;转slb1蒺藜苜蓿35s:gfp-slb1#5旗瓣面积测量结果(mm
2
):28.2、26.1、26.8、27.2、27.8、24.4、24.8、22.4、21.0、22.9、22.9、20.9、27.0、27.3、24.9,平均为24.9;转slb1蒺藜苜蓿35s:gfp-slb1#7旗瓣面积测量结果(mm
2
):27.4、29.5、27.4、21.1、26.4、28.1、24.2、24.7、23.9、28.9、22.9、29.2、28.2、24.0、27.2,平均为26.2。
[0177]
野生型蒺藜苜蓿r108百粒重测量结果(g):0.33、0.30、0.32,平均为0.31;转slb1蒺藜苜蓿35s:gfp-slb1#5百粒重测量结果(g):0.40、0.36、0.38,平均为0.38;转slb1蒺藜苜蓿35s:gfp-slb1#7百粒重测量结果(g):0.41、0.38、0.41,平均为0.4。
[0178]
结果如图3c、3d、3e所示。结果表明:转slb1蒺藜苜蓿株系的叶片面积、花面积和百粒重均显著大于野生型蒺藜苜蓿r108。说明slb1基因过表达可以增大蒺藜苜蓿叶片、花和种子大小。
[0179]
实施例4、转slb1大豆的构建及表型分析
[0180]
本实施例通过向大豆栽培种(glycine max)williams 82中导入slb1基因,进一步说明slb1基因在改良大豆器官大小中的作用。
[0181]
一、过表达载体的构建
[0182]
过表达载体35s:gfp-slb1构建方法同实施例3的步骤一。
[0183]
二、转slb1大豆的构建
[0184]
1、将步骤一得到的35s:gfp-slb1互补载体转化农杆菌eha105,得到重组菌eha105/35s:gfp-slb1。
[0185]
2、准备用浓盐酸和次氯酸钠反应出的氯气灭过菌的豆子,同时摇菌。
[0186]
3、将豆子对半切开,去掉一部分胚尖,在豆子的分生区部分划伤口,泡在无菌水中。下午取出摇好的菌液,离心(4000prm,10min),调菌,使菌液od值=0.4~0.6,将豆子中的无菌水倒掉,加入调好的菌液,放在摇床中摇30min(28℃,200prm左右),取出吹10min左右,平铺在共培培养基中暗培3天。
[0187]
4、暗培3天后,胚芽长长,用无菌水和加入激素的液体诱导培养基各洗4-5次,确保将农杆菌洗净。
[0188]
5、将长出的胚芽切掉,只保留3-4mm长度,胚芽朝下,有伤口的一面朝上斜插入固体诱导培养基中,放入温室中光照培养。
[0189]
6、在温室培养10天后,有的豆瓣开始出芽,有芽的从桩部将芽切掉并转到新的固体诱导培养基中,没长芽的扔掉。
[0190]
7、温室中培养10天后,将长芽的继代到新的固体诱导培养基中,没有长芽的豆瓣
扔掉,温室培养10天。豆瓣在固体诱导培养基中一共培养30天。
[0191]
8、将长好的愈伤组织与豆瓣分离,扔掉豆瓣,把愈伤组织上黑色表面刮掉,转到固体伸长培养基中,每20天更换一次新的固体伸长培养基,一般继代3-4次,合计60-80天。
[0192]
9、愈伤在伸长培养的同时也在筛选,在筛选的过程中会有苗长出来。
[0193]
10、当苗长到超过100ml刻度的时候从愈伤上切下来,移到生根培养基中。
[0194]
11、苗子在培养基中培养20-30天左右,长得壮实有发达根系的苗子就可以开始放在背光处炼苗了,一般炼苗五天。
[0195]
12、每种一棵苗就标上豆子品种,基因名称,生根日期和土培日期,以及培养人的名字。加入适量水,绿肥和缓释肥,盖上一层薄膜放在光照下,使其适应强光,3天后去膜。
[0196]
三、转slb1大豆的基因型与表型分析
[0197]
1、表型分析
[0198]
观察野生型大豆williams 82和转slb1大豆(35s:gfp-slb1#1和35s:gfp-slb1#3)的叶片和种子大小。
[0199]
结果如图4a所示。结果表明:转slb1大豆株系的叶片和种子均显著大于野生型大豆williams 82。说明slb1基因过表达可以增大大豆叶片和种子的大小。
[0200]
2、基因型分析
[0201]
将步骤二得到的转slb1大豆(35s:gfp-slb1#1和35s:gfp-slb1#3)在rna水平上进行鉴定,以野生型大豆williams 82作为对照,具体方法如下:
[0202]
提取野生型大豆williams 82、转slb1大豆(35s:gfp-slb1#1和35s:gfp-slb1#3)的总rna,反转录为cdna,检测slb1表达量,以大豆actin基因作为内参基因。
[0203]
qgmactin-f:5
’-
atcttgactgagcgtggttattcc-3
’
;
[0204]
qgmactin-r:5
’-
gctggtcctggctgtctcc-3
’
。
[0205]
结果如图4b所示。结果表明:与野生型williams 82相比,转slb1大豆中slb1基因的表达量显著增加。
[0206]
3、表型分析
[0207]
按照实施例1步骤一3中的叶片面积大小的测定方法,分别检测经步骤2鉴定为阳性的转slb1大豆株系的叶片面积(每个株系选取5个植株)和种子十粒重(每个株系选取6个植株),以野生型大豆williams 82作为对照。
[0208]
野生型大豆williams 82小叶面积测量结果(cm
2
):46.5、50.2、52.2、51.0、51.7,平均为50.3;转slb1大豆35s:gfp-slb1#1小叶面积测量结果(cm
2
):80.0、68.3、71.1、63.1、65.4,平均为69.5;转slb1大豆35s:gfp-slb1#3小叶面积测量结果(cm
2
):77.1、86.7、70.2、72.9、76.7,平均为76.7。
[0209]
野生型大豆williams 82十粒重测量结果(g):1.1、1.4、1.2、1.2、1.1、1.1,平均为1.1;转slb1大豆35s:gfp-slb1#1十粒重测量结果(g):2.7、2.3、2.3、2.3、2.2、1.9,平均为2.2;转slb1大豆35s:gfp-slb1#3十粒重测量结果(g):2.8、2.7、2.6、2.7、2.7、3.6,平均为2.8。
[0210]
结果如图4c、4d所示。结果表明:转slb1大豆的叶片面积和十粒重均显著大于野生型大豆williams 82。说明slb1基因在大豆中过表达可以显著增大大豆叶片和种子的大小。
[0211]
以上对本发明进行了详述。对于本领域技术人员来说,在不脱离本发明的宗旨和
范围,以及无需进行不必要的实验情况下,可在等同参数、浓度和条件下,在较宽范围内实施本发明。虽然本发明给出了特殊的实施例,应该理解为,可以对本发明作进一步的改进。总之,按本发明的原理,本申请欲包括任何变更、用途或对本发明的改进,包括脱离了本申请中已公开范围,而用本领域已知的常规技术进行的改变。按以下附带的权利要求的范围,可以进行一些基本特征的应用。
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询

tips


 商标分类
商标分类  商标转让
商标转让 



