杀伤、分泌、抗耗竭、CD4比例提高的甲基化重编程CART细胞及其制备方法和应用与流程
 2021-02-02 16:02:03|
2021-02-02 16:02:03| 234|
234| 起点商标网
起点商标网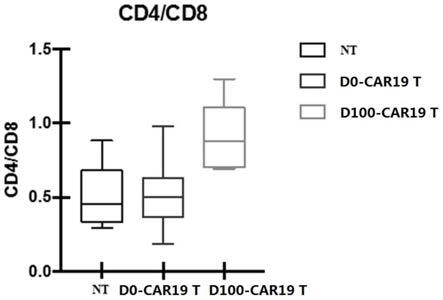
杀伤、分泌、抗耗竭、cd4比例提高的甲基化重编程car t细胞及其制备方法和应用
技术领域
[0001]
本发明涉及细胞工程领域,具体地,涉及一种杀伤、分泌、抗耗竭、cd4/cd8比例提高的car t细胞(甲基化重编程car t细胞)的制备方法,该方法制备的甲基化重编程car t细胞,以该细胞在制备用于治疗肿瘤的制剂中的应用。
背景技术:
[0002]
car-t,嵌合抗原受体t细胞,是目前较为有效的恶性肿瘤的治疗方式之一。嵌合抗原受体(car)是car-t的核心部件,赋予t细胞hla非依赖的方式识别肿瘤抗原的能力,这使得经过car改造的t细胞相较于天然t细胞表面受体tcr能够识别更广泛的目标。car的基础设计中包括一个肿瘤相关抗原(tumor-associated antigen,taa)结合区(通常来源于单克隆抗体抗原结合区域的scfv段),一个胞外铰链区,一个跨膜区和一个胞内信号区。目标抗原的选择对于car的特异性、有效性以及基因改造t细胞自身的安全性来讲都是关键的决定因素。
[0003]
目前car t细胞治疗血液系统肿瘤已经获得了非常好的疗效,在b细胞白血病中,有80%以上患者获得完全缓解;在b细胞淋巴瘤患者中,50%以上的患者会获得完全缓解。随着car t细胞的应用,高缓解率的同时也暴露出一些问题。例如,40%完全缓解的患者会在一年内复发,而且复发的患者再次对car t细胞治疗无反应;另外依然有20-50%的患者对car t细胞治疗反应无应,这些关键car t治疗出现的新的临床问题需要解决。
技术实现要素:
[0004]
本发明的目的是将car t细胞在化学药物的作用下重编程,提供一种提高杀伤能力、细胞因子分泌能力、抗耗竭能力以及cd4比例的甲基化重编程car t细胞(简称d-car t细胞)的制备方法,该方法制备的d-car t细胞具有提高的细胞因子分泌能力、抗耗竭能力以及cd4/cd8比例,对肿瘤细胞具有更高的杀伤力。
[0005]
本发明的发明人发现,改善car t细胞基因组成分从而阻断或削弱car t细胞耗竭的细胞通路、提高cd4/cd8细胞比率、提高细胞因子分泌能力、增强t细胞活化、增殖及杀伤细胞通路可能是有效延长car t体内作用时间,降低疾病复发的有效手段。因此,需要开发一种制备更强效杀伤能力、在体内持久性能力强、cd4/cd8细胞比率高、抗耗竭的car t细胞的方法。而本发明的发明人在研究中进一步发现,低剂量dna去甲基化药物能够重编程car t细胞,提高car t细胞的杀伤能力、细胞因子分泌能力、抗耗竭能力和cd4/cd8比例,尤其是在极低效靶比的情况下,d-car t细胞依然保持高效的杀伤能力,耗竭程度低于普通car t,从而使得d-car t细胞能够更有效发挥在体内的抗肿瘤作用。
[0006]
因此,为了实现上述目的,第一方面,本发明提供一种甲基化重编程car t细胞的制备方法,该方法包括将car t细胞在dna去甲基化药物的存在下进行培养,或者表达car的慢病毒表达载体在dna去甲基化药物的存在下感染t细胞,得到甲基化重编程car t细胞,所
述甲基化重编程car t细胞具有提高的杀伤能力、细胞因子分泌能力、抗耗竭能力和cd4/cd8比例。
[0007]
第二方面,本发明提供了由如上所述的方法制得的d-car t细胞。
[0008]
第三方面,本发明提供了如上所述的d-car t细胞在制备用于治疗肿瘤的制剂中的应用。
[0009]
第四方面,本发明提供了dna去甲基化药物在制备甲基化重编程car t细胞中的应用,所述甲基化重编程car t细胞具有提高的杀伤能力、细胞因子分泌能力、抗耗竭能力和cd4/cd8比例。
[0010]
本发明通过使用dna去甲基化药物对car t细胞重编程,在不影响相应car表达的情况下,能够显著提高car t细胞中cd4/cd8的比例;且对靶细胞具有更高效、快速的杀伤能力,尤其在超低效靶比的情况下;与靶细胞接触后,其细胞因子(例如,tnf-α、il-2、ifn-γ)的分泌量显著增加,且对肿瘤细胞的杀伤活性明显增强,此外,通过基因组学分析显示,重编程后的car t细胞,阻断或削弱了car t细胞耗竭的细胞通路,增强t细胞活化、增殖及杀伤细胞通路。本发明提供的d-car t细胞临床安全性好,无毒副作用,整体抗肿瘤效果可观,具有巨大的临床应用价值。具体的,
[0011]
1)如实施例2所示的,dna去甲基化药物基本不影响car19 t细胞中car的表达;
[0012]
2)如实施例3所示的,显著提高了car19 t细胞中cd4/cd8的比例,且接近于1;
[0013]
3)如实施例4所示的,在0.2:1的效靶比下,20小时内杀伤83%的靶细胞,明显高于未使用dna去甲基化药物处理的car19 t细胞及nt组;
[0014]
4)如实施例5所示的,去甲基化药物增强型car19 t细胞分泌细胞因子的能力明显高于普通型car19 t细胞;
[0015]
5)如实施例6所示的,在超低效靶比的情况下(e:t=1:30),本发明提供的d-car19 t细胞,在12小时内即迅速展示出强大的杀伤能力,相比于普通car19 t,体现出显著的杀伤能力,96小时杀伤效率能够达到90%以上;
[0016]
6)如实施例7所示的,采用本发明的方法得到的d-car19 t的记忆表型细胞增加,说明本发明提供的方法制备的d-car t对靶细胞具有更高效、快速的杀伤能力;
[0017]
7)如实施例8所示的,通过基因组学分析显示,重编程后的car19 t细胞,阻断或削弱了car19 t细胞耗竭的细胞通路,增强t细胞活化、增殖及杀伤细胞通路。
[0018]
本发明的其它特征和优点将在随后的具体实施方式部分予以详细说明。
附图说明
[0019]
附图是用来提供对本发明的进一步理解,并且构成说明书的一部分,与下面的具体实施方式一起用于解释本发明,但并不构成对本发明的限制。在附图中:
[0020]
图1为dna去甲基化药物处理后的car19 t细胞(图1-1)与未处理的car19 t细胞(图1-2)中car19表达效果;
[0021]
图2为dna去甲基化药物处理后的car19 t细胞中cd4/cd8比例提高情况;
[0022]
图3为dna去甲基化药物处理后的car19 t细胞在效靶比0.2:1的条件下对cd19阳性的raji细胞的杀伤效果;
[0023]
图4为dna去甲基化药物处理后的car19 t细胞在效靶比1:1的条件下接触24小时
后,培养上清中细胞因子(il-2(图4-1)、ifn-γ(图4-2)、tnf-α(图4-3))的分泌情况;
[0024]
图5为超低效靶比的情况下(e:t=1:30)本发明方法制备的d-car t细胞对naml6细胞的杀伤情况;
[0025]
图6为本发明的方法得到的d-car t细胞的记忆表型细胞量;
[0026]
图7为本发明的方法得到的d-car t细胞的基因组学分析图。
具体实施方式
[0027]
以下对本发明的具体实施方式进行详细说明。应当理解的是,此处所描述的具体实施方式仅用于说明和解释本发明,并不用于限制本发明。
[0028]
在本发明中,在未作相反说明的情况下,涉及的培养等步骤均在体外进行。
[0029]
第一方面,本发明提供一种甲基化重编程car t细胞的制备方法,该方法包括将car t细胞在dna去甲基化药物的存在下进行培养,或者表达car的慢病毒表达载体在dna去甲基化药物的存在下感染t细胞,得到甲基化重编程car t细胞,所述甲基化重编程car t细胞具有提高的杀伤能力、细胞因子分泌能力、抗耗竭能力和cd4/cd8比例。
[0030]
根据本发明,所述dna去甲基化药物的加入时机可以在较宽的范围内进行选择,例如,可以在刚进行car t细胞培养时加入(也即培养的第一天),也可以培养一段时间后再加入。优选的,所述dna去甲基化药物在car t细胞培养的第1-7天加入。更为优选的,所述dna去甲基化药物在car t细胞培养的第12-72小时,例如,12小时、15小时、18小时、20小时、25小时、30小时、40小时、50小时、60小时、70小时、72小时加入。
[0031]
根据本发明,所述car t细胞在dna去甲基化药物中培养的时间也可以在较宽的范围内进行选择。优选的,所述car t细胞在dna去甲基化药物的存在下培养的时间为24-72小时(例如,24小时、30小时、35小时、40小时、45小时、50小时、55小时、60小时、65小时、72小时或者上述任意两个数值之间的范围),在该范围内,所述car t细胞可更为有效地进行dna重编程,从而实现本发明的目的。
[0032]
根据本发明,当在t细胞被表达car的慢病毒表达载体感染的过程中加入dna去甲基化药物的情况下,在感染结束后,还包括在dna去甲基化药物的药物中将感染后的t细胞(也即,得到的car t细胞)继续培养24-72小时(例如,24小时、30小时、35小时、40小时、45小时、50小时、55小时、60小时、65小时、72小时或者上述任意两个数值之间的范围)。
[0033]
根据本发明,对所述dna去甲基化药物的用量没有特别的要求,但是,优选情况下,在细胞培养基中,所述dna去甲基化药物的用量使得其浓度为5-2000nm,优选10-1000nm(如10nm、20nm、30nm、40nm、50nm、60nm、70nm、80nm、90nm、100nm、200nm、300nm、400nm、500nm、600nm、700nm、800nm、900nm、1000nm或者上述任意两个数值之间的范围)。
[0034]
根据本发明,用于培养的培养基可以为本领域常规的用于car t细胞的培养基,例如,可以为x-vivo 15
tm
无血清细胞培养基。
[0035]
根据本发明,所述dna去甲基化药物可以为常规的用于dna去甲基化的药物,如地西他滨和/或阿杂胞苷等。优选地,所述dna去甲基化药物为地西他滨。
[0036]
根据本发明,待重编程的car t细胞可以为本领域中任意的car t细胞,其可以为单car t细胞和/或多car t细胞。其中,术语“单car t细胞”是指单靶向的car t细胞,也即,car部分表达一种受体,而术语“多car t细胞”是指多靶向的car t细胞,也即,car部分表达
至少两种受体。
[0037]
优选的,所述car t细胞选自car19 t细胞、car20 t细胞、car22 t细胞、car30 t细胞、car133 t细胞、carmsln t细胞、carher1t细胞、carher2 t细胞、car138 t细胞、car20-19 t细胞和car22-19 t细胞;更优选的,所述car t细胞为car19 t细胞、car20 t细胞、car22 t细胞、car20-19 t细胞和car22-19 t细胞。
[0038]
其中,需要说明的是,如上car t细胞中car后面所跟的数字代表car t细胞所靶向的抗原的类型,例如,car19 t细胞表示靶向cd19的car t细胞,其他类似。
[0039]
其中,各car t细胞的制备方法为本领域技术人员所公知,例如,car19 t细胞、car22 t细胞、car22-19 t细胞的制备可以按照201811190780.5中公开的方法;car20 t细胞、car20-19 t细胞的制备可以按照201811062721.x中公开的方法;car30 t细胞的制备可以按照2015106705068中公开的方法;car133 t细胞的制备可以按照201610248750.x中公开的方法;car138 t细胞的制备可以按照201510531218.4中公开的方法,这些专利申请通过全文援引的方式合并于此。
[0040]
根据本发明,所述car t细胞培养的条件可以本领域公知的用于培养t细胞的条件,这些条件在如上引用的专利申请均有记载,为了避免不必要的重复,此处不再重复说明。
[0041]
根据本发明,优选的,为了进一步促进car t细胞的重编程,所述培养在细胞因子的存在下进行;更优选的,所述细胞因子为白介素2,进一步优选的,所述细胞因子为重组人白介素2。
[0042]
第二方面,本发明公开了如上所述的方法制得的甲基化重编程car t细胞。
[0043]
根据本发明,相较于未经过dna去甲基化药物共培养的car t细胞,经过dna去甲基化药物重编程后的car t细胞,cd4/cd8的比例有了明显的提高,接近于1,细胞因子分泌能力也得到了显著的提高,在1:30效靶比情况下,96小时杀伤效率能够达到90%以上,且通过基因组学分析,抗耗竭能力增强,活化和增殖能力也得到了增强。
[0044]
第三方面,本发明提供了如上所述的甲基化重编程car t细胞在制备用于治疗肿瘤的制剂中的应用。
[0045]
其中,所述待治疗的肿瘤的种类可以根据不同的car t细胞类型进行选择,这些均是本领域技术人员所公知的,此处不再详述。
[0046]
第四方面,本发明提供了dna去甲基化药物在制备甲基化重编程car t细胞中的应用,如前所述,本发明的发明人发现采用dna去甲基化药物处理car t细胞能够重编程car t细胞,得到的甲基化重编程car t细胞具有提高的杀伤能力、细胞因子分泌能力、抗耗竭能力和cd4/cd8比例。
[0047]
以下将通过实施例对本发明进行详细描述。
[0048]
下述实施例中的实验方法,如无特殊说明,均为常规方法;下述实施例中所用的实验材料,如无特殊说明,均通过商购得到。
[0049]
cd8单克隆抗体、cd3单克隆抗体、cd4单克隆抗体、fab单克隆抗体、cd62l单克隆抗体、cd45ra单克隆抗体均购自美国bd公司。
[0050]
t细胞培养液x-vivo 15
tm
无血清细胞培养基购自美国lonza公司。
[0051]
il-2、ifnγ和tnf-α的elisa试剂盒均购自美国r&d公司。
t以效靶比(效应细胞:靶细胞)0.2:1加入,nt,d0-car19 t,d100-car19 t作为效应细胞,动态检测效应细胞对靶细胞的杀伤过程,结果见图3所示。
[0070]
由图3可以看出,d100-car19 t在0.2:1的效靶比下,20小时内杀伤83%的cd19阳性的raji细胞,明显高于d0-car19 t组及nt组。
[0071]
实施例5
[0072]
本实施例用来说明d-car19 t释放的细胞因子
[0073]
(1)分别取实施例1中d0-car19 t(表示地西他滨终浓度为0)、d5-car19 t(表示地西他滨终浓度为5nm)、d10-car19 t(表示地西他滨终浓度为10nm)、d2000-car19 t(表示地西他滨终浓度为2000nm)各效应细胞与靶细胞(分别为表达cd19的raji细胞和k562细胞)按照1:1的效靶比加入到96孔板中,于37℃,5%co
2
的细胞培养箱中相互作用24小时后,收集上清并离心。按照il2,ifn-γ,tnfα的elisa试剂盒说明书分别检测上述上清中细胞因子的水平(图中标记为d-car19 t)。如图4所示(il2如图4-1,ifn-γ如图4-2、tnfα如图4-3)。
[0074]
此外,按照il2,ifn-γ,tnfα的elisa试剂盒说明书分别检测未接触靶细胞的各效应细胞上清中细胞因子的水平(图中标记为d-car19 t),如图4所示(il2如图4-1,ifn-γ如图4-2、tnfα如图4-3)。
[0075]
其中,图中,a代表d0-car19 t,b代表d5-car19 t,c代表d10-car19 t,d代表d2000-car19 t,每组中,最左侧柱代表raji细胞,中间柱代表k562细胞,最右侧柱代表不与靶细胞接触的效应细胞。
[0076]
(2)将1201811190780.5中公开的方法制备的t细胞弃去培养液的细胞转至未进行任何包被的6孔板中,加入新鲜的t细胞培养液,300u/ml的重组人白介素2以及分别按照终浓度0、5nm、10nm、100nm、1000nm、2000nm的剂量加入地西他滨(dac),使t细胞的浓度为1
×
10
6
/ml,于37℃、饱和湿度为5%的co
2
培养箱中继续培养3天,得到地西他滨增强的t细胞,简称d-t。
[0077]
分别取d0-t(表示地西他滨终浓度为0)、d5-t(表示地西他滨终浓度为5nm)、d10-t(表示地西他滨终浓度为10nm)、d2000-t(表示地西他滨终浓度为2000nm)各效应细胞与靶细胞(表达cd19的raji细胞和k562细胞)按照1:1的效靶比加入到96孔板中,于37℃,5%co
2
的细胞培养箱中相互作用24小时后,收集上清并离心。按照il2,ifn-γ,tnfα的elisa试剂盒说明书分别检测上述上清中细胞因子的水平(图中标记为nt)。如图4所示(il2如图4-1,ifn-γ如图4-2、tnfα如图4-3)。
[0078]
此外,按照il2,ifn-γ,tnfα的elisa试剂盒说明书分别检测未接触靶细胞的各效应细胞上清中细胞因子的水平(图中标记为nt),如图4所示(il2如图4-1,ifn-γ如图4-2、tnfα如图4-3)。
[0079]
其中,图中,a代表d0-t,b代表d5-t,c代表d10-t,d代表d2000-t,每组中,最左侧柱代表raji细胞,中间柱代表k562细胞,最右侧柱代表不与靶细胞接触的效应细胞。
[0080]
由图4可以看出,与靶细胞接触后,dac增强型car19 t细胞分泌细胞因子的能力明显高于普通型car19 t,而对于t细胞而言,dac并不能够增强其分泌细胞因子的能力。
[0081]
实施例6
[0082]
本实施例用来说明体外检测d-car19 t的杀伤活性
[0083]
靶细胞:同时表达cd19+和cd20+的naml6细胞用plenti-cmv-luc2-ires-puro病毒
感染,使naml6细胞表达荧光素酶。通过嘌呤霉素选择建立稳定表达荧光素酶的naml6细胞。
[0084]
为了测试效应细胞在体外对靶细胞的杀伤力,将效应细胞(nt细胞、d0-car t细胞以及d10-car t细胞)与靶细胞在96孔板中以效靶比e:t=1:30比例共培养。将100μl 2
×
d-荧光素溶液(300μg/ml)加入各孔中,并在2-5分钟后通过varioskan tm lux(thermo fisher)测量信号。信号值为靶细胞存活率,结果如图5所示。
[0085]
由图5可以看出,在超低效靶比的情况下(e:t=1:30),本发明提供的d10-car19 t细胞,在12小时内即迅速展示出强大的杀伤能力,相比于普通d0-car19 t细胞,体现出显著的杀伤能力,96小时杀伤效率能够达到90%以上。
[0086]
实施例7
[0087]
本实施例用来说明d-car19 t的记忆表型细胞
[0088]
按照201811190780.5中公开的方法制备慢病毒(慢病毒表达载体prrlsin-car19)感染的t细胞(来源于同一患者),并将感染12小时并弃去培养液的细胞转至未进行任何包被的6孔板中,加入新鲜的t细胞培养液,300u/ml的重组人白介素2以及分别按照终浓度0、10nm、100nm、1000nm、2000nm的剂量加入地西他滨(dac),使t细胞的浓度为1
×
10
6
/ml,于37℃、饱和湿度为5%的co
2
培养箱中继续14天,并在培养的第0、3、5、7、14天使用流式抗体(cd3、cd62l、cd45ra)检测记忆表型细胞,结果如图6所示。
[0089]
如图6可以看出,相比于nt细胞、d0-car19 t细胞(dac浓度为0nm),采用本发明的方法得到的d10-car19 t(dac浓度为10nm)的记忆表型细胞增加,说明本发明提供的方法制备的d-car19 t具有更高效的杀伤能力。其余浓度结果未示出。
[0090]
实施例8
[0091]
本实施例用于说明d-car19 t的基因组学上的分析
[0092]
按照201811190780.5中公开的方法制备慢病毒(慢病毒表达载体prrlsin-car19)感染的t细胞(来源于同一患者),并将感染12小时并弃去培养液的细胞转至未进行任何包被的6孔板中,加入新鲜的t细胞培养液,300u/ml的重组人白介素2以及分别按照终浓度0、10nm、100nm、1000nm、2000nm的剂量加入地西他滨(dac),使t细胞的浓度为1
×
10
6
/ml,于37℃、饱和湿度为5%的co
2
培养箱中继续培养3天,之后提取rna后进行真核转录组测序分析,d10-car19 t(dac浓度为10nm)的结果如图7所示,其余未示出。
[0093]
由图7可以看出,在基因组学上,d-car19 t细胞基因组成分在dac的作用下发生了改变,其中,与抗耗竭、增殖和活化能力相关的基因的表达得到了提升,进一步说明了本发明的方法能够提高car19 t细胞的抗耗竭能力、增殖活性和靶细胞杀伤活性。
[0094]
以上详细描述了本发明的优选实施方式,但是,本发明并不限于上述实施方式中的具体细节,在本发明的技术构思范围内,可以对本发明的技术方案进行多种简单变型,这些简单变型均属于本发明的保护范围。
[0095]
另外需要说明的是,在上述具体实施方式中所描述的各个具体技术特征,在不矛盾的情况下,可以通过任何合适的方式进行组合,为了避免不必要的重复,本发明对各种可能的组合方式不再另行说明。
[0096]
此外,本发明的各种不同的实施方式之间也可以进行任意组合,只要其不违背本发明的思想,其同样应当视为本发明所公开的内容。
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
相关标签: 甲基
 热门咨询
热门咨询

tips


 商标分类
商标分类  商标转让
商标转让 



