一种α-芳基化酰胺化合物的合成方法与流程
 2021-02-02 16:02:51|
2021-02-02 16:02:51| 305|
305| 起点商标网
起点商标网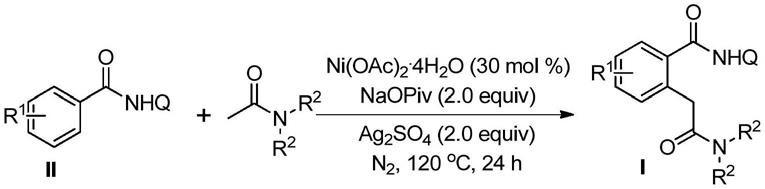
一种
α-芳基化酰胺化合物的合成方法
技术领域
[0001]
本发明属于有机合成领域,具体涉及一种α-芳基化酰胺化合物的合成方法。
背景技术:
[0002]
α-芳基化酰胺化合物是一类十分重要的结构分子,其广泛存在于药物分子、天然产物以及功能性材料中。目前,能够有效合成α-芳基化酰胺化合物的方法主要集中在以下几种。使反应条件控制在强碱条件下,拔除酰胺化合物α-羰基的氢,再与芳基卤代烃发生偶联反应得到目标产物。由于该反应不仅需要对芳烃进行官能团化得到活性比较高的芳基卤代烃并且反应条件苛刻,难于控制和操作,所以大大限制该反应的应用。另外一种方法就是将酰胺化合物直接进行α位的卤化,再进一步与金属试剂发生反应也能够生成目标产物。同样,该方法也难以避免需要对底物进行官能团转化,从而才能进行反应。冗长的反应步骤以及苛刻的反应条件都会使得反应体系产生大量的废碱,废酸以及金属废料。寻求发展新型高效的合成方法是非常必要的。
[0003]
近年来,过渡金属催化的导向基团辅助的c-h键活化的策略,经过几十年的发展提供了一种原子经济型、步骤经济型方法来构筑碳碳以及碳杂键,同时在导向基团的辅助下,反应活性以及化学选择性得到大大的提升。我们课题组一直致力于利用双齿导向基团的辅助策略,来实现一些新颖的化学转化以及一些难于实现的化学转化。我们利用8-氨基喹啉苯甲酰胺的底物作为导向基团,在廉价易得无毒的金属镍的催化下,首次发展了一种以硫酸银作为反应的氧化剂,特戊酸钠作为添加剂在氮气的反应氛围下能够顺利合成α-芳基化酰胺化合物,该方法条件温和,反应化学选择性高,而作为导向基团的8-氨基喹啉基在反应结束之后,可以通过酸性条件或者碱性条件进行脱除(1、da liu等,european journal of organic chemistry, 2019年,第41期第6930-6934页,nickel-catalyzed ortho c
–
h methylation of aromatic amides with di-tert-butyl peroxide as methylation reagent;2、j.org.chem.2018,83,7860-7866, palladium-catalyzed h/d exchange reaction with 8-aminoquinoline as the directing group:access to ortho-selective deuterated aromatic acids andβ
ꢀ-
selective deuterated aliphatic acids),为合成对称以及不对称的α-芳基化酰胺化合物提供了一种行之有效的方法。
技术实现要素:
[0004]
本发明提供了一种α-芳基化酰胺化合物的合成方法,该合成方法底物适用性广,化学选择性好,反应活性高。
[0005]
一种α-芳基化酰胺化合物的合成方法,包括如下步骤:将苯甲酰胺衍生物、醋酸镍水合物、硫酸银以及特戊酸钠加入到有机溶剂n,n-二甲基乙酰胺中,氮气条件下加热到120℃进行反应24h,反应完全后,后处理得到所述的α-芳基化酰胺化合物;
[0006]
所述的苯甲酰胺衍生物的结构如式(ii)所示:
[0007][0008]
所述的α-芳基化酰胺化合物的结构如式(i)所示:
[0009][0010]
式(i)~(ii)中,r
1
选自甲基、苯基、甲氧基、苯基、三氟甲基、卤素、萘基以及脂肪烷基;
[0011]
本发明的合成方法不需要在苛刻的反应条件下,以及不需要对底物进行预官能团化得到活化物种进而发生经典的偶联反应即可实现目标产物的合成,可直接由芳香烃以及小分子酰胺化合物通过碳氢键之间的直接偶联得到目标α-芳基化酰胺产物,值得注意的是酰胺化合物在反应过程中不仅仅作为反应底物同时也作为反应溶剂参与到反应过程中来。
[0012]
r
2
选自c
1
~c
5
烷基。
[0013]
作为优选,r
1
选自甲基、苯基、三氟甲基、甲氧基、溴、氟中的一个或者多个;
[0014]
r
2
选自甲基或者乙基。
[0015]
作为优选,所述的有机溶剂为n,n-二甲基乙酰胺(dmac)。
[0016]
作为优选,反应催化剂为水合醋酸镍,反应氧化剂为硫酸银,反应最优的碱为特戊酸钠。
[0017]
作为优选,反应温度为120℃,反应时间为24小时。
[0018]
同现有技术相比,本发明的有益效果体现在:
[0019]
(1)本发明通过简单易得的原料直接通过导向基团辅助的策略,可以在温和的反应条件下,通过碳氢键的直接交叉偶联一步合成α-芳基化酰胺化合物,转化效率高,原子经济性好;
[0020]
(2)本发明的合成方法操作简单,反应收率高,同时底物适应性广。
附图说明
[0021]
图1为实施例1得到的化合物的氢谱和碳谱谱图;
[0022]
图2为实施例2得到的化合物的氢谱和碳谱谱图;
[0023]
图3为实施例3得到的化合物的氢谱和碳谱谱图;
[0024]
图4为实施例4得到的化合物的氢谱和碳谱谱图;
[0025]
图5为实施例5得到的化合物的氢谱和碳谱谱图;
[0026]
图6为实施例6得到的化合物的氢谱和碳谱谱图;
[0027]
图7为实施例7得到的化合物的氢谱和碳谱谱图;
[0028]
图8为实施例8得到的化合物的氢谱和碳谱谱图;
[0029]
图9为实施例9得到的化合物的氢谱和碳谱谱图;
[0030]
图10为实施例10得到的化合物的氢谱和碳谱谱图;其中,氢谱在400 mhz核磁仪器上进行测试。碳谱在100mhz核磁仪器上进行测试。测试条件均为室温下使用四甲基硅烷作内标,样品用氘代氯仿溶解。
具体实施方式
[0031]
下面结合具体实施例对本发明做进一步的描述,以下具体实施例都是本发明的最优实施方式。
[0032]
实施例1~10
[0033]
按照表1的原料配比在试管中加入苯甲酰胺(0.2mmol)、四水合醋酸镍(0.06mmol)、硫酸银(0.4mmol)、特戊酸钠(0.4mmol)和有机溶剂 dmac(2ml),混合搅拌均匀,充氮气在氮气氛围下反应24h。按照表2 的反应条件反应完成后,冷却,用硅藻土抽滤,用饱和食盐萃取,收集有机相用硫酸钠干燥,硅胶拌样,经过柱层析纯化得到相应的α-芳基化酰胺化合物(-),反应过程如下式所示:
[0034][0035][0036]
表1实施例1~10的原料配比
[0037][0038]
表2实施例1~10的反应条件和反应结果
[0039][0040]
表1和表2中,t为反应温度,t为反应时间,me为甲基,cf
3
为三氟甲基,ph为苯基,1-naphthyl为1-萘基。
[0041]
实施例1~10制备得到部分化合物的结构确认数据:
[0042][0043]
2-(2-(dimethylamino)-2-oxoethyl)-6-methyl-n-(quinolin-8-yl)benzamide (i-1)
[0044]
yield:(45.0mg,65%,18:1);white solid;mp:125.3-126.5℃.
1
h nmr (cdcl
3
,400mhz)δ10.05(s,1h),8.96(dd,j
1
=7.2hz,j
2
=2.4hz,1h), 8.76(dd,j
1
=4.0hz,j
2
=1.6hz,1h),8.17(dd,j
1
=8.4hz,j
2
=1.6hz,1h), 7.62-7.56(m,2h),7.44(dd,j
1
=8.0hz,j
2
=4.0hz,1h),7.32(t,j=7.6hz, 1h),7.19(d,j=7.6hz,2h),4.72(d,j=21.6hz,0.12h)3.82(s,1.87h), 2.89(s,3h),2.77(s,3h),2.45(s,3h).
13
c nmr(cdcl
3
,100mhz)δ168.6, 148.5,138.6,137.8,136.2,134.8,134.4,132.3,129.4,129.0,128.0,127.3, 127.2,122.2,121.8,116.8,37.9,37.6,35.5,19.6.hrms(ei-tof)calcd for c
21
h
21
n
3
o
2
[m]
+
:347.1634,found:347.1634.
[0045][0046]
3-(2-(dimethylamino)-2-oxoethyl)-n-(quinolin-8-yl)-[1,1'-biphenyl]-2-carb oxade(i-2)
[0047]
yield:(54.0mg,66%,18:1);white solid;mp:208.4-209.5℃.
1
h nmr (cdcl
3
,400mhz)δ9.71(s,1h),8.71(dd,j
1
=7.2hz,j
2
=1.6hz,1h),8.59 (dd,j
1
=4.0hz,j
2
=1.6hz,1h),8.04(dd,j
1
=8.4hz,j
2
=1.6hz,1h), 7.52-7.42(m,5h),7.39(t,j=6.4hz,
2h),7.33(dd,j
1
=8.0hz,j
2
=4.0hz, 1h),7.19(t,j=7.6hz,2h),7.06(t,j=7.6hz,1h),4.84(d,j=12.8hz, 0.11h),3.96(s,1.9h),2.97(s,3h),2.79(s,3h).
13
c nmr(cdcl
3
,100mhz) δ170.8,168.1,148.1,140.3,139.9,138.4,136.6,135.9,134.4,133.7,129.6, 129.3,128.9,128.7,128.2,127.7,127.3,127.1,121.8,121.5,116.3,37.8,37.7, 35.6.hrms(ei-tof)calcd for c
26
h
23
n
3
o
2
[m]
+
:409.1790,found:409.1792.
[0048][0049]
2-(2-(dimethylamino)-2-oxoethyl)-n-(quinolin-8-yl)-6-(trifluoromethyl)ben zamie(i-3)
[0050]
yield:(28.9mg,36%);white solid;mp:144.5-146.3℃.
1
h nmr(cdcl
3
, 400mhz)δ10.12(s,1h),8.92(dd,j
1
=5.6hz,j
2
=3.6hz,1h),8.77(dd,j
1
=4.4hz,j
2
=1.6hz,1h),8.17(dd,j
1
=8.4hz,j
2
=1.6hz,1h),7.68(d,j= 7.6hz,1h),7.62-7.59(m,3h),7.55(t,j=7.6hz,1h),7.44(dd,j
1
=8.0hz, j
2
=4.4hz,1h),3.84(br,2h),2.86(s,3h),2.68(s,3h).
13
c nmr(cdcl
3
, 100mhz)δ169.9,165.7,148.6,138.5,136.2,135.4(q,j=1.8hz),134.5, 134.4,134.2,129.5,127.9,127.5(q,j=31.6hz),127.2,124.9,(q,j=4.5hz), 122.5,121.8,116.9,37.5,37.3,35.5.hrms(ei-tof)calcd for c
21
h
18
f
3
n
3
o
2 [m]
+
:401.1351,found:401.1353.
[0051][0052]
6-(2-(dimethylamino)-2-oxoethyl)-3-methoxy-2-methyl-n-(quinolin-8-yl)be nzade(i-4)
[0053]
yield:(54.3 mg,72%);white solid;mp:143.2-145.6℃.
1
h nmr(cdcl
3
, 400mhz)δ10.02(s,1h),8.95(dd,j
1
=7.2hz,j
2
=2.0hz,1h),8.75(dd,j
1
=4.0hz,j
2
=1.6hz,1h),8.16(dd,j
1
=8.0hz,j
2
=1.6hz,1h),7.61-7.55 (m,2h),7.43(dd,j
1
=8.4hz,j
2
=4.4hz,1h),7.18(d,j=8.8hz,1h),6.89 (d,j=8.4hz,1h),3.86(s,3h),3.75(s,2h),2.88(s,3h),2.74(s,3h),2.29 (s,3h).
13
c nmr(cdcl
3
,100 mhz)δ171.1,168.4,156.7,148.5,138.8, 138.6,136.2,134.3,128.0,127.9,127.2,123.8,123.5,122.2,121.8,116.7, 111.1,55.7,37.6,37.3,35.5,13.1.hrms(ei-tof)calcd for c
22
h
23
n
3
o
3 [m]
+
:377.1739,found:377.1737.
[0054][0055]
3-bromo-6-(2-(dimethylamino)-2-oxoethyl)-2-methyl-n-(quinolin-8-yl)ben zamide(i-5)
[0056]
yield:(21.3mg,50%);white solid;mp:123.5-125.2℃.
1
h nmr(cdcl
3
, 400mhz)δ10.06(s,1h),8.93(dd,j
1
=5.6hz,j
2
=3.2hz,1h),8.78(dd,j
1
=4.0hz,j
2
=1.6hz,1h),8.18(dd,j
1
=8.4hz,j
2
=1.6hz,1h),7.61-7.59 (m,3h),7.45(dd,j
1
=8.4hz,j
2
=4.4hz,1h),7.08(d,j=8.4hz,1h),3.74 (s,2h),2.87(s,3h),2.71(s,3h),2.48(s,3h).
13
c nmr(cdcl
3
,100mhz)δ 170.2,167.6,148.6,139.4,138.5,136.2,134.5,134.1,133.4,131.7,129.0, 128.0,127.2,124.5,122.5,121.9,66.9,37.6,37.5,35.5,20.4.hrms(ei-tof) calcd for c
21
h
20
brn
3
o
2
[m]
+
:425.0739,found:425.0738.
[0057][0058]
2-(2-(dimethylamino)-2-oxoethyl)-4,6-dimethyl-n-(quinolin-8-yl)benzamid e(i-6)
[0059]
yield:(50.6 mg,70%,39:1);white solid;mp:128.3-129.6℃.
1
h nmr (cdcl
3
,400mhz)δ10.03(s,1h),8.95(dd,j
1
=6.8hz,j
2
=1.6hz,1h), 8.75(dd,j
1
=4.4hz,j
2
=1.6hz,1h),8.16(dd,j
1
=8.4hz,j
2
=1.6hz,1h), 7.61-7.54(m,2h),7.43(dd,j
1
=8.4hz,j
2
=4.0hz,1h),7.01(s,2h),4.69 (d,j=19.6hz,0.06h)3.79(s,1.93h),2.89(s,3h),2.77(s,3h),2.41(s,3h), 2.34(s,3h).
13
c nmr(cdcl
3
,100mhz)δ170.9,168.9,148.4,139.2,138.6, 136.2,135.1,134.7,134.4,132.2,129.8,128.0,127.8,127.3,122.1,121.7, 116.7,37.9,37.6,35.5,21.3,19.6.hrms(ei-tof)calcd for c
22
h
23
n
3
o
2 [m]
+
:361.1790,found:361.1791.
[0060][0061]
2-(2-(dimethylamino)-2-oxoethyl)-3-fluoro-6-methyl-n-(quinolin-8-yl)benz amide(i-7)
[0062]
yield:(38.0mg,52%);white solid;mp:155.2-157.9℃.
1
h nmr(cdcl
3
, 400mhz)δ10.22(s,1h),8.94(dd,j
1
=6.0hz,j
2
=2.4hz,1h),8.80(dd,j
1
=4.4hz,j
2
=1.6hz,1h),
8.16(dd,j
1
=8.4hz,j
2
=1.6hz,1h),7.61-7.56 (m,2h),7.44(dd,j
1
=8.4hz,j
2
=4.0hz,1h),7.16(dd,j
1
=8.4hz,j
2
=5.2 hz,1h),7.05(t,j=9.2hz,1h),3.79(d,j=1.2hz,2h),2.93(s,3h),2.69(s, 3h),2.40(s,3h).
13
c nmr(cdcl
3
,100mhz)δ169.5,167.5(d,j
c-f
=2.7 hz),159.5(d,j
c-f
=242.9hz),148.6,139.6(d,j
c-f
=3.6hz),138.8,136.1, 134.4,130.5(d,j
c-f
=8.1hz),130.4(d,j
c-f
=3.6hz),128.0,127.2,122.3, 121.7,120.4(d,j
c-f
=18.1hz),117.0,115.8(d,j
c-f
=22.5hz),37.3,35.5, 31.1(d,j
c-f
=2.7hz),19.1.hrms(ei-tof)calcd for c
21
h
20
fn
3
o
2 [m]
+
:365.1540,found:365.1538.
[0063][0064]
2-(2-(dimethylamino)-2-oxoethyl)-n-(quinolin-8-yl)-1-naphthamide(i-8)
[0065]
yield:(30.0mg,39%);white solid;mp:168.2-169.5℃.
1
h nmr(cdcl
3
, 400mhz)δ10.25(s,1h),9.10(dd,j
1
=7.2hz,j
2
=1.2hz,1h),8.68(dd,j
1
=4.4hz,j
2
=1.6hz,1h),8.17(dd,j
1
=8.4hz,j
2
=1.6hz,1h),8.02-8.00 (m,1h),7.92(d,j=8.4hz,1h),7.89-7.87(m,1h),7.67-7.59(m,2h), 7.53-7.47(m,3h),7.42(dd,j
1
=8.0hz,j
2
=4.0hz,1h),4.01(s,2h),2.93(s, 3h),2.82(s,3h).
13
c nmr(cdcl
3
,100mhz)δ170.5,168.2,148.5,138.6, 136.2,134.6,134.4,132.4,130.2,130.1,129.7,128.1,128.0,127.3,127.2, 127.1,126.2,125.0,122.4,121.8,117.0,38.4,37.6,35.6.hrms(ei-tof) calcd for c
24
h
21
n
3
o
2
[m]
+
:383.1634,found:383.1635.
[0066][0067]
6-(2-(diethylamino)-2-oxoethyl)-3-methoxy-2-methyl-n-(quinolin-8-yl)ben zamide(i-9)
[0068]
yield:(41.3mg,51%);white solid;mp:138.2-139.6℃.
1
h nmr(cdcl
3
, 400mhz)δ10.04(s,1h),8.95(dd,j
1
=6.8hz,j
2
=1.6hz,1h),8.75(dd,j
1
=4.0hz,j
2
=1.6hz,1h),8.16(dd,j
1
=8.4hz,j
2
=1.6hz,1h),7.61-7.54 (m,2h),7.43(dd,j
1
=8.0hz,j
2
=4.0hz,1h),7.18(d,j=8.4hz,1h),6.89 (d,j=8.4hz,1h),3.86(s,3h),3.79(s,2h),3.24-3.15(m,4h),2.29(s,3h), 0.94(t,j=7.2hz,3h),0.85(t,j=7.2hz,3h).
13
c nmr(cdcl
3
,100mhz) δ170.2,168.5,156.7,148.4,138.9,138.6,136.2,134.4,128.1,127.9,127.2, 124.0,123.5,122.1,121.7,116.7,111.0,55.6,42.2,40.2,37.3,14.0,13.1,12.7. hrms(ei-tof)calcd for c
24
h
27
n
3
o
3
[m]
+
:405.2052,found:405.2055.
[0069][0070]
n5,n5,2,2-tetramethyl-n1-(quinolin-8-yl)pentanediamide(i-10)
[0071]
yield:(21.9mg,35%);organe liquid.
1
h nmr(cdcl
3
,400mhz)δ10.27(s, 1h),8.82(dd,j
1
=4.0hz,j
2
=1.6hz,1h),8.77(dd,j
1
=6.8hz,j
2
=1.6hz, 1h),8.16(dd,j
1
=8.4hz,j
2
=1.6hz,1h),7.56-7.49(m,2h),7.46(dd,j
1
= 8.4hz,j
2
=4.0hz,1h),2.97(s,3h),2.91(s,3h),2.41-2.38(m,2h), 2.10-2.06(m,2h),1.45(s,6h).
13
c nmr(cdcl
3
,100mhz)δ176.0,172.7, 148.4,138.7,136.3,134.5,127.9,127.4,121.7,121.4,116.2,43.3,37.3,36.5, 35.4,29.3,25.7.hrms(ei-tof)calcd for c
18
h
23
n
3
o
2
[m]
+
:313.1790, found:313.1792。
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
相关标签:
 热门咨询
热门咨询

tips


 商标分类
商标分类  商标转让
商标转让 



