一种马兜铃生物碱及其中间体的制备方法与流程
 2021-02-02 16:02:05|
2021-02-02 16:02:05| 395|
395| 起点商标网
起点商标网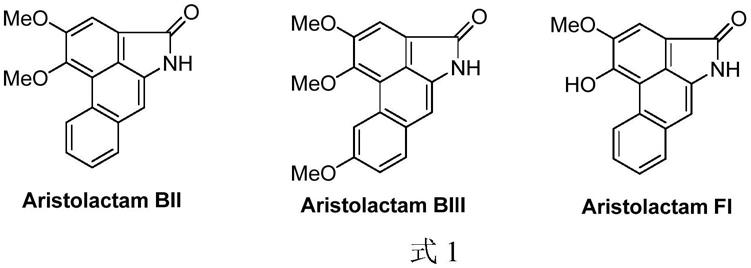
[0001]
本发明属于药物中间体合成领域,具体涉及一种马兜铃生物碱及其中间体的制备方法。
背景技术:
[0002]
马兜铃内酰胺属于阿朴菲类生物碱的一种(式1)(nat.prod.rep.2003,20,565-583)。研究表明,马兜铃内酰胺类生物碱具有良好的抗血小板凝聚(j.nat.prod.2000,63,1160-1163)、抗炎(bioorg.med.chem.2007,15,988-996)、抗细菌(j.nat.prod.1992,55,1165-1169)等生物活性。
[0003][0004]
传统合成该类化合物的方法为:第一步,以9-氨基菲作为起始原料与10当量的丁基锂试剂反应生成菲基锂化合物;第二步,菲基锂化合物与二氧化碳反应生成羧酸化合物,随后羧酸与氨基通过缩合反应生成目标产物。该方法中需要使用大量非常活泼的丁基锂试剂,反应条件苛刻,大大增加了反应的复杂性和可操作性。
技术实现要素:
[0005]
本发明提供了一种马兜铃生物碱的制备方法,相对于传统的合成方法,新方法操作条件更加温和,可操作性更强。
[0006]
一种马兜铃生物碱中间体的制备方法,包括:
[0007]
在钯催化剂和添加剂的作用下,n-芳基-喹啉-2-甲酰胺与α-溴代芳基酮发生烷基化反应,得到马兜铃生物碱中间体;
[0008]
所述的n-芳基-喹啉-2-甲酰胺的结构如式(ii)所示:
[0009][0010]
所述的马兜铃生物碱中间体的结构如式(iii)所示:
[0011][0012]
r选自h、c
1
~c
5
烷基或者c
1
~c
5
烷氧基;
[0013]
ar为芳基,其中,虚线表示该苯环可以存在也可以不存在。
[0014]
作为优选,所述的r为h或甲基;
[0015]
所述的ar为苯基或者甲苯基。
[0016]
作为优选,所述的钯催化剂为醋酸钯,所述的添加剂为phcook。
[0017]
作为优选,所述的烷基化反应的溶剂为1,2-二氯乙烷。
[0018]
作为优选,所述的烷基化反应的温度为80~100℃,反应时间为8~24小时。
[0019]
本发明还提供了一种马兜铃生物碱的制备方法,包括以下步骤:
[0020]
(1)按照上述的制备方法得到所述的马兜铃生物碱中间体;
[0021]
(2)在碱和氧化剂的作用下,步骤(1)得到的马兜铃生物碱中间体进行氧化环合反应,得到所述的马兜铃生物碱;
[0022]
所述的马兜铃生物碱的结构如式(i)所示:
[0023][0024]
该方法以9-氨基菲起始原料出发,分别通过8-碳氢键官能化和氧化碳碳键断裂环化反应得到目标的马兜铃内酰胺生物碱。
[0025]
作为优选,步骤(2)中,所述的碱为氢氧化锂;
[0026]
所述的氧化剂为双氧水。
[0027]
作为优选,所述的氧化环合反应的溶剂为四氢呋喃。
[0028]
作为优选,所述的氧化环合反应的温度为室温,反应时间为12~36小时。
[0029]
具体反应式示例如下:
[0030][0031]
同现有技术相比,本发明的有益效果体现在:
[0032]
我们从9-氨基菲起始原料出发,分别通过8-碳氢键官能化和氧化碳碳键断裂环化反应得到目标的马兜铃内酰胺生物碱。相对于传统的合成方法,新方法避免了丁基锂的使用,操作条件更加温和,可操作性更强。
具体实施方式
[0033]
实施例1
[0034]
将喹啉-2-甲酸(20mmol),萘-1-胺(20mmol,2.86g)和et
3
n(40mmol,5.6ml)溶解在
ch
2
cl
2
(40ml)中,然后在0℃滴加pocl
3
(3.76ml)。反应混合物在0℃搅拌0.5h。然后,在室温下继续反应2h直到萘-1-胺消耗完。在反应结束后,反应混合物冷却至0℃,缓慢加入冰水淬灭反应。收集有机相,水相用ch
2
cl
2
(3
×
20ml)萃取。合并有机相,用饱和的nahco
3
(2
×
40ml)水溶液洗涤,无水mgso
4
干燥。减压蒸去溶剂,残余物用ch
2
cl
2
/石油醚进行结晶,得到目标化合物ii-1。
[0035]
反应式如下:
[0036][0037]
产物表征数据如下:
[0038]
n-(naphthalen-1-yl)quinoline-2-carboxamide(ii-1,cas号:298193-67-6):产量:4.29g;收率72%;粉红固体;mp=146-147℃;
1
h nmr(400mhz,cdcl
3
)δ10.95(s,1h),8.43(d,j=8.4hz,2h),8.36(d,j=8.0hz,1h),8.25(d,j=8.4hz,1h),8.16(d,j=8.4hz,1h),7.91(d,j=8.0hz,2h),7.81(t,j=7.2hz,1h),7.71(d,j=8.4hz,1h),7.59(m,4h);
13
c nmr(100mhz,cdcl
3
)δ162.4,149.9,146.3,138.0,134.2,132.5,130.4,129.9,129.5,128.9,128.2,127.9,126.5,126.3,126.1,126.0,125.1,120.5,118.8,118.7;hrms(esi)calcd for c
20
h
14
n
2
o[m+h]
+
299.1179,found 299.1182.
[0039]
实施例2制备原料n-(菲-9-基)喹啉-2-甲酰胺ii-2
[0040]
反应式如下:
[0041][0042]
(1)将喹啉-2-甲酸(3.46g,20mmol,1equiv)和(boc)
2
o(5.68g,26mmol,1.3equiv)溶解在1,4-二氧六环(100ml)中,然后加入吡啶(2ml)。搅拌10min,再分批加入nh
4
hco
3
(2.06g,26mmol,1.3equiv),然后反应混合物在室温下搅拌24h。反应完成之后,蒸除溶剂,剩余物溶解于etoac(200ml)中。有机相依次用饱和的nahco
3
(3
×
80ml)水溶液和水(80ml)洗涤,无水na
2
so
4
干燥,减压旋干得到喹啉-2-甲酰胺。
[0043]
结构和表征数据如下:
[0044][0045]
quinoline-2-carboxamide(cas no.5382-42-3):2.96g,86%收率;白色固体;mp=126-128℃;
1
h nmr(400mhz,cdcl
3
)δ8.31(d,j=8.4hz,1h),8.25(d,j=8.4hz,1h),8.18(s,1h),8.08(d,j=8.4hz,1h),7.82(d,j=8.4hz,1h),7.72(t,j=7.6hz,1h),7.58(t,j=
7.6hz,1h),6.92(s,1h);
13
c nmr(100mhz,cdcl
3
)δ167.5,149.5,146.6,137.4,130.1,129.8,129.3,128.0,127.7,118.8。
[0046]
(2)将喹啉-2-酰胺(1.72g,10.0mmol,1.0equiv),菲-9-硼酸(4.44g,20.0mmol,2.0equiv),cu(oac)
2
(1.99g,11mmol,1.1equiv)和吡啶(1.58g,20.0mmol,2.0equiv)溶解在ch
2
cl
2
(40ml)中,在室温下搅拌12h。反应混合物在真空上浓缩至干,剩余物用二氯甲烷/石油醚作为洗脱剂进行柱层析,以30%的收率得到目标产物ii-2。
[0047]
n-(phenanthren-9-yl)quinoline-2-carboxamide(ii-2):1.04g,30%收率;黄色固体;mp=191-193℃;
1
h nmr(500mhz,cdcl
3
)δ10.96(s,1h),8.74(m,2h),8.61(m,1h),8.44(d,j=8.0hz,1h),8.36(d,j=8.5hz,1h),8.25(d,j=8.0hz,1h),8.21(d,j=8.5hz,1h),7.91(m,2h),7.81(t,j=8.0hz,1h),7.72(m,2h),7.61(m,3h);
13
c nmr(125mhz,cdcl
3
)δ162.6,149.9,146.3,138.0,132.1,131.2,130.4,130.3,129.9,129.6,128.8,128.4,128.2,127.9,127.1,127.0,126.8,126.6,126.1,123.6,122.4,121.0,118.8,118.5;hrms(esi)calcd for c
24
h
16
n
2
o[m+h]
+
349.1335,found 349.1337.
[0048]
实施例3烷基化步骤
[0049]
在空气氛围中,将酰胺ii-1或ii-2(0.25mmol,1.0equiv),α-溴代芳基酮(0.5mmol,2.0equiv),pd(oac)
2
(0.025mmol,6mg),phcook(0.25mmol,40mg)和1,2-二氯乙烷(2.0ml)加入到35ml带有聚四氟乙烯帽的压力反应管中。将反应管加热到70℃反应12小时。反应混合物冷却至室温,用乙酸乙酯(5ml)稀释,硅藻土过滤,减压浓缩,残余物采用乙酸乙酯/石油醚用硅胶柱进行纯化,得到目标产物。
[0050]
产物的结构和表征数据如下:
[0051][0052]
n-(8-(2-oxo-2-phenylethyl)naphthalen-1-yl)quinoline-2-carboxamide(iii-1):85mg,82%收率;棕色固体;柱层析洗脱剂:乙酸乙酯/石油醚=1/4,v/v);mp=146-147℃.
1
h nmr(600mhz,cdcl
3
)δ10.31(s,1h),8.25(d,j=7.8hz,1h),8.18(d,j=9.0hz,1h),7.88(t,j=8.4hz,2h),7.77(m,3h),7.71(d,j=7.2hz,1h),7.54(m,4h),7.42(t,j=7.2hz,1h),7.26(d,j=6.6hz,1h),7.07(t,j=7.2,1h),6.97(t,j=7.8hz,2h),4.93(s,2h);
13
c nmr(150mhz,cdcl
3
)δ198.9,164.2,149.4,146.1,137.5,136.5,136.2,132.5,131.6,130.1,130.0,129.9,129.8,129.3,129.2,129.1,128.2,128.1,128.0,127.9,127.5,127.3,125.6,125.5,118.9,46.4.hrms(esi)calcd for c
28
h
20
n
2
o
2
[m+h]
+
417.1598,found 417.1589.
[0053]
[0054]
n-(8-(2-oxo-2-(p-tolyl)ethyl)naphthalen-1-yl)quinoline-2-carboxamide(iii-3):85mg,79%收率;棕色固体;柱层析洗脱剂:乙酸乙酯/石油醚=1/4,v/v);mp=164-165℃.
1
h nmr(500mhz,cdcl
3
)δ10.26(s,1h),8.25(d,j=8.0hz,1h),8.19(d,j=8.5hz,1h),7.87(t,j=8.5hz,2h),7.77(d,j=8.0hz,1h),7.65(d,j=7.5hz,3h),7.53(m,4h),7.42(t,j=7.5hz,1h),7.25(d,j=6.5hz,1h),6.71(d,j=8.0hz,2h),4.88(s,2h),2.02(s,3h);
13
c nmr(125mhz,cdcl
3
)δ198.2,164.2,149.5,146.1,143.3,137.2,136.1,134.0,132.5,131.5,130.1,130.0,129.9,129.5,129.2,129.0,128.8,128.1,127.8,127.3,127.2,125.4,118.8,46.1,21.3;hrms(esi)calcd for c
29
h
22
n
2
o
2
[m+h]
+
431.1754,found 431.1741.
[0055][0056]
n-(8-(2-oxo-2-phenylethyl)phenanthren-9-yl)quinoline-2-carboxamid e(iii-2):87mg,75%收率;黄色固体;柱层析洗脱剂:乙酸乙酯/石油醚=1/4,v/v);mp=176-177℃.
1
h nmr(500mhz,cdcl
3
)δ10.28(s,1h),8.77(d,j=8.5hz,1h),8.68(d,j=8.5hz,1h),8.22(d,j=8.5hz,1h),8.13(d,j=8.5hz,1h),8.03(s,1h),7.85(d,j=7.5hz,1h),7.72(m,3h),7.58(m,6h),7.35(d,j=7.5hz,1h),7.03(t,j=7.5hz,1h),6.91(t,j=7.5,2h),4.96(s,2h);
13
c nmr(125mhz,cdcl
3
)δ198.4,164.0,149.3,146.0,137.4,136.4,133.0,132.4,132.2,131.4,130.7,130.6,130.2,129.8,129.7,129.2,129.1,128.3,128.0,127.9,127.8,127.4,127.2,127.0,126.9,126.2,123.2,123.0,118.7,46.8;hrms(esi)calcd for c
32
h
22
n
2
o
2
[m+h]
+
467.1754,found 467.1746.
[0057]
实施例4氧化碳碳键断裂制备i-1和i-2
[0058][0059]
将iii-1、iii-2或iii-3(0.15mmol)溶解在1.6ml thf中,在0℃、搅拌条件下,加入h
2
o(0.4ml)。混合物冷却至0℃,然后加入lioh
·
h
2
o(48mg,1.15mmol)和h
2
o
2
(37%,0.12ml,1.50mmol),反应混合物在室温下搅拌24小时。反应完成后,反应液用水进行稀释。水溶液用etoac(3
×
5ml)进行萃取,有机相水(5ml)洗,无水硫酸钠干燥。真空旋干溶剂,残留物采用乙酸乙酯/石油醚用柱层析进行纯化,得到目标化合物i-1或i-2。
[0060][0061]
benzo[cd]indol-2(1h)-one(i-1;cas号:130-00-7):20mg,80%收率;黄色固体;柱层析洗脱剂:乙酸乙酯/石油醚=1/5,v/v);mp=176-177℃;
1
h nmr(500mhz,cdcl
3
)δ8.75(s,1h),8.11(d,j=7.0hz,1h),8.06(d,j=8.0hz,1h),7.74(t,j=7.5hz,1h),7.56(d,j=8.5hz,1h),7.46(t,j=7.5hz,1h),7.01(d,j=7.0hz,1h);
13
c nmr(125mhz,cdcl
3
)δ170.1,137.1,131.2,129.5,128.7,128.6,126.7,126.4,124.4,120.3,106.5;hrms(esi)calcd for c
11
h
7
no[m+h]
+
170.0600,found 170.0597.
[0062][0063]
dibenzo[cd,f]indol-4(5h)-one(i-2,cas号:4643-75-8):10mg,30%收率;黄色固体;柱层析洗脱剂:乙酸乙酯/石油醚=1/10,v/v);mp=227-229℃;
1
h nmr(500mhz,c
2
d
6
so)δ11.00(s,1h),8.89(d,j=8.0hz,1h),8.72(d,j=7.5hz,1h),8.07(d,j=7.5hz,1h),8.01(d,j=7.5hz,1h),7.94(t,j=7.5hz,1h),7.61(m,2h),7.29(s,1h);
13
c nmr(125mhz,c
2
d
6
so)δ168.9,135.6,134.2,129.3,128.9,127.7,127.6,126.9,126.8,126.6,126.5,125.2,123.4,123.3,105.4;hrms(esi)calcd for c
15
h
9
no[m+h]
+
220.0757,found 220.0753。
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询

tips


 商标分类
商标分类  商标转让
商标转让 



