经卤化的生物素修饰二聚体及其应用的制作方法
 2021-02-02 16:02:35|
2021-02-02 16:02:35| 437|
437| 起点商标网
起点商标网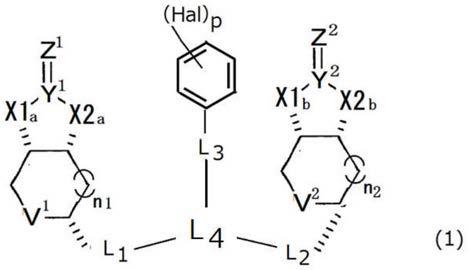
[0001]
本发明涉及经卤化的生物素修饰二聚体及其应用。
背景技术:
[0002]
亲和素与生物素、或者链霉亲和素与生物素之间的亲和性非常高(kd=10-15
~10-14
m),作为生物双分子间的相互作用,这是最强的相互作用之一。目前,亲和素/链霉亲和素-生物素相互作用在生物化学、分子生物学或医学领域被广泛应用。已经设计了将亲和素/链霉亲和素与生物素的高结合能力和抗体分子组合的药物递送方法、预靶向法。
[0003]
鸡来源的亲和素或微生物来源的链霉亲和素对人体显示高免疫原性,因此在对人体给予后早期产生抗亲和素/链霉亲和素抗体则成为问题,且成为阻碍预靶向法的实用化的原因之一。报道了用于解决该问题的低免疫原性链霉亲和素(国际公开wo2010/095455)。
[0004]
低免疫原性链霉亲和素虽然具有对人体的免疫原性降低的特征,但由于对人体所固有(内在)的生物素具有亲和性,所以在诊断用途的情况下存在背景变高的问题,或者在治疗用途的情况下也担心有可能无法特异性地对疾病发挥药效。
[0005]
因此,报道了:降低了对天然生物素的亲和性的链霉亲和素突变体、以及对于该对天然生物素呈低亲和性的链霉亲和素突变体具有高亲和性的生物素修饰体(国际公开wo2014/129446)。还报道了:降低了对天然生物素的亲和性的链霉亲和素突变体、以及对于该对天然生物素呈低亲和性的链霉亲和素突变体具有高亲和性的生物素修饰二聚体(国际公开wo2015/125820)。
[0006]
现有技术文献
[0007]
专利文献
[0008]
专利文献1:国际公开wo2010/095455;
[0009]
专利文献2:国际公开wo2014/129446;
[0010]
专利文献3:国际公开wo2015/125820。
技术实现要素:
[0011]
发明所要解决的课题
[0012]
本发明所应解决的课题在于:提供在对于对天然生物素呈低亲和性的链霉亲和素突变体具有高亲和性的生物素修饰二聚体中,通过标记卤族元素,可进行如影像诊断或治疗的经卤化的生物素修饰二聚体。本发明所应解决的课题还在于:提供使用了上述经卤化的生物素修饰二聚体与链霉亲和素突变体的组合的诊断试剂盒/治疗试剂盒。
[0013]
用于解决课题的手段
[0014]
为了解决上述课题,本发明人进行了深入研究,成功地向国际公开wo2015/125820所记载的生物素修饰二聚体中引入(导入)了卤族元素。而且,确认到所得的经卤化的生物素修饰二聚体以高亲和性与对天然生物素呈低亲和性的链霉亲和素突变体结合,从而完成了本申请发明。
[0015]
即,根据本发明,提供以下的发明。
[0016]
[1]下述式(1)所示的化合物或其盐:
[0017]
[化学式1]
[0018][0019]
式中,
[0020]
x1a、x1b、x2a和x2b分别独立地表示o或nh,
[0021]
y
1
和y
2
分别独立地表示c或s,
[0022]
z
1
和z
2
分别独立地表示o、s或nh,
[0023]
v
1
和v
2
分别独立地表示s或s
+-o-,n1和n2分别独立地表示0或1的整数,
[0024]
l
1
、l
2
和l
3
分别独立地表示二价连接基,
[0025]
l
4
表示三价连接基,
[0026]
hal表示卤族元素,
[0027]
p表示1~5的整数。
[0028]
[2][1]所述的化合物,其中,式(1)所示的化合物为下述式(1a)或下述式(1b)所示的化合物:
[0029]
[化学式2]
[0030]
[0031]
式中的各符号的含义与[1]同义。
[0032]
[3][1]或[2]所述的化合物或其盐,其如n1和n2为0的下述式(2)或下述式(3)所示:
[0033]
[化学式3]
[0034][0035]
式中的各符号的含义与[1]同义。
[0036]
[4][1]~[3]中任一项所述的化合物或其盐,其中,x1a、x1b、x2a和x2b表示nh,y
1
和y
2
表示c,
[0037]
z
1
和z
2
表示nh,v
1
和v
2
表示s。
[0038]
[5][1]~[4]中任一项所述的化合物或其盐,其中,l
1
、l
2
和l
3
分别独立地是由选自-conh-、-nhco-、-coo-、-oco-、-co-、-o-和碳原子数为1~10的亚烷基的基团的组合构成的二价连接基。
[0039]
[6][1]~[5]中任一项所述的化合物或其盐,其中,
[0040]
l
1
表示-(ch
2
)
m1-l
11-(ch
2
)
m2-l
12
-※
,
[0041]
l
2
表示
※-
l
13-(ch
2
)
m3-l
14-(ch
2
)
m4-,
[0042]
l
3
表示l
15-l
21-l
16-,
[0043]
这里,l
11
、l
12
、l
13
、l
14
、l
15
和l
16
分别独立地表示-conh-、-nhco-、-coo-、-oco-、-co-或-o-,
[0044]
m
1
、m
2
、m
3
和m
4
分别独立地表示1~10的整数,
[0045]
※
表示与苯环结合的位置,
[0046]
l
21
表示-ch
2-(och
2
)
m5-,m
5
表示1~10的整数。
[0047]
[7][1]~[6]中任一项所述的化合物或其盐,其中,hal为i、
125
i或
211
at。
[0048]
[8][1]~[7]中任一项所述的化合物或其盐,其中,p为1。
[0049]
[9]以下的任一种化合物:
[0050]
[化学式4]
[0051][0052]
[10]用于治疗或诊断的试剂盒,其包括:(1)[1]~[9]中任一项所述的化合物;以及(b)通过使分子探针与包含seq id no:19所记载的氨基酸序列的链霉亲和素突变体结合而得到的链霉亲和素突变体-分子探针结合物。
[0053]
[11][1]~[9]中任一项所述的化合物或其盐的制造方法,该制造方法包括:使下述式(a)所表示的化合物与卤化钠或卤素反应,
[0054]
[化学式5]
[0055][0056]
式中的各符号的含义与[1]同义。
[0057]
[12][1]~[9]中任一项所述的化合物或其盐的制造方法,该制造方法包括:使下述式(b)所表示的化合物与卤化钠或卤素反应,
[0058]
[化学式6]
[0059][0060]
式中的各符号的含义与[1]同义。
[0061]
发明效果
[0062]
本发明的经卤化的生物素修饰二聚体和包含其的试剂盒在基于预靶向法的诊断法/治疗法中有用。
附图说明
[0063]
[图1]图1表示结构域结构的概略。
[0064]
[图2]图2表示cea-v2122的sds-page电泳cbb染色图像。
[0065]
[图3]图3表示her2-v2122结构图。
[0066]
[图4]图4表示her2-v2122的sds-page电泳cbb染色图像。
[0067]
[图5]图5表示通过磁珠确认psyche b砹标记物与herceptin-cupid的结合复合物的结果。
[0068]
[图6]图6表示使用卵巢癌细胞skov3来确认psyche b砹标记物与herceptin-cupid的结合复合物的结果。
具体实施方式
[0069]
以下,更详细地对本发明进行说明。
[0070]
(1)经卤化的生物素修饰二聚体
[0071]
本发明为下述式(1)所示的化合物或其盐,优选为下述式(1a)、下述式(1b)、下述式(2)或下述式(3)所示的化合物或其盐。本发明的化合物还称为“卤化生物素修饰二聚体”。
[0072]
[化学式7]
[0073][0074]
[化学式8]
[0075][0076][0077]
[化学式9]
[0078][0079]
式中,
[0080]
x1a、x1b、x2a和x2b分别独立地表示o或nh,
[0081]
y
1
和y
2
分别独立地表示c或s,
[0082]
z
1
和z
2
分别独立地表示o、s或nh,
[0083]
v
1
和v
2
分别独立地表示s或s
+-o-,n1和n2分别独立地表示0或1的整数,
[0084]
l
1
、l
2
和l
3
分别独立地表示二价连接基,
[0085]
l
4
表示三价连接基,
[0086]
hal表示卤族元素,
[0087]
p表示1~5的整数。
[0088]
在式(1)、式(1a)、式(1b)、式(2)、式(3)中,下述结构:
[0089]
[化学式10]
[0090][0091]
所示的部分优选为下述的任一种,但并不限于这些,
[0092]
[化学式11]
[0093]
[0094]
优选x1a、x1b、x2a和x2b表示nh,优选y
1
和y
2
表示c,优选z
1
和z
2
表示nh,优选v
1
和v
2
表示s。
[0095]
优选l
1
、l
2
和l
3
分别独立地是由选自-conh-、-nhco-、-coo-、-oco-、-co-、-o-和碳原子数为1~10的亚烷基的基团的组合构成的二价连接基。
[0096]
优选l
1
、l
2
和l
3
分别独立地是由选自-conh-、-nhco-、-o-和碳原子数为1~10的亚烷基的基团的组合构成的二价连接基。
[0097]
优选l
1
和l
2
分别独立地是由选自-conh-、-nhco-和碳原子数为1~10的亚烷基的基团的组合构成的二价连接基。
[0098]
优选l
1
表示-(ch
2
)
m1-l
11-(ch
2
)
m2-l
12
-※
,优选l
2
表示
※-
l
13-(ch
2
)
m3-l
14-(ch
2
)
m4-,优选l
3
表示l
15-l
21-l
16-。
[0099]
l
11
、l
12
、l
13
、l
14
、l
15
和l
16
分别独立地表示-conh-、-nhco-、-coo-、-oco-、-co-或-o-。
[0100]
优选l
11
和l
12
为-conh-、-nhco-或-o-。特别优选l
11
为-o-、且l
12
为-nhco-。
[0101]
优选l
13
和l
14
为-nhco-、-conh-或-o-。特别优选l
13
为-conh-、且l
14
为-o-。
[0102]
优选l
15
为-conh-或单键。
[0103]
优选l
16
为-nhco-。
[0104]
m
1
、m
2
、m
3
和m
4
分别独立地表示1~10的整数,优选表示2~10的整数,更优选表示2~8的整数,更优选表示2~6的整数。
[0105]
※
表示与l4的结合位置,
[0106]
l
21
优选表示-(ch
2
)
2-(o(ch
2
)
2
)
m5-。
[0107]
m
5
表示1~10的整数,优选表示1~6的整数,更优选表示1~4的整数。
[0108]
l
4
表示三价连接基,优选为:
[0109]
[化学式12]
[0110][0111]
或
[0112]
[化学式13]
[0113][0114]
(来源于苯的三价连接基或氮原子)。
[0115]
作为hal所表示的卤族元素,可列举:氟(f)、氯(cl)、溴(br)、碘(i)、砹(at)、tennessine(ts)及其同位素,但优选为碘、砹及其同位素。作为卤族元素,可列举:
123
i、
124
i、
125
i、
131
i、
210
at、
211
at等。上述之中也优选i、
123
i、
124
i、
125
i、
131
i、
211
at。
[0116]
p表示1~5的整数,优选表示1~3的整数,特别优选表示1。
[0117]
(2)卤化生物素修饰二聚体的制造方法
[0118]
本发明的卤化生物素修饰二聚体可如下制造:如后述的实施例所记载,通过在n-溴代琥珀酰亚胺或n-碘代琥珀酰亚胺的甲醇和乙酸的混合溶液中加入溶解于甲醇的卤化
钠(碘化钠、na
125
i等)或卤素(
211
at)进行搅拌,之后加入溶解于甲醇的下述式(a)所表示的化合物使之反应来制造。n-溴代琥珀酰亚胺或n-碘代琥珀酰亚胺的添加量优选为0.1~1.0当量,更优选为0.1~0.5当量,进一步优选为0.1~0.3当量。优选n-溴代琥珀酰亚胺或n-碘代琥珀酰亚胺的添加量较卤化钠或卤素的添加量(当量)多,但若n-溴代琥珀酰亚胺或n-碘代琥珀酰亚胺的添加量过多,则担心式(a)所表示的化合物分解,因此优选调节至适量。
[0119]
[化学式14]
[0120][0121]
式中的各符号的含义与式(1)中的定义为同义。
[0122]
本发明的卤化生物素修饰二聚体还可如下制造:如后述的实施例所记载,通过在下述(b)所表示的化合物的甲醇和乙腈的混合溶液中加入四(吡啶)三氟甲磺酸铜(ii)(添加量优选为1~10当量,更优选为2~8当量)、3,4,7,8-四甲基-1,10-菲咯啉(添加量优选为1~10当量,更优选为2~8当量)和卤化钠使之反应来制造。
[0123]
[化学式15]
[0124][0125]
式中的各符号的含义与式(1)中的定义为同义。
[0126]
(3)卤化生物素修饰二聚体的应用
[0127]
根据本发明,提供将本发明的卤化生物素修饰二聚体和链霉亲和素突变体-分子探针结合物组合而得到的治疗剂或诊断剂。
[0128]
作为链霉亲和素突变体,可使用国际公开wo2014/129446和国际公开wo2015/125820中记载的链霉亲和素突变体。特别优选可使用国际公开wo2015/125820的实施例3(国际公开wo2015/125820的seq id no:4)中记载的链霉亲和素突变体v2122。
[0129]
作为分子探针,例如可列举:抗体、肽、核酸、适体等,具体而言,可使用以在癌中特异性地表达的以下抗原为靶的抗体、肽、核酸、适体等。
[0130]
外调蛋白(epiregulin)、robo1,2,3,4、1-40-β-淀粉状蛋白、4-1bb、5ac、5t4、acvr2b、腺癌抗原、甲胎蛋白(α-fetoprotein)、血管生成素-2、炭疽毒素、aoc3(vap-1)、b-淋巴瘤细胞、b7-h3、baff、β淀粉状蛋白、c242抗原、c5、ca-125、碳酸酐酶9(ca-ix)、心脏肌
球蛋白、ccl11(嗜酸性粒细胞趋化因子-1(eotaxin-1))、ccr4、ccr5、cd11、cd18、cd125、cd140a、cd147(基础免疫球蛋白(basigin))、cd147(基础免疫球蛋白)、cd15、cd152、cd154(cd40l)、cd154、cd19、cd2、cd20、cd200、cd22、cd221、cd23(ige受体)、cd25(il-2受体的α链)、cd28、cd3、cd30(tnfrsf8)、cd33、cd37、cd38(环状adp核糖水解酶)、cd4、cd40、cd41(整联蛋白α-iib)、cd44 v6、cd5、cd51、cd52、cd56、cd6、cd70、cd74、cd79b、cd80、cea、cfd、ch4d5、cldn18.2、艰难梭菌(clostridium difficile)、聚集因子(clumping factor)a、csf2、ctla-4、巨细胞病毒、巨细胞病毒糖蛋白b、dll4、dr5、大肠杆菌志贺毒素1型、大肠杆菌志贺毒素2型、egfl7、egfr、内毒素、epcam、上皮唾液蛋白(episialin)、erbb3、大肠杆菌(escherichia coli)、呼吸道合胞体病毒(respiratory syncytial virus)的f蛋白、fap、纤维蛋白iiβ链、纤连蛋白胞外结构域-b、叶酸受体1、卷曲受体、gd2、gd3神经节苷脂、gmcsf受体α链、gpnmb、乙型肝炎表面抗原、乙型肝炎病毒、her1、her2/neu、her3、hgf、hiv-1、hla-drβ、hngf、hsp90、人β淀粉状蛋白、人分散因子(scatter factor)受体激酶、人tnf、icam-1(cd54)、ifn-α、ifn-γ、ige、ige fc区、igf-1受体、igf-i、igg4、ighe、il-1β、il-12、il-13、il-17、il-17a、il-22、il-23、il-4、il-5、il-6、il-6受体、il-9、ilgf2、甲型流感血凝素、胰岛素样生长因子i受体、整联蛋白α4、整联蛋白α4β7、整联蛋白α5β1、整联蛋白α7β7、整联蛋白αiibβ3、整联蛋白αvβ3、整联蛋白γ诱导蛋白、干扰素受体、干扰素α/β受体、itga2、itgb2(cd18)、kir2d、l-选择素(cd62l)、lewis-y抗原、lfa-1(cd11a)、脂磷壁酸(lipoteichoicacid)、loxl2、lta、mcp-1、间皮素、ms4a1、muc1、粘蛋白癌抗原、肌生长抑制素、n-羟乙酰神经氨酸(n-glycolylneuraminic acid)、narp-1、nca-90(粒细胞抗原)、ngf、nogo-a、nrp1、穴兔(oryctolagus cuniculus)、ox-40、oxldl、pcsk9、pd-1、pdcd1、pdgf-rα、磷脂酰丝氨酸、前列腺癌细胞、绿脓杆菌(pseudomonas aeruginosa)、狂犬病病毒糖蛋白、rankl、呼吸道合胞体病毒、rhd、rh(rhesus)因子、ron、rtn4、骨硬化蛋白(sclerostin)、sdc1、选择素p、slamf7、sost、1-磷酸鞘氨醇、tag-72、tem1、肌腱蛋白c、tfpi、tgfβ1、tgfβ2、tgf-β、tnf-α、trail-r1、trail-r2、肿瘤抗原ctaa16.88、muc1的肿瘤特异性糖基化、tweak受体、tyrp1(糖蛋白75)、vegf-a、vegfr-1、vegfr2、波形蛋白、vwf。
[0131]
调制癌抗原特异性抗体分子等的分子探针与链霉亲和素突变体的融合体,将其给予患者,从而可使链霉亲和素突变体特异性地聚集于癌细胞。接下来,通过对患者给予对上述链霉亲和素突变体具有亲和性的本发明的卤化生物素修饰二聚体,可使卤素准确地聚集于癌细胞。在本发明中,通过低免疫原性化使抗体的产生受到抑制,可防止因抗体引起的早期的从体内清除、过敏反应等的休克。另外,在本发明中,通过以使用了由患者采集的组织、血清等的体外诊断药、临床检查药的形式使用,存在于组织、血清等中的生物素或生物素结合蛋白来源的噪音减少,可进行更高s/n比的诊断、检查。
[0132]
或者,在本发明中,还可调制使癌抗原特异性抗体分子等的分子探针和链霉亲和素突变体的融合体、与本发明的卤化生物素修饰二聚体结合而得到的结合体,且将上述结合体给予患者。
[0133]
与链霉亲和素突变体结合的抗体可使用各种分子。多克隆抗体、单克隆抗体均可使用。对抗体的亚类没有特别限定,但优选使用igg,特别适合使用igg
1
。另外,“抗体”包括修饰抗体和抗体断片的全部。可列举:人源化抗体、人型抗体、人抗体,小鼠、兔、大鼠、豚鼠、猴等各种动物来源的抗体,人抗体与各种动物来源的抗体的嵌合抗体,双抗体、scfv、fd、
66155号公报)的1ml甲醇溶液中,加入19.3mg(51μmol)化合物2和47.3μl(510μmol)三乙胺,在室温下搅拌2小时。减压去除溶剂,所得的粗产物通过反相hplc(梯度:2%2分钟、2-100%90分钟,ch
3
cn的0.1%hcooh水溶液,保留时间=43.6分钟,ymc-triart c18,流速=6.3ml/分钟)进行纯化,从而得到了15.0mg标题化合物3(收率33%、白色无定形状)。
[0147]
1
h nmr(500mhz,cd
3
od)δ:0.29(s,9h),1.35-1.45(m,8h),1.48-1.80(m,16h),2.18(t,4h,j=7.4hz),2.37(t,4h,j=7.4hz),2.80(d,2h,j=13.2hz),2.97(dd,2h,j=5.2hz,13.2hz),3.24-3.29(m,2h),3.50-3.58(m,4h),3.62-3.67(m,8h),4.50(dd,2h,j=4.6hz,8.0hz),4.70(dd,2h,j=4.6hz,8.0hz),7.37(t,1h,j=7.4hz),7.62(d,1h,j=6.9hz),7.70(d,2h,j=2.1hz),7.92-7.94(m,1h),8.01(t,1h,j=1.7hz),8.51-8.57(m,1h).lrms(esi):m/z 614[m+2h]
2+
.
[0148]
(2)
[0149]
(3as,3a
’
s,4s,4
’
s,6ar,6a
’
r)-4,4
’-
(((((5-((2-(2-(2-(3-碘代苯甲酰氨基)乙氧基)乙氧基)乙基)氨基甲酰基)-1,3-亚苯基)双(氮烷二基))双(6-氧代己烷-6,1-二基))双(氮烷二基))双(5-氧代戊烷-5,1-二基))双(四氢-1h-噻吩并[3,4-d]咪唑-2(3h)-亚胺鎓)2,2,2-三氟乙酸盐
[0150]
[化学式17]
[0151][0152]
在0.0027mg(0.152μmol)n-溴代琥珀酰亚胺的560μl甲醇和0.76μl乙酸的混合溶液中,加入溶解于100μl甲醇的0.00114mg(0.076μmol)碘化钠,在室温下搅拌5分钟,之后加入溶解于100μl甲醇的0.1mg(0.076μmol)双亚氨基生物素3,在室温下搅拌10分钟。反应溶液无需浓缩,通过反相hplc(梯度:30%2分钟、30-100%20分钟,ch
3
cn的0.1%cf
3
cooh水溶液,保留时间=8.5分钟,ymc-triart c18,流速=1.0ml/分钟)进行纯化,从而得到了标题化合物4(黄色高粘稠油状)。在lc-ms分析中,所得产物的保留时间和观测质量与通过其他方法合成的标准品一致。
[0153]
标题化合物4也称作psycheb-碘体。
[0154]
1
h nmr(400mhz,cdcl
3
)δ:1.34-1.75(m,24h),2.18(t,4h,j=7.2hz),2.38(t,4h,j=7.2hz),2.80(d,2h,j=13.0hz),2.98(dd,2h,j=4.9hz,13.5hz),3.18(t,4h,j=7.2hz),3.23-3.28(m,2h),3.55(t,4h,j=5.4hz),3.63-3.70(m,8h),4.50(dd,2h,j=
4.5hz,8.1hz),4.70(dd,2h,j=4.5hz,8.1hz),7.19(t,1h,j=7.6hz),7.70(d,2h,j=1.8hz),7.76-7.80(m,1h),7.83-7.87(m,1h),7.98(t,1h,j=1.8hz),8.15(t,1h,1.8hz).lrms(esi):m/z 595[m+2h]
2+
.
[0155]
(3)
[0156]
(3as,3a
’
s,4s,4
’
s,6ar,6a
’
r)-4,4
’-
(((((5-((2-(2-(2-(3-(碘-125
i)苯甲酰氨基)乙氧基)乙氧基)乙基)氨基甲酰基)-1,3-亚苯基)双(氮烷二基))双(6-氧代己烷-6,1-二基))双(氮烷二基))双(5-氧代戊烷-5,1-二基))双(四氢-1h-噻吩并[3,4-d]咪唑-2(3h)-亚胺鎓)2,2,2-三氟乙酸盐
[0157]
[化学式18]
[0158][0159]
在0.00271mg(0.152μmol)n-溴代琥珀酰亚胺的560μl甲醇和0.76μl乙酸的混合溶液中,加入溶解于100μl甲醇的na
125
i(7.1mbq),在室温下搅拌5分钟,之后加入溶解于100μl甲醇的0.1mg(0.076μmol)双亚氨基生物素3,在室温下搅拌10分钟。反应溶液无需浓缩,通过反相hplc(30%2分钟、30-100%20分钟,ch
3
cn的0.1%cf
3
cooh水溶液,保留时间=8.5分钟,ymc-triart c18,流速=1.0ml/分钟)进行纯化,从而得到了标题化合物5。
[0160]
(4)
[0161]
(3as,3a
’
s,4s,4
’
s,6ar,6a
’
r)-4,4
’-
(((((5-((2-(2-(2-(3-(砹-211at)苯甲酰氨基)乙氧基)乙氧基)乙基)氨基甲酰基)-1,3-亚苯基)双(氮烷二基))双(6-氧代己烷-6,1-二基))双(氮烷二基))双(5-氧代戊烷-5,1-二基))双(四氢-1h-噻吩并[3,4-d]咪唑-2(3h)-亚胺鎓)2,2,2-三氟乙酸盐
[0162]
[化学式19]
[0163][0164]
在0.0034mg(0.152μmol)n-碘代琥珀酰亚胺的560μl甲醇和0.76μl乙酸的混合溶液中,加入溶解于100μl甲醇的
211
at(20.6mbq),在室温下搅拌1分钟,之后加入溶解于100μl甲醇的0.1mg(0.076μmol)双亚氨基生物素3,在室温下搅拌10分钟。反应溶液无需浓缩,通过反相hplc纯化(30%2分钟、30-80%13分钟,ch
3
cn的0.1%cf
3
cooh水溶液,保留时间=7.0分钟,ymc-triart c18,流速=1.0ml/分钟)进行纯化,从而得到了标题化合物6。标题化合物6也称作psyche b-at211。
[0165]
<实施例2>
[0166]
(1)
[0167]
2,5-二氧代吡咯烷-1-基3-(4,4,5,5-四甲基-1,3,2-二氧杂硼烷-2-基)苯甲酸酯
[0168]
[化学式20]
[0169][0170]
在3-(4,4,5,5-四甲基-1,3,2-二氧杂硼烷-2-基)苯甲酸的3ml二氯甲烷、26μl(188μmol)三乙胺的混合溶液中,加入21.4mg(188μmol)n-羟基琥珀酰亚胺、36mg(188μmol)1-(3-二甲基氨基丙基)-3-乙基碳化二亚胺盐酸盐,在氩环境下于室温下搅拌4小时。减压去除溶剂,之后加入水,用乙酸乙酯提取,将有机层用饱和氯化铵水溶液洗涤1次、用饱和碳酸氢钠水溶液洗涤1次、用饱和盐水洗涤1次。用硫酸钠干燥,之后减压去除溶剂,得到了42.7mg目标化合物7(收率80%,白色固体)。
1
h nmr(400mhz,cdcl
3
)δ:1.35(s,12h),2.85-2.98(br,4h),7.52(t,1h,j=7.6hz),8.06-8.10(m,1h),8.20(dt,1h,j=1.8hz,j=7.6hz),8.59(s,1h).lrms(esi):m/z 368[m+na]
+
.
[0171]
(2)
[0172]
(3-((2-(2-(2-(3,5-双(6-(5-((3as,4s,6ar)-2-亚氨基六氢-1h-噻吩并[3,4-d]咪唑-4-基)戊酰氨基)己酰氨基)苯甲酰氨基)乙氧基)乙氧基)乙基)氨基甲酰基)苯基)硼酸
[0173]
[化学式21]
[0174][0175]
在10mg(7.68μmol)双亚氨基生物素1(国际公开wo2015/125820;日本特开2017-66155号公报)的400μl dmf溶液中,加入3.9mg(11.5μmol)化合物7和16μl(115μmol)三乙胺,在室温下搅拌4.5小时。减压去除溶剂,将所得的粗产物通过反相hplc(梯度:0%5分钟、0-100%90分钟,ch
3
cn的0.1%hcooh水溶液,保留时间=32.5分钟,ymc-triart c18,流速=3.5ml/分钟)进行纯化,从而得到了3.6mg标题化合物8(收率39%,白色无定形状)。
[0176]
1
h nmr(500mhz,cdcl
3
)δ:1.34-1.75(m,24h),2.17(t,4h,j=7.4hz),2.37(t,4h,j=7.4hz),2.79(d,2h,j=13.2hz),2.96(dd,2h,j=4.6hz,13.2hz),3.17(t,4h,j=6.3hz),3.21-3.28(m,2h),3.50-3.57(m,4h),3.61-3.69(m,8h),4.49(dd,2h,j=4.0hz,7.4hz),4.69(dd,2h,j=4.6hz,8.0hz),7.35(t,1h,j=7.4hz),7.65-7.79(m,3h),7.96-8.03(m,2h),8.50(s,1h).lrms(esi):m/z 554[m+2h]
2+
.
[0177]
(3)
[0178]
(3as,3a
’
s,4s,4
’
s,6ar,6a
’
r)-4,4
’-
(((((5-((2-(2-(2-(3-碘代苯甲酰氨基)乙氧基)乙氧基)乙基)氨基甲酰基)-1,3-亚苯基)双(氮烷二基))双(6-氧代己烷-6,1-二基))双(氮烷二基))双(5-氧代戊烷-5,1-二基))双(四氢-1h-噻吩并[3,4-d]咪唑-2(3h)-亚胺鎓)2,2,2-三氟乙酸盐
[0179]
[化学式22]
[0180][0181]
在双亚氨基生物素8的17.5μl甲醇和2.5μl乙腈的混合溶液中,加入2.8mg(4.2μmol)四(吡啶)三氟甲磺酸铜(ii)、0.99mg(4.2μmol)3,4,7,8-四甲基-1,10-菲咯啉和
0.0125mg(0.0834μmol)碘化钠,在室温下搅拌10分钟。进行反应溶液的lcms分析,保留时间和观测质量与通过其他方法合成的标准品一致。
[0182]
标题化合物4也称作psycheb-碘体。
[0183]
<实施例3>
[0184]
5-((2s,3s,4r)-3,4-二氨基四氢噻吩-2-基)戊酸氢溴酸甲酯
[0185]
[化学式23]
[0186][0187]
在2.5g(10.2mmol)生物素7中,加入12ml 47%的氢溴酸水溶液,在氩环境下于150℃下边回流边搅拌48小时,之后减压去除溶剂。所得的粗产物8未进行进一步的纯化操作,而用于以下的反应。
[0188]
5-((2s,3s,4r)-3,4-二氨基四氢噻吩-2-基)戊酸氢溴酸甲酯
[0189]
[化学式24]
[0190][0191]
在粗产物8中,加入20ml甲醇,在氩环境下边回流边搅拌5小时。减压去除溶剂,所得的粗产物9未进行进一步的纯化操作,而用于以下的反应。
[0192]
5-((2s,3s,4r)-3,4-二氨基四氢噻吩-2-基)戊-1-醇
[0193]
[化学式25]
[0194][0195]
在冰冷下用30分钟向1.55g(40.9mmol)氢化铝锂的50ml thf溶液中滴加粗产物9的400ml thf溶液。在氩环境下于冰浴上搅拌3小时,之后加入1.5ml水、1.5ml 15%的naoh水溶液、4.5ml水,对通过硫酸钠过滤而得到的滤液进行减压浓缩。所得的1.9g粗纯化物10(黄色固体)未进行进一步的纯化操作,而用于以下的反应。
[0196]
((2s,3s,4r)-2-(5-羟基戊基)四氢噻吩-3,4-二基)二氨基甲酸二叔丁酯[化学式26]
[0197][0198]
在室温下向粗产物10的20ml 1,4-二噁烷溶液中加入4.26g(20.5mmol)二碳酸二叔丁酯,在冰冷下加入20ml 1m的naoh水溶液。在氩环境下于室温下搅拌15小时。减压去除溶剂,之后加入1m hcl水溶液,用乙酸乙酯提取,用饱和盐水洗涤有机层。用硫酸钠干燥后,减压去除溶剂。将所得的粗纯化物通过硅胶层析(己烷/乙酸乙酯=67:33
→
20:80
→
0:100
→
乙酸乙酯/甲醇=95:5
→
90:10)进行纯化,从而得到了1.77g目标化合物11(从化合物7开始4个阶段的收率为46%,白色无定形)。
[0199]
1
h nmr(500mhz,cdcl
3
)δ:1.20-1.38(m,4h),1.38-1.50(m,19h),1.50-1.57(m,2h),1.57-1.78(m,1h),2.45(t,j=10.3hz,1h),3.10-3.27(m,1h),3.45-3.46(m,1h),3.60(t,j=6.9hz,2h),4.05-4.25(m,1h),4.25-4.40(m,1h),4.70-4.85(m,1h),4.90-5.05(m,1h).lrms(esi):m/z 427[m+h]
+
.
[0200]
((2s,3s,4r)-2-(5-氧代戊基)四氢噻吩-3,4-二基)二氨基甲酸二叔丁酯[化学式27]
[0201][0202]
在1.15g(2.84mmol)化合物11的12ml乙酸乙酯溶液中,加入4.08g(5.68mmol)2-碘酰基苯甲酸(纯度39%的市售品)。在氩环境下于80℃下边回流边搅拌4小时。用celite过滤溶液,减压去除滤液。将所得的粗产物通过硅胶层析(己烷/乙酸乙酯=76:24
→
)进行纯化,从而得到了0.53g目标化合物12(收率46%,白色无定形)。
[0203]
12
h nmr(500mhz,cd
3
od)δ:1.30-1.50(m,24h),2.42(t,j=5.7hz,2h),2.47(t,j=10.3hz,1h),3.15-3.25(m,1h),3.45-3.55(m,1h),4.10-4.35(m,2h),4.65-4.80(m,1h),4.90-5.00(m,1h),9.75(t,j=1.7hz,1h).
[0204]
((2s,3s,4r)-2-(5,5-双(4-(1,3-二氧代异吲哚啉-2-基)丁氧基)戊基)四氢噻吩-3,4-二基)二氨基甲酸二叔丁酯
[0205]
[化学式28]
[0206]
[0207]
在室温下向235.7mg(0.59mmol)化合物12的2ml甲醇溶液中加入333μl(2.95mmol)原甲酸甲酯和13.6mg(0.059mmol)对甲苯磺酸吡啶鎓。在氩环境下于室温下搅拌10小时,减压去除溶剂和原甲酸甲酯。加入13ml甲苯和1.03g(4.68mmol)2-(4-羟基丁基)异吲哚啉-1,3-二酮,使用dean-stark装置边回流边搅拌8小时。减压去除溶剂,将所得的粗产物通过硅胶层析(己烷/乙酸乙酯=64:36
→
46:54
→
35:65)进行纯化,从而得到了0.32g目标化合物13(收率67%)。
[0208]
1
h nmr(500mhz,cdcl
3
)δ:1.28-1.80(m,34h),2.46(t,j=10.3hz,1h),3.05-3.35(m,1h),3.34-3.44(m,2h),3.47-3.62(m,3h),3.70,(t,j=7.4hz,4h),4.18-4.23(m,1h),4.28-4.33(m,1h),4.39(t,j=5.2hz,1h),4.74-4.81(m,1h),4.97-5.03(m,1h),7.68-7.74(m,4h),7.80-7.84(m,4h).
[0209]
2-(4-((5-((2s,3s,4r)-3,4-二氨基四氢噻吩-2-基)戊基)氧基)丁基)异吲哚啉-1,3-二酮
[0210]
[化学式29]
[0211][0212]
在室温下向302mg(0.367mmol)化合物13的7.2ml二氯甲烷溶液中加入468μl(2.93mmol)三乙基硅烷、234μl(0.881mmol)三氟化硼二乙醚络合物(boron trifluoride diethyl etherate),在氩环境下于室温下搅拌11小时。在反应溶液中加入500μl甲醇,在室温下搅拌1小时后,减压去除溶剂。将所得的粗产物通过硅胶层析(氯仿/甲醇=99:1
→
75:25
→
65:35)进行纯化。在所得的化合物中加入饱和碳酸氢钠水溶液,用二氯甲烷提取。用硫酸钠干燥后,减压去除溶剂,得到了67.6mg目标化合物14(收率45%,黄色油状)。
[0213]
1
h nmr(400mhz,cdcl
3
)δ:1.32-1.62(m,9h),1.67-1.76(m,3h),2.55(d,j=13.2hz,1h),2.93(dd,j=5.7hz,12.6hz,1h),3.20-3.30(m,1h),3.41(t,j=6.3hz,2h),3.45(t,j=6.3hz,2h),3.68(t,j=6.9hz,2h)3.82(t,j=5.7hz,1h),3.94(t,j=6.3hz,1h),7.76-7.81(m,2h),7.82-7.87(m,2h).lrms(esi):m/z 406[m+h]
+
.
[0214]
((3as,4s,6ar,e)-4-(5-(4-(1,3-二氧代异吲哚啉-2-基)丁氧基)戊基)四氢-1h-噻吩并[3,4-d]咪唑-2(3h)-亚基)氨基甲酸叔丁酯
[0215]
[化学式30]
[0216][0217]
在室温下向43.5mg(0.107mmol)化合物14的300μl二噁烷、30μl(0.214mmol)三乙胺的混合溶液中加入溶解于400μl二噁烷的42mg(0.107mmol)goodman试剂。在氩环境下于
室温下搅拌21小时,减压去除溶剂。将所得的粗产物通过硅胶层析(氯仿/甲醇=100:0
→
10:1
→
5:1)进行纯化,得到了9.1mg目标化合物15(收率16%)。
[0218]
1
h nmr(500mhz,cdcl
3
)δ:1.32-1.50(m,4h),1.43(s,9h),1.51-1.69(m,5h),1.71-1.81(m,3h),2.86-2.95(m,2h),3.18-3.24(m,1h),3.38(t,j=6.3hz,2h),3.42(t,j=6.3hz,2h),3.71(t,j=6.9hz,2h),4.42(dd,j=5.2hz,8.0hz,1h),4.62(m,1h),7.67-7.73(m,2h),7.80-7.86(m,2h).lrms(esi):m/z 531[m+h]
+
.
[0219]
((3as,4s,6ar,e)-4-(5-(4-氨基丁氧基)戊基)四氢-1h-噻吩并[3,4-d]咪唑-2(3h)-亚基)氨基甲酸叔丁酯
[0220]
[化学式31]
[0221][0222]
在室温下向31.7mg(0.06mmol)化合物15的500μl乙醇溶液中加入10mg(0.3mmol)水合肼。在50℃下将反应溶液搅拌10小时。吸引过滤反应溶液,减压去除滤液。将所得的粗产物通过硅胶层析(氨基化二氧化硅、氯仿/甲醇=100:0
→
94:6)进行纯化,得到了11.8mg目标化合物16(收率49%)。
[0223]
1
h nmr(400mhz,cdcl
3
)δ:1.40-1.50(m,13h),1.51-1.69(m,7h),1.72-1.82(m,1h),2.69(t,j=6.7hz,2h),2.81(d,j=6.3hz,1h),2.97(dd,j=4.9hz,13.0hz,1h),3.24-3.32(m,1h),3.40-3.48(m,4h),4.41(dd,j=4.5hz,8.1hz,1h),4.62(dd,j=4.5hz,8.1hz,1h).lrms(esi):m/z 401[m+h]
+
.
[0224]
14-(羧甲基)-2,2-二甲基-4-氧代-3,8,11-三氧杂-5,14-二氮杂十六烷-16-酸
[0225]
[化学式32]
[0226][0227]
在131.1mg(240.7mmol)化合物17(amgen inc.wo2006/14645,2006,a1)的5ml甲醇溶液中,加入24.1mg(22.6μmol)10%的钯碳,在氢环境下于室温下搅拌3小时。celite过滤后,减压去除溶剂,所得的93.3mg粗产物18(收率定量,无色高粘性油状)未进行进一步的纯化操作,而用于以下的反应。
[0228]
(22-((3as,4s,6ar,e)-2-((叔丁氧基羰基)亚氨基)六氢-1h-噻吩并[3,4-d]咪唑-4-基)-9-(2-((4-((5-((3as,4s,6ar,z)-2-((叔丁氧基羰基)亚氨基)六氢-1h-噻吩并[3,4-d]咪唑-4-基)戊基)氧基)丁基)氨基)-2-氧代乙基)-11-氧代-3,6,17-三氧杂-9,12-二氮杂二十二烷基)氨基甲酸叔丁酯
[0229]
[化学式33]
[0230][0231]
在室温下向6.4mg(17.5μmol)化合物18的400μl二氯甲烷溶液中加入12.9mg(32.2μmol)化合物16和6.9mg(36μmol)1-乙基-3-(3-二甲基氨基丙基)碳化二亚胺盐酸盐。在氩环境下于室温下搅拌36小时,减压去除溶剂。将所得的粗产物通过硅胶层析(氨基化二氧化硅、氯仿/甲醇=200:1
→
50:1
→
30:1
→
20:1
→
10:1
→
5:1
→
3:1)进行纯化,得到了9.6mg目标化合物19(收率49%)。
[0232]
1
h nmr(400mhz,cd
3
od)δ:1.34-1.50(m,35h),1.51-1.64(m,14h),1.72-1.82(m,2h),2.81(d,j=12.6hz,2h),2.97(dd,j=4.9hz,12.6hz,2h),3.18-3.30(m,10h),3.39-3.65(m,20h),4.41(dd,j=4.5hz,8.1hz,2h),4.63(dd,j=4.5hz,8.1hz,2h).lrms(esi):m/z 565[m+2h]
2+
.2,2
’-
((2-(2-(2-氨基乙氧基)乙氧基)乙基)氮烷二基)双(n-(4-((5-((3as,4s,6ar)-2-亚氨基六氢-1h-噻吩并[3,4-d]咪唑-4-基)戊基)氧基)丁基)乙酰胺)2,2,2-三氟乙酸盐
[0233]
[化学式34]
[0234][0235]
在室温下向5.2mg(4.6μmol)化合物19的200μl水溶液中加入400μl三氟乙酸。在氩环境下于室温下搅拌18小时,减压去除溶剂。将所得的粗产物通过反相hplc(梯度:0%5分钟、0-100%90分钟,ch
3
cn的0.1%cf
3
cooh水溶液,ymc-triart c18,流速=3.5ml/分钟)进行纯化,得到了3.5mg目标化合物20(收率59%)。
[0236]
1
h nmr(500mhz,cd
3
od)δ:1.34-1.50(m,8h),1.52-1.63(m,14h),1.71-1.81(m,2h),2.82(d,j=13.2hz,2h),2.99(dd,j=4.6hz,13.2hz,2h),3.14(t,j=4.6hz,4h),3.20-3.30(m,6h),3.43(t,j=6.3hz,8h),3.60-3.74(m,12h),4.53(dd,j=4.0hz,8.0hz,
2h),4.72(dd,j=4.6hz,8.0hz,2h).lrms(esi):m/z 415[m+2h]
2+
.
[0237]
2-((4-((5-((3as,4s,6ar)-2-亚氨基六氢-1h-噻吩并[3,4-d]咪唑-4-基)戊基)氧基)丁基)氨基)-n-(2-((4-((5-((3as,4s,6ar)-2-亚氨基六氢-1h-噻吩并[3,4-d]咪唑-4-基)戊基)氧基)丁基)氨基)-2-氧代乙基)-2-氧代-n-(2-(2-(2-(3-(三甲基甲锡烷基)苯甲酰氨基)乙氧基)乙氧基)乙基)乙-1-铵鎓甲酸盐
[0238]
[化学式35]
[0239][0240]
在室温下向3.5mg(2.72μmol)化合物20的300μl dmf溶液中加入1.1mg(2.99μmol)化合物21和5.7μl(40.8μmol)三乙胺。在氩环境下于室温下搅拌3小时,减压去除溶剂。将所得的粗产物通过反相hplc(梯度:0%5分钟、2-100%90分钟,ch
3
cn的0.1%hcooh水溶液,保留时间:42.0分钟,ymc-triart c18,流速=3.5ml/分钟)进行纯化,得到了1.5mg目标化合物22(收率45%)。lrms(esi):m/z 366[m+3h]
3+
.2,2
’-
((2-(2-(2-(3-碘代苯甲酰氨基)乙氧基)乙氧基)乙基)氮烷二基)双(n-(4-((5-((3as,4s,6ar)-2-亚氨基六氢-1h-噻吩并[3,4-d]咪唑-4-基)戊基)氧基)丁基)乙酰胺)2,2,2-三氟乙酸盐
[0241]
[化学式36]
[0242][0243]
在室温下向2.4mg(1.87μmol)双亚氨基生物素20的150μl dmf溶液中加入溶解于100μl dmf的0.7mg(2.06μmol)化合物23和4μl(28.3μmol)三乙胺。在氩环境下于室温下搅拌2小时,减压去除溶剂。将所得的粗产物通过反相hplc(梯度:0%5分钟、2-100%90分钟,ch
3
cn的0.1%cf
3
cooh水溶液,保留时间:47.6分钟,ymc-triart c18,流速=3.5ml/分钟)进行纯化,得到了1.3mg目标化合物24(收率50%)。lrms(esi):m/z 354[m+3h]
3+
.
[0244]
目标化合物24也称作psychep-碘体。
[0245]
2,2
’-
((2-(2-(2-(3-碘代苯甲酰氨基)乙氧基)乙氧基)乙基)氮烷二基)双(n-(4-((5-((3as,4s,6ar)-2-亚氨基六氢-1h-噻吩并[3,4-d]咪唑-4-基)戊基)氧基)丁基)乙酰胺)2,2,2-三氟乙酸盐
[0246]
[化学式37]
[0247][0248]
在0.00288mg(0.162μmol)n-溴代琥珀酰亚胺的610μl甲醇和0.81μl乙酸的混合溶液中,加入溶解于100μl甲醇的0.00121mg(0.081μmol)碘化钠,在室温下搅拌5分钟后,加入溶解于100μl甲醇的0.1mg(0.081μmol)双亚氨基生物素22,在室温下搅拌10分钟。在反应液的lc-ms分析中,保留时间和观测质量与通过上述方法合成的标准品(24)一致。目标化合物24也称作psychep-碘体。
[0249]
<cea-v2122的制造>
[0250]
v2122是国际公开wo2015/125820的实施例3(国际公开wo2015/125820的seq id no:4)中记载的链霉亲和素突变体。将v2122的氨基酸序列(在c末端具有6
×
his标签的序列)记载于序列表的seq id no:1中。
[0251]
scfv-v2122是使抗ceacam5的单链抗体(scfv)与上述的v2122结合而得到的。该scfv型的抗ceacam5抗体为专利文献us7626011b2中记载的scfv序列。将scfv型的抗ceacam5抗体的氨基酸序列记载于序列表的seq id no:2中。另外,将cea-v2122的氨基酸序列记载于序列表的seq id no:3中,所述cea-v2122的氨基酸序列是将scfv型的抗ceacam5抗体和v2122通过氨基酸接头(ggggsgggg)(seq id no:11)结合而得到的。
[0252]
为了表达cea-v2122融合蛋白,使将用于在大肠杆菌中分泌表达的pelb信号插入n末端、并将6
×
his-tag序列插入c末端而得到的cea-v2122基因序列的dna密码子在大肠杆菌中优化,进行了人工基因合成。将该氨基酸序列记载于序列表的seq id no:4中,将dna序列记载于序列表的seq id no:5中。另外,结构域结构的概略见图1。
[0253]
具体的蛋白表达载体使用了在petduet1载体的mcs2中插入有蛋白伴侣skp基因而得到的载体。对于skp基因,根据序列表的seq id no:6中记载的氨基酸序列,将密码子在大肠杆菌中优化,进行了dna的人工基因合成。所合成的skp基因使用引物(aaggagatatacatatggataaaattgccattgttaatat(seq id no:12)、ttgagatctgcc atatgttatttcacttgtttcagaacg(seq id no:13))通过pcr进行扩增,使用in-fusion hd克隆试剂盒,将其克隆到经限制酶ndei进行了直链化的petdue1载体的mcs2中,制成petduet_
skp。接下来,在petduet_skp的mcs1中插入cea-v2122基因。具体而言,使用引物(agaaggagatataccatgaaatatctgctgccgac(seq id no:14)、cgccgagctcgaattttaatgatggtgatgatgatg(seq id no:15))通过pcr扩增人工合成的cea-v2122基因。另外,使用引物(ggtatatctccttcttaaagttaaac(seq id no:16)、aattcgagctcggcgcgcctgcag(seq id no:17))通过pcr将petduet_skp进行直链化。使用in-fusionhd克隆试剂盒对通过pcr扩增的cea-v2122和直链化(线性化)的petduet_skp进行克隆。根据测序进行所插入的基因序列的确认,所克隆的载体为petduet_cea-v2122_skp。
[0254]
为了蛋白表达,将petduet_cea-v2122_skp转化至bl21(de3)(nippon gene公司),在2
×
yt培养基(sigma-adlrich公司)中、于37℃下进行一夜的预培养。将已进行预培养的培养基添加在新的培养基中使其稀释100倍,在37℃下进行培养直至od(600nm)=0.5~2.0。接下来,添加最终浓度为0.5mm的iptg,在37℃下培养4小时,回收培养上清,之后在4℃下保存。
[0255]
对于cea-v2122蛋白,利用附加在c末端的6
×
his-tag,通过批量法进行粗纯化。具体而言,将用缓冲液a(50mm trishcl、0.2mnacl、1mm edta、5mm咪唑、ph8.0)进行了平衡化的complete his-tag purification resin添加在于4℃下保存的培养上清中,在4℃下搅拌2小时~一夜,进行与树脂的蛋白结合处理。接下来,将树脂回收到柱中,用缓冲液a进行20柱容量的洗涤操作。之后,用缓冲液b(50mm trishcl、0.2m nacl、1mm edta、400mm咪唑、ph8.0)洗脱,回收cea-v2122的粗纯化物。
[0256]
接下来,利用蛋白l柱对粗纯化物进行纯化。具体而言,将1ml capto l(gehealthcare life sciences)填充至pd-10柱,用10倍柱体积的pbs进行平衡化,之后加载上述的粗纯化物,用10倍柱容积的pbs洗涤,之后用10mm甘氨酸盐酸(ph2.0)洗脱,利用vivaspin turbo 15(mwco 100,000)进行离心浓缩。再使用pd-10(ge healthcare life sciences公司)进行向pbs的缓冲液置换,再利用vivaspin turbo 4(mwco 100,000)进行离心浓缩,制成最终纯化物。sds-page电泳后,通过cbb染色进行四聚体cea-v2122的纯度检测,结果见图2。sds-page凝胶使用mini-protean tgx 4-15%(bio-rad公司),cbb染色液使用bullet cbb stain one(ready to use)(nacalai tesque公司)。
[0257]
由图2确认到:所纯化的cea-v2122以约150kda的四聚体作为主要成分。
[0258]
<herceptin-v2122的制造>
[0259]
v2122是国际公开wo2015/125820的实施例3(国际公开wo2015/125820的seq id no:4)中记载的链霉亲和素突变体。将v2122的氨基酸序列记载于序列表的seq id no:1中。
[0260]
scfv-v2122是使抗her2(erbb2)的单链抗体(scfv)与上述的v2122结合而得到的。该scfv型的抗her2抗体为zhang h等人,therapeutic potential of an anti-her2 single chain antibody-dm1conjugates for the treatment of her2-positive cancer.signal transduct target ther.2017may 19;2:17015.doi:10.1038/sigtrans.2017.15中记载的scfv序列。将scfv型的抗her2抗体的氨基酸序列记载于序列表的seq id no:7中。另外,将scfv型的抗her2抗体和v2122通过氨基酸接头(gggggsggggg)(seq id no:18)结合而得到的her2-v2122的结构图见图3,氨基酸序列见序列表的seq id no:8。
[0261]
为了her2-v2122融合蛋白的表达,使将用于在大肠杆菌中分泌表达的pelb信号插
sciences公司),对传感器芯片cm5(ge healthcare life sciences公司)设定成目标值5000ru,进行所纯化的cea-v2122的固定化。分析物的浓度使用1e-08m~6.25e-10m的2倍稀释系列的5种。使用biacoret200(ge healthcare life sciences公司),测定温度设定为25度,通过单循环动力学(single-cycle kinetics)分析获取动力学数据。利用biacore t200评估软件2.0版(ge healthcare life sciences公司),以bivalent analyze模式对所得数据实施曲线拟合,得到各参数的评价值。解离常数k
d
通过kd/ka=kd求出。这些结果见表1。由结果确认到:psyche b-碘体和psyche p-碘体与cea-v2122形成稳定的结合。
[0269]
[表1]
[0270] ka(ms-1
)kd(s-1
)k
d
(m)psycheb-碘2.9e+046.4e-072.2e-11psychep-碘6.8e+033.1e-054.5e-09
[0271]
试验例2:利用磁珠确认psyche b砹标记物与herceptin-cupid的结合复合物
[0272]
为了确认砹标记的psyche b是否具有与cupid的结合能力,使用herceptin-cupid和与herceptin-cupid所附带的6
×
his标签结合的ni-nta磁珠(thermo公司制造)实施结合测定。这里使用的psyche b-at211按照实施例1之(4)进行调制,herceptin-cupid如上所述按照日本特愿2018-247363中记载的方法进行调制。具体的测定方法如下。
[0273]
向1.5ml的管中分别注入4μl herceptin-v2122溶液或对照用pbs。向其中添加10μl(相当于5.8kbq)psyche-at211,在室温下培育5分钟。接下来,添加用pbs进行了平衡化的10μl ni-nta磁珠,在室温下培育5分钟。之后,使用磁铁使珠粒沉淀、固定化,回收上清,之后用100μl pbs洗涤2次,利用γ计数器进行放射线量的计数。结果为图5的图表。确认到psyche-at211依赖于herceptin-v2122的存在而沉淀。
[0274]
试验例3:使用卵巢癌细胞skov3确认psyche b砹标记物与herceptin-cupid的结合复合物
[0275]
对砹标记的psyche b是否具有与事先结合于her2阳性skov3细胞的herceptin-v2122的结合能力进行了确认。另外,使用cea-v2122作为阴性对照。这里使用的psyche b-at211按照实施例1之(4)进行调制,herceptin-v2122和cea-v2122如上所述按照日本特愿2018-247363中记载的方法进行调制。具体的测定方法如下。
[0276]
准备4支1.5ml的管,向各管中分别注入细胞使达到0.875
×
10
6
个细胞/管。向2支管中添加herceptin-v2122使n=2,在剩下的2支管中添加cea-v2122。接下来,在冰上培育1小时,添加砹标记的psyche b使达到10kbq/管。之后,在室温下边渗透边培育30分钟。最后通过离心使细胞沉淀,回收上清,用pbs洗涤2次,使用γ计数器进行放射线量的计数。结果为图6的图表。成为herceptin-v2122依赖性的测定结果,确认到psyche b-at212经由herceptin-v2122与skov3细胞结合。
[0277]
seq id no:1
[0278][0279]
seq id no:2(sm3e-scfv序列)
[0280][0281]
seq id no:3
[0282][0283]
seq id no:4
[0284][0285]
seq id no:5
[0286][0287]
seq id no:6
[0288][0289]
seq id no:7
[0290][0291]
seq id no:8
[0292][0293]
seq id no:9
[0294][0295]
seq id no:10
[0296]
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询

tips


 商标分类
商标分类  商标转让
商标转让 



