用于广谱检测磺酰脲类药物的半抗原、人工抗原及其抗体和应用的制作方法
 2021-02-02 15:02:13|
2021-02-02 15:02:13| 449|
449| 起点商标网
起点商标网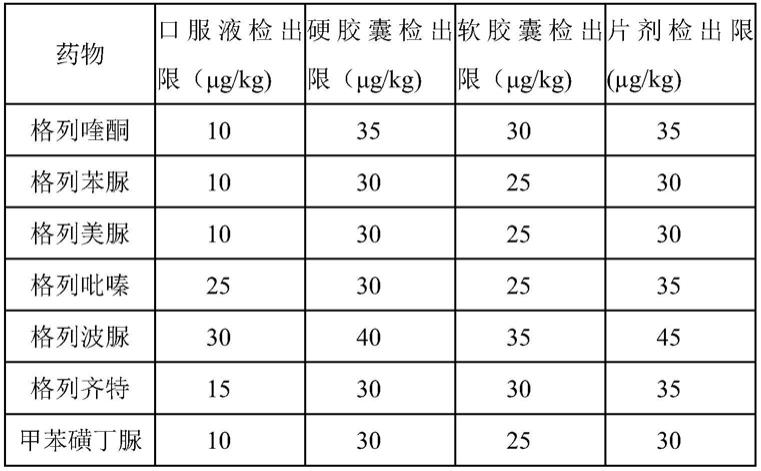
[0001]
本发明属于食品药品安全检测技术领域。更具体地,涉及用于广谱检测磺酰脲类药物的半抗原、人工抗原及其抗体和应用。
背景技术:
[0002]
随着人类社会的不断发展,人们越来越重视自身的健康状况,而保健食品,作为一种具有调节人体功能的特殊食品,也越来越受到广大消费者的青睐。在众多门类的保健食品中,辅助降血糖保健食品由于含有益于糖尿病患者维持正常血糖水平的天然功效成分,受到了广大糖尿病患者的喜爱。而根据国际糖尿病联合会(idf)发布的数据也显示,我国是全球糖尿病人数最多的国家,截止到2019年,患糖尿病的总人口数约为1.164亿人,因此,我国有着很大的辅助降糖类保健品消费市场。但是,有些不法商家为了追求高额的利润,在辅助降糖类保健品中添加一些西药成分,以达到保健食品远远不能达到的短期内见效显著的效果,而其中磺酰脲类药物是一类常见的违法添加物。
[0003]
磺酰脲类(sus)药物是临床上常用的2型糖尿病口服降糖药,具备共有的基本结构r
1-so
2
nhconh-r
2
,能够直接刺激胰岛分泌胰岛素来降低人体的血糖含量,并凭借着其价格低廉、作用迅速、效果持久的特点,在2型糖尿病人中占有广泛的市场。但长期、过量、与其他药物同服或不遵照合理服药时间服用,则极易产生不良反应;其最主要的不良反应是体重增加和低血糖,而严重的低血糖会引起病人神经兴奋度降低,以至昏迷和死亡。违法添加磺酰脲类药物最主要的急性危害来自于不确定的药物摄入量所引起的低血糖症状,此外,该类药物和常规药物一样都是通过肝脏代谢,并由肾脏清除。所以,对于那些肝或肾损害的晚期患者来说,在不知情的情况下摄入此类违法保健食品有可能导致肝肾的损害加重。因此,检测磺酰脲类药物在保健食品等产品中的添加量是必要的。
[0004]
目前,应用于保健食品中磺酰脲类药物的检测方法主要有仪器检测方法和快速检测方法;然而,hplc、hplc-ms、hplc-ms/ms等仪器检测方法虽然可以对样品中磺酰脲类物质进行精确定量,而且结果稳定,但前处理相对复杂,检测周期长,设备昂贵,同时还需要专业的技术人员进行操作,因此不利于基层机构的使用。快速检测方法包括薄层色谱(tlc)法和免疫检测方法,tlc是应用最早、最广泛的检测技术,是最经典的化合物检测方法,但其灵敏度低、重现性差、操作繁琐、时间长且安全性差,因此逐渐被质检机构淘汰;而免疫检测方法,由于其灵敏、快速、简单、方便等特点,逐渐成为快速检测方法的主流。
[0005]
公开日为2011年3月16日、公开号为cn101986156a的中国发明专利公开了一种快速检测格列苯脲及其衍生物的胶体金层析试纸条及制备方法,但是该方法仅是针对一个磺酰脲类药物(格列苯脲)进行检测;公开日为2011年4月13日、公开号为cn102012427a的中国发明专利公开了一种格列苯脲、格列齐特和格列吡嗪三联检测卡及其检测方法,该方法是将不同检测对象的几个方法通过物理连接方式合并在一起构成对两个或三个磺酰脲类降糖药的同时检测,其步骤复杂、能够同时检测的药物对象少、检测效率低;因此,提供一种能
够同时检测7种磺酰脲类药物的免疫检测方法具有重要意义。
技术实现要素:
[0006]
本发明要解决的技术问题是克服现有同时检测7种磺酰脲类药物的空白,提供用于广谱检测磺酰脲类药物的半抗原、人工抗原及其抗体和应用。本发明通过将7种磺酰脲类药物按结构分为两个部分,设计出2个半抗原,在此基础上利用碳二亚胺法将2种半抗原与载体蛋白偶联制备人工抗原,然后用2种人工抗原免疫新西兰大白兔得到2种针对7种磺酰脲类药物特异性完全互补的多克隆抗体,并根据这两种抗体的特性成功建立了一种用于广谱检测磺酰脲类药物的胶体金免疫层析试纸条快速检测方法。
[0007]
本发明的目的是提供一种用于检测磺酰脲类药物的半抗原。
[0008]
本发明另一目的是提供所述半抗原在制备用于检测磺酰脲类药物的人工抗原中的应用。
[0009]
本发明另一目的是提供一种用于检测磺酰脲类药物的人工抗原。
[0010]
本发明另一目的是提供所述半抗原或所述人工抗原在制备用于检测磺酰脲类药物的多克隆抗体中的应用。
[0011]
本发明另一目的是提供一种用于检测磺酰脲类药物的多克隆抗体。
[0012]
本发明另一目的是提供一种重组细胞。
[0013]
本发明另一目的是提供所述多克隆抗体或所述重组细胞在检测磺酰脲类药物中的应用。
[0014]
本发明另一目的是提供一种检测磺酰脲类药物的方法。
[0015]
本发明上述目的通过以下技术方案实现:
[0016]
本发明提供了一种用于检测磺酰脲类药物的半抗原,其特征在于,包括半抗原1和半抗原2,所述半抗原1为4-(2-氨基乙基)-n-(环己基氨基甲酰基)苯磺酰胺,其结构式如式(i)所示:所述半抗原2为n-((4-氨基丁基)氨基甲酰基)-4-甲基苯磺酰胺,其结构式如式(ii)所示:
[0017]
所述半抗原在制备用于检测磺酰脲类药物的人工抗原中的应用,也应在本发明的保护范围之内。
[0018]
本发明还提供了一种用于检测磺酰脲类药物的人工抗原,包括人工抗原1和人工抗原2,所述人工抗原1是将所述半抗原1与载体蛋白偶联得到;所述人工抗原2是将所述半抗原2与载体蛋白偶联得到。
[0019]
优选地,所述载体蛋白为鸡卵清蛋白或钥孔血蓝蛋白。
[0020]
所述半抗原或所述人工抗原在制备用于检测磺酰脲类药物的多克隆抗体中的应用,也应在本发明的保护范围之内。
[0021]
本发明还提供了一种用于检测磺酰脲类药物的多克隆抗体,由所述半抗原或所述人工抗原制备而得到。
[0022]
优选地,由所述人工抗原1和人工抗原2分别对新西兰兔进行1次首次免疫和3次加强免疫后,得到兔血清,即得多克隆抗体1和多克隆抗体2。
[0023]
本发明还提供了一种重组细胞,所述重组细胞为能够表达所述多克隆抗体的细胞。
[0024]
所述多克隆抗体或所述重组细胞在检测磺酰脲类药物中的应用,也应在本发明的保护范围之内。
[0025]
本发明还提供了一种检测磺酰脲类药物的方法,以所述半抗原1与鸡卵清蛋白偶联得到的完全抗原sus1-ova、所述半抗原2与鸡卵清蛋白偶联得到的完全抗原sus2-ova作为包被原,以所述多克隆抗体1和多克隆抗体2作为检测抗体进行检测。
[0026]
本发明具有以下有益效果:
[0027]
本发明提供了用于广谱检测磺酰脲类药物的半抗原、人工抗原及其抗体和应用。本发明利用7种磺酰脲类药物结构的特征,在试验数据的基础上,设计了2种半抗原,由半抗原制备得到人工半抗原,并由人工半抗原进一步制备了2种对7种磺酰脲类药物特异性互补的广谱性多克隆抗体,使建立同时检测7种磺酰脲类药物免疫检测方法成为可能。
[0028]
本发明从技术上解决了免疫分析方法对磺酰脲类药物不能同时检测的问题,提出了一种更加简便、快速的针对在保健食品中非法添加磺酰脲类药物的广谱免疫分析方法,该方法相对于传统仪器及一般免疫检测方法,优势明显,市场接受程度高,具有很好的推广应用前景。
附图说明
[0029]
图1是本发明广谱检测磺酰脲类药物的流程图。
[0030]
图2是半抗原1的合成路线。
[0031]
图3是半抗原2的合成路线。
[0032]
图4是透析后的sus1-ova和sus1-klh的紫外全波长扫描结果。
[0033]
图5是透析后的sus2-ova和sus2-klh的紫外全波长扫描结果。
[0034]
图6是sus1-klh和sus2-klh免疫所得血清对7种磺酰脲类药物的活性检测结果。
[0035]
图7是磺酰脲类药物胶体金快速检测试纸条的侧面结构图;其中,1代表样品垫;2代表金标结合物垫;3代表4-(2-氨基乙基)-n-(环己基氨基甲酰基)苯磺酰胺-鸡卵清蛋白偶联物检测线;4代表n-((4-氨基丁基)氨基甲酰基)-4-甲基苯磺酰胺-鸡卵清蛋白偶联物检测线;5代表羊抗兔igg对照线;6代表硝酸纤维膜;7代表吸水垫;8代表pvc衬板。
[0036]
图8是磺酰脲类药物胶体金快速检测试纸条的俯瞰结构图;其中,1代表样品垫;2代表金标结合物垫;3代表4-(2-氨基乙基)-n-(环己基氨基甲酰基)苯磺酰胺-鸡卵清蛋白偶联物检测线;4代表n-((4-氨基丁基)氨基甲酰基)-4-甲基苯磺酰胺-鸡卵清蛋白偶联物检测线;5代表羊抗兔igg对照线;6代表硝酸纤维膜;7代表吸水垫。
[0037]
图9是检测试纸条的阴阳性判断标准;其中,a、b、c、d代表有效,e、f代表无效。
具体实施方式
[0038]
以下结合具体实施例来进一步说明本发明,但实施例并不对本发明做任何形式的限定。除非特别说明,本发明采用的试剂、方法和设备为本技术领域常规试剂、方法和设备。
[0039]
除非特别说明,以下实施例所用试剂和材料均为市购。
[0040]
本发明广谱检测磺酰脲类药物的流程图如图1所示。
[0041]
实施例1半抗原1和半抗原2的合成与鉴定
[0042]
1、实验方法
[0043]
半抗原1的合成路线如图2所示,其具体制备方法包括以下步骤:
[0044]
s1.称取4-(2-氨基乙基)苯磺酰胺4g(20mmol)溶于10ml二甲基甲酰胺中。称取二碳酸二叔丁酯4.36g(20mmol)缓慢滴加到混合物中。在室温下搅拌反应5小时。反应完成后,加入100ml水于反应物中。过滤析出固体,用水洗涤,得到4-氨磺酰基苯乙基氨基甲酸酯叔丁基。
[0045]
s2.称取步骤s1所得4-氨磺酰基苯乙基氨基甲酸酯叔丁基3g(10mmol),碳酸钾2g(15mmol)与60ml丙酮混合。在53℃下将混合物加热至回流,逐滴滴加环己基异氰酸酯(1.25g 10mmol),继续回流反应6小时。反应完成后,待反应物温度回到室温,加入100ml水于混合物中,过滤出不溶性物质,用盐酸将滤液ph调至5.5,过滤得到析出的固体,得到(4-(n-(环己基氨基甲酰基)氨磺酰基)苯乙基)氨基甲酸叔丁酯。
[0046]
s3.称取步骤s2所得(4-(n-(环己基氨基甲酰基)氨磺酰基)苯乙基)氨基甲酸叔丁酯于反应容器中,加入10ml甲醇和20ml 1m hcl将反应物溶解,在53℃下搅拌反应3小时。待反应结束后,将甲醇减压蒸馏除去,剩下的水溶液用1m naoh调节ph为7.2,过滤得到的固体4-(2-氨基乙基)-n-(环己基氨基甲酰基)苯磺酰胺,即为半抗原1。
[0047]
半抗原2的合成路线如图3所示,其具体制备方法包括以下步骤:
[0048]
(1)称取0.243g(1mmol)n-(4-甲基苯基)磺酰氨基甲酸乙酯溶于5ml甲苯当中,125℃加热至回流,称取0.376g(2mmol)n-叔丁氧羰基-1,4丁二胺与2ml甲苯混合后,再逐滴滴加到反应体系中,继续回流反应6h。反应结束后,将甲苯旋干,生成0.192g白色固体,得到(4-(3-甲苯磺酰脲基)丁基)氨基甲酸叔丁酯。
[0049]
(2)称取0.1g(0.26mmol)步骤(1)所得(4-(3-甲苯磺酰脲基)丁基)氨基甲酸叔丁酯,加入4ml二氯甲烷和2ml三氟乙酸(二氯甲烷和三氟乙酸的体积比为2:1),常温搅拌反应2小时,反应结束后将溶剂旋干,得到粘稠状液体n-((4-氨基丁基)氨基甲酰基)-4-甲基苯磺酰胺,即为半抗原2。
[0050]
2、实验结果
[0051]
(4-(n-(环己基氨基甲酰基)氨磺酰基)苯乙基)氨基甲酸叔丁酯的核磁共振氢谱结果如下:
1
h nmr(600mhz,acetone-d
6
)δ7.91(d,j=8.2hz,2h),7.47(d,j=8.3hz,2h),6.28(d,j=7.9hz,1h),6.10(s,1h),3.52
–
3.42(m,1h),3.36(q,j=6.7hz,2h),2.91(t,j=7.2hz,2h),1.83
–
1.75(m,2h),1.70
–
1.62(m,2h),1.58
–
1.52(m,1h),1.38(s,9h),1.34
–
1.26(m,2h),1.26
–
1.16(m,3h)。
[0052]
半抗原1的质谱结果如下:ms:c
15
h
23
n
3
o
3
s:325.15,esi-[m-h]-:323.6。
[0053]
根据核磁共振氢谱和质谱结果可以看出,本发明成功合成了4-(2-氨基乙基)-n-(环己基氨基甲酰基)苯磺酰胺,命名为半抗原1,其结构式如式(i)所示:
0.20g,kh
2
po
4 0.20g,加蒸馏水定容至1000ml。
[0073]
将透析后的sus2-ova和sus2-klh和进行紫外全波长扫描。
[0074]
(2)实验结果
[0075]
透析后的sus2-ova和sus2-klh的紫外全波长扫描结果如图5所示,可以看出,相较于ova和klh的紫外吸收,sus2-ova和sus2-klh在250和280波长时的紫外吸收峰发生了明显的偏移,这意味着半抗原2偶联载体蛋白ova和klh成功,得到了人工抗原2。
[0076]
实施例3抗体的制备与检测
[0077]
1、抗n-氨基甲酰基-4-甲苯磺酰胺结构多克隆抗体的制备
[0078]
选取健康的一雄一雌4周大新西兰大白兔用于动物免疫,每只兔子都进行1次首次免疫和3次加强免疫。每两次免疫间隔时间为21天。
[0079]
首次免疫:将sus1-klh(2mg/ml)500μl与等体积弗式完全佐剂混合乳化,制得免疫试剂。然后,采取背部多点皮下免疫的方法对兔子进行免疫。
[0080]
加强免疫:将sus1-klh(2mg/ml)500μl与等体积弗式不完全佐剂混合乳化,制得免疫试剂。然后,采取背部多点皮下免疫的方法对兔子进行免疫。
[0081]
在第三次加强免疫后一周,对兔子进行心脏取血,将兔血放在37℃孵育1小时后转入4℃存放过夜,吸取上清液,得到兔血清,-20℃保存备用,得到抗n-氨基甲酰基-4-甲苯磺酰胺结构多克隆抗体,命名为sus1-klh抗体(多克隆抗体1)。
[0082]
2、抗n-(环己基氨基甲酰基)苯磺酰胺结构多克隆抗体的制备
[0083]
选取健康的一雄一雌4周大新西兰大白兔用于动物免疫,每只兔子都进行1次首次免疫和3次加强免疫。每两次免疫间隔时间为21天。
[0084]
首次免疫:将sus2-klh(2mg/ml)500μl与等体积弗式完全佐剂混合乳化,制得免疫试剂。然后,采取背部多点皮下免疫的方法对兔子进行免疫。
[0085]
加强免疫:将sus2-klh(2mg/ml)500μl与等体积弗式不完全佐剂混合乳化,制得免疫试剂。然后,采取背部多点皮下免疫的方法对兔子进行免疫。
[0086]
在第三次加强免疫后一周,对兔子进行心脏取血,将兔血放在37℃孵育1小时后转入4℃存放过夜,吸取上清液,得到兔血清,-20℃保存备用,得到抗n-(环己基氨基甲酰基)苯磺酰胺结构多克隆抗体,命名为sus2-klh抗体(多克隆抗体2)。
[0087]
3、抗体活性的检测
[0088]
(1)实验方法
[0089]
将包被原(sus1-ova和sus2-ova)用碳酸盐缓冲液稀释成1μg/ml,加入96孔酶标板中,每孔100μl,37℃水浴箱孵育过夜。用pbst洗板2次后,每孔加入120μl 5%脱脂奶粉,37℃水浴箱孵育3小时。用pbst配制适量1μg/ml的药物溶液(甲苯磺丁脲、格列齐特、格列波脲、格列本脲、格列吡嗪、格列喹酮、格列美脲),然后用pbst将兔血清倍比稀释稀释成原来的32k、64k、128k倍。
[0090]
将上述溶液按一般间接竞争elisa方法在已包被好对应包被原的96孔板中加样,37℃水浴箱孵育40分钟,pbst洗板5次,加入5000倍稀释辣根过氧化酶标记的羊抗兔溶液100μl,37℃水浴箱孵育30分钟,pbst洗板5次,加入显色液,再次37℃水浴箱孵育10分钟,加入2mol/l浓硫酸终止反应,在酶标仪上读取数据。
[0091]
其中,碳酸盐缓冲液的配方为:na
2
co
3 1.69g,nahco
3 2.95g,加蒸馏水定容至
1000ml。pbst的配方为:na
2
hpo
4
·
12h
2
o 2.90g,nacl 8.50g,kcl 0.20g,kh
2
po
4 0.20g,tween-20 12ml,加蒸馏水定容至1000ml。
[0092]
最终数据以抑制率的形式表示,其计算公式为:抑制率(%)=1-药物吸光度/同血清浓度下未加药物吸光度。
[0093]
(2)实验结果
[0094]
sus1-klh和sus2-klh免疫所得血清对7种磺酰脲类药物的活性检测结果如图6所示,可以看出,抗n-氨基甲酰基-4-甲苯磺酰胺结构多克隆抗体和抗n-(环己基氨基甲酰基)苯磺酰胺结构多克隆抗体对7种磺酰脲类药物的亲和性存在完全互补的特性,因此,基于2种抗体所建立的两线对比法定性检测磺酰脲类药物胶体金免疫层析方法成为可能。
[0095]
实施例4磺酰脲类药物胶体金免疫层析方法的建立
[0096]
(1)金标抗体和金标结合物垫的制备
[0097]
采用柠檬酸三钠还原氯金酸的方法,制备平均直径在40nm的胶体金悬浮液。在回流条件下,把100ml 0.01%的氯金酸溶液加热至沸腾,不停的搅拌,迅速加入1.1ml 1%的柠檬酸三钠。当反应溶液颜色变成葡萄红色时继续加热搅拌5min。冷却至室温后,加入0.05%的叠氮化钠4℃保存。
[0098]
胶体金分别与sus1-klh抗体和sus2-klh抗体标记,具体标记过程如下:
[0099]
胶体金在与抗体标记前用0.2m的k
2
co
3
溶液调到ph为8.2左右,采用经典nacl滴定法确定30μg抗体为标记1ml胶体金溶液的最佳标记量。然后按最佳标记量进行标记,标记1小时后,在搅拌下加入10%bsa,使最终bsa浓度为1%,孵育1小时。然后4℃10000rpm离心25min,并去上清。加入胶体金溶液同体积的5%bsa溶液重悬,4℃10000rpm离心25min,重复两次。最后,用1/5胶体金溶液体积的tb溶液(含3%bsa、3%蔗糖、0.01mol/l硼酸钠和0.05%叠氮化钠)重悬,4℃保存。用xyz-3060三维喷膜仪把4%的bsa溶液以8μl/cm的量喷在玻璃棉上,使用干燥箱42℃干燥50min,再把金标记抗体以6μl/cm的量喷在玻璃棉上,干燥箱42℃干燥50min,真空干燥保存。
[0100]
(2)偶联抗原羊抗兔包被纤维素膜
[0101]
用xyz-3060三维喷膜仪把浓度为1mg/ml的包被原(sus1-ova和sus2-ova)以1.2μl/cm的量分别喷在纤维素膜的偏下侧,作为检测线(如图7中的3和4);用xyz-3060三维喷膜仪把浓度为120μg/l的羊抗兔igg以1.2μl/cm的量喷在纤维素膜的偏上侧,作为对照线(如图7中的5);sus1-ova和sus2-ova两线间隔2mm,对照线与包被原两线中线间隔10mm。
[0102]
(3)快速试纸条的组装
[0103]
磺酰脲类药物胶体金快速检测试纸条的侧面结构图如图7所示,磺酰脲类药物胶体金快速检测试纸条的俯瞰结构图如图8所示,把硝酸纤维膜6粘贴在pvc衬板8中间部位上,吸水垫7粘贴在硝酸纤维膜6上侧和硝酸纤维膜6重叠1mm。金标结合物垫2粘贴在纤维素膜6下方重叠1mm。样品垫1粘贴在金标结合物垫2下方重叠2mm。组装好的试纸板用斩切机切成3.08mm宽的试纸条。
[0104]
(4)快速试纸条的检测反应原理
[0105]
如图7所示,当待测样品溶液加入试纸条或试纸卡测试端后,待测溶液通过虹吸作用带动待测物及金标结合物垫2中的金标sus1-klh抗体和金标sus2-klh抗体一起向纤维素膜6扩散,并最终渗入吸水垫7端。在扩散过程中,如果样品中含有某一种或多种待测物时,
待测物和金标sus1-klh抗体和金标sus2-klh抗体结合,而被抗原占据结合位点的金标抗体不能与纤维素膜6上隐形检测线3和4(sus1-ova和sus2-ova)结合,从而导致隐形检测线3和4之间的显色深浅变得不一致或者都不显色,即表示检测样品阳性。如果样品中没有待测样品时,金标sus1-klh抗体和金标sus2-klh抗体在上移过程中,会分别与隐形检测线3和4结合,显示为两条颜色深浅基本一致的红线,即表示检测样品阴性。同样,两种金标抗体也与纤维素膜6上的隐形对照线5(羊抗兔igg)结合,使隐形对照线5显红色。隐形对照线5颜色的有或无分别表示此试纸条的有效或无效。
[0106]
(5)检测样品液的制备
[0107]
根据药物的形态不同做不同方式的前处理:
[0108]
液态药物(口服液等):取100μl加到900μl pbst当中,得到样品液。
[0109]
片剂:去外层糖衣,研磨成粉,将粉末用5倍体积处理液(含50%甲醇的碳酸盐缓冲液,ph 9.6)溶解,涡旋3min,3000r/min离心6min取上清100μl加到900μl pbst当中,得到样品液。
[0110]
胶囊:去囊衣,将粉末用5倍体积处理液(含50%甲醇的碳酸盐缓冲液,ph 9.6)溶解,涡旋3min,3000r/min离心6min取上清100μl加到900μl pbst当中,得到样品液。
[0111]
(6)检测及结果判断
[0112]
取200μl上述样品液加到96孔板的孔中,将胶体金检测试纸条样品端插入待检测样品中,待测溶液通过虹吸作用带动待测物及金标结合物垫2中的两种金标抗体一起向纤维素膜6扩散,并最终渗入吸水垫7端。在扩散了5分钟后,取出试纸条,如果隐形检测线3和4的显色有明显差异或者都不显色即表示检测样品为阳性(如图8中的b、c、d);如果隐形检测线3和4显示的颜色基本一致即表示检测样品为阴性(如图8中的a)。同样,金标抗体也与纤维素膜6上的隐形对照线5(羊抗兔igg)结合,使隐形对照线5显红色,隐形对照线5颜色的有或无分别表示此试纸条的有效或无效(检测试纸条的阴阳性判断标准如图9所示,其中a、b、c、d代表有效,e、f代表无效)。
[0113]
(7)稳定性实验
[0114]
1)实验方法
[0115]
将检测试纸条放入铝铂袋中真空包装,并且室温保存,3个月后测定各项指标。
[0116]
2)实验结果
[0117]
3个月后各项指标均符合要求,即检测试纸条的选择和灵敏度达不变,检测显色深度均一,反应结果一致。
[0118]
(8)检出限的测定
[0119]
1)实验方法
[0120]
往空白口服液、硬胶囊、软胶囊、片剂样品中添加标准药物(甲苯磺丁脲、格列齐特、格列波脲、格列本脲、格列吡嗪、格列喹酮、格列美脲),使待测样品最终浓度分别达0μg/kg、5μg/kg、10μg/kg、15μg/kg、20μg/kg、25μg/kg、30μg/kg、35μg/kg、40μg/kg、45μg/kg、50μg/kg的标准药物,经样品前处理,用上述胶体金试纸条对样品进行检测,通过肉眼定性判断,确定可视检测限。
[0121]
检出限的测定结果如表1所示,可以看出,本发明建立的磺酰脲类药物胶体金免疫层析方法能够成功检测出7种药物(甲苯磺丁脲、格列齐特、格列波脲、格列本脲、格列吡嗪、
格列喹酮、格列美脲),且检测灵敏度高,检测限低于质谱方法,符合检测需求。
[0122]
表1检出限的测定结果
[0123][0124]
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询

tips


 商标分类
商标分类  商标转让
商标转让 



