一种L-苯丙氨酸的生产方法与流程
 2021-02-02 15:02:52|
2021-02-02 15:02:52| 389|
389| 起点商标网
起点商标网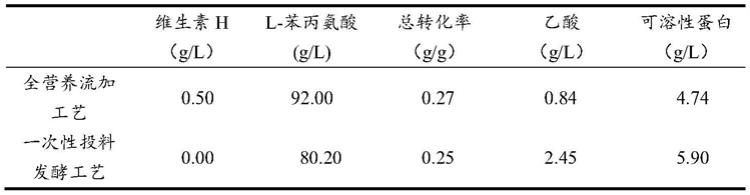
一种l-苯丙氨酸的生产方法
技术领域
[0001]
本发明涉及生物工程技术领域,尤其是一种l-苯丙氨酸的生产方法。
背景技术:
[0002]
l-苯丙氨酸(l-phenylalanine,l-phe)人体不能合成8种必须氨基酸之一,在食品和制药工业中均有诸多应用,如用作营养补充剂、合成食品添加剂和药品的前体,如作为新型甜味剂阿斯巴甜的合成前体。除此之外,该氨基酸还可作为抗癌药物的载体,有效的将抗癌药物导入肿瘤位置,在增强治疗效果的同时,大幅度降低了药物的副作用。目前常用的生产方法为酶法与微生物发酵法,二者各有利弊,但由于酶的稳定性差、成本高等缺点,导致酶法在工业化中受限制较多。微生物发酵法因具有原料廉价易得,环境污染小,产物纯度高等优点而成为了工业化生产l-苯丙氨酸的主流方法。
[0003]
l-苯丙氨酸是一种与生长部分耦联的产物,即菌体持续生长的产酸效率要高于在稳定期产酸的效率。当量维生素h控制一直是微生物发酵生产的重要调节方法,一方面维生素h在脂肪酸生物合成、氨基酸代谢和糖异生的羧化反应中作为酶促辅因子,能够激活相应酶的羧基转移亚基的co2。另一方面脂肪酸会进一步影响细胞膜通透性与产物排出效率。添加维生素h会加快菌体生长速率,提高菌体浓度,但也会出现糖酸转化率降低与菌体过早进入稳定期的问题。此外,发酵过程中,当发酵液中l-苯丙氨酸浓度接近最大溶解度时,会出现难以结晶,严重影响产酸效率的问题。因此,对于l-苯丙氨酸的生产方法有待进一步发展完善,以达到提高l-苯丙氨酸产量、提高生产效率的目的。
技术实现要素:
[0004]
本发明所要解决的技术问题在于提供一种l-苯丙氨酸的生产方法。
[0005]
为解决上述技术问题,本发明的技术方案是:
[0006]
一种l-苯丙氨酸的生产方法,具体步骤包括:菌种活化、种子培养和发酵培养,其中,发酵培养基中维生素h浓度为0mg/l、0.5mg/l、1mg/l或2mg/l,表面活性剂(消泡剂)的blh值范围为1-3,表面活性剂(消泡剂)添加量为1
‰-
6
‰
、添加时间为l-苯丙氨酸即将达到结晶浓度时。
[0007]
优选的,上述l-苯丙氨酸的生产方法,所述维生素h浓度为0.5mg/l。
[0008]
优选的,上述l-苯丙氨酸的生产方法,所述表面活性剂(消泡剂)为聚醚性消泡剂(如多维桥化工有限公司,dx-09-2)或高效有机硅消泡剂(如多维桥化工有限公司,dx-02-1、dx-02-2)。
[0009]
优选地,上述l-苯丙氨酸的生产方法,所述消泡剂添加量为4
‰
。
[0010]
优选地,上述l-苯丙氨酸的生产方法,所述结晶浓度为47g/l。
[0011]
优选地,上述l-苯丙氨酸的生产方法,所述的菌种活化所用培养基成分为葡萄糖5g/l,酵母粉4g/l,蛋白胨10g/l,k
2
hpo
4
.3h
2
o 1g/l,酪氨酸1g/l,琼脂粉25g/l。
[0012]
优选地,上述l-苯丙氨酸的生产方法,所述的种子培养所有培养基成分为葡萄糖
30g/l,酵母粉6g/l,蛋白胨1g/l,柠檬酸1.5g/l,mgso
4
.7h
2
o 1.5g/l,kh
2
po
4 2.0g/l,硫酸铵2.0g/l,v
b1 1mg/l,feso
4
.7h
2
o 10mg/l,mnso
4
.h
2
o 5mg/l,维生素h1mg/l,酪氨酸3g/l,卡那霉素20mg/l。
[0013]
优选的,上述l-苯丙氨酸的生产方法,所述的发酵培养还包括采用全营养流加发酵工艺,所述全营养流加发酵工艺是指将发酵培养基分为底物发酵培养基与浓缩流加培养基,具体为配制3l发酵用量的发酵培养基定容至600ml,取200ml加水定容至2.6l作为底物发酵培养基,剩余400ml作为浓缩流加培养基;所述发酵培养基成分为mgso
4
.7h
2
o 1.5g/l,酵母粉3g/l,蛋白胨1g/l,硫酸铵2g/l,柠檬酸1g/l,k
2
hpo
4
.3h
2
o 6g/l,酪氨酸2g/l,谷氨酸1g/l,feso
4
.7h
2
o 20mg/l,mnso
4 10mg/l,v
b
混合液2ml/l,微量元素混合液1.5ml/l,卡那霉素10mg/l。
[0014]
优选的,上述l-苯丙氨酸的生产方法,所述的发酵培养还包括额外的酪氨酸流加,流加方式为随葡萄糖流加,方法为将酪氨酸用氢氧化钠溶液溶解后单独装瓶,并与流加葡萄糖分开灭菌,待流加葡萄糖与酪氨酸均冷却至室温后混匀。
[0015]
优选的,上述l-苯丙氨酸的生产方法,所述流加葡萄糖为发酵培养所需主要碳源,发酵期间采用葡萄糖亚适量控制工艺,根据罐内残糖浓度确定流加速度,且残糖浓度<2。
[0016]
优选的,上述l-苯丙氨酸的生产方法,所述浓缩流加培养基开始流加时间为发酵2h,流加结束时间为发酵32h;2-7h流加速度为13ml/h,7-12h流加速度为14ml/h,12-22h流加速度为15ml/h,22-27h流加速度为13ml/h,27-32h流加速度为10ml/h。
[0017]
有益效果:
[0018]
上述l-苯丙氨酸的生产方法,通过对发酵培养基中维生素h浓度的优化,提高了最大菌体浓度;通过采用全营养流加工艺解决了添加维生素h带来的糖酸转化率降低与菌体生长过程快的问题,提高了糖酸转化率,避免了培养基营养成分浪费,延长了菌体生长时间;通过优化表面活性剂的添加量与添加时间解决了l-苯丙氨酸难结晶影响生产效率的问题;所述生产方法显著提高了l-苯丙氨酸的产量,最终l-苯丙氨酸浓度达到了92g/l,大大提高了生产效率。
附图说明
[0019]
图1为添加表面活性剂对l-苯丙氨酸产量的影响,其中左图为产量全程变化图,右图为在结晶阶段每半小时产量变化图。
[0020]
图2为不同浓度维生素h对生物量及l-苯丙氨酸产量的影响其中图a为生物量,图b为l-苯丙氨酸产量。
[0021]
图3为不同浓度维生素h对实时糖酸转化率、耗糖速率、总耗糖量和总转化率的影响,其中图c为实时糖酸转化率,图d为耗糖速率,图e柱状图为总耗糖量,折线图为总转化率。
[0022]
图4为不同浓度维生素h对主要副产物乙酸及可溶性蛋白的影响,其中图f为乙酸,图g为可溶性蛋白。
[0023]
图5为全营养流加发酵工艺对生物量及l-苯丙氨酸产量及生物量的影响。
具体实施方式
[0024]
实施例1
[0025]
l-苯丙氨酸的生产方法,使用生产菌为大肠杆菌,购自天津科技大学代谢工程实验室,具体实施步骤与方法如下:
[0026]
特别的,本实施例所述步骤与方法适用于下述所有实施例。
[0027]
菌种活化:取甘油保菌管中菌株置于斜面培养基上,用接种环在试管斜面上划匀,于37℃倒置恒温培养12h,为一代种子;用接种环取一环一代种子,在茄形瓶斜面化匀,于37℃倒置恒温培养12h,为二代种子。
[0028]
种子培养:利用5l发酵罐进行种子培养,初始发酵液体积为3l。初始发酵温度为37℃,初始通气量为1.6l/min,初始搅拌转速为200r/min,后期调节通气量与转速维持do在50左右,通过流加25%氨水调节发酵液ph为6.8~7.0,菌体干重≥7.5g/l时接发酵。
[0029]
发酵培养:利用5l发酵罐进行发酵培养,接种量为20%~30%,定容至2.5l。初始发酵温度为37℃,初始通气量为0.65l/min,初始搅拌转速为200r/min,后期调节通气量与转速维持do在35-60,通过流加25%氨水控制发酵ph为6.8~7.0。
[0030]
流加葡萄糖溶液浓度为800g/l,并随糖液流加菌株缺陷物质:酪氨酸,每升糖液混合1g酪氨酸。其中酪氨酸利用naoh溶液溶解后单独灭菌,待糖液与酪氨酸溶液均冷却后混匀。
[0031]
发酵培养过程中的ph、do、温度均采用梅特勒电极在线实时检测,并配合精密ph试纸(6.4~8.0)人工矫正ph。
[0032]
发酵培养过程中每隔2-3h取样测定l-苯丙氨酸产量、生物量、乙酸产量、可溶性蛋白产量,对应记录耗糖量并计算耗糖速率。
[0033]
特别的,l-苯丙氨酸产量采用lc20at高效液相色谱仪测定,采用agilent c18(15mm
×
4.6mm,3.5μm)色谱柱,流动相为10%乙腈冲液,柱温为40℃,检测波长为210nm,流动相总流速为1ml/min,采用二元梯度洗脱的方法。
[0034]
特别的,有机酸检测采用高效液相色谱法检测有机酸含量。色谱柱aminex hpx-87h column(300mm
×
7.8mm);流动相5mmol/l h
2 so
4
;柱温30℃;流速0.5ml/min;紫外检测波长215nm。
[0035]
特别的,菌体生物量以每升发酵液中菌体干重(g dcw/l)表示。发酵液离心后用去离子水洗涤菌体2次,于80℃恒温箱中加热至恒重后,用分析天平称重。
[0036]
特别的,耗糖速率(g/(l.h))=单位时间耗糖量/时间/发酵液体积
[0037]
糖酸转化率sa计算公式
[0038][0039]
式中:ρ,l-苯丙氨酸质量浓度,g/l;v,发酵液总体积,l;m,总耗糖量,g。
[0040]
特别的,使用bca蛋白浓度测定试剂盒检测(北京索莱宝科技有限公司)上清液中的蛋白含量。
[0041]
实施例2
[0042]
该部分实施例未采用全营养流加工艺,未添加生物素h,仅对添加消泡剂(dx-09-2)对l-苯丙氨酸产量的影响作说明,如图1所示:
[0043]
在发酵液中l-苯丙氨酸达到47g/l(26.5h)时,未添加dx-09-2的发酵批次产酸速率明显下降,一直持续到28h,1.5h产酸量为1.5g,并且在该阶段出现了大量泡沫,在28h取样的发酵液中有明显结晶物质生成,因此在接近发酵浓度时会出现产酸抑制的问题;在26.5h添加dx-09-2的发酵批次明显避免了该问题的出现,结晶阶段产酸效率未受到明显影响,总产量比未添加表面活性剂的发酵批次提高了3.9%。添加dx-09-2使得因结晶导致的泡沫难以生成,降低了发酵液表面张力,发酵液极性下降,l-苯丙氨酸溶解度随之下降,l-苯丙氨酸在添加dx-09-2时极速结晶,解决了抑制问题。
[0044]
实施例3
[0045]
该部分实施例未采用全营养流加工艺,在l-苯丙氨酸即将结晶时添加消泡剂(dx-09-2)前提下,对发酵培养基中维生素h浓度对发酵生产l-苯丙氨酸的影响作说明,维生素h浓度(mg/l)分别是0、0.5、1和2,并以添加0mg/l的发酵批次作为对照组。
[0046]
其中,发酵培养基中维生素h浓度对菌体量与l-苯丙氨酸产量的影响如图2所示:
[0047]
对照组生物量在36h达到最大值40.98g/l,38h出现生物量下降现象。添加0.5mg/l维生素h的发酵批次生物量在34h达到最大值44.94g/l,36h出现生物量下降现象,与对照组相比,提前了2h达到菌体稳定期,生物量增加了9.6%。随着更高浓度的维生素h的添加,生物量不再增长与开始衰退的时间随之提前。一方面,随着维生素h浓度的提高,菌体生长速率提高,最大生物量也随之提高,菌体更快的进入稳定期,导致大量的糖与营养物质流向菌体生长代谢方向,这并不利于l-苯丙氨酸的积累;另一方面,当维生素h过量时,菌体能够生成更完整的细胞膜,使得细胞的通透性下降,增加了产物排出胞外的难度。发酵的12-32h为菌体生长速率最快阶段,此时也是l-苯丙氨酸的生成速率最快的阶段。当进入菌体生长进入稳定期与衰退期后,产酸速度开始逐渐下降。对照组最终生物量为39.1g/l,l-苯丙氨酸产量为80.2g/l;添加0.5mg/l维生素h的发酵批次产量为84.5g/l,与对照组相比提高了5.3%。添加1mg/l、2mg/l维生素h的发酵批次产量分别为78g/l、70.9g/l,与对照组相比分别下降了2.7%、11.6%。
[0048]
发酵培养基中维生素h浓度对实时糖酸转化率、耗糖速率、总耗糖量与总转化率的影响如图3所示:
[0049]
如图c所示,维生素h浓度越高,最大耗糖速率越高,达到最大耗糖速率与耗糖速率开始下降的时间越早,这与生物量与产量变化趋势吻合。如图d、e所示,在12h之前,添加1mg/l、2mg/l的维生素h,转化率相对较高,但随着时间的推移,转化率上升速度减缓,27h转化率开始下降,最高转化率与总转化率要远低于对照组与添加0.5mg/l的发酵批次,与之对应的耗糖速度与总耗糖量却远高于低添加维生素h的发酵批次。过高浓度的维生素h导致菌体快速生长,葡萄糖更多流向菌体生长代谢方面,导致出现较低的糖酸转化率;同时消耗了大量发酵培养基中的营养物质,营养物质过早消耗殆尽不仅造成浪费,还会出现过早进入发酵后期的问题。由图5可以看出,添加1mg/l、2mg/l维生素h的发酵批次分别消耗了1819g、1803g糖,对应总转化率却仅有21.7%与20.3%,相比对照组(1417.6g、25.43%),耗糖量分别提高了28.3%、27.1%,转化率下降了14.6%、20%;添加0.5mg/l维生素h的发酵批次,在进入耗糖速率下降阶段的时间较对照组提前了4h的前提下,发酵全阶段耗糖速率依旧均高于对照组,在总耗糖量较对照组提升了13%的前提下,总转化率仅下降了1.22%,因此添加0.5mg/l维生素h具有提高l-苯丙氨酸的潜力。
[0050]
发酵培养基中维生素h浓度对主要副产物乙酸与可溶性蛋白含量的影响如图4所示:
[0051]
如图f所示,添加1mg/l、2mg/l维生素h的发酵批次乙酸生成速度与最终产量均远高于对照组,维生素h过高时,菌体各个代谢途径均处于旺盛状态,此时乙酸过早开始快速生成,在菌体生长时期即分别积累了1.9g/l、2.1g/l的乙酸,既抑制了菌体正常生长又降低了产酸效率;过量乙酸导致菌体处于稳定期的时间缩短,从而过早进入菌体衰亡期。发酵后期乙酸生成速率加快,此时生物量急速下降,产酸趋近停止,在发酵结束时分别积累了2.98g/l、3.7g/l的乙酸。添加0.5mg/l维生素h发酵批次的乙酸生成与积累情况与对照组相比并无明显差异,仅在菌体衰亡期乙酸浓度略高于对照组,菌体衰亡期耗糖速率下降不明显,但此时菌体产酸能力下降导致无法匹配其耗糖速率,导致乙酸增多。
[0052]
如图g所示,维生素h浓度升高,发酵液可溶性蛋白随之增多,添加0mg/l、0.5mg/l、1mg/l、2mg/l分别积累了5g/l、6.2g/l、7.6g/l、8.4g/l的可溶性蛋白。在生物量下降阶段,可溶性蛋白增加速度明显加快,当可溶性蛋白含量大于5g/l时,发酵液开始大量产生泡沫。对照组在48h出现明显泡沫,与对照组相比,添加0.5mg/l、1mg/l、2mg/l维生素h的发酵批次出现明显泡沫的时间分别提前了2h、7h、10h。
[0053]
综上得知,最优维生素h浓度为0.5g/l。
[0054]
实施例4
[0055]
该部分实施例中,采用上述最优维生素h浓度:0.5g/l,并在发酵液中l-苯丙氨酸浓度达到47g/l时添加4
‰
消泡剂(dx-09-2),采用全营养流加发酵工艺进行三批重复实验,取三次实验数据平均值对大肠杆菌发酵生产l-苯丙氨酸的影响作说明,结果如图5,表1所示:
[0056]
配制3l发酵用量的发酵培养基定容至600ml,取200ml加水定容至2.6l作为底物发酵培养基加入发酵罐内,剩余400ml作为浓缩流加培养基通过蠕动泵在发酵培养期间流加;所述发酵培养基成分为mgso
4
.7h
2
o 1.5g/l,酵母粉3g/l,蛋白胨1g/l,硫酸铵2g/l,柠檬酸1g/l,k
2
hpo
4
.3h
2
o 6g/l,酪氨酸2g/l,谷氨酸1g/l,feso
4
.7h
2
o 20mg/l,mnso
4 10mg/l,v
b
混合液2ml/l,微量元素混合液1.5ml/l,卡那霉素10mg/l。所述浓缩流加培养基开始流加时间为发酵2h,流加结束时间为发酵32h;流加速度分别为:2-7h流加速度为13ml/h,7-12h流加速度为14ml/h,12-22h流加速度为15ml/h,22-27h流加速度为13ml/h,27-32h流加速度为10ml/h。
[0057]
最终在41h达到最大生物量50.6g/l,发酵结束生物量为47g/l,最终产酸达到了92g/l,与对照组相比提高了14.7%;糖酸转化率达到了27.1%,与对照组相比提高了8%;副产物乙酸最终积累浓度分为0.84g/l,与对照组相比降低了63.4%;可溶性蛋白最终积累浓度为4.74g/l,与对照组相比降低了32%。全营养流加工艺使得营养物质在发酵过程中的分布更加合理,使得营养物质更多的流向l-苯丙氨酸生成方向,既提高了产酸效率,又降低了副产物的积累。
[0058]
表1两种发酵工艺对l-苯丙氨酸发酵的影响
[0059][0060]
结果表明,采用本发明发酵生产l-苯丙氨酸可有效提高糖酸转化率与l-苯丙氨酸产量;有效降低副产物乙酸和可溶性蛋白产量,这对提高生长耦联型产物l-苯丙氨酸产量具有积极意义。
[0061]
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询

tips


 商标分类
商标分类  商标转让
商标转让 



