双氢克尿噻半抗原、人工抗原、抗体及其制备方法和应用与流程
 2021-02-02 15:02:11|
2021-02-02 15:02:11| 395|
395| 起点商标网
起点商标网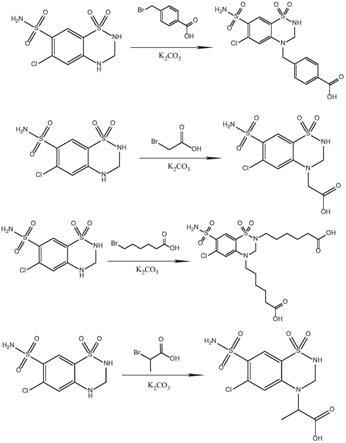
[0001]
本发明涉及抗原抗体检测技术领域,更具体地,涉及双氢克尿噻半抗原、人工抗原、抗体及其制备方法和应用。
背景技术:
[0002]
双氢克尿噻(hydrochlorothiazide,hct)又名双氢氯噻嗪,双氢氯散疾,双氢氯消疾,具有中效利尿作用和降压作用,作用于水肿性疾病,它能够排泄体内过多的钠和水,减少细胞外容量,起到消除水肿的作用,可以用于治疗高血压和中枢性的、肾性的尿崩症以及肾结石。
[0003]
据统计,全球成年高血压患者的数量从1975年的5亿9400万增加到了2015年的11亿3000 万。从1979年到2016年,全球肥胖成年妇女人数从6千9百万人增加到3亿9千万人,肥胖男性从3千1百万增加到2亿8千1百万。在这个大背景下,社会对于辅助减肥和降血压保健食品的需求量大大增加。一些非法分子为了牟取暴利,在降压类保健食品或减肥保健食品中非法加入 hct从而达到迅速降血压的效果或短时间内降低体重的效果。在不知情的情况下服用非法添加hct的保健食品,可能导致高尿酸血症,引起心血管系统、内分泌系统的不良反应;老年患者服用本类药物更易发生低血压、电解质紊乱和肾功能损害。因此,对保健食品中的hct 进行监控检测就显得十分必要。
[0004]
目前我国保健食品中hct含量的检测方法主要有液相色谱-串联质谱法、高效液相色谱法、电化学传感器、毛细管电泳法、红外光谱法等。这些检测方法仪器昂贵,便携性差,样本前处理复杂,并且需要专业技术人员进行操作,不能达到现代化检测对快速、准确的要求。免疫分析检测方法通过抗原和抗体特异性结合的原理,根据显色就可以检测目标物,检测方法快速、灵敏、准确、成本低且操作简便,弥补了仪器分析方法的缺陷并且检测灵敏度能达到要求。
[0005]
建立免疫分析方法的关键是能够制造出对小分子化合物具有高亲和力和高特异性的抗体。由于小分子化合物是半抗原,不具有免疫原性,无法直接诱导机体产生特异性抗体,只有通过适当的化学修饰,在半抗原分子结构的某个位置上带上端部为活性基团的连接臂,再与大分子载体偶联成为人工抗原,才能诱导机体产生免疫应答,产生特异性抗体。因此设计免疫半抗原分子,开发一种简单、快捷、用于检测hct的方法显得尤为重要。
技术实现要素:
[0006]
为了克服上述现有技术的不足,本发明的首要目的是提供一种双氢克尿噻半抗原。
[0007]
本发明的第二个目的是提供上述双氢克尿噻人工抗原。
[0008]
本发明的第三个目的是提供双氢克尿噻抗体。
[0009]
本发明的第四个目的是提供双氢克尿噻半抗原的制备方法。
[0010]
本发明的第五个目的是提供双氢克尿噻半抗原的应用。
氨磺酰-2,3
-ꢀ
二氢-4h-苯并[e][1,2,4]噻二嗪-4-基)丙酸(即: 2-(6-chloro-1,1-dioxido-7-sulfamoyl-2,3-dihydro-4h-benzo[e][1,2,4]thiadiazin-4-yl)propanoicacid)。
[0018]
所述双氢克尿噻半抗原4-((6-氯-1,1-二氧基-7-氨磺酰-2,3-二氢-4h-苯并[e][1,2,4]噻二嗪
ꢀ-
4-基)甲基)苯甲酸与双氢克尿噻分子骨架结构重叠度高,有利于进行免疫诱导,能有效提高双氢克尿噻抗原4-((6-氯-1,1-二氧基-7-氨磺酰-2,3-二氢-4h-苯并[e][1,2,4]噻二嗪-4-基) 甲基)苯甲酸-载体蛋白偶联物的免疫原性。
[0019]
本发明还提供上述双氢克尿噻半抗原4-((6-氯-1,1-二氧基-7-氨磺酰-2,3-二氢-4h-苯并 [e][1,2,4]噻二嗪-4-基)甲基)苯甲酸、2-(6-氯-1,1-二氧化物-7-氨磺酰-2,3-二氢-4h-苯并[e][1,2,4] 噻二嗪-4-基)乙酸、6,6
′-
(6-氯-1,1-二恶英-7-氨磺酰-2h-苯并[e][1,2,4]噻二嗪-2,4(3h)-二基) 二己酸、2-(6-氯-1,1-二氧化物-7-氨磺酰-2,3-二氢-4h-苯并[e][1,2,4]噻二嗪-4-基)丙酸的制备方法,是将双氢克尿噻六元杂环上的亚氨基官能团作为手臂延长位点,通过分别与4-(2-溴乙基)苯甲酸、溴乙酸、6-溴己酸、2-溴丙酸发生反应得到四种双氢克尿噻半抗原。
[0020]
具体的,当制备式(i)所述半抗原时,包括以下步骤:
[0021]
将双氢克尿噻溶于20ml无水乙腈中,以k
2
co
3
作为催化剂,再加入4-(2-溴乙基)苯甲酸于40~80℃回流反应5h后,除去溶剂,萃取反应液,收集有机相,水相再用乙酸乙酯萃取,收集有机相,无水na
2
so
4
干燥、过滤,滤液通过减压蒸馏除去溶剂后,残留物进行硅胶柱层析纯化,以石油醚-乙酸乙酯(1∶1,v/v)溶液作为流动相梯度洗脱,减压浓缩滤液得到黄色油状物质,即得式(i)的半抗原。
[0022]
当制备式(ii)所述半抗原时,包括以下步骤:
[0023]
将双氢克尿噻溶于20ml无水乙腈中,以k
2
co
3
作为催化剂,再加入溴乙酸于40~80℃回流反应5h后,除去溶剂,萃取反应液,收集有机相,水相再用乙酸乙酯萃取,收集有机相,无水na
2
so
4
干燥、过滤,滤液通过减压蒸馏除去溶剂后,残留物进行硅胶柱层析纯化,以石油醚-乙酸乙酯(5∶4,v/v)溶液作为流动相梯度洗脱,减压浓缩滤液得到白色粉末,即得式(ii)的半抗原。
[0024]
当制备式(iii)所述半抗原时,包括以下步骤:
[0025]
将双氢克尿噻溶于20ml无水乙腈中,以k
2
co
3
作为催化剂,再加入6-溴己酸于60~ 80℃回流反应5h后,除去溶剂,萃取反应液,收集有机相,水相再用乙酸乙酯萃取,收集有机相,无水na
2
so
4
干燥、过滤,滤液通过减压蒸馏除去溶剂后,残留物进行硅胶柱层析纯化,以石油醚-乙酸乙酯(5∶6,v/v)溶液作为流动相梯度洗脱,减压浓缩滤液得到白色固体粉末,即得式(iii)的半抗原。
[0026]
当制备式(iv)所述半抗原时,包括以下步骤:
[0027]
将双氢克尿噻溶于20ml无水乙腈中,以k
2
co
3
作为催化剂,再加入2-溴丙酸于40~ 80℃回流反应5h后,除去溶剂,萃取反应液,收集有机相,水相再用乙酸乙酯萃取,收集有机相,无水na
2
so
4
干燥、过滤,滤液通过减压蒸馏除去溶剂后,残留物进行硅胶柱层析纯化,以石油醚-乙酸乙酯(7∶8,v/v)溶液作为流动相梯度洗脱,减压浓缩滤液得到黄色粉末,即得式(iv)的半抗原。
[0028]
本发明在制备半抗原时,使用乙腈作为溶剂,乙腈易除去,提高了处理反应的简便
性,使用溴代酸直接进行一步反应,使大大降低了时间成本,温度适中避免了副产物的生成,大大提高了产率。
[0029]
具体地,所述半抗原4-((6-氯-1,1-二氧基-7-氨磺酰-2,3-二氢-4h-苯并[e][1,2,4]噻二嗪-4
-ꢀ
基)甲基)苯甲酸的制备方法包括以下步骤:
[0030]
将1mol双氢克尿噻溶解于20ml无水乙腈中,加入2mol k
2
co
3
作为催化剂,再加入 1.2mol 4-(2-溴乙基)苯甲酸,磁力搅拌下在40~80℃回流反应后,通过tlc监测反应,展开剂为石油醚-乙酸乙酯(1∶1,v/v),反应5h后使用冰水猝灭反应,减压蒸馏去除溶剂。反应液用乙酸乙酯和水萃取,收集有机相;水相再用乙酸乙酯萃取,收集有机相,合并有机相,再用无水na
2
so
4
干燥并过滤,滤液通过减压蒸馏去除溶剂后,残留物经硅胶柱层析纯化,以石油醚-乙酸乙酯(1∶1,v/v)溶液作为流动相梯度洗脱,减压浓缩滤液得到黄色油状物质,所述为双氢克尿噻半抗原4-((6-氯-1,1-二氧基-7-氨磺酰-2,3-二氢-4h-苯并[e][1,2,4]噻二嗪-4
-ꢀ
基)甲基)苯甲酸。
[0031]
具体地,所述半抗原2-(6-氯-1,1-二氧化物-7-氨磺酰-2,3-二氢-4h-苯并[e][1,2,4]噻二嗪-4
-ꢀ
基)乙酸的制备方法包括以下步骤:
[0032]
将1mol双氢克尿噻溶解于20ml无水乙腈中,加入2mol k
2
co
3
作为催化剂,再加入 1.2mol溴乙酸,磁力搅拌下在40~80℃回流反应后,通过tlc监测反应,展开剂为石油醚
ꢀ-
乙酸乙酯(2∶3,v/v),反应5h后使用冰水猝灭反应,减压蒸馏去除溶剂。反应液用乙酸乙酯和水萃取,收集有机相,水相再用乙酸乙酯萃取,收集有机相,合并有机相,再用无水na
2
so
4
干燥并过滤,滤液通过减压蒸馏去除溶剂后,残留物经硅胶柱层析纯化,以石油醚-乙酸乙酯 (2∶3,v/v)溶液作为流动相梯度洗脱,减压浓缩滤液得到白色粉末,所述为双氢克尿噻半抗原2-(6-氯-1,1-二氧化物-7-氨磺酰-2,3-二氢-4h-苯并[e][1,2,4]噻二嗪-4-基)乙酸。
[0033]
具体地,所述半抗原6,6
′-
(6-氯-1,1-二恶英-7-氨磺酰-2h-苯并[e][1,2,4]噻二嗪-2,4(3h)
ꢀ-
二基)二己酸的制备方法包括以下步骤:
[0034]
将1mol双氢克尿噻溶解于20ml无水乙腈中,加入2mol k
2
co
3
作为催化剂,再加入 1.2mol 6-溴己酸,磁力搅拌下在60~80℃回流反应后,通过tlc监测反应,展开剂为石油醚-乙酸乙酯(5∶6,v/v),反应5h后使用冰水猝灭反应,减压蒸馏去除溶剂。反应液用乙酸乙酯和水萃取,收集有机相;水相再用乙酸乙酯萃取,收集有机相,合并有机相,再用无水 na
2
so
4
干燥并过滤,滤液通过减压蒸馏去除溶剂后,残留物经硅胶柱层析纯化,以石油醚
-ꢀ
乙酸乙酯(5∶6,v/v)溶液作为流动相梯度洗脱,减压浓缩滤液得到白色固体粉末,所述为双氢克尿噻6,6
′-
(6-氯-1,1-二恶英-7-氨磺酰-2h-苯并[e][1,2,4]噻二嗪-2,4(3h)-二基)二己酸。
[0035]
具体地,所述半抗原2-(6-氯-1,1-二氧化物-7-氨磺酰-2,3-二氢-4h-苯并[e][1,2,4]噻二嗪-4
-ꢀ
基)丙酸的制备方法包括以下步骤:
[0036]
将1mol双氢克尿噻溶解于20ml无水乙腈中,加入2mol k
2
co
3
作为催化剂,再加入 1.2mol 2-溴丙酸,磁力搅拌下在40~80℃回流反应后,通过tlc监测反应,展开剂为石油醚-乙酸乙酯(7∶8,v/v),反应5h后使用冰水猝灭反应,减压蒸馏去除溶剂。反应液用乙酸乙酯和水萃取,收集有机相;水相再用乙酸乙酯萃取,收集有机相,合并有机相,再用无水 na
2
so
4
干燥并过滤,滤液通过减压蒸馏去除溶剂后,残留物经硅胶柱层析纯化,以石油醚
-ꢀ
乙酸乙酯(7∶8,v/v)溶液作为流动相梯度洗脱,减压浓缩滤液得到白色固体粉末,所述为双氢克尿噻2-(6-氯-1,1-二氧化物-7-氨磺酰-2,3-二氢-4h-苯并[e][1,2,4]噻二嗪-4-基)丙酸。
[0037]
本发明还提供一种双氢克尿噻人工抗原,由上述半抗原和载体蛋白偶联得到,所述载体蛋白为牛血清白蛋白(bovine serum albumin,bsa)或者鸡卵清白蛋白(ovalbumin,ova)。
[0038]
所述双氢克尿噻半抗原4-((6-氯-1,1-二氧基-7-氨磺酰-2,3-二氢-4h-苯并[e][1,2,4]噻二嗪
ꢀ-
4-基)甲基)苯甲酸与载体蛋白偶联时,双氢克尿噻半抗原4-((6-氯-1,1-二氧基-7-氨磺酰
ꢀ-
2,3-二氢-4h-苯并[e][1,2,4]噻二嗪-4-基)甲基)苯甲酸的特异性结构突出于载体蛋白的表面,作为载体的一个抗原表位暴露给动物免疫系统,为得到特异性高、质量高的抗体奠定了基础。
[0039]
本发明还提供所述人工抗原的制备方法,是采用活泼酯法制备得到,具体包括以下步骤:
[0040]
s1、将式(i),式(ii),式(iii),或式(iv)所示半抗原分别溶于无水dmf中,加入nhs和edc,4℃下搅拌4~6h,记为a液;
[0041]
s2、将载体蛋白溶于碳酸盐缓冲溶液中,记为b液,将a液逐滴加入到b液中,4℃下反应6~10h;
[0042]
s3、4℃下用磷酸盐缓冲溶液透析3天,每天换3次透析液,透析完成后,即得双氢克尿噻人工抗原。
[0043]
所述碳酸盐缓冲液(0.1m,ph 9.6)的制备:称量1.59g naco
3
和2.93g nahco
3
,用去离子水定容1000ml。
[0044]
所述磷酸盐缓冲溶液(0.01m,ph 7.4)的制备:na
2
hpo
4
·
12h
2
o 2.90g,nacl 8.50g, kcl 0.20g,kh
2
po
4 0.20g,加去离子水定容至1000ml。
[0045]
优选的,s1所述双氢克尿噻人工抗原、nhs和edc的投料比为1∶1~2∶1~2;所述载体蛋白和半抗原的摩尔比为1∶60~80。
[0046]
更优选的,s1所述双氢克尿噻人工抗原、nhs和edc的投料比为1∶1.5∶1.5。
[0047]
本发明还提供所述双氢克尿噻人工抗原的应用,是以双氢克尿噻人工抗原作为免疫原制备双氢克尿噻抗体,或者以双氢克尿噻人工抗原作为包被原;所述抗体包括单克隆抗体、多克隆抗体,或者基因工程抗体。
[0048]
本发明还提供一种双氢克尿噻抗体,是由所述双氢克尿噻人工抗原制备得到。
[0049]
具体的,当制备的是抗体时,所述双氢克尿噻抗体的制备方法如下:
[0050]
用双氢克尿噻半抗原4-((6-氯-1,1-二氧基-7-氨磺酰-2,3-二氢-4h-苯并[e][1,2,4]噻二嗪-4
-ꢀ
基)甲基)苯甲酸偶联bsa的人工抗原免疫新西兰大白兔,分别将1mg/ml的人工抗原溶液与等量佐剂混合乳化,初次免疫与弗氏完全佐剂混合乳化后免疫,之后的加强免疫使用免疫原与弗氏不完全佐剂乳化后免疫,共免疫五次,每次间隔3周,每次免疫剂量为0.5ml/只;第五次免疫后第十天采血,采用辛酸-硫酸铵法纯化抗体。
[0051]
本发明还提供所述双氢克尿噻抗体在检测双氢克尿噻中的应用。
[0052]
本发明还提供一种用于检测双氢克尿噻的试剂盒,包括所述双氢克尿噻半抗原、所述双氢克尿噻人工抗原、或者所述双氢克尿噻抗体。
[0053]
本发明还提供一种检测双氢克尿噻的方法,以所述双氢克尿噻半抗原2-(6-氯-1,1-二氧化物-7-氨磺酰-2,3-二氢-4h-苯并[e][1,2,4]噻二嗪-4-基)乙酸与鸡卵清白蛋白的偶联物作为包被原,以所述双氢克尿噻抗体作为检测抗体,采用间接竞争elisa法进行检测。
[0054]
与现有技术相比,本发明具有以下有益效果:
[0055]
本发明首先提供了多种双氢克尿噻半抗原,双氢克尿噻半抗原4-((6-氯-1,1-二氧基-7
-ꢀ
氨磺酰-2,3-二氢-4h-苯并[e][1,2,4]噻二嗪-4-基)甲基)苯甲酸与待测物双氢克尿噻的骨架结构重叠度高,有效地提高了双氢克尿噻半抗原-载体蛋白偶联物的免疫原性,与半抗原结构差异较大,形成较大空间位阻,进一步提高抗体亲和力,利用该双氢克尿噻半抗原得到的人工抗原作为免疫原免疫新西兰大白兔,采用辛酸-硫酸铵法纯化抗体后为抗体。所得到抗体的效价高、特异性强、亲和力高,利用其所建立的对双氢克尿噻的lod为0.26ng/ml,ic
50
为12.27 ng/ml,定量检测范围为1.07~140.39ng/ml,检测灵敏度高,线性范围广;本发明的抗体具有简便快速、特异性强、线性范围广,灵敏度高的特点,在双氢克尿噻的快速有效检测中具有良好的应用前景和广阔的发展空间。
附图说明
[0056]
图1为人工抗原4-((6-氯-1,1-二氧基-7-氨磺酰-2,3-二氢-4h-苯并[e][1,2,4]噻二嗪-4-基) 甲基)苯甲酸-bsa的紫外扫描图;
[0057]
图2为人工抗原2-(6-氯-1,1-二氧化物-7-氨磺酰-2,3-二氢-4h-苯并[e][1,2,4]噻二嗪-4-基) 乙酸-ova的紫外扫描图;
[0058]
图3为半抗原合成路径图;
[0059]
图4为双氢克尿噻elisa标准曲线图;
[0060]
图5为双氢克尿噻胶体金免疫层析试纸条目视判定示意图;
[0061]
图6为双氢克尿噻胶体金免疫层析试纸条的侧面示意图;其中,1-pvc底板;2-样品垫; 3-结合垫;4-nc膜;5-检测线(t线);6-质控线(c线);7-吸水垫。
具体实施方式
[0062]
下面对本发明的具体实施方式作进一步说明。在此需要说明的是,对于这些实施方式的说明用于帮助理解本发明,但并不构成对本发明的限定。此外,下面所描述的本发明各个实施方式中所涉及的技术特征只要彼此之间未构成冲突就可以相互组合。
[0063]
下述实验例中所使用的试验方法如无特殊说明,均为常规方法;所使用的材料、试剂等,如无特殊说明,为可从商业途径得到的试剂和材料。
[0064]
实施例1双氢克尿噻半抗原的制备
[0065]
一、双氢克尿噻半抗原4-((6-氯-1,1-二氧基-7-氨磺酰-2,3-二氢-4h-苯并[e][1,2,4]噻二嗪
ꢀ-
4-基)甲基)苯甲酸的合成
[0066]
合成路径如图3所示。
[0067]
合成步骤包括:
[0068]
将1mol双氢克尿噻溶解于20ml无水乙腈中,加入2mol k
2
co
3
作为催化剂,再加入 1.2mol 4-(2-溴乙基)苯甲酸,磁力搅拌下在40~80℃回流反应后,通过tlc监测反应,展开
剂为石油醚-乙酸乙酯(1∶1,v/v),反应5h后使用冰水猝灭反应,减压蒸馏去除溶剂。反应液用乙酸乙酯和水萃取,收集有机相;水相再用乙酸乙酯萃取,收集有机相,合并有机相,再用无水na
2
so
4
干燥并过滤,滤液通过减压蒸馏去除溶剂后,残留物经硅胶柱层析纯化,以石油醚-乙酸乙酯(1∶1,v/v)溶液作为流动相梯度洗脱,减压浓缩滤液得到黄色油状物质,所述为双氢克尿噻半抗原4-((6-氯-1,1-二氧基-7-氨磺酰-2,3-二氢-4h-苯并[e][1,2,4]噻二嗪-4
-ꢀ
基)甲基)苯甲酸。结构式如下所示:
[0069]
二、双氢克尿噻半抗原2-(6-氯-1,1-二氧化物-7-氨磺酰-2,3-二氢-4h-苯并[e][1,2,4]噻二嗪
ꢀ-
4-基)乙酸的合成
[0070]
合成步骤包括:
[0071]
将1mol双氢克尿噻溶解于20ml无水乙腈中,加入2mol k
2
co
3
作为催化剂,再加入 1.2mol溴乙酸,磁力搅拌下在40~80℃回流反应后,通过tlc监测反应,展开剂为石油醚
ꢀ-
乙酸乙酯(2∶3,v/v),反应5h后使用冰水猝灭反应,减压蒸馏去除溶剂。反应液用乙酸乙酯和水萃取,收集有机相,水相再用乙酸乙酯萃取,收集有机相,合并有机相,再用无水na
2
so
4
干燥并过滤,滤液通过减压蒸馏去除溶剂后,残留物经硅胶柱层析纯化,以石油醚-乙酸乙酯 (2∶3,v/v)溶液作为流动相梯度洗脱,减压浓缩滤液得到白色粉末,所述为双氢克尿噻半抗原2-(6-氯-1,1-二氧化物-7-氨磺酰-2,3-二氢-4h-苯并[e][1,2,4]噻二嗪-4-基)乙酸。结构式如下所示:
[0072]
三、双氢克尿噻半抗原6,6
′-
(6-氯-1,1-二恶英-7-氨磺酰-2h-苯并[e][1,2,4]噻二嗪-2,4(3h)
ꢀ-
二基)二己酸的合成
[0073]
合成步骤包括:
[0074]
将1mol双氢克尿噻溶解于20ml无水乙腈中,加入2mol k
2
co
3
作为催化剂,再加入 1.2mol 6-溴己酸,磁力搅拌下在60~80℃回流反应后,通过tlc监测反应,展开剂为石油醚-乙酸乙酯(5∶6,v/v),反应5h后使用冰水猝灭反应,减压蒸馏去除溶剂。反应液用乙酸乙酯和水萃取,收集有机相;水相再用乙酸乙酯萃取,收集有机相,合并有机相,再用无水 na
2
so
4
干燥并过滤,滤液通过减压蒸馏去除溶剂后,残留物经硅胶柱层析纯化,以石油醚
-ꢀ
乙酸乙酯(5∶6,v/v)溶液作为流动相梯度洗脱,减压浓缩滤液得到白色固体粉末,所述为双
氯-1,1-二氧基-7-氨磺酰-2,3-二氢-4h-苯并[e][1,2,4]噻二嗪-4-基)甲基)苯甲酸。
[0084]
二、双氢克尿噻半抗原2-(6-氯-1,1-二氧化物-7-氨磺酰-2,3-二氢-4h-苯并[e][1,2,4]噻二嗪
ꢀ-
4-基)乙酸的鉴定
[0085]
氢谱核磁结果如下:
1
h nmr(600mhz,meod)δ8.18(s,1h),6.97(s,1h),5.34(t,j=4.7 hz,1h),5.05(s,2h),3.55(s,2h)。
[0086]
质谱结果如下:esi-ms:m/z[m-h]-353.8(c
9
h
10
cln
3
o
6
s
2
)。
[0087]
由质谱结果可以看出,353.80为半抗原2-(6-氯-1,1-二氧化物-7-氨磺酰-2,3-二氢-4h-苯并[e][1,2,4]噻二嗪-4-基)乙酸的负离子分子峰,计算得其相对分子质量为354.97,与实际的相对分子质量相符,说明成功制备得到了双氢克尿噻半抗原2-(6-氯-1,1-二氧化物-7-氨磺酰
ꢀ-
2,3-二氢-4h-苯并[e][1,2,4]噻二嗪-4-基)乙酸。
[0088]
三、双氢克尿噻半抗原6,6
′-
(6-氯-1,1-二恶英-7-氨磺酰-2h-苯并[e][1,2,4]噻二嗪-2,4(3h)
ꢀ-
二基)二己酸的鉴定
[0089]
氢谱核磁结果如下:1h nmr(600mhz,meod)δ8.23(s,1h),7.74-7.70(m,1h),7.64
-ꢀ
7.59(m,1h),6.99(s,1h),4.29(t,j=6.6hz,2h),2.88(t,j=6.9,3.5hz,4h),2.25(t,j=7.4,6.4 hz,4h),1.48-1.44(m,6h),1.33-1.29(m,6h).碳谱核磁结果如下:13c nmr(151mhz, meod)δ176.06(s),149.82(s),136.17(s),133.28(s),130.95(s),128.47(s),118.14(s),65.26(s), 42.32(s),42.13(s),33.34(s),30.32(s),28.91(s),28.80(s),25.80(s),24.16(s),18.86(s),12.65 (s)。
[0090]
质谱结果如下:esi-ms:m/z[m-h]-524.1(c
19
h
28
cln
3
o
8
s
2
)。
[0091]
由质谱结果可以看出,523.9为半抗原bp的负离子分子峰,计算得其相对分子质量为 525.10,与实际的相对分子质量相符,说明成功制备得到了双氢克尿噻半抗原6,6
′-
(6-氯-1,1
-ꢀ
二恶英-7-氨磺酰-2h-苯并[e][1,2,4]噻二嗪-2,4(3h)-二基)二己酸。
[0092]
四、双氢克尿噻半抗原2-(6-氯-1,1-二氧化物-7-氨磺酰-2,3-二氢-4h-苯并[e][1,2,4]噻二嗪
ꢀ-
4-基)丙酸的鉴定
[0093]
氢谱核磁结果如下:1h nmr(600mhz,meod)δ8.18(s,1h),6.92(s,1h),5.12(q,j= 11.3hz,2h),4.39(q,j=7.2hz,1h),4.29(t,j=6.6hz,1h),3.35(s,1h),1.41(d,j=7.6hz, 3h)。
[0094]
质谱结果如下:esi-ms:m/z[m-h]-367.60(c
10
h
12
cln
3
o
6
s
2
)。
[0095]
由质谱结果可以看出,367.60为半抗原bp的负离子分子峰,计算得其相对分子质量为 368.99,与实际的相对分子质量相符,说明成功制备得到了双氢克尿噻半抗原2-(6-氯-1,1
-ꢀ
二氧化物-7-氨磺酰-2,3-二氢-4h-苯并[e][1,2,4]噻二嗪-4-基)丙酸。
[0096]
实施例3双氢克尿噻人工抗原的制备
[0097]
一、人工抗原的合成
[0098]
一种双氢克尿噻人工抗原的制备方法,包括以下步骤:
[0099]
将实施例1制备得到的双氢克尿噻半抗原4-((6-氯-1,1-二氧基-7-氨磺酰-2,3-二氢-4h
-ꢀ
苯并[e][1,2,4]噻二嗪-4-基)甲基)苯甲酸、2-(6-氯-1,1-二氧化物-7-氨磺酰-2,3-二氢-4h-苯并 [e][1,2,4]噻二嗪-4-基)乙酸,6,6
′-
(6-氯-1,1-二恶英-7-氨磺酰-2h-苯并[e][1,2,4]噻二嗪-2,4(3h)
ꢀ-
二基)二己酸,2-(6-氯-1,1-二氧化物-7-氨磺酰-2,3-二氢-4h-苯并[e][1,2,4]噻二嗪-4-基)丙酸通过活泼酯法分别偶联牛血清蛋白bsa
苯并[e][1,2,4]噻二嗪-4-基)甲基)苯甲酸在290nm处有特征峰,而偶联反应后,4-((6-氯-1,1-二氧基-7
-ꢀ
氨磺酰-2,3-二氢-4h-苯并[e][1,2,4]噻二嗪-4-基)甲基)苯甲酸-bsa在270nm处出现特征峰,对比三者曲线可看出发生显著位移,故说明反应产物是载体蛋白bsa与4-((6-氯-1,1-二氧基-7-氨磺酰-2,3-二氢-4h-苯并[e][1,2,4]噻二嗪-4-基)甲基)苯甲酸的复合物,偶联成功。
[0106]
取人工抗原2-(6-氯-1,1-二氧化物-7-氨磺酰-2,3-二氢-4h-苯并[e][1,2,4]噻二嗪-4-基)乙酸
ꢀ-
ova进行紫外扫描,结果如图2所示。
[0107]
2-(6-氯-1,1-二氧化物-7-氨磺酰-2,3-二氢-4h-苯并[e][1,2,4]噻二嗪-4-基)乙酸、ova和人工抗原2-(6-氯-1,1-二氧化物-7-氨磺酰-2,3-二氢-4h-苯并[e][1,2,4]噻二嗪-4-基)乙酸-ova分别进行紫外(150~500nm)扫描鉴定,其中,三者浓度均为1mg/ml,并通过比较偶联前后的各物质的最高吸光值,发现人工抗原的吸收曲线与载体蛋白明显不同,ova仅在280nm 处有特征峰,2-(6-氯-1,1-二氧化物-7-氨磺酰-2,3-二氢-4h-苯并[e][1,2,4]噻二嗪-4-基)乙酸在 300nm处有特征峰,而偶联反应后,2-(6-氯-1,1-二氧化物-7-氨磺酰-2,3-二氢-4h-苯并[e][1,2,4] 噻二嗪-4-基)乙酸-ova在270nm处出现特征峰,对比三者曲线可看出发生显著位移,故说明反应产物是载体蛋白ova与2-(6-氯-1,1-二氧化物-7-氨磺酰-2,3-二氢-4h-苯并[e][1,2,4]噻二嗪-4-基)乙酸的复合物,偶联成功。
[0108]
实施例4双氢克尿噻抗体的制备
[0109]
一、动物免疫
[0110]
用健康的体重为1.5~2kg的新西兰大白兔作为实验动物,以双氢克尿噻人工抗原4-((6
-ꢀ
氯-1,1-二氧基-7-氨磺酰-2,3-二氢-4h-苯并[e][1,2,4]噻二嗪-4-基)甲基)苯甲酸-bsa,2-(6
-ꢀ
氯-1,1-二氧化物-7-氨磺酰-2,3-二氢-4h-苯并[e][1,2,4]噻二嗪-4-基)乙酸-bsa,2-(6-氯-1,1
-ꢀ
二氧化物-7-氨磺酰-2,3-二氢-4h-苯并[e][1,2,4]噻二嗪-4-基)丙酸-bsa作为免疫原,在大白兔颈背部进行皮下注射,分别将1mg/ml的人工抗原溶液与等量佐剂混合乳化,初次免疫与弗氏完全佐剂混合乳化后免疫,之后的加强免疫使用免疫原与弗氏不完全佐剂乳化后免疫,共免疫五次,每次间隔3周,每次免疫剂量为0.5ml/只;期间耳缘静脉取少量血进行抗体质量鉴定,第五次免疫后第十天采血,采用辛酸-硫酸铵法纯化抗体。
[0111]
二、双氢克尿噻半抗原4-((6-氯-1,1-二氧基-7-氨磺酰-2,3-二氢-4h-苯并[e][1,2,4]噻二嗪
ꢀ-
4-基)甲基)苯甲酸抗体纯化(辛酸-硫酸铵法):
[0112]
(1)取兔血清,在4℃条件下,12000rpm离心15min,去除沉淀;
[0113]
(2)取1体积的兔血清与2体积的醋酸盐缓冲液混合(ph 4.8),室温搅拌下,逐滴加入正辛酸,使用量为75μl正辛酸/ml兔血清;
[0114]
(3)室温搅拌混合30min,4℃静止2h使其充分沉淀;
[0115]
(4)4℃条件下,12000r/min离心15min,去除沉淀;
[0116]
(5)上清经砂芯漏斗或125μm尼龙网过滤后,加入1/10体积的pbs缓冲液(0.1m, ph 7.4),用2m的氢氧化钠调ph至7.4,计算总溶液体积;
[0117]
(6)冰浴下于30min内加入0.277g/ml的硫酸铵,使其成为45%饱和溶液;
[0118]
(7)4℃静止1h以上后,4℃条件下,12000rpm离心15min,弃上清;
[0119]
(8)沉淀用pbs缓冲液(0.1m,ph 7.4)溶解并透析三天。
[0120]
实施例5双氢克尿噻免疫原和包被原组合优化
[0121]
分别将双氢克尿噻人工抗原4-((6-氯-1,1-二氧基-7-氨磺酰-2,3-二氢-4h-苯并[e][1,2,4] 噻二嗪-4-基)甲基)苯甲酸-bsa,2-(6-氯-1,1-二氧化物-7-氨磺酰-2,3-二氢-4h-苯并[e][1,2,4] 噻二嗪-4-基)乙酸-bsa,2-(6-氯-1,1-二氧化物-7-氨磺酰-2,3-二氢-4h-苯并[e][1,2,4]噻二嗪-4
-ꢀ
基)丙酸-bsa进行免疫新西兰大白兔,制得的抗体进行所有结构的包被原筛选,经elisa 检测效价和抑制率如表1所示。
[0122]
具体操作步骤如下:
[0123]
(1)将双氢克尿噻抗体用pbst稀释为1∶1000、1∶2000、1∶4000、1∶8000、1∶16000、1∶32000、1∶64000、1∶128000、1∶256000,同时设置空白对照孔(用pbst代替);
[0124]
(2)将双氢克尿噻人工抗原4-((6-氯-1,1-二氧基-7-氨磺酰-2,3-二氢-4h-苯并[e][1,2,4] 噻二嗪-4-基)甲基)苯甲酸-ova,2-(6-氯-1,1-二氧化物-7-氨磺酰-2,3-二氢-4h-苯并[e][1,2,4] 噻二嗪-4-基)乙酸-ova,6,6
′-
(6-氯-1,1-二恶英-7-氨磺酰-2h-苯并[e][1,2,4]噻二嗪-2,4(3h)
ꢀ-
二基)二己酸-ova,2-(6-氯-1,1-二氧化物-7-氨磺酰-2,3-二氢-4h-苯并[e][1,2,4]噻二嗪-4-基) 丙酸-ova分别用包被液(0.05m碳酸盐缓冲溶液,ph 9.6)稀释至125ng/ml的浓度,包被 96孔酶标板,每孔加入100μl,37℃恒温水浴箱温育过夜,弃包被液,用pbst(0.01m pbs, 0.06%tween-20(v/v))洗涤2次;
[0125]
(3)每孔加入120μl封闭液(1%的鱼胶蛋白),37℃封闭3h,弃去封闭液,拍板,在干燥箱37℃烘干备用;
[0126]
(4)用pbst将1mg/ml双氢克尿噻稀释1000倍,为1000ng/ml;
[0127]
(5)每行加50μl双氢克尿噻稀释液(三组平行),再加50μl pbst稀释液/孔,在37℃温育40min,洗涤5次;
[0128]
(6)加入羊抗兔二抗igg-hrp(5000倍稀释),37℃温育30min,洗涤5次,拍板;
[0129]
(7)加入显色液显色10min;
[0130]
(8)加入50μl 10%h
2
so
4
终止反应,并在450nm处读取od值;
[0131]
实验结果:免疫新西兰大白兔所获得的抗血清的效价抑制率检测结果如表1所示,可以看出,免疫的兔子均产生兔多抗,所得抗血清对目标分析物双氢克尿噻有均不同程度的抑制效果,且1号新西兰大白兔的抗体抑制率最高,为88.2%,说明对该抗体双氢克尿噻的特异性识别最强,进一步说明1号的免疫人工抗原和包被人工抗原是最佳组合。
[0132]
抑制率=(效价的od值-抑制的od值)/抑制的od值*100%;
[0133]
表1双氢克尿噻三种免疫原和包被原最佳组合的效价和抑制率数据
[0134][0135]
实施例6双氢克尿噻elisa标准曲线的建立
[0136]
一、elisa检测
[0137]
(1)将双氢克尿噻抗体用pbst稀释为1∶64000,同时设置空白对照孔(用pbst代替);
[0138]
(2)将双氢克尿噻2-(6-氯-1,1-二氧化物-7-氨磺酰-2,3-二氢-4h-苯并[e][1,2,4]噻二嗪-4
-ꢀ
基)乙酸-ova人工抗原用包被液稀释至125ng/ml的浓度,包被96孔酶标板,每孔加入100 μl,37℃恒温水浴箱温育过夜,弃去包被液,用pbst(0.01m pbs,0.06%tween-20(v/v)) 洗涤2次;
[0139]
(3)每孔加入120μl封闭液(1%的鱼胶蛋白),37℃封闭3h,弃去封闭液,拍板,在干燥箱37℃烘干备用;
[0140]
(4)用pbst将1ug/ml双氢克尿噻先5倍稀释,再进行3倍稀释,并将双氢克尿噻稀释至1000.00,200.00,66.67,22.22,7.41,2.47,0.82ng/ml;
[0141]
(5)每行加50μl双氢克尿噻稀释液(三组平行),再加50μl pbst稀释液/孔,在37℃温育40min,洗涤5次;
[0142]
(6)加入羊抗兔二抗igg-hrp(5000倍稀释),37℃温育30min,洗涤5次,拍板;
[0143]
(7)加入显色液显色10min;
[0144]
(8)加入50μl 10%h
2
so
4
终止反应,并在450nm处读取od值;
[0145]
二、结果
[0146]
以双氢克尿噻标准品浓度对横坐标,b/b
0
(加入双氢克尿噻的孔的od
450
/未加入双氢克尿噻的孔的od
450
)为纵坐标,建立间接竞争标准曲线。双氢克尿噻elisa标准曲线图如
图4所示,可以看出,标准曲线呈s型,线性相关性较好,对双氢克尿噻的最低检测限为0.26ng/ml,ic
50
为12.27ng/ml,线性范围为1.07~140.39ng/ml,检测灵敏度高,线性范围广。
[0147]
实施例7双氢克尿噻胶体金快速检测方法
[0148]
一、金标抗体和金标结合物垫的制备
[0149]
采用柠檬酸三钠还原氯金酸的方法,制备平均直径在40nm的胶体金悬浮液。在回流条件下,把100ml 0.01%的氯金酸溶液加热至沸腾,不停的搅拌,迅速加入1.1ml 1%的柠檬酸三钠。当反应溶液颜色变成葡萄红色时继续加热搅拌5min。冷却至室温后,加入0.05%的叠氮化钠4℃保存。
[0150]
胶体金在与抗体标记前以0.2mol的k
2
co
3
溶液调到ph为8.2左右,采用经典nacl滴定法确定30μg抗体标记1ml胶体金溶液。然后按最佳标记量进行标记,标记1小时后,搅拌下加入10%bsa(使最终bsa浓度为1%),孵育1小时后4℃10000rpm离心25min,并去上清。加入胶体金溶液同体积的5%bsa溶液重悬,4℃10000rpm离心25min,重复两次。最后,用1/5胶体金溶液体积的tb溶液(含3%bsa、3%蔗糖、0.01mol/l硼酸钠和0.05%叠氮化钠)重悬,4℃保存。用xyz-3000三维喷膜仪把4%的bsa溶液以8μl/cm的量喷在玻璃棉上,使用干燥箱42℃干燥50min,再把金标记抗体以6μl/cm的量喷在玻璃棉上,干燥箱42℃干燥50min,真空干燥保存。
[0151]
二、偶联抗原羊抗兔包被纤维素膜
[0152]
用xyz-3000三维喷膜仪把浓度为0.15mg/ml的包被抗原以0.8μl/cm的量喷在纤维素膜的偏下侧,作为检测线。用xyz-3060三维喷膜仪把浓度为0.24mg/l的羊抗兔igg以0.8μ l/cm的量喷在纤维素膜的偏上侧,作为对照线,两线间隔7mm。
[0153]
三、快速试纸条的组装
[0154]
如图6所示,把纤维素膜4粘贴在衬板1中间部位上,吸水垫7粘贴在纤维素膜4上侧和纤维素膜4重叠1mm。金标结合物垫3粘贴在纤维素膜4下方重叠1mm。样品垫2粘贴在金标结合物垫3下方重叠2mm。组装好的试纸板用斩切机切成3.05mm宽的试纸条。
[0155]
四、检测样品液的制备
[0156]
口服液等液态保健品,取100μl加到900μl pbst当中,得到样品液。
[0157]
片剂:去外层糖衣,研磨成粉,将粉末用5倍体积处理液(含50%甲醇的碳酸盐缓冲液, ph 9.6)溶解,涡旋3min,3000r/min离心6min取上清100μl加到900μl pbst当中,得到样品液。
[0158]
胶囊:去囊衣,将粉末用5倍体积处理液(含50%甲醇的碳酸盐缓冲液,ph 9.6)溶解,涡旋3min,3000r/min离心6min取上清100μl加到900μl pbst当中,得到样品液。
[0159]
1、快速检测试纸条检测及判断
[0160]
当待测样品溶液加入试纸条或试纸卡测试端后,待测溶液通过虹吸作用带动待测物及金标结合物垫3中的金标抗体一起向纤维素膜4扩散,并最终渗入吸水垫7端。在扩散过程中,如果样品中有待测物时,待测物和金标抗体结合,进而占据了金标抗体上的抗原结合点,阻止金标抗体与纤维素膜4上隐形检测线5(半抗原与载体蛋白的结合物)的结合,使隐形检测线 5不显色或者显色很弱即表示检测样品阳性或者弱阳性;如果样品中没有待测样品时,金标抗体在上移过程中,遇隐形检测线5显示一条清晰红线即表示检测样品阴性。同
样,金标抗体也与纤维素膜4上的隐形对照线6(羊抗兔igg)结合,使隐形对照线6显红色。隐形对照线 6颜色的有或无分别表示此试纸条的有效或无效,判定结果如图5所示。
[0161]
2、检出限的测定
[0162]
往空白口服液,硬胶囊,软胶囊,片剂样品中添加一系列浓度的标准药物,经样品前处理,用上述胶体金试纸条对样品进行检测,通过肉眼定性判断,确定可视检测限。具体结果见下表。
[0163]
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询

tips


 商标分类
商标分类  商标转让
商标转让 



