一种双功能量子点微球复合纳米材料、制备方法及其应用与流程
 2021-02-02 14:02:49|
2021-02-02 14:02:49| 334|
334| 起点商标网
起点商标网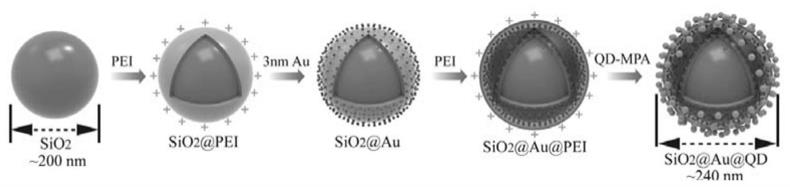
[0001]
本发明涉及纳米材料技术领域,尤其涉及一种双功能量子点微球复合 纳米材料、制备方法及其应用。
背景技术:
[0002]
胶体金免疫层析作为一种快速诊断技术已广泛应用于生物检测领域。 胶体金是由一定大小的金颗粒由于静电作用成为一种稳定的胶体状态,形 成带负电的疏水胶溶液,由于静电作用而成为稳定的胶体状态。以胶体金 作为示踪标志物可用于抗原抗体免疫标记技术(例如使用胶体金免疫层析 试纸条),但是胶体金诊断法存在一些固有缺陷,包括定量能力不足,只 能作定性或半定量检测而不能做定量检测、检测灵敏度差、存在假阴性等 缺点。
[0003]
量子点微球是将发光材料量子点与微米级或纳米级微球制备为荧光量 子点微球。量子点微球已被广泛应用于生物检测领域。然而,量子点微球 存在一些缺点,例如量子点性质敏感、稳定性不强、易团聚等使得其使用 受到较大的限制。将量子点微球复合于聚合物材料等载体中,可以提高量 子点微球的稳定性、荧光性能及更好的分散性。因而,可被用作免疫层析 系统的荧光分子标签,用于生物抗原或抗体的检测。
[0004]
核壳结构的复合纳米材料近年来得到越来越多的关注并在生物、医学 以及化学领域得到广泛应用。二氧化硅纳米材料因其具有稳定性好,可重 复利用、分散性强、粒径大小可控以及比面积大等优势在核壳结构的复合 纳米材料领域得到广泛应用。核壳量子点是纳米材料的研究热点之一,然 而,目前只有硅球量子点的核壳结构,尚无将胶体金和量子点结合起来的 双功能硅核量子点的纳米材料。制备核壳量子点的方法有多种,包括前提 高温入注法、种子生长法以及离子交换法等,但现有技术中的硅球纳米复 合材料制备方法复杂,操作难度大。
[0005]
为解决上述技术问题,特提出本发明。
技术实现要素:
[0006]
本发明的目的在于提供一种具有双功能、单分散性的新型量子点微球 复合纳米材料及其制备方法和应用。所述双功能量子点微球复合纳米材料 的制备过程利用正电性多聚物聚乙酰亚胺(polyethyleneimine,pei)的层 层自组装特性,在结构上既具有胶体金和量子点双功能外壳。该材料既具 有胶体金比色的定性功能,又具有量子点优异的荧光性能;可提供肉眼可 读的比色信号及紫外激发的荧光信号,可用于不同粒径的硅球量子点微球 的制备。
[0007]
为了实现本发明的上述目的,本发明采用的技术方案如下:
[0008]
一种双功能量子点微球复合纳米材料,所述量子点微球复合纳米材料 具有核壳结构;内核层为sio
2
纳米颗粒,中间层为胶体金颗粒,外壳层为 带负电荷的量子点;所述内核层与所述中间层之间以及所述中间层与所述 外壳层之间为pei自组装层。
[0009]
在一个具体的实施方案中,所述sio
2
纳米颗粒的粒径大小范围为100~ 350nm;所述pei自组装层的厚度为1~10nm;所述量子点微球复合纳米 材料的粒径大小为150~400nm;荧光发射波长范围为400~800nm胶体金 颗粒为aunp颗粒;所述带负电荷的量子点为羧基化量子点;优选地所述 羧基化量子点为cdse/zns-cooh颗粒。
[0010]
本发明还提供一种双功能量子点微球复合纳米材料的制备方法,具体 为以下步骤:
[0011]
(1)将sio
2
颗粒添加到水中,通过超声反应使sio
2
颗粒单分散,形 成sio
2
水溶液;
[0012]
(2)将步骤(1)所得的sio
2
水溶液添加到聚乙烯亚胺(pei)溶液中, 通过超声反应使pei在sio
2
纳米颗粒表面自组装,形成pei修饰的表面带 正电荷的sio
2
@pei颗粒;
[0013]
(3)将步骤(2)所得的sio
2
@pei颗粒添加到胶体金颗粒溶液中,通 过超声反应,使胶体金颗粒紧密的吸附在sio
2
@pei颗粒表面,获得硅核金 壳复合纳米颗粒材料(sio
2
@au);
[0014]
(4)将步骤(3)所得的sio
2
@au颗粒添加到聚乙烯亚胺(pei)溶 液中,通过超声反应使pei在sio
2
@au纳米颗粒表面再次自组装,形成第 二层pei修饰的表面带正电荷的sio
2
@au@pei颗粒;
[0015]
(5)将步骤(4)所得的sio
2
@au@pei颗粒添加到带负电荷的羧基 化量子点溶液中,通过超声反应,使负电性的羧基化量子点颗粒紧密的吸 附在正电性的sio
2
@au@pei颗粒表面,获得一种双功能量子点微球复合 纳米颗粒的材料(sio
2
@au@qds)。
[0016]
在一个实施方案中,所述步骤(1)中,所述sio
2
颗粒采用含硅的前驱 体、还原剂、去离子水以及有机溶剂来制备。
[0017]
在步骤(1)中,将含硅的前驱体和还原剂添加到有机溶剂中,搅拌均 匀后放入锥形瓶中进行合成反应,待反应完成后离心收集产物,得 到sio
2
颗粒。
[0018]
优选地,含硅的前驱体采用正硅酸乙酯(teos),有机溶剂为无水乙 醇,还原剂采用27%-29%氨水,室温反应4~6h。
[0019]
在一个实施方案中,所述正硅酸乙酯、27%-29%氨水、去离子水、无 水乙醇的体积比为3-5:3-4:5-8:100,优选为4∶3.5∶6∶100。
[0020]
上述的双功能量子点微球复合纳米材料制备方法,所述步骤(2)中, pei的分子量为5000~80000,pei溶液的浓度为0.2mg/ml~5mg/ml,优 选为1mg/ml;所述超声反应的时间为20~60min,优选为40min。
[0021]
在一个实施方案中,在步骤(2)后,还包括:将sio
2
@pei颗粒离心 后用去离子水清洗除去溶液中多余的pei,保存在去离子水中待用。所述离 心后清洗次数为1~2次。
[0022]
在一个实施方案中,所述步骤(3)中,胶体金为柠檬酸钠还原法制备 的aunp颗粒,表面带负电荷,粒径大小范围为3~50nm;所述超声反应 时间为20~50min,优选为30min。
[0023]
在一个实施方案中,在步骤(3)中,所述sio
2
@pei颗粒与胶体金颗 粒的体积比为1:50。
[0024]
在一个实施方案中,所述步骤(4)中,pei的分子量为5000~80000, pei溶液的浓度为0.2mg/ml~5mg/ml,优选为1mg/ml;所述超声时间 为30~70min,优选为60min。
[0025]
在一个实施方案中,在步骤(4)后,还包括将sio
2
@au@pei颗粒离 心后,用去离子水清洗除去溶液中多余的pei,保存在去离子水中待使用; 所述离心后清洗次数为2~3次。
[0026]
在一个实施方案中,所述步骤(5)中羧基化量子点颗粒为 cdse/zns-cooh颗粒,荧
光发射波长范围为400~800nm;所述量子点浓 度为0.1nmol~1nmol;所述的超声反应的时间为20~50min,优选为30 min。
[0027]
在一个实施方案中,在步骤(5)中,所述sio
2
@au@pei颗粒与羧基 化量子点颗粒的体积比为1:50。
[0028]
在一个实施方案中,在步骤(5)后,还包括将制备的sio
2
@au@qds 使用离心机离心后用去离子水清洗,重悬于10ml去离子水中;所述清洗次 数为1~2次,优选2次。
[0029]
本发明还提供了上述双功能量子点微球复合纳米材料作为量子点微球 标签在免疫层析检测中的应用。
[0030]
在一个具体的实施方案中,所述双功能量子点微球复合纳米材料的表 面修饰有重组抗原,所述重组抗原通过量子点外壳的羧基基团与重组抗原 的氨基端形成肽链偶联。
[0031]
在一个具体的实施方案中,所述应用的具体步骤如下:在所述双功能 量子点微球复合纳米材料表面修饰上新型冠状病毒重组抗原s1作为多功能 硅球量子点微球免疫标签(immuno-sio
2
@au@qds);将 immuno-sio
2
@au@qds涂在结合垫(玻璃纤维)上后制备免疫层析试纸条 待用;将1微升人类临床血清添加到99微升缓冲液里混匀后添加到试纸条 进样口(检测线处分别划有抗人igg和igm捕获抗体),15分钟后读取免 疫层析试纸条检测线处的比色或荧光信号,既可利用胶体金比色法实现定 性检测,又可以利用量子点荧光实现超敏检测。
[0032]
与现有技术相比,本发明的优势在于:
[0033]
(1)本发明提出的双功能量子点微球复合纳米材料在结构上既具有胶 体金和量子点双功能外壳;该材料既具有胶体金比色的定性功能,又具有 量子点优异的荧光性能;可提供肉眼可读的比色信号及紫外激发的荧光信 号。所述复合纳米材料尺寸大小可调控、稳定性强、易储存且可实现均一 粒径(分散性好);既可用于大规模的定性筛查,也可用于小规模的超敏 定量筛查。本发明方法制备出的双功能量子点微球复合纳米材料具有良好 的分散性及比色及荧光性能,且粒径可控,表面的羧基易于抗体修饰,在 生物样本检测具有广阔的应用前景。
[0034]
(2)本发明提出制备方法操作简便、成本低、效率高、质量稳定性好、 检测重复性好。本发明提出的方法利用pei层层自组装,可以通过对sio
2
颗粒粒径的选择而调控硅球量子点的不同粒径大小(150~400nm)。
[0035]
(3)本发明提出的双功能量子点微球复合纳米材料可应用与包括生物 传感、现场快速检测等多个领域。在双功能量子点微球复合纳米材料表面 修饰上检测抗体,结合荧光检测仪,可实现快速定量检测,具有良好的临 床应用前景和意义。
[0036]
(4)本发明提出的双功能量子点微球复合纳米材料作为硅球量子点标 签用于免疫层析检测,具有肉眼可读的比色信号及紫外激发的荧光信号。 它既可以作为基层单位大规模快速筛查工具,又可借助荧光读取仪进行荧 光信号检测,特别是低浓度样本的快速定量检测。该量子点标签分散性好、 粒径大小可调、比色及荧光性能强且易于批量制备,可用于复杂样本中目 标物质的定性及高灵敏检测。
附图说明
[0037]
图1为本发明的双功能量子点微球复合纳米材料的制备方法示意图;
[0038]
图2为双功能量子点微球复合纳米材料制备过程中各组分的透射电子 显微镜图(tem)及元素扫描图,其中a图为sio
2
颗粒tem图,b图为 sio
2
@au颗粒tem图,c图为sio
2
@au@qds颗粒tem图,d-f分别为 sio
2
、sio
2
@au、sio
2
@au@qds颗粒的高清透射电子显微图,g图为 sio
2
@au@qds的元素扫描图,从元素扫描图中可以看出胶体金颗粒和量 子点颗粒均匀的分布在sio
2
表面;
[0039]
图3为双功能量子点微球复合纳米材料制备过程中的表征图,其中a 图为sio
2
、sio
2
@au、sio
2
@au@qds颗粒的粒径分布图,由图可知合成 的双功能量子点微球粒径大小为240nm,b图为各组分的zeta电位图,c 图为sio
2
、sio
2
@au、sio
2
@au@qds颗粒在日光及紫外光激发下的图片 和荧光光谱图,由图可知,只有合成的双功能量子点微球具有比色信号和 荧光信号;
[0040]
图4为sio
2
@au@qds的稳定性照片,由图可知sio
2
@au@qds颗粒 的荧光性能稳定,能耐受住高浓度盐离子,且荧光强度不会随着时间的增 加而减弱;
[0041]
图5为本发明实施例2的双功能量子点微球复合纳米材料表面修饰重 组抗原的制备过程;
[0042]
图6为本发明实施例3的双功能量子点微球标签作为高性能荧光标签 与免疫层析系统联用检测血清中人igg和igm的实验流程图;
[0043]
图7为本发明实施例3的基于双功能量子点微球标签的免疫层析系统 检测血清中人igg和igm的荧光及比色结果照片及荧光强度柱形图;从图 中可知,荧光结果的检测限比胶体金比色检测限高100倍;
[0044]
图8为本发明实施例3基于双功能量子点微球标签的免疫层析系统检 测临床血清的重复性结果;由图可知,检测同一样本时,荧光强度基本不 变,证明双功能量子点微球标签性能稳定。
具体实施方式
[0045]
下面将结合实施例对本发明的技术方案进行清楚、完整地描述,显然, 所描述的实施例是本发明一部分实施例,而不是全部的实施例。基于本发 明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得 的所有其他实施例,都属于本发明保护的范围。
[0046]
实施例1
[0047]
本发明制备的双功能量子点微球复合纳米材料,包括sio
2
核心、两层 pei夹层及一层胶体金壳和一层羧基化量子点壳。其中sio
2
颗粒的粒径大小 为200nm,pei夹层的厚度为5nm,胶体金颗粒的粒径为4nm,羧基化量子 点的粒径为10nm,合成的硅球量子点的最终粒径约为240nm,同时具有比 色信号与荧光信号,且分散性良好。
[0048]
上述本实施例的双功能量子点微球复合纳米材料的制备方法,如图1所 示,包括以下步骤:
[0049]
(1)制备分散性良好的200nm sio
2
核心:
[0050]
依次将100ml无水乙醇、6ml去离子水、3.5ml28%氨水添加到200ml 广口瓶中,加入干净的搅拌子,磁力搅拌20min。一次性快速加入4ml正 硅酸乙酯溶液,室温条件下搅拌5h。反应结束后,6000rpm离心6min得到 sio
2
沉淀物,无水乙醇洗涤3次后,将产物置于真空
烘箱中60℃真空干燥6h, 得到200nm sio
2
颗粒干粉备用。
[0051]
(2)制备sio
2
@pei颗粒:
[0052]
称取约10mg的200nm sio
2
颗粒并溶解于50ml新鲜配置的pei溶液 中(1mg/ml),超声反应40分钟。6000rpm离心6min,并用去离子水洗2 遍后重悬于5ml去离子水中待用。
[0053]
(3)制备硅核金壳sio
2
@au颗粒:
[0054]
将制备的sio
2
@pei溶液(5ml)添加到100ml 4nm aunp溶液中, 剧烈超声30分钟,表面带强正电的sio
2
@pei大量吸附带负电荷的aunp, 形成sio
2
@au颗粒。5500rpm离心6min,用去离子水洗一遍后重悬于5ml 去离子水中待用。
[0055]
(4)制备sio
2
@au@pei颗粒:
[0056]
将制备的sio
2
@au溶液(5ml)添加到50ml新鲜配置的pei溶液中 (1mg/ml),超声反应60分钟。5500rpm离心6min,去离子水洗2遍后重 悬于5ml去离子水中待用。
[0057]
(5)制备双功能量子点微球sio
2
@au@qds颗粒:
[0058]
将制备的sio
2
@au@pei溶液(5ml)添加到100ml cdse/zns-cooh 溶液中,剧烈超声30分钟,表面带强正电的sio
2
@qds@pei大量吸附带 负电荷的cdse/zns-cooh,形成sio
2
@au@qds量子点颗粒。5000rpm 离心6min,用去离子水洗一遍后重悬于10ml去离子水中待用。
[0059]
图2中a图为本实施例步骤(1)制得的sio
2
内核颗粒,b图为步骤(3) 制得的sio
2
@au颗粒,c图为步骤(5)制得的sio
2
@au@qds颗粒的透 射电子显微镜图(tem)。由上述tem结果可见,双功能量子点微球复合 纳米材料粒径均一,胶体金壳和量子点壳依次包裹在sio
2
颗粒表面,使得 产物同时具有比色信号和荧光信号。
[0060]
本实施例所制得的双功能量子点微球复合纳米材料的表征结果如图3 所示。图3中a图为sio
2
@au@qds颗粒的粒径分布图;本发明提出的双 功能量子点微球复合纳米材料采用pei介导的层层自组装法制备,由图3 中b图各组分的zeta电位变化可知,利用pei的强正电吸附作用将负电性 的胶体金和量子点吸附在硅核表面;图3中c图为sio
2
、sio
2
@au、 sio
2
@au@qds在日光及紫外光激发下的照片及荧光光谱图,由图可知, 只有合成的双功能量子点微球具有比色信号和荧光信号。
[0061]
本实施例所制得的双功能量子点微球复合纳米材料的稳定性结果如图 4所示。由图可知,双功能量子点微球sio
2
@au@qds颗粒能耐受住高浓 度盐离子,且荧光强度不随着时间的改变而改变。说明该双功能量子点微 球荧光性能稳定。
[0062]
实施例2
[0063]
本发明提出的双功能量子点微球复合纳米材料的表面为羧基化量子点, 表面的羧基可以用于偶联抗体,可实现纳米材料的表面功能化。本发明提 出的双功能量子点微球复合纳米材料表面抗体修饰的步骤如图5所示,包 括以下步骤:
[0064]
将1mg sio
2
@au@qds粉末溶解在1ml 2-(n-吗啉)乙磺酸溶液(0.1 m,ph 5.5)中,然后加入100μl碳二亚胺溶液(0.01m)和20μl n-羟基 琥珀酰亚胺溶液(0.1m),超声反应15min活化sio
2
@au@qds表面的 羧基;然后通过离心回收sio
2
@au@qds,重悬于200μl pbst溶液中(0.01 m,ph 7.4);加入15μg新冠重组抗原s1,室温震荡反应2h后加入150μlbsa(10%),继续封闭反应1h后,离心回收产物并用pbst清洗1遍, 重悬于100μl pbst中,加入100μl金标稀释液,混匀后铺在硝酸纤维膜 上制作结合垫,组装成试纸条待用。
[0065]
实施例3
[0066]
本发明提出的双功能量子点微球复合纳米材料表面修饰重组抗原后可 作为高性能比色及荧光纳米标签用于免疫层析系统。本实施例采用新型冠 状病毒重组抗原s1修饰的双功能量子点微球标签与免疫层析系统相结合, 检测人血清中不同浓度的igg和igm。图6为本实施例所示的双功能量子点微 球标签作为硅球荧光标签与免疫层析系统联用快速检测人血清中igg和igm 的实验流程图。图7为基于双功能量子点微球免疫层析系统检测人新冠阳性 血清中igg和igm的测试分析结果。图7中,a图为检测人新冠阳性血清中不 同稀释倍数的igg和igm的试纸条荧光结果(365nm波长紫外激发)。从图 中可见,试纸条检测线(t线)上的比色及荧光强度随着新冠阳性血清稀释 倍数的增加而逐渐减弱,肉眼观察到的比色信号为稀释1万倍,荧光分析仪 读值的检测限为稀释100万倍。从图中可知,荧光结果的检测限比胶体金比 色检测限高100倍(a图中(i)为双功能量子点微球标签胶体金比色结果, (ii)为双功能量子点微球标签荧光结果)。图7中,b图根据人新冠阳性血 清不同稀释倍数和t线处荧光信号强度,建立了基于双功能量子点微球标签 的荧光信号的柱状图。误差线为测量五次所得。图8为本发明实施例3基于 双功能量子点微球标签的免疫层析系统检测临床血清的重复性结果。结果 显示基于该双功能量子点微球标签的免疫层析系统稳定性良好。
[0067]
最后应说明的是:以上各实施例仅用以说明本发明的技术方案,而非 对其限制;尽管参照前述各实施例对本发明进行了详细的说明,本领域的 普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进 行修改,或者对其中部分或者全部技术特征进行等同替换;而这些修改或 者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的范围。
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询

tips


 商标分类
商标分类  商标转让
商标转让 



