以赖氨酸、酪氨酸为锚点三组分协同反应合成环肽的方法与流程
 2021-02-02 14:02:33|
2021-02-02 14:02:33| 336|
336| 起点商标网
起点商标网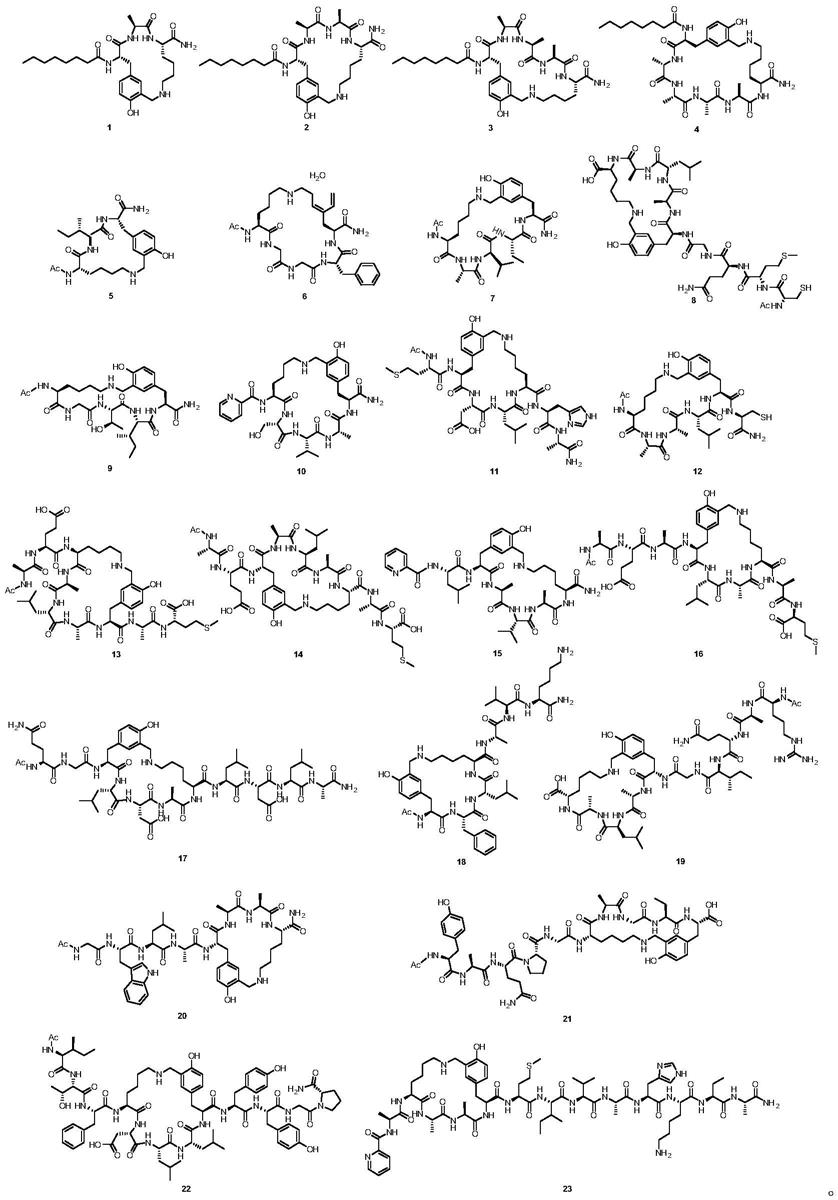
[0001]
本发明涉及多肽化学合成领域,尤其涉及一种以赖氨酸、酪氨酸为锚点三组分协同反应合成环肽的方法。
背景技术:
[0002]
在小分子药物与大分子的生物制品之间的“中分子”层面上,多肽分子占据了非常广阔的化学生物空间,进而扮演了一类具有非常独特生物学意义的角色。然而,天然多肽的成药性往往不够理想,需要经过进一步的修饰和改构才能成为更具疗效的药物候选物。在多肽修饰的策略中,通过连接两个“锚点”进行大环化反应构建订书肽(stapled peptides)的方法已被证明在改善和调节多肽的化学和生物学性质上能够取得显著效果,从而推动了多肽药物开发的进程,但是目前通过位点选择性控制订书肽合成的理念相对而言仍处于初级阶段。虽然以点击化学(如叠氮-炔烃环加成反应)为代表的正交反应已经为订书肽的合成提供了强有力的工具,但若能在天然形式存在多肽上以位点选择性的方式构建“订书环”则会更加受到研究者们的青睐,因为天然多肽更容易被获得而且还具有基因编码性。
[0003]
半胱氨酸由于其优越的亲核性和独特的自由基或金属介导的反应性而常常作为“锚定”的主导选择。在现有的大多数以半胱氨酸为基础的订书肽合成方法里,协调两个锚点处的反应顺序是非常困难的,因此就得依赖于锚点基团在反应上具有对称性。更重要的是,现有的订书肽合成方法通常缺乏对复杂多肽底物的位点选择性,使得多肽上处于不同位置的相同类型的残基无法得到区分。但是在生物学上,一些进化的酶通过分子识别便具有了区分在不同位点上的相同氨基酸残基,因此这种选择性将极大提高化学家精准设计具有复杂序列的天然多肽。
[0004]
那么通过两个锚点(氨基酸侧链)进行订书肽的合成,它们既可以相同也可以不同。虽然使用相同的锚点进行合成时具有简便的优势,但除了加速多肽选择两个距离相对较近的锚点进行化学连接以外,两个锚点之间反应的相互作用也会受到限制。相比之下,使用两个不同的锚点可以突出反应的选择性控制,并且可以嵌入一个序列调控的元素,使得底物的设计更加复杂多样化。当考虑可逆性因素,从动力学和热力学的角度合理地设计反应顺序时,克服位点选择性问题的想法就有可能实现。
技术实现要素:
[0005]
本发明为解决上述问题提供了一种以赖氨酸、酪氨酸为锚点三组分协同反应合成环肽的方法,利用赖氨酸与空间上邻近的酪氨酸在甲醛的参与下,以天然多肽为原料进行订书肽的合成。这种订书肽的合成方法可以在非常温和的条件下进行,且具有高效、原子经济性好以及良好的位点选择性的特点,所形成的环合楔点具有着独特的物理化学性质。
[0006]
反应原理:
[0007]
利用甲醛来固定蛋白从而用于测定蛋白质-蛋白质之间的相互作用或者蛋白质-dna之间的相互作用是非常经典、成熟且古老的分析技术。但是,由于蛋白上的众多活性基
团都会与甲醛进行反应,在化学层面上来看,这属于非常混乱并且缺乏化学选择性的反应,研究证明,使用大量的醛和芳胺的混合物可以与多肽的酪氨酸(tyr)侧链的邻位通过形成亚甲基的链接从而进行多肽的选择性修饰。普遍认为反应是通过分子间的曼尼希型机理进行的,即对芳胺产生的亚胺离子中间体进行亲核加成反应。然而在同样的反应条件下脂肪胺则是不能发生反应。受此鼓舞,我们提出设想,是否空间上的邻近效应能够促进赖氨酸侧链的脂肪胺基与酪氨酸侧链在甲醛的参与下进行分子内的反应。通过对反应条件的筛选,我们发现在合适的条件下,赖氨酸的侧链脂肪胺胺基是可以同酪氨酸的侧链进行反应,并且反应非常高效,甲醛的用量只需3个当量,远远低于固定蛋白和francis课题组之前报道所用的甲醛量(>100倍),并且反应的温度只需要在室温下即可。
[0008]
本发明所采取的技术方案:
[0009]
以赖氨酸、酪氨酸为锚点三组分协同反应合成环肽的方法,其制备步骤为:
[0010]
(1)关环前体线性直链肽即式i化合物的制备:采用c-端为酰胺的直链肽制备通法制备:
[0011][0012]
其中,i)fmoc保护基的脱除;ii)氨基酸缩合;iii)rink-amide am树脂的裂解;
[0013]
i)fmoc保护基的脱除:将溶剂加入到固相合成管中振摇反应10分钟,随后抽掉反应溶剂,以dmf,dcm分别洗两遍;再将上述操作重复一遍完成fmoc保护基的脱除。
[0014]
ii)氨基酸缩合:将fmoc-aa-oh(3.0equiv),2-肟氰乙酸乙酯(3.0equiv)溶解到nmp中并制成澄清溶液,随后向其中加入dic(3.3equiv)并于冰水浴下反应5min,随后再将反应溶液加入到固相合成管中,室温下反应1.5小时。再将反应溶剂抽干,分别以dmf,dcm洗两遍,进行下一步脱保护反应。
[0015]
iii)rink-amide-am树脂的裂解:将三氟乙酸和水按照95:5的体积比制得裂解液,随后将其加入到固相合成管中,室温下反应2小时,随后将裂解液收集,除去溶剂,向残留物中加入冷乙醚将多肽沉淀出来,随后通过离心得到c-端为酰胺键的多肽粗品。
[0016]
(2)环肽化合物即式ii化合物的制备:以式-化合物甲醛和碱在室温、搅拌作用下在溶剂中进行分子内三组
分反应构建环肽,生成式-化合物即
[0017]
其中aa为α-氨基酸,甘氨酸、丙氨酸、脯氨酸、2-氨基丁酸、缬氨酸、异亮氨酸、亮氨酸、叔亮氨酸、苯丙氨酸、苏氨酸、丝氨酸、赖氨酸、精氨酸、谷氨酸、谷氨酰胺、天冬氨酸、天冬酰胺、色氨酸、半胱氨酸、甲硫氨酸、酪氨酸、组氨酸;
[0018]
ak代表侧链具有胺基的氨基酸,赖氨酸,鸟氨酸,2,4-二氨基丁酸;
[0019]
ay代表侧链具有酚羟基的氨基酸,酪氨酸,对羟基苯甘氨酸;
[0020]
n代表侧链的长度,n的取值范围为0-2。
[0021]
所述的式-化合物在溶剂中的浓度为10-100mm,所述式-化合物:甲醛:碱的摩尔比为1:3.0-5.0:3.0-10.0。
[0022]
所述的式-化合物在溶剂中的浓度为10-20mm。
[0023]
所述的溶剂为六氟异丙醇、三氟乙醇和乙酸中的任意一种。
[0024]
所述的甲醛为37%甲醛水溶液、多聚甲醛和三聚甲醛中的任意一种。
[0025]
所述的碱为无机碱中碳酸氢钠,碳酸钠,碳酸钾和有机碱中三乙胺,n,n-二异丙基乙胺,n-甲基吗啉中的任意一种。
[0026]
所述的分子内三组分反应条件为室温反应,反应时间为2-24小时。
[0027]
本发明的有益效果:1)本发明只需要在天然的多肽上就可以进行订书肽的合成,无需在序列中引入任何非天然氨基酸作为合成砌块,原料的合成更为简单直接,而且更有利于与基因编码技术相结合。2)本发明利用甲醛的成环策略只需要在非常温和的条件下进行,并且甲醛的用量非常少,与传统的曼尼希反应相比操作性和实用性上大大增强。3)本发明中订书肽的合成策略具有非常高的化学选择性,因此对于无保护的干扰性基团,如羟基,吲哚,酰胺,羧酸,咪唑等都可以非常好的兼容并且几乎不受干扰。4)本发明中订书肽的合成策略具有非常高的位点选择性,对序列上不同位点上的相同氨基酸残基,可以通过空间邻近的调控方式对其进行分子内成环标记。5)本发明增添了一种可以在两种不同残基之间进行协同反应成环的订书肽合成方法,弥补了现有的半胱氨酸合成多数订书肽合成方法的不足。
附图说明
[0028]
图1为本发明第二步骤制备环肽化合物的示意图。
具体实施方式
[0029]
下面将结合具体实施例对本发明进行详细阐述。
[0030]
实施例1
[0031]
以赖氨酸、酪氨酸为锚点三组分协同反应合成环肽的方法,其制备步骤为:
[0032]
(1)关环前体线性直链肽即式i化合物的制备:采用c-端为酰胺的直链肽制备通法制备:
[0033][0034]
其中,i)fmoc保护基的脱除;ii)氨基酸缩合;iii)rink-amide am树脂的裂解;
[0035]
i)fmoc保护基的脱除:将20%哌啶/dmf加入到固相合成管中振摇反应10分钟,随后抽掉反应溶剂,以dmf,dcm分别洗两遍;再将上述操作重复一遍完成fmoc保护基的脱除。
[0036]
ii)氨基酸缩合:将fmoc-aa-oh(3.0equiv),2-肟氰乙酸乙酯(3.0equiv)溶解到nmp中并制成澄清溶液,随后向其中加入dic(3.3equiv)并于冰水浴下反应5min,随后再将反应溶液加入到固相合成管中,室温下反应1.5小时。再将反应溶剂抽干,分别以dmf,dcm洗两遍,进行下一步脱保护反应。
[0037]
iii)rink-amide-am树脂的裂解:将三氟乙酸和水按照95:5的体积比制得裂解液,随后将其加入到固相合成管中,室温下反应2小时,随后将裂解液收集,除去溶剂,向残留物中加入冷乙醚将多肽沉淀出来,随后通过离心得到c-端为酰胺键的多肽粗品。
[0038]
(2)环肽化合物即式ii化合物的制备:以式-化合物、甲醛和碱在室温、搅拌作用下在溶剂中进行分子内三组分反应构建环肽,生成式-化合物;
[0039][0040]
反应溶剂的筛选:将式-化合物、甲醛和dipea在30℃、搅拌作用下在以下各溶剂中进行分子内三组分反应构建环肽,生成式-化合物;试验结果如表1所示:
[0041]
表1反应溶剂的筛选
[0042]
组别溶剂液相产率(%)1meohn.r.2etohn.r.3t-buohn.r.4tfe~3%/22%
a
5hfip97%6acoh~10%/67%
a
7ch
3
cnn.r.8h
2
on.r.9dcen.r.10thfn.r.11acetonen.r.
[0043]
从表1可以看出,能够发生反应的溶剂为六氟异丙醇(hfip)、三氟乙醇和乙酸,其中,溶剂为hfip,产率较高。
[0044]
实施例2
[0045]
反应所用碱的筛选:将式-化合物、甲醛和各种碱在30℃、搅拌作用下在10mm的hfip溶剂中进行分子内三组分反应构建环肽,反应2h,生成式-化合物;试验结果如表2所示:
[0046]
表2反应碱的筛选
[0047]
组别碱产率1nonen.r.2nahco
3
22%3na
2
co
3
91%4k
2
co
3
94%5naoac90%6nmm92%7dipea97%
[0048]
从表2可以看出,能够反应的无机碱nahco
3
、na
2
co
3
、k
2
co
3
和有机碱三乙胺,n,n-二异丙基乙胺,n-甲基吗啉,其中无机碱k
2
co
3
产率较高,然仍不如dipea的产率。
[0049]
实施例3
[0050]
溶剂中不同水量添加量的筛选:
[0051][0052]
表3不同水的含量筛选
[0053]
组别含水率(%)产率15%90%210%77%320%64%430%41%
[0054]
从表3可以看出,在溶剂中加水,在5%含量的水对反应影响最小,产率较高,说明含水率越高反应干扰越多,产率越低。
[0055]
实施例4
[0056]
式-化合物在溶剂中的浓度筛选:
[0057][0058]
表4反应浓度的筛选
[0059]
组别加入量.产率110mm97%220mm93%350mm40%4100mm16%
[0060]
从表4可以看出,浓度为10mm时反应效果最好,浓度越高反应干扰越多,产率越低,式-化合物在溶剂中的最优浓度为10-20mm。
[0061]
实施例5
[0062]
将式-化合物(44.1mg,0.05mmol,1.0equiv)称重于8ml反应瓶中(以ptfe盖子密封),加入溶剂hfip 4ml,再陆续加入碱dipea(26.0ul,0.15mmol,3.0equiv),37%甲醛水溶液(10ul,0.15mmol,3.0equiv)于室温下搅拌2h,通过lcms监测反应完全后,通过高效液相制备分离得到最终的关环产物,式-化合物的具体选择以及具体的反应条件如表5所示。
[0063]
表5式-化合物具体结构反应
[0064]
[0065][0066]
分离出的式-化合物的结构式为:
[0067]
对式-化合物进行质谱和核磁鉴定:
[0068]
1
[0069]
hrms:calcd for c
27
h
43
n
5
o
5
[m+h
+
]:518.3337;found:518.3355.
1
h nmr(400mhz,methanol-d
4
)δ7.15(s,1h),7.03(d,j=8.4hz,1h),6.89(d,j=8.0hz,1h),4.69-4.62(m,2h),4.35-4.28(m,2h),4.01(d,j=13.6hz,1h),3.14-3.07(m,2h),3.01-2.93(m,1h),
2.82-2.74(m,1h),2.23(t,j=7.6hz,2h),2.06-1.96(m,1h),1.90-1.77(m,2h),1.64-1.56(m,3h),1.53-1.49(m,1h),1.45(d,j=7.2hz,3h),1.37-1.26(m,9h),0.90(t,j=6.4hz,3h).
[0070]
2
[0071]
hrms:calcd for c
30
h
48
n
6
o
6
[m+h
+
]:589.3708;found:589.3734.
[0072]
1
h nmr(400mhz,methanol-d
4
)δ7.19(s,1h),7.12(d,j=7.6hz,1h),6.84(d,j=8.4hz,1h),4.36-4.33(m,1h),4.30-4.25(m,2h),4.24-4.16(m,2h),4.09(d,j=7.2hz,1h),3.18-3.11(m,1h),3.07-3.01(m,1h),2.93(d,j=8.0hz,2h),2.28(t,j=7.6hz,2h),1.93-1.87(m,1h),1.80-1.71(m,3h),1.66-1.59(m,4h),1.44(d,j=7.2hz,3h),1.37-1.32(m,8h),1.29(d,j=7.2hz,3h),0.92(t,j=7.2hz,3h).
[0073]
3
[0074]
hrms:calcd for c
33
h
53
n
7
o
7
[m+h
+
]:660.4079;found:660.4102.
[0075]
1
h nmr(400mhz,acetic acid-d
4
)δ7.14(s,1h),7.08(d,j=8.8hz,1h),6.87(d,j=8.4hz,1h),4.67-4.62(m,2h),4.55(dd,j=10.8,4.0hz,1h),4.34-4.27(m,3h),4.26-4.22(m,1h),3.24(t,j=7.6hz,2h),3.04(dd,j=13.6,4.8hz,1h),2.86(dd,j=13.6,11.2hz,1h),2.35(t,j=7.6hz,2h),1.99-1.93(m,1h),1.86-1.80(m,1h),1.72-1.63(m,4h),1.50-1.44(m,5h),1.37-1.31(m,11h),1.29(d,j=7.2hz,3h),0.94-0.90(m,3h).
[0076]
4
[0077]
hrms:calcd for c
36
h
58
n
8
o
8
[m+h
+
]:731.4450;found:731.4418.
[0078]
1
h nmr(400mhz,acetic acid-d
4
)δ7.23(s,1h),7.07(d,j=8.4hz,1h),6.89(d,j=8.4hz,1h),4.76(dd,j=10.8,5.2hz,1h),4.58-4.53(m,1h),4.51-4.47(m,1h),4.46-4.42(m,1h),4.42-4.34(m,2h),4.22(d,j=13.2hz,1h),4.17-4.09(m,1h),3.10-2.98(m,3h),2.96-2.90(m,1h),2.32(t,j=7.6hz,2h),1.85-1.75(m,3h),1.66-1.60(m,2h),1.53-1.50(m,1h),1.46-1.38(m,10h),1.34-1.28(m,12h),0.91(t,j=6.4hz,3h).
[0079]
5
[0080]
hrms:calcd for c
24
h
38
n
5
o
5
[m+h
+
]:467.2867;found:467.2863
[0081]
1
h nmr(400mhz,methanol-d
4
)δ7.23(s,1h),7.18(d,j=8.4,1h),6.84(d,j=8.4hz,1h),4.80(dd,j=11.2,3.2hz,1h),4.35-4.26(m,2h),4.21(d,j=7.6hz,1h),4.07(d,j=13.2hz,1h),3.11(dd,j=14.8,3.2hz,1h),3.03-2.96(m,1h),2.95-2.81(m,2h),1.96(s,3h),1.88-1.71(m,2h),1.70-1.48(m,4h),1.40-1.37(m,1h),1.31-1.11(m,3h),0.95(d,j=6.8hz,3h),0.89(t,j=7.6hz,3h).
[0082]
13
c nmr(100mhz,methanol-d
4
)δ174.66,172.37,172.28,171.63,154.78,132.55,130.81,128.72,116.85,114.82,57.47,53.30,52.43,46.19,44.83,37.41,36.52,29.63,24.33,23.81,21.23,20.90,14.58,10.02.
[0083]
6
[0084]
hrms:calcd for c
31
h
41
n
7
o
7
[m+h
+
]:624.3140;found:624.3143.
[0085]
1
h nmr(400mhz,methanol-d
4
)δ7.30-7.27(m,4h),7.24(d,j=2.4hz,1h),7.23-7.19(m,1h),7.17(dd,j=8.4,2.4hz,1h),6.84(d,j=8.4hz,1h),4.56-4.50(m,2h),4.32(dd,j=8.8,6.0hz,1h),4.28-4.16(m,2h),4.07(d,j=16.8hz,1h),3.83-3.76(m,3h),
3.20(dd,j=14.0,3.6hz,1h),3.13-3.02(m,3h),2.90-2.81(m,2h),2.04(s,3h),1.96-1.84(m,3h),1.77-1.69(m,1h),1.61-1.51(m,2h).
[0086]
13
c nmr(100mhz,acetic acid-d
4
)δ175.48,173.86,173.12,172.16,171.28,170.20,154.50,136.16,132.39,132.08,129.09,128.43,128.19,126.88,117.08,115.61,54.52,53.98,53.11,48.69,46.99,46.62,42.50,42.33,37.50,36.40,30.68,24.52,21.35.
[0087]
7
[0088]
hrms:calcd for c
30
h
47
n
7
o
7
[m+h
+
]:618.3610;found:618.3581.
[0089]
1
h nmr(400mhz,acetic acid-d
4
)δ7.15(d,j=8.4hz,1h),7.08(s,1h),6.90(d,j=7.2hz,1h),4.93(t,j=5.2hz,1h),4.57(d,j=6.4hz,1h),4.51-4.43(m,2h),4.38(d,j=13.2hz,1h),4.31(d,j=4.8hz,1h),4.22(d,j=8.4hz,1h),3.28(t,j=6.8hz,2h),3.13(d,j=12.8hz,1h),3.01(dd,j=14.0,6.8hz,1h),2.15-2.08(m,1h),2.04(s,3h),1.93-1.82(m,2h),1.79-1.65(m,4h),1.60-1.51(m,1h),1.48(d,j=7.2hz,3h),1.46-1.39(m,1h),0.99(d,j=6.4hz,3h),0.95-0.88(m,6h).
[0090]
13
c nmr(100 mhz,acetic acid-d
4
)δ175.24,174.56,173.41,172.91,172.84,172.47,154.69,132.85,131.64,127.51,117.12,115.94,59.76,54.42,53.41,52.75,50.83,46.79,46.50,36.49,31.33,30.57,25.12,25.02,21.68,21.31,18.44,18.12,16.38.
[0091]
8
[0092]
hrms:calcd for c
45
h
73
n
11
o
13
s
2
[m+2h
+
]:519.7410;found:519.7406.
[0093]
1
h nmr(600mhz,acetic acid-d
4
)δ7.14(d,j=6.7hz,1h),7.03(s,1h),6.90(d,j=8.3hz,1h),4.70-4.65(m,2h),4.64-4.53(m,4h),4.39(ddd,j=23.6,11.3,3.5hz,2h),4.32-4.26(m,1h),4.15-4.04(m,3h),3.24-3.17(m,2h),3.10-2.90(m,4h),2.61(dq,j=9.4,5.4,4.7hz,1h),2.54(dt,j=13.6,7.8hz,1h),2.48(t,j=7.8hz,2h),2.24(dq,j=11.3,6.6,5.9hz,1h),2.18-2.09(m,5h),2.05-1.99(m,2h),1.88-1.80(m,2h),1.78-1.59(m,5h),1.49-1.41(m,3h),1.36(d,j=6.9hz,3h),1.35-1.30(m,4h),1.01(d,j=6.6hz,3h),0.97(d,j=6.4hz,3h).
[0094]
9
[0095]
hrms:calcd for c
30
h
47
n
7
o
8
[m+h
+
]:634.3559;found:634.3589.
[0096]
1
h nmr(400mhz,acetic acid-d
4
)δ7.16(d,j=7.2hz,2h),6.90(d,j=8.4hz,1h),4.90(dd,j=9.2,4.4hz,1h),4.64(dd,j=8.8,5.2hz,1h),4.45(d,j=4.0hz,1h),4.37(d,j=9.2hz,1h),4.30(d,j=6.8hz,3h),4.27(s,1h),3.93(d,j=16.8hz,1h),3.27(t,j=6.4hz,2h),3.19(dd,j=14.4,4.4hz,1h),2.94(dd,j=14.0,9.2hz,1h),2.07(s,3h),1.95-1.88(m,2h),1.87-1.75(m,4h),1.65-1.55(m,2h),1.50-1.45(m,1h),1.21(d,j=6.4hz,3h),0.89-0.82(m,6h).
[0097]
13
c nmr(100 mhz,acetic acid-d
4
)δ175.63,173.98,173.05,172.43,171.40,171.13,154.61,132.48,131.94,127.97,117.17,115.72,67.37,58.90,57.54,53.84,53.16,48.70,47.31,42.96,36.58,35.97,31.09,30.33,29.19,25.01,24.36,21.72,21.40,17.15.
4.19(m,2h),3.27-3.10(m,3h),2.99-2.91(m,1h),2.72-2.65(m,1h),2.61-2.55(m,3h),2.34-2.17(m,4h),2.12(s,3h),2.09(s,3h),1.98-1.91(m,1h),1.88-1.77(m,3h),1.77-1.67(m,2h),1.64-1.50(m,12h),1.47(d,j=7.2hz,3h),0.99(d,j=5.2hz,3h),0.96(d,j=5.6hz,3h).
[0112]
14
[0113]
hrms:calcd for c
46
h
72
n
10
o
14
s[m+h
+
]:1021.5023;found:1021.5031.
[0114]
1
h nmr(400mhz,acetic acid-d
4
)δ7.19(d,j=8.4hz,1h),7.03(s,1h),6.92(d,j=8.4hz,1h),4.72(dd,j=9.2,4.4hz,1h),4.57-4.51(m,2h),4.50-4.41(m,5h),4.30-4.24(m,2h),4.09(d,j=13.2hz,1h),3.12-3.01(m,4h),2.65-2.54(m,4h),2.35-2.16(m,4h),2.12(s,3h),2.09(s,3h),1.95-1.89(m,1h),1.86-1.78(m,3h),1.72-1.62(m,4h),1.49-1.45(m,10h),1.39(d,j=7.2hz,3h),0.98(d,j=6.4hz,3h),0.95(d,j=6.4hz,3h).
[0115]
15
[0116]
hrms:calcd for c
39
h
57
n
9
o
8
[m+h
+
]:780.4403;found:780.4372.
[0117]
1
h nmr(400mhz,methanol-d
4
)δ8.71(d,j=4.8hz,1h),8.14(d,j=8.0hz,1h),8.02(td,j=7.6,1.6hz,1h),7.62(dd,j=7.6,4.8hz,1h),7.12(d,j=8.4hz,1h),6.97(s,1h),6.78(d,j=8.4hz,1h),4.47(dd,j=8.8,5.6hz,1h),4.28(d,j=13.2hz,1h),4.24-4.14(m,3h),4.11-4.06(m,1h),4.03(d,j=12.8hz,1h),3.78(d,j=8.4hz,1h),3.00(dd,j=13.6,4.8hz,1h),2.94-2.80(m,3h),2.21-2.13(m,1h),1.95-1.83(m,2h),1.83-1.75(m,3h),1.60-1.52(m,2h),1.46(d,j=7.2hz,3h),1.44-1.39(m,2h),1.36(d,j=7.2hz,3h),1.10(d,j=6.8hz,3h),1.05-0.98(m,9h).
[0118]
13
c nmr(100mhz,methanol-d
4
)δ175.76,175.66,174.04,173.91,173.71,172.49,155.11,148.98,148.63,137.64,132.45,131.83,127.50,126.89,121.99,116.65,115.09,62.09,57.60,53.78,52.77,50.98,50.06,45.86,45.75,40.27,36.32,30.49,29.48,24.78,24.74,22.84,21.72,20.88,18.97,18.28,15.89,15.48.
[0119]
16
[0120]
hrms:calcd for c
46
h
72
n
10
o
14
s[m+h
+
]:1021.5023;found:1021.5028.
[0121]
1
h nmr(400mhz,acetic acid-d
4
)δ7.31(s,1h),7.07(d,j=8.4hz,1h),6.87(d,j=8.4hz,1h),4.73(dd,j=8.8,4.4hz,1h),4.62-4.56(m,5h),4.55-4.51(m,1h),4.40(d,j=12.8hz,1h),4.31-4.24(m,3h),3.28-3.20(m,2h),3.16-3.08(m,1h),2.98-2.90(m,1h),2.62-2.58(m,1h),2.57-2.50(m,3h),2.27-2.17(m,2h),2.11(s,3h),2.09(s,3h),1.96-1.91(m,1h),1.86-1.69(m,5h),1.65-1.53(m,3h),1.45-1.40(m,12h),0.92(d,j=6.4hz,3h),0.86(d,j=6.4hz,3h).
[0122]
17
[0123]
hrms:calcd for c
57
h
91
n
14
o
18
[m+h
+
]:1259.6630;found:1259.6631.
[0124]
1
h nmr(400mhz,acetic-d
4
)δ7.21(d,j=8.0hz,1h),6.98(s,1h),6.94(d,j=8.0hz,1h),4.61-4.53(m,1h),4.53-4.37(m,4h),4.35-4.12(m,6h),4.08-3.94(m,3h),3.20-2.97(m,6h),2.95-2.82(m,2h),2.52-2.44(m,2h),2.12(s,3h),1.92-1.74(m,8h),1.72-1.60(m,5h),1.49(d,j=7.2hz,3h),1.41(d,j=7.2hz,4h),1.35-1.28(m,2h),1.00(s,6h),0.96-0.84(m,14h).
[0125]
18
[0126]
hrms:calcd for c
68
h
109
n
19
o
15
s[m+2h
+
]:461.2815;found:461.2813
[0127]
1
h nmr(400mhz,acetic-d
4
)δ7.27-7.18(m,4h),7.14(d,j=8.0hz,2h),6.98(d,j=8.0hz,1h),6.83(d,j=8.0hz,1h),4.61-4.52(m,5h),4.37(d,j=8.0hz,1h),4.31(s,2h),4.23(dd,j=10.0,4.8hz,1h),3.32-3.19(m,2h),3.08-2.97(m,4h),2.86-2.73(m,2h),2.02(s,3h),1.92-1.85(m,2h),1.82-1.64(m,9h),1.54-1.45(m,4h),1.38(d,j=8.0hz,4h),0.96-0.93(m,12h).
[0128]
19
[0129]
hrms:calcd for c
57
h
91
n
14
o
18
[m+2h
+
]:572.8273;found:572.8267.
[0130]
1
h nmr(400mhz,acetic acid-d
4
)δ7.17(d,j=8.4hz,1h),7.04(s,1h),6.92(d,j=8.0hz,1h),4.62-4.55(m,2h),4.52-4.43(m,4h),4.42-4.36(m,2h),4.35-4.31(m,1h),4.27(d,j=7.2hz,1h),4.22-4.16(m,1h),4.09-4.01(m,2h),3.97(d,j=17.2hz,1h),3.32-3.25(m,2h),3.15-3.04(m,4h),2.49(t,j=7.2hz,2h),2.27-2.19(m,2h),2.13(s,3h),2.01-1.83(m,9h),1.76-1.61(m,7h),1.52-1.48(m,3h),1.46(d,j=7.2hz,3h),1.38(d,j=7.2hz,3h),1.01-0.96(m,5h),0.96-0.91(m,7h).
[0131]
20
[0132]
hrms:calcd for c
46
h
66
n
11
o
10
[m+h
+
]:932.4989;found:932.4982
[0133]
1
h nmr(600mhz,methanol-d
4
)δ7.55(d,j=7.8hz,1h),7.36(d,j=8.4hz,1h),7.25(d,j=1.8hz,1h),7.21(s,1h),7.12-7.07(m,1h),7.00(dd,j=8.4,2.4hz,1h),6.97-6.94(m,1h),6.79(d,j=8.2hz,1h),4.53(t,j=6.0hz,1h),4.32(d,j=12.6hz,1h),4.24(dd,j=10.8,5.4hz,1h),4.17(q,j=7.2hz,1h),4.12-4.08(m,2h),4.08-4.07(m,1h),4.03(dd,j=9.6,5.4hz,1h),3.93(d,j=16.2hz,1h),3.86(q,j=7.2hz,1h),3.74(d,j=16.2hz,1h),3.34-3.32(m,2h),3.07-2.98(m,2h),2.82-2.76(m,2h),1.92(s,3h),1.84-1.75(m,2h),1.73-1.67(m,1h),1.61-1.55(m,2h),1.52-1.47(m,2h),1.43(d,j=7.2hz,4h),1.39(d,j=7.2hz,4h),1.34(d,j=7.2hz,3h),0.90(d,j=6.6hz,3h),0.82(d,j=6.6hz,3h).
[0134]
21
[0135]
hrms:calcd for c
51
h
72
n
12
o
15
[m+h
+
]:1093.5313;found:1093.5313.
[0136]
1
h nmr(400mhz,methanol-d4)δ7.14-7.08(m,2h),7.05(d,j=8.5hz,2h),6.78(d,j=8.1hz,1h),6.70(d,j=8.5hz,2h),4.63(dd,j=8.5,5.4hz,1h),4.54-4.49(m,2h),4.39-4.27(m,5h),4.20(s,2h),3.96(d,j=5.2hz,1h),3.92(d,j=5.2hz,1h),3.86-3.67(m,4h),3.20-3.12(m,1h),3.05-2.92(m,4h),2.80-2.72(m,1h),2.38-1.93(m,8h),1.90(s,3h),1.87-1.45(m,8h),1.41(d,j=7.2hz,3h),1.32(d,j=7.2hz,3h),0.93(t,j=7.4hz,3h).
[0137]
22
[0138]
hrms:calcd for c
78
h
109
n
14
o
19
[m+h
+
]:1545.7988;found:1545.7992
[0139]
1
h nmr(400mhz,acetic acid-d
4
)δ7.28-7.26(m,2h),7.23-7.18(m,3h),7.11-7.00(m,4h),6.95(d,j=12.0hz,2h),6.83(d,j=12.0hz,1h),6.73(d,j=11.4hz,2h),6.67(d,j=12.0hz,2h),4.86(t,j=9.6hz,1h),4.80-4.72(m,4h),4.61-4.56(m,3h),
4.52-4.45(m,3h),4.36-4.25(m,3h),4.20(d,j=13.2hz,1h),4.00(d,j=25.2hz,1h),3.76-3.68(m,1h),3.58-3.54(m,1h),3.29-3.18(m,2h),3.14-3.09(m,1h),3.07-2.96(m,5h),2.94-2.82(m,4h),1.80-1.59(m,9h),1.52-1.44(m,4h),1.34-1.30(m,2h),1.16(d,j=6.0hz,4h),0.97-0.83(m,21h).
[0140]
23
[0141]
hrms:calcd for c
68
h
109
n
19
o
15
s[m+2h
+
]:737.9030;found:737.9033;[m+3h
+
]:492.2711;found:492.2713
[0142]
1
h nmr(400mhz,acetic acid-d
4
)δ8.79(s,1h),8.63(d,j=4.8hz,1h),8.18(d,j=7.6hz,1h),7.99-7.95(m,1h),7.57(dd,j=7.6,4.8hz,1h),7.37(s,1h),7.14-7.06(m,2h),6.87(d,j=8.2hz,1h),4.94-4.89(m,2h),4.74-4.65(m,2h),4.62-4.49(m,4h),4.48-4.35(m,5h),4.28(q,j=7.2hz,1h),4.10(d,j=13.0hz,1h),3.52-3.41(m,1h),3.40-3.31(m,1h),3.30-3.21(m,1h),3.19-3.08(m,2h),3.05(t,j=7.6hz,2h),2.87-2.72(m,1h),2.56-2.44(m,2h),1.94-1.67(m,11h),1.61-1.27(m,19h),1.20(d,j=7.2hz,3h),1.17(overlap,1h),0.98-0.86(m,15h).
[0143]
综上,本发明中订书肽的合成策略具有非常高的化学选择性,如含有丝氨酸的化合物10,含有谷氨酸的化合物13,含有精氨酸的化合物19,含有色氨酸的化合物20,含有谷氨酰胺的化合物21以及含有组氨酸的化合物23,这些无保护的干扰性基团在我们的反应体系中可以非常好地被兼容,反应几乎不受干扰。
[0144]
本发明中订书肽的合成策略具有非常高的位点选择性,如化合物18和化合物23中含有两个赖氨酸,化合物22中含有三个酪氨酸,对于这种序列上不同位点处含有相同的氨基酸残基,可以通过空间邻近的调控方式对其进行分子内的成环标记。
[0145]
以上对本发明的实施例进行了详细说明,但所述内容仅为本发明的较佳实施例,不能被认为用于限定本发明的实施范围。凡依本发明申请范围所作的均等变化与改进等,均应仍归属于本发明的专利涵盖范围之内。
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询

tips


 商标分类
商标分类  商标转让
商标转让 



