基于CRISPR-Cas自催化放大网络的核酸检测方法及其应用与流程
 2021-02-02 14:02:18|
2021-02-02 14:02:18| 403|
403| 起点商标网
起点商标网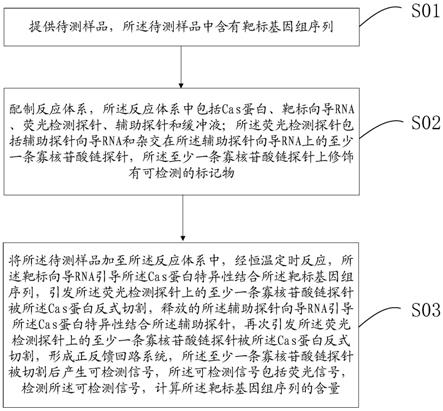
基于crispr-cas自催化放大网络的核酸检测方法及其应用
技术领域
[0001]
本申请涉及核酸检测领域,特别涉及一种基于crispr-cas自催化放大网络的核酸检测方法及其应用。
背景技术:
[0002]
核酸检测是应用分子生物学的手段检测受检样品的遗传物质或携带的病毒、病原体的基因;其在食品安全、环境微生物污染检测和人体病原菌感染等领域具有重要意义。近年来,基于crispr/cas系统(clustered regularly interspaced short palindromic repeats/crispr-associated protein)基因编辑技术的核酸检测工具,引起了研究者们的广泛关注。其中,crispr/cas系统是细菌在抵御外来病毒和噬菌体入侵的过程中不断进化而来的一种获得性免疫防御机制。利用crispr系统中的2类效应蛋白—cas蛋白(例如cas9、cas12a、cas12b和cas13a)的,并结合核酸扩增技术,研究者们已经建立了包括sherlock、detectr、cdetection、nasbacc和holmes等在内的核酸检测技术。有望使核酸检测领域发生一定程度的革命性突破。
[0003]
根据cas蛋白在检测中的作用,目前crispr-dx(crispr诊断技术)方法主要分为两类。在第一类中,由于2类ii型cas蛋白(cas9)的特异性序列识别和切割功能,被用作初始靶标识别模块。另一类依赖于具有反式切割(trans-cleavage)活性的v型或vi型cas蛋白(例如cas12a、cas12b或cas13a),作为先前核酸扩增后的终点信号报告模块。一般来说,在crispr-dx的两个类别中,额外的核酸扩增步骤,如nasba、rpa、pcr、lamp、rca或sda都是必不可少的。这使得以显著增加crispr-dx系统复杂性为代价,换来阿摩尔的高灵敏度。因此,这些核酸检测方法也存在需要多种酶/蛋白质、复杂的引物设计、非连续多步反应及高成本等缺点。
技术实现要素:
[0004]
有鉴于此,本申请提供了一种基于crispr-cas自催化放大网络的核酸检测方法及其应用。所述核酸检测方法操作简便,成本低,使用一种cas蛋白,能高灵敏度、高特异性的一步检测核酸分子。本申请所述核酸检测方法可称为“conan”(crispr-cas-only amplification network)。所述核酸检测方法的应用包括荧光检测探针、试剂盒和检测装置。
[0005]
第一方面,本申请提供了一种名为“conan”的基于crispr-cas自催化放大网络的核酸检测方法,包括:
[0006]
提供待测样品,所述待测样品中含有靶标基因组序列;
[0007]
配制反应体系,所述反应体系中包括cas蛋白、靶标向导rna、荧光检测探针、辅助探针和缓冲液;所述荧光检测探针包括辅助探针向导rna和杂交在所述辅助探针向导rna上的至少一条寡核苷酸链探针,所述至少一条寡核苷酸链探针上修饰有可检测的标记物;
[0008]
将所述待测样品加至所述反应体系中,经恒温定时反应,所述靶标向导rna引导所
述cas蛋白特异性结合所述靶标基因组序列,引发所述荧光检测探针上的至少一条寡核苷酸链探针被所述cas蛋白反式切割,释放的所述辅助探针向导rna引导所述cas蛋白特异性结合所述辅助探针,再次引发所述荧光检测探针上的至少一条寡核苷酸链探针被所述cas蛋白反式切割,形成正反馈回路系统,所述至少一条寡核苷酸链探针被切割后产生可检测信号,所述可检测信号包括荧光信号,检测所述可检测信号,计算所述靶标基因组序列的含量。
[0009]
本申请实施方式中,所述靶标向导rna包括锚定序列和靶标向导序列,所述辅助探针向导rna包括所述锚定序列和与所述辅助探针匹配的辅助探针向导序列,所述锚定序列能与所述cas蛋白特异性识别;所述荧光检测探针上的所述至少一条寡核苷酸链探针包括第一寡核苷酸链探针和第二寡核苷酸链探针,所述第一寡核苷酸链探针杂交在所述锚定序列上,且在所述锚定序列上形成第一凸起;所述第二寡核苷酸链探针杂交在所述辅助探针向导序列上,且在所述辅助探针向导序列上形成第二凸起,所述第一凸起和所述第二凸起分别至少包括两个以上的核苷酸。本申请中,所述荧光检测探针,可缩写为scgrna。
[0010]
本申请所述核酸检测方法的原理包括:所述靶标向导rna的锚定序列能自主形成发卡结构,可以与cas蛋白结合,所述靶标向导rna的靶标向导序列也能特异性识别所述靶标基因组序列,并与之结合形成复合物,继而激发cas蛋白的反式切割活性,引起其自催化将荧光检测探针作为底物进行切割,所述scgrna(荧光检测探针)中的寡核苷酸链探针(dna链)(尤其是寡核苷酸链探针的凸起结构)会被切割,以释放可检测的标记物和辅助探针向导rna;反应体系中的辅助探针向导rna、cas蛋白、辅助探针和体系中剩余的scgrna之间又可以进一步形成一个正反馈回路系统,最大化放大cas蛋白的反式切割活性,实现反应体系中可检测的标记物呈指数级释放,其对应的可检测信号(如荧光信号)呈指数级扩增,在额定的时间内大大提升所述核酸检测方法的灵敏度和特异性。
[0011]
本申请实施方式中,所述靶标核酸序列包括基因组dna、质粒和/或双链dna片段。可选地,所述基因组dna为血液、组织、细胞生物样本和/或微生物的基因组。可选地,所述待测样品可以但不限于为细胞、细菌、组织和血液。所述待测样品可经过核酸提取处理,例如,使用核酸提取试剂盒,根据核酸提取试剂盒说明书提供的核酸提取技术提取获得的总核酸样品。其中,所述待测样品可以但不限于来源于包括人类在内的哺乳动物或植物。
[0012]
本申请中,所述辅助探针可以但不限于为双链dna(dsdna)。所述辅助探针序列与所述待测基因序列不同。可选地,所述辅助探针可以但不限于包括25-45个碱基互补配对的核苷酸序列,所述核苷酸独立选自a、c、t或g。一实施方式中,所述辅助探针可以但不限于包括30-40个碱基互补配对的核苷酸序列。另一实施方式中,所述辅助探针可以但不限于包括35-40个碱基互补配对的核苷酸序列。
[0013]
可选地,所述靶标基因组序列中还包括pam(protospacer adjacent motif)序列。所述辅助探针中也包括所述pam序列。本申请中,所述pam序列能用于提升crispr系统的靶向特异性,有利于cas蛋白识别靶标基因组序列或辅助探针序列。可选地,所述pam序列为aaan,碱基n独立选自a、c、t或g。本申请中,术语“匹配”是指碱基互补配对。术语“切割”是指核苷酸分子的共价主链的断裂;其中,所述核苷酸分子可以但不限于为脱氧核糖核苷酸分子。
[0014]
本申请中,所述靶标向导rna和所述荧光检测探针中的辅助探针向导rna均为rna
链;所述靶标向导rna的锚定序列与所述辅助探针向导rna的锚定序列相同。
[0015]
本申请实施方式中中,所述可检测的标记物可以为荧光基团、生物素或其他可产生可检测信号的物质。
[0016]
本申请实施方式中,所述第一凸起和所述第二凸起上均分别修饰有荧光基团和淬灭基团。可选地,所述第一凸起上的两个核苷酸分别修饰有荧光基团和淬灭基团,和所述第二凸起上的两个核苷酸分别修饰有荧光基团和淬灭基团。可选地,修饰有所述荧光基团的核苷酸与修饰有所述淬灭基团的核苷酸之间间隔有1-9个未与所述辅助探针向导rna杂交的核苷酸。一实施方式中,所述修饰有所述荧光基团的核苷酸与修饰有所述淬灭基团的核苷酸之间间隔有3-9个未与所述辅助探针向导rna杂交的核苷酸。例如,修饰有所述荧光基团的核苷酸与修饰有所述淬灭基团的核苷酸之间间隔有5个未与所述辅助探针向导rna杂交的核苷酸。所述荧光基团和所述淬灭基团分别修饰在第一凸起的两个不同的碱基上,以及修饰在第二凸起的两个不同的碱基上。
[0017]
本申请实施方式中,所述第一寡核苷酸链探针和第二寡核苷酸链探针的末端分别修饰有荧光基团和/或淬灭基团。例如,第一寡核苷酸链探针的末端修饰有荧光基团,第二寡核苷酸链探针的末端修饰有淬灭基团;或者,第一寡核苷酸链探针的末端修饰有淬灭基团,第二寡核苷酸链探针的末端修饰有荧光基团。
[0018]
本申请实施方式中,所述荧光基团包括羧基四甲基罗丹明(tamra)、羧基荧光素(fam)、2,7-二甲基-4,5-二氯-6-羧基荧光素(joe)和六氯-6-甲基荧光素(hex)中的一种或多种;所述淬灭基团包括4-[(2-氯-4-硝基-苯基)-偶氮基]-苯胺(eclipse)和黑洞淬灭剂(bhq)中的一种或多种。其中,所述羧基荧光素(fam)包括5-羧基荧光素(5-fam)或6-羧基荧光素(6-fam)。所述黑洞淬灭剂(bhq)包括黑洞淬灭剂1(bhq-1)、黑洞淬灭剂2(bhq-2)或黑洞淬灭剂(bhq-3)。可选地,所述荧光基团还可以其他发射波长的荧光染料。
[0019]
本申请实施方式中,当scgrna(荧光检测探针)中的寡核苷酸链探针未被切割时,此时寡核苷酸链探针(包括第一寡核苷酸链探针和第二寡核苷酸链探针)上的可检测的标记物未释放可检测信号,如淬灭基团与荧光基团之间发生荧光淬灭,外界不能检测到荧光基团发出的荧光信号。本申请所述第一凸起或所述第二凸起中修饰的荧光基团和淬灭基团是经过合理搭配的,由于荧光基团和淬灭基团之间间隔距离短,所述第一凸起、所述第二凸起或第一寡核苷酸链探针和第二寡核苷酸链探针上的荧光基团均处于荧光被淬灭状态,因此,scgrna的背景荧光低。当所述第一凸起和所述第二凸起被激活的cas蛋白反式切割后,所述第一寡核苷酸链探针和第二寡核苷酸链探针中未被切割的片段也会由于与辅助探针向导rna序列之间的tm值改变而迅速从辅助探针向导rna上脱离,释放荧光基团和辅助探针向导rna序列。本申请中,基于scgrna中所述第一凸起、所述第二凸起上或第一寡核苷酸链探针和第二寡核苷酸链探针末端修饰选择的荧光基团不同,所述核酸检测方法的荧光检测过程中采用的激发波长也会不同。例如,所述荧光基团可以但不限于为6-羧基荧光素,所述荧光检测过程中采用的激发波长约为490nm,收集6-羧基荧光素的发射波长约为520nm。
[0020]
本申请实施方式中,所述cas蛋白包括cas12a、cas12b蛋白中的至少一种;所述cas蛋白来源于毛螺菌(lachnospiraceae bacterium)、新凶手弗朗西丝菌(francisella novicida)、氨基酸球菌(acidaminococcus sp.)和酸土脂环酸芽孢杆菌(moraxella bovoculi)中的至少一种。其中,所述cas12a蛋白又称cpf1蛋白。可选地,所述cas12a可以但
不限于为ascas12a、fncas12a、mbcas12a和lbcas12a中的一种或多种。其中,所述cas12a蛋白可以来源于毛螺菌nd2006。本申请中,基于不同cas蛋白,所述锚定序列可以略有差异。当所述cas蛋白为lbcas12a时,所述锚定序列可以如seq id no:1所示,即所述锚定序列包括5
’-
uaauuucuacuaaguguagau-3
’
。
[0021]
本申请中,所述cas蛋白可以但不限于通过重组表达、蛋白纯化的方式获得。一实施方式中,将编码所述cas蛋白的核酸序列构建至重组基因表达载体中,然后进行异源表达;其中,所述编码cas蛋白的核酸序列还可以但不限于经过基因改造,例如基因突变。可选地,所述cas也可以通过商业购买获得。
[0022]
本申请中,所述锚定序列包括:5
’-
uaauuucuacuaaguguagau-3
’
;所述靶标向导序列包括连接在所述锚定序列3
’
端的至少18个碱基n,所述辅助探针向导序列包括连接在所述锚定序列3
’
端的至少18个碱基m;其中,每个所述碱基m、碱基n分别独立选自a、c、u或g;所述第一寡核苷酸链探针包括:
[0023]
5
’-
atctacactt/i6famdt/ttatt/ibhq1dt/agtagaaatta-3
’
;所述第一凸起由i6famdt/ttatt/ibhq1dt组成;所述第二寡核苷酸链探针的所述第二凸起与所述第一凸起相同。
[0024]
其中,这里提到的每个所述碱基m、碱基n分别独立选自a、c、u或g是指:所述靶标向导序列包括的至少18个碱基n,每个碱基n可以独立选自a、c、u或g;所述辅助探针向导序列包括的至少18个碱基m;每个碱基m可以独立选自a、c、u或g。
[0025]
本申请中,所述反应体系中的所述缓冲液有利于保持cas蛋白的高活性,以及提升反应过程中cas蛋白被激活后的反式切割活性。可选地,所述缓冲液可以但不限于使用depc水进行配制。所述depc水是指用depc(diethyl pyrocarbonate,焦碳酸二乙酯)处理过并经高温高压灭菌的miliq纯水,无色液体;不含杂质rna、dna和蛋白质。
[0026]
可选地,所述缓冲液的ph为7.0-7.8。一实施方式中,所述缓冲液的ph为7.2-7.8。另一实施方式中,所述缓冲液的ph为7.4-7.6。例如,所述缓冲液的ph具体为7.0、7.1、7.2、7.3、7.4、7.5、7.6、7.7或7.8。
[0027]
可选地,所述缓冲液的成分包括tris-hcl、氯化钾(kcl)、氯化镁(mgcl
2
)、甘油(glycerol)、肝素(heparin)和二硫苏糖醇(dithiothreitol,dtt)中的一种或多种。
[0028]
其中,所述tris-hcl的浓度为10-30mm。可选地,所述tris-hcl的浓度为15-25mm。例如,所述tris-hcl的浓度可以为10mm、15mm、20mm、25mm或30mm。
[0029]
可选地,所述氯化钾的浓度为50-150mm。可选地,所述氯化钾的浓度为50-150mm。例如,所述氯化钾的浓度可以为50mm、60mm、70mm、80mm、90mm、100mm、110mm、120mm、130mm、140mm或150mm。
[0030]
可选地,所述氯化镁的浓度为1-10mm。可选地,所述氯化镁的浓度为3-8mm。例如,所述氯化镁的浓度可以为1mm、2mm、3mm、4mm、5mm、6mm、7mm、8mm、9mm或10mm。
[0031]
可选地,所述甘油的体积百分含量为2-8%。可选地,所述甘油的体积百分含量为2-6%。例如,所述甘油的体积百分含量可以为2%、3%、4%、5%、6%、7%或8%。
[0032]
可选地,所述肝素的浓度为20-80μg/ml。可选地,所述肝素的浓度为20-80μg/ml。例如,所述肝素的浓度可以为20μg/ml、30μg/ml、40μg/ml、50μg/ml、60μg/ml、70μg/ml或80μg/ml。
[0033]
可选地,所述dtt的浓度为0.1-2mm。可选地,所述dtt的浓度为0.5-1.5mm。例如,所述dtt的浓度可以为0.1mm、0.3mm、0.5m m、0.8mm、1.0mm、1.2mm、1.5mm、1.8mm或2.0mm。
[0034]
可选地,所述cas蛋白的浓度为0.5-5μm。可选地,所述cas蛋白的浓度为0.8-1.5μm。本申请中,所述cas蛋白相对于所述靶标向导rna过量。
[0035]
可选地,所述荧光检测探针的浓度为0.5-5μm。可选地,所述荧光检测探针的浓度为1-5μm。本申请中,所述荧光检测探针的物质的量相对于所述靶标向导rna过量。
[0036]
可选地,所述辅助探针的浓度为0.5-5μm。可选地,所述辅助探针的浓度为1-5μm。
[0037]
本申请实施方式中,检测所述待测样本,包括绘制标准曲线,步骤包括:
[0038]
提供多个不同浓度梯度的阳性标准品,所述阳性标准品含有所述靶标基因组序列;
[0039]
将所述不同浓度梯度的阳性标准品分别添加至所述反应体系中,经恒温定时反应后,检测所述可检测信号,根据所述不同浓度梯度的阳性标准品对应的所述荧光信号数值绘制得到标准曲线。
[0040]
可选地,绘制标准曲线时,所述检测所述阳性标准品的反应条件与检测所述待测样本时的反应条件一致。本申请中,高浓度的阳性标准品的荧光信号增长速率会大于低浓度的阳性标准品的荧光信号增长速率,在定时条件下,不同浓度的阳性标准品会对应产生荧光值,从而可以绘制标准曲线。本申请中,通过采用标准曲线法,可以快速检测得到待测样品中靶标基因组序列浓度,从而快速获得含有该靶标基因组序列的核酸浓度。本申请所述核酸检测方法还可以用于快速定性判断待测样品内是否存在靶标基因组序列。
[0041]
可选地,所述核酸检测方法的检测限为1-4copies/μl。本申请中,所述核酸检测方法具有很高灵敏度和特异性,远远高于传统crispr-dx的核酸检测方法。由于本申请所述检测方法无需使用其它聚合酶和设计扩增引物,因此,本申请所述核酸检测方法成本也非常低,检测更便捷。
[0042]
可选地,所述核酸检测方法可以用于各种癌症的核酸序列检测。可选地,所述核酸检测方法可以用于肝癌、膀胱癌、肺癌、乳腺癌、卵巢癌、子宫癌、鼻咽癌或淋巴癌的核酸序列检测。
[0043]
本申请一实施方式中,提供一用于乙型肝炎的核酸检测方法,其中,所述靶标向导rna包括如seq id no:2所示的核苷酸序列。所述荧光检测探针中,所述辅助探针向导rna包括如seq id no:3或seq id no:4所示的核苷酸序列;所述第一寡核苷酸链探针为和所述第二寡核苷酸链探针分别为:
[0044]
5
’-
atctacactt/i6famdt/ttatt/ibhq1dt/agtagaaatta-3
’
;
[0045]
5
’-
tcatagttag/i6famdt/ttatt/ibhq1dt/cgtaacgatc-3
’
。所述辅助探针包括由seq id no:5和seq id no:6所示的核苷酸序列组成的双链dna序列;或者由seq id no:7和seq id no:8所示的核苷酸序列组成的双链dna序列。所述核酸检测方法中,所述乙型肝炎的靶向基因组序列如seq id no:9所示。
[0046]
本申请另一实施方式中,提供一用于膀胱癌的核酸检测方法,其中,所述靶标向导rna包括如seq id no:10所示的核苷酸序列。所述荧光检测探针中,所述辅助探针向导rna包括如seq id no:3或seq id no:4所示的核苷酸序列;所述第一寡核苷酸链探针为和所述第二寡核苷酸链探针分别为:
[0047]
5
’-
atctacactt/i6famdt/ttatt/ibhq1dt/agtagaaatta-3
’
;
[0048]
5
’-
tcatagttag/i6famdt/ttatt/ibhq1dt/cgtaacgatc-3
’
。
[0049]
所述辅助探针包括由seq id no:5和seq id no:6所示的核苷酸序列组成的双链dna序列;或者由seq id no:7和seq id no:8所示的核苷酸序列组成的双链dna序列。所述核酸检测方法中,所述膀胱癌的靶向基因组序列如seq id no:11所示。
[0050]
本申请第一方面所述的核酸检测方法克服了传统检测技术中的灵敏度低、特异性差、成本高的缺点,能够对各种核酸样品进行检测。本申请所述核酸检测方法在保证痕量高灵敏度、高特异性检测的情况下,还能够对病毒感染以及肿瘤相关的单碱基变异进行有效检测。所述核酸检测方法可以在生物、医疗领域具有广泛的应用前景。
[0051]
第二方面,本申请还提供了一种荧光检测探针(scgrna),所述荧光检测探针包括辅助探针向导rna和至少一条寡核苷酸链探针,所述辅助探针向导rna包括锚定序列和辅助探针向导序列;所述至少一条寡核苷酸链探针上修饰有可检测的标记物,所述至少一条寡核苷酸链探针包括第一寡核苷酸链探针和第二寡核苷酸链探针,所述第一寡核苷酸链探针杂交在所述锚定序列上,且在所述锚定序列上形成第一凸起;所述第二寡核苷酸链探针杂交在所述辅助探针向导序列上,且在所述辅助探针向导序列上形成第二凸起;所述锚定序列包括能与cas蛋白特异性识别rna序列,所述辅助探针向导序列包括连接在所述锚定序列3
’
端的至少18个碱基m,每个所述碱基m独立选自a、c、u或g。
[0052]
本申请实施方式中,所述第一凸起和所述第二凸起上均分别修饰有荧光基团和淬灭基团;
[0053]
或者,所述第一寡核苷酸链探针和第二寡核苷酸链探针的末端分别修饰有荧光基团和/或淬灭基团。
[0054]
可选地,所述荧光检测探针中,所述辅助探针向导rna的锚定序列包括:
[0055]
5
’-
uaauuucuacuaaguguagau-3
’
;所述辅助探针向导序列包括连接在所述锚定序列3
’
端的至少18个碱基n,每个所述碱基n独立选自a、c、u或g;所述第一寡核苷酸链探针包括:
[0056]
5
’-
atctacactt/i6famdt/ttatt/ibhq1dt/agtagaaatta-3
’
;其中,所述第一凸起由i6famdt/ttatt/ibhq1dt组成;所述第二寡核苷酸链探针与所述辅助探针向导序列杂交,所述第二寡核苷酸链探针的所述第二凸起与所述第一凸起相同。
[0057]
本申请第二方面所述的荧光检测探针可以应用于核酸检测,所述荧光检测探针经cas蛋白反式切割催化后,能够释放荧光信号,同时释放能引发正反馈回路系统的辅助探针向导rna,致使荧光信号呈指数扩增。
[0058]
第三方面,本申请还提供了一种试剂盒,用于核酸检测,包括本申请第二方面所述的荧光检测探针。
[0059]
本申请实施方式中,所述试剂盒还包括cas蛋白、靶标向导rna、辅助探针和缓冲液。
[0060]
可选地,所述试剂盒还包括阳性对照品和阴性对照品。其中,所述阳性对照品中含有所述待测基因。所述阴性对照品可以但不限于包括depc水。
[0061]
具体地,所述试剂盒包括一盒体,设置在所述盒体内的多种试剂和使用说明书。所述多种试剂包括荧光检测探针、cas蛋白、靶标向导rna、辅助探针、缓冲液、阳性对照品和阴
性对照品。所述多种试剂可以但不限于分别独立封装,例如,所述多种试剂可以分别通过冷冻干燥的方式封装在试剂瓶中。
[0062]
本申请第三方面所述试剂盒具有简便、快速和成本低的优点,能够实现对核酸的快速、高灵敏检测,适用于大规模的工业化生产。基于不同的待测样品对象,所述试剂盒可以分别设计为对应的产品。
[0063]
第四方面,本申请还提供了一种应用于本申请第一方面所述核酸检测方法的检测装置,包括:
[0064]
样品反应槽;
[0065]
温控组件,用于控制所述样品反应槽内的反应温度和加热时间;
[0066]
荧光检测组件,包括激发单元和荧光收集单元,所述激发单元用于向所述反应槽内提供至少一种额定波长的激发光,所述荧光收集单元用于收集并检测所述反应槽内的荧光信号。
[0067]
可选地,所述检测装置还包括显示组件和控制组件。所述显示组件用于显示所述检测装置工作中的检测参数。所述控制组件可以但不限于包括微处理芯片,用于调控所述检测装置中的温控组件、荧光检测组件和显示组件。
[0068]
可选地,所述检测装置还包括箱体,所述样品反应槽、所述温控组件、所述荧光检测组件设于所述箱体内。当所述检测装置还包括显示组件和控制组件时,所述显示组件固定在所述箱体的一侧壁的外表面上所述控制组件设于所述箱体内,且所述控制组件与所述样品反应槽、温控组件、荧光检测组件和所述显示组件均实现电连接。所述箱体还包括一与所述箱体可活动连接的箱盖,以形成避光检测环境。
[0069]
本申请第四方面所述的检测装置适用于作为本申请第一方面所述核酸检测方法的检测装置。所述检测装置结构精简,能够大规模批量化生产;配合所述核酸检测方法,所述检测装置能够快速、精准的测得待测基因组的浓度。所述检测装置的尺寸可以偏小,能够随身携带,可广泛用于任何工作场景。例如,所述检测装置可以直接在户外进行实时检测。
[0070]
由于所述检测装置的便携性强,作为一个实时提供核酸检测的检测平台,因此,本申请所述检测装置可以进一步缩短整个核酸检测的时间,使其更方便地应用于临床检测,特别是突发性疾病(例如传染病)的核酸检测,为疾病的治疗和控制赢取宝贵的时间,具有重要意义。
[0071]
本申请的优点将会在下面的说明书中部分阐明,一部分根据说明书是显而易见的,或者可以通过本申请实施例的实施而获知。
附图说明
[0072]
为更清楚地阐述本申请的内容,下面结合附图与具体实施例来对其进行详细说明。
[0073]
图1为本申请一实施例提供的核酸检测方法的流程示意图;
[0074]
图2为本申请一实施例制备的cas蛋白的活性验证曲线图;
[0075]
图3为本申请一实施例提供的荧光检测探针(scgrna)的结构示意图;
[0076]
图4为本申请一实施例提供的核酸检测方法的原理示意图;
[0077]
图5为本申请一实施例提供的乙型肝炎病毒感染细胞和血液临床样本的核酸检测
的数据图;
[0078]
图6为本申请一实施例提供的膀胱癌的细胞和组织临床样本核酸检测的数据图;
[0079]
图7为本申请一实施例提供的核酸检测的灵敏检测数据图;
[0080]
图8为本申请一实施例提供的核酸特异性检测数据图;
[0081]
图9为本申请一实施例提供的检测装置100的结构示意图。
具体实施方式
[0082]
以下所述是本申请的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本申请原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也视为本申请的保护范围。
[0083]
若无特别说明,下面实施例使用的化学试剂均为市售试剂。
[0084]
请参考图1,图1是本发明一实施例提供的核酸检测方法的流程示意图,包括:
[0085]
s01、提供待测样品,所述待测样品中含有靶标基因组序列;
[0086]
s02、配制反应体系,所述反应体系中包括cas蛋白、靶标向导rna、荧光检测探针、辅助探针和缓冲液;所述荧光检测探针包括辅助探针向导rna和杂交在所述辅助探针向导rna上的至少一条寡核苷酸链探针,所述至少一条寡核苷酸链探针上修饰有可检测的标记物;
[0087]
s03、将所述待测样品加至所述反应体系中,经恒温定时反应,所述靶标向导rna引导所述cas蛋白特异性结合所述靶标基因组序列,引发所述荧光检测探针上的至少一条寡核苷酸链探针被所述cas蛋白反式切割,释放的所述辅助探针向导rna引导所述cas蛋白特异性结合所述辅助探针,再次引发所述荧光检测探针上的至少一条寡核苷酸链探针被所述cas蛋白反式切割,形成正反馈回路系统,所述至少一条寡核苷酸链探针被切割后产生可检测信号,所述可检测信号包括荧光信号,检测所述可检测信号,计算所述靶标基因组序列的含量。
[0088]
可选地,所述第一凸起和所述第二凸起上均分别修饰有荧光基团和淬灭基团。可选地,所述第一凸起上的两个核苷酸分别修饰有荧光基团和淬灭基团,和所述第二凸起上的两个核苷酸分别修饰有荧光基团和淬灭基团。
[0089]
可选地,所述第一寡核苷酸链探针和第二寡核苷酸链探针的末端分别修饰有荧光基团和/或淬灭基团。例如,第一寡核苷酸链探针的末端修饰有荧光基团,第二寡核苷酸链探针的末端修饰有淬灭基团;或者,第一寡核苷酸链探针的末端修饰有淬灭基团,第二寡核苷酸链探针的末端修饰有荧光基团。
[0090]
其中,所述步骤s03中,所述恒温定时反应的反应温度为35-38℃。一实施方式中,所述恒温定时反应的反应温度为36-37℃。优选地,所述恒温定时反应的反应温度为37℃。所述恒温定时反应的反应时间为30-300min。例如,所述恒温定时反应的反应时间为60-240min。或者所述恒温定时反应的反应时间为100-240min。
[0091]
本申请所述检测方法中,由于在反应体系中加入由修饰有荧光基团和淬灭基团的至少一条寡核苷酸链探针(idna)和辅助探针向导rna(grna)组成的荧光检测探针(scgrna),当cas蛋白在靶标向导rna(grna-t)的辅助,识别具有待测基因组的dna序列后,被激活附属切割活性的cas蛋白可以催化降解scgrna中的寡核苷酸链探针,从而产生荧光
信号,同时释放辅助探针向导rna(grna),在辅助探针的帮助下构建正反馈回路系统,实现对靶标基因组的指数放大检测。
[0092]
下面分多个实施例对本发明实施例进行进一步的说明。
[0093]
实施例1lbcas12a蛋白表达、纯化和活性验证
[0094]
(1)从addgene上购买pet-lbcas12a-2nls蛋白质粒,lbcas12a的基因序列经密码子优化和合成后,克隆到pet28a质粒中,得到粒pet28a-lbcas12a重组质粒。将pet28a-lbcas12a重组质粒转导至大肠杆菌bl21菌株中,于lb平板上37℃培养过夜;
[0095]
(2)从lb平板上挑取一单克隆菌株接入5ml lb培养基,37℃培养过夜;
[0096]
(3)取步骤(2)中约3ml过夜培养后的菌液接入3l新鲜的lb液体培养基中,37℃培养至od600≈0.8,加入0.2mmol/l的iptg,16℃诱导16h;
[0097]
(4)将培养好的菌液放入离心机中,5000r/min离心10-15min,弃去上清,收集菌体,离心后的菌体沉淀悬浮于25ml裂解缓冲液(50mm tris-hcl ph 8.0,1.5m nacl)
[0098]
(5)通过ni-nta琼脂糖色谱法纯化蛋白质,然后通过脱盐色谱法将缓冲液更换为脱盐缓冲液(20mm tris-hcl ph 8.0,600mm nacl,2mm dtt,10%甘油)。
[0099]
(6)通过使用改良的bradford蛋白测定染料试剂盒以牛血清白蛋白(bsa)为标准品对纯化的lbcas12a蛋白进行定量。
[0100]
(7)加入等体积甘油混匀后,置于-80℃保存待用;
[0101]
(8)lbcas12a蛋白的活性验证;使用上面所述制备方法制得的制备lbcas12a蛋白;设计并合成一荧光基团和淬灭基团标记的ssdna探针(例如,具体为5
’-
6-fam-ttatt-bhq1-3
’
),并配制基于crispr-cas系统的反应体系,用于实时荧光验证lbcas12a的反式切割(trans-cleavage)。
[0102]
具体反应体系包括(20μl体系):50nm lbcas12a,50nm第一向导rna(grna-1),1
×
crispr缓冲液(20mm tris-hcl,ph 7.5,100mm kcl,5mm mgcl
2
,1mm dtt,5%甘油,50μg/ml肝素),1μm ssdna探针,50nm靶标序列。
[0103]
采用恒温37℃反应60-240min,然后进行荧光检测,其中,每30s采集fam荧光一次,其检测条件为:激发波长为490nm,发射波长约为520nm。然后判断扣除crispr-cas系统荧光背景下,在有或无添加cas12a蛋白条件下,体系中的荧光信号数值变化。
[0104]
结果如图2所示,反应体系中,添加cas12a蛋白实验组,随着反应时间的增加,体系的荧光信号也逐渐增加;体系中靶标序列和靶标向导rna成功激活cas12a的反式切割活性,体系中的ssdna探针被切割,并释放出荧光基团;而未添加cas12a蛋白的实验组,体系中几乎没有荧光信号的变化。
[0105]
实施例2:荧光检测探针(scgrna)的设计
[0106]
本申请可运用nupack和diamelt软件设计所述荧光检测探针,然后进行合成,其中,所述荧光检测探针也可以通过委托第三方公司合成获得。
[0107]
本申请荧光检测探针(scgrna)包括辅助探针向导rna(grna)和至少一条寡核苷酸链探针(idna),其中,grna包括锚定序列(handle)和辅助探针向导序列(spacer),即5
’-
handle-spacer-3
’
。
[0108]
其中,handle序列能够与cas蛋白结合,基于不同的cas蛋白,handle序列之间会存在一点差异。spacer序列为能与辅助探针序列互补的序列片段。其中,基于不同的辅助探针
序列,spacer序列也会存在不同。
[0109]
然后基于grna,运用nupack设计至少一条寡核苷酸链探针(idna)。参见图3,首先设计不同序列长度的idna(图3中a),由于不同序列长度的idna(i-vii)与grna互补时,能生成具有不同热稳定性的grna/idna双链体,针对不同热稳定性的grna/idna双链体,其导致cas蛋白的反式切割活性也会不同。例如,当grna与idna-vii完全杂交匹配时,激活的cas蛋白反式切割活性几乎完全被抑制,其中idna-vii的核苷酸序列如seq id no:12所示。接着设计使idna与grna杂交后形成凸起结构,而且在反应温度下,当凸起结构被激活的cas蛋白反式切割后,grna能够释放出来。最后在辅助探针的帮助下,cas蛋白反式切割活性增强,因此可以实现对cas蛋白的反式切割活性关-开的调控。
[0110]
一实施方式中,参见图3中b,分别设计第一寡核苷酸链探针(idna-h)和第一寡核苷酸链探针(idna-s)。其中,idna-h能与handle区域序列杂交形成双链体,且形成第一凸起;idna-s能与spacer区域序列杂交形成双链体,且形成第二凸起。然后在所述第一凸起上不同两个核苷酸上分别修饰荧光基团和淬灭基团;修饰有所述荧光基团的核苷酸与修饰有所述淬灭基团的核苷酸之间间隔有1-9个核苷酸;在所述第二凸起上不同两个核苷酸上分别修饰荧光基团和淬灭基团;修饰有所述荧光基团的核苷酸与修饰有所述淬灭基团的核苷酸之间间隔有1-9个核苷酸。其中,通过间隔一个或多个核苷酸,以控制淬灭基团与荧光基团的间隔,使淬灭基团能更有效地淬灭荧光基团,减少反应体系中的背景荧光,提升检测灵敏度。所述修饰有所述荧光基团的核苷酸与修饰有所述淬灭基团的核苷酸之间间隔的核苷酸数目还会影响激活的cas蛋白反式切割活性、以及荧光检测探针的热稳定性,熔链温度(tm)值等。
[0111]
以handle序列为5
’-
uaauuucuacuaaguguagau-3
’
为例,spacer序列为5
’-
gaucguuacgcuaacuauga-3
’
为例,所述辅助探针向导rna(grna)的序列为:
[0112]
5
’-
uaauuucuacuaaguguagaugaucguuacgcuaacuauga-3
’
。
[0113]
设计与grna杂交的第一寡核苷酸链探针(idna-h)和第一寡核苷酸链探针(idna-s),其中idna-h包含一个7nt的第一凸起和idna-s也包含一个7nt的第二凸起。idna-h和idna-s的凸起上间隔5个碱基的两个t碱基分别修饰有荧光基团和淬灭基团,
[0114]
其中,idna-h可以设计为:
[0115]
5
’-
atctacactt/i6famdt/ttatt/ibhq1dt/agtagaaatta-3
’
;
[0116]
idna-s可以设计为:
[0117]
5
’-
tcatagttag/i6famdt/ttatt/ibhq1dt/cgtaacgatc-3
’
;
[0118]
构建的荧光检测探针(scgrna),如图3中b所示。经加入额外具有反式切割活性的lbcas12a后,该scgrna在37℃左右反应温度下,idna-h和idna-s上的凸起会被切割,释放出原本封闭grna,并且该grna能识别与spacer序列相匹配的辅助探针序列,并依然能激活lbcas12a自身的反式切割活性,最大化放大cas蛋白的反式切割活性,实现指数级扩增。
[0119]
实施例3:核酸检测方法的构建及效果评价
[0120]
构建检测体系,包括:待测基因组,cas蛋白、靶标向导rna(grna-t)、荧光检测探针(scgrna)、辅助探针(adna)和缓冲液。参见图4,图4为所述核酸检测方法的原理示意图,其中,本申请所述核酸检测方法可以由3个信号处理器组成,即传感器t1,t2和信号放大器a,其中t1和a串联连接,并且a和t2的并联连接形成一个正反馈环路。具体来说,首先cas蛋白
和待测基因的靶向基因序列dna、grna-t能形成cas蛋白/grna-t/dna复合物,预先组装为t1,已转换为具有反式切割活性的cas蛋白的输出。scgrna作为a,scgrna可响应具有反式切割活性的cas蛋白的输入,输出放大的荧光信号和多个活性grna分子。grna引导辅助探针adna,与cas蛋白另外形成cas蛋白/grna-2/adna复合物,因此t2能够将释放的grna-2的输入转化为具有反式切割活性cas蛋白的输出。在这种情况下,a的每个输出会导致一个有活性的cas蛋白,进而产生更多数量的有活性的cas蛋白以及放大的荧光信号,从而导致a和传感器t2之间的正反馈回路具有较高的环路增益。因此,每个待测基因在所述核酸检测方法中被转换为指数扩增的荧光信号,从而可以进行超灵敏的核酸检测。
[0121]
为了进一步评估本申请所描述的核酸检测方法的检测效果,进行如下效果实施例。实施例仅用来举例,并不构成对本发明保护范围的任何限制,本发明的保护范围在权利要求书中说明。
[0122]
效果实施例1对乙型肝炎病毒(hbv)的核酸检测
[0123]
设计靶向hbv基因组的靶标向导rna(grna-t),grna-t靶向hbv基因组的正向序列(2315-2334),hbv基因组的正向序列源于hbv基因组序列,如seq id no:9所示;grna-t的序列为:
[0124]
5
’-
uaauuucuacuaaguguagaucggaaguguugauaggauag-3
’
[0125]
待测样本的核酸提取:选取10
6-10
7
个hbv感染与未感染的hlcz01细胞和18份临床血液样品,其中,正常人临床血液样品9份,hbv病人临床血液样品9份。按照核酸提取试剂盒的操作手册,提取待测样本的基因组dna。
[0126]
检测反应体系:总体积为20μl,其中包括1μm lbcas12a,50nm grna-1,1
×
crispr缓冲液(20mm tris-hcl,ph 7.5,100mm kcl,5mm mgcl
2
,1mm dtt,5%甘油,50μg/ml肝素),1μm scgrna,1μm adna,6μl样品基因组dna。恒温37℃反应120-240min,然后进行荧光检测,每30s采集荧光信号一次。其中,辅助探针adna为以下两条ssdna杂交形成,分别为:
[0127]
adna-ts:5
’-
tcatagttagcgtaacgatctaaagttttgtcgtc-3
’
,
[0128]
adna-nts:5
’-
gacgacaaaactttagatcgttacgctaactatga-3
’
。
[0129]
结果如图5所示,其中,图5中a为乙肝感染与未感染的hlcz01细胞实验组的核酸检测结果;图5中b为我们的检测方法“conan”与单纯cas12应用于乙肝感染hlcz01细胞的检测限对比结果;图5中c为乙肝感染与未感染的血液样品的核酸检测结果;图5中d为我们的检测方法“conan”与rt-pcr对乙肝感染的血液样品结果对比,可以看出,本申请实施例提供的核酸检测方法不仅可以对感染hbv与未感染hbv的细胞进行高灵敏检测,检测限比单纯cas12的灵敏度提高了7个数量级,还能有效实现对临床hbv病人和正常人的样本检测,准确度和rt-pcr相当。
[0130]
效果实施例2对膀胱癌的核酸检测
[0131]
设计靶向膀胱癌pik3ca_1633g>a基因组的靶标向导rna(grna-t);grna-t的序列为:
[0132]
5
’-
uaauuucuacuaaguguagauuccugcuuagugauuucaga-3
’
[0133]
待测样本的核酸提取:选取10
6-10
7
个pik3ca_1633g>a的细胞系tccsup细胞与人正常干细胞lo2和6份临床膀胱组织样品,其中,正常人临床膀胱组织样品3份,膀胱癌病人临床膀胱组织样品3份。按照核酸提取试剂盒的操作手册,提取待测样本的基因组dna。
[0134]
检测反应体系:总体积为20μl,其中包括1μm lbcas12a,50nm grna-1,1
×
crispr缓冲液(20mm tris-hcl,ph 7.5,100mm kcl,5mm mgcl
2
,1mm dtt,5%甘油,50μg/ml肝素),1μm scgrna,1μm adna,6μl样品基因组dna。恒温37℃反应120-240min,然后进行荧光检测,每30s采集荧光信号一次。其中,辅助探针adna为以下两条ssdna杂交形成,分别为:
[0135]
adna-ts:5
’-
tcatagttagcgtaacgatctaaagttttgtcgtc-3
’
,
[0136]
adna-nts:5
’-
gacgacaaaactttagatcgttacgctaactatga-3
’
。
[0137]
结果如图6所示,其中,图6中a为人正常干细胞lo2与膀胱癌tccsup细胞的核酸检测结果;图6中b为膀胱癌tccsup细胞基因组浓度(1nmol/l)与荧光信号的线性关系;图6中c为我们的方法“conan”6份临床膀胱组织样品的核酸检测结果;图6中d为高通量测序技术对6份临床膀胱组织样品的核酸检测结果,可以看出,本申请实施例提供的核酸检测方法能够对膀胱癌pik3ca_1633g>a基因组进行高灵敏检测,包括对膀胱癌的细胞样品或组织样品的核酸检测,而且针对于不同突变频率的膀胱癌组织样品,检测结果与高通量测序技术相当。
[0138]
参照前面实施例所述内容,本申请所述核酸检测方法同样适用于包括非洲猪瘟病毒(asfv)、狂犬病病毒(pseudorabies virus)、人乳头瘤病毒-18(hpv-18)、人乳头瘤病毒-16(hpv-16)、艾滋病病毒(hiv)、金黄色葡萄球菌(streptococcus aureus)、大肠杆菌(e.coli)或单核细胞增生李斯特菌(listeria monocytogenes)的核酸序列检测,对上述对各个检测对象的具体实验过程本申请所述实施例中不再一一赘述。其中,非洲猪瘟病毒的靶标基因组序列如seq id no:13和seq id no:14所示,狂犬病病毒的靶标基因组序列如seq id no:15和seq id no:16所示,人乳头瘤病毒-18的靶标基因组序列如seq id no:17和seq id no:18所示,人乳头瘤病毒-16的靶标基因组序列如seq id no:19和seq id no:20所示,艾滋病病毒的靶标基因组序列如seq id no:21和seq id no:22所示,金黄色葡萄球菌的靶标基因组序列如seq id no:23和seq id no:24所示,金黄色葡萄球菌的靶标基因组序列如seq id no:23和seq id no:24所示,大肠杆菌的靶标基因组序列如seq id no:25和seq id no:26所示,单核细胞增生李斯特菌的靶标基因组序列如seq id no:27和seq id no:28所示。
[0139]
效果实施例3检测灵敏度的评估
[0140]
考察本申请所述核酸检测方法的灵敏性,将含有pik3ca基因组为模,并进行一系列梯度稀释(5amol/l,100amol/l,1fmol/l,100fmol/l,1pmol/l,10pmol/l,100pmol/l,1nmol/l),以不加靶标pik3ca基因组为阴性对照。这里的amol/l为10-18
mol/l。
[0141]
结果如图7所示,其中图7中a为在相同的pik3ca基因组浓度(1nmol/l),我们建立的“conan”方法相对于单纯cas12的线性扩增,其展示出信号更强指数级扩增,拟合方程为:y=696.0*
e0.012t-693.9;图7中b为所述核酸检测方法的最低检测浓度为5amol,其线性回归方程为y=1475x+25342,r
2
=0.996。
[0142]
效果实施例4特异性评估
[0143]
进一步考察本申请所述核酸检测方法的特异性,其中,将pik3ca基因组片段一次设计单碱基突变做体系特异性考察,同时以无突变的pik3ca基因组片段做阳性对照,以不加靶标pik3ca基因组为阴性对照。
[0144]
结果如图8所示。本申请所述核酸检测方能够将pik3ca基因组与其它单碱基突变的序列区分开来,说明本申请所述核酸检测方法具有很强的特异性。因此,所述检测方法不
仅可以对肿瘤相关的单碱基突变的对应细胞系进行检测,还能有效的应用于不同单碱基突变频率的癌症临床样本中。
[0145]
由于现有利用crispr-cas系统附属切割活性对核酸检测方法中,都存在灵敏度低、特异性低的缺点,并且现有技术中通过结合聚合酶链式反应(pcr)或重组聚合酶扩增(rpa)等方式实现线性信号放大的方法,破坏了整个检测方法的连续性,使检测过程更复杂,容易造成检测误差,以使准确率下降;同时,使用pcr和rpa等方法,需要多种酶/蛋白质参与、精心设计的引物,非连续性操作大大增加了整个检测方法的成本和操作的复杂性。而本申请实施方式中所述的核酸检测方法,将自催化驱动正反馈概念和crispr-cas附属切割活性相结合,实现一种crispr-cas蛋白对反应体系中荧光基团呈指数级释放,其对应的荧光信号呈指数级扩增,从而对靶标核酸的高灵敏和强特异性检测;且所述检测方法连续一步无需引入额外的核酸扩增步骤,条件温和,操作更简便,成本更低。
[0146]
此外,本申请所述核酸检测方法在保证痕量高灵敏度、高特异性检测的情况下,能够对病毒感染以及肿瘤相关的单碱基变异进行有效检测。因此,本申请所述核酸检测方法可以在生物、医疗领域具有广泛的应用前景。例如,所述核酸检测方法可以应用于疾病预防、诊断或治疗等方面。
[0147]
请参考图9,本发明一实施例还提供了一种应用于所述核酸检测方法的检测装置100,包括:
[0148]
样品反应槽10;
[0149]
温控组件20,用于控制所述样品反应槽10内的反应温度和加热时间;
[0150]
荧光检测组件30,包括激发单元31和荧光收集单元32,所述激发单元31用于为所述反应槽内10的待测样品提供至少一种额定波长的激发光,所述荧光收集单元32收集并检测所述反应槽内10的荧光信号。
[0151]
可选地,所述检测装置100还包括显示组件40和控制组件(未示出)。所述显示组件40用于显示所述检测装置100工作中的检测参数。所述控制组件用于调控所述检测装置中的温控组件20、荧光检测组件30和显示组件40。
[0152]
其中,所述检测装置100还包括箱体101和与所述箱体可活动连接的箱盖102。所述箱盖102能使所述箱体101形成避光检测环境。
[0153]
本申请实施方式中,所述样品反应槽10、所述温控组件20、所述荧光检测组件30设于所述箱体101内,所述显示组件40固定在所述箱体101的一侧壁的外表面上。所述控制组件设于所述箱体101内,且所述控制组件与所述样品反应槽10、温控组件20、荧光检测组件30和所述显示组件40均实现电连接。
[0154]
本申请实施方式中,检测装置100中的具体形状或尺寸可以基于实际应用进行调整,本实施例不做过多限定。其中,检测装置100中的各个组件,例如,样品反应槽、温控组件、荧光检测组件和显示组件的具体结构、位置也可以为其他方式搭配,本实施方式中也不做过多限定。
[0155]
本申请所述实施例提供的检测装置可用于作为本申请前面实施例所述核酸检测方法的检测装置。所述检测装置结构精简,能够大规模批量化生产;配合所述核酸检测方法,所述检测装置能用于便携、快速、精准地测定待测基因的浓度。
[0156]
以上所述实施例仅表达了本申请的几种实施方式,其描述较为具体和详细,但并
不能因此而理解为对本申请专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本申请构思的前提下,还可以做出若干变形和改进,例如进行修饰、替代、组合或简化的等效的置换方式,这些都属于本申请的保护范围。因此,本申请专利的保护范围应以所附权利要求为准。
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询

tips


 商标分类
商标分类  商标转让
商标转让 



