细胞样本荧光原位杂交的前处理液、试剂盒及前处理方法与流程
 2021-02-02 13:02:08|
2021-02-02 13:02:08| 300|
300| 起点商标网
起点商标网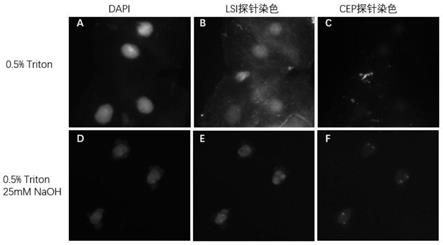
[0001]
本发明属于生物技术领域,具体而言,涉及一种细胞样本荧光原位杂交的前处理液、试剂盒及前处理方法。
背景技术:
[0002]
荧光原位杂交(fish)是20世纪80年代发展起来的一种分子生物学与细胞遗传学相结合的新技术,其原理是利用荧光标记的核酸探针与样本中核酸的互补区域进行杂交,目前已经被广泛应用于遗传病诊断、病毒感染分析、产前诊断、肿瘤遗传学和基因组研究等许多领域。
[0003]
细胞学样本包括血细胞以及各类脱落细胞,包括尿液、宫颈样本、胸腹水、羊水等,其中含有各组织的脱落细胞,被广泛地应用于临床诊断和科学研究。例如,尿液中的脱落细胞可以通过fish,检测染色体的异常,从而进行膀胱癌的诊断与监控。胸水里的脱落细胞可以进行alk基因重组的fish检测,从而指导克挫替尼等靶向药物对肺癌治疗的适用性。羊水脱落细胞可以通过fish检测21号染色体、13号及18号染色体的多倍体,进行唐氏综合征等遗传病的诊断。
[0004]
脱落细胞的fish检测过程,包括以下几个步骤:1)制片:将脱落细胞进行化学固定,并使其附着在载玻片上;2)前处理:通常采用蛋白酶消化,去除一部分蛋白质,从而使dna暴露;3)fish探针杂交。4)洗涤去除未杂交的探针。5)封片、读片。这一流程需要2天的时间。
[0005]
dna位于细胞核里,无法直接用于荧光原位杂交(fish)检测。细胞核内的dna与组蛋白及其他核蛋白结合形成复合物,其外面有核浆(nuclear plasma)、核膜、细胞质、细胞膜,因此荧光探针是无法接触到dna进行杂交的。为了使样本能够用于fish探针的杂交实验,样本必须进行前处理。而前处理是荧光原位杂交实验中目标dna充分暴露且与探针结合的关键步骤之一。前处理的目的,是使整个细胞呈松散状,便于后续的蛋白酶对蛋白质的消化分解。不充分的前处理会导致dna不能够充分暴露,进而导致杂交效果差甚至杂交失败。
[0006]
目前细胞学样本的前处理,包括高温老化、37℃蛋白酶消化等多个复杂步骤,时间长,处理的程度与蛋白酶的浓度和活性有关。不同的蛋白酶批次活性不同,并且长期使用后,活性会逐渐下降,可导致酶消化不完全。
[0007]
因此,仍需要对现有的欲进行荧光原位杂交的细胞样本的前处理进行改进。
技术实现要素:
[0008]
本发明的主要目的在于提供一种细胞样本荧光原位杂交的前处理液、试剂盒及前处理方法,以缩短实验时间,减少由于前处理过程中生物试剂的不稳定导致实验的不确定性。
[0009]
为了实现上述目的,根据本发明的一个方面,提供了一种细胞样本荧光原位杂交的前处理液,前处理液包括:20~110mm的naoh或koh;及0.1~1.0%的非离子型表面活性
剂。
[0010]
进一步地,前处理液包括:25~100mm的naoh或koh;及0.3~1%的非离子型表面活性剂;优选地,前处理液包括0.3~0.5%的非离子型表面活性剂;优选地,非离子型表面活性剂选自triton x-100、np-40、吐温20、吐温40及吐温80中的任意一种。
[0011]
根据本发明的第二个方面,提供了一种细胞样本切片荧光原位杂交检测试剂盒,该试剂盒包括荧光原位杂交的前处理液,该前处理液为上述任一种前处理液。
[0012]
根据本发明的第三个方面,提供了一种细胞样本荧光原位杂交的前处理方法,该前处理方法在20-30℃下进行,且前处理方法包括:将负载细胞样本的载玻片置于上述任一种前处理液中处理3~10min,得到前处理玻片;对前处理玻片依次进行洗涤和脱水,得到待荧光原位杂交玻片。
[0013]
进一步地,将负载细胞样本的载玻片置于前处理液中处理4~6min,得到前处理玻片。
[0014]
进一步地,采用如下任一种中性缓冲液进行洗涤:1x pbs及1xtbs。
[0015]
进一步地,脱水采用乙醇梯度脱水;优选地,乙醇梯度脱水包括:采用体积浓度依次为60~70%、80~85%、95~100%的乙醇处理,每一梯度温育1~2min,自然晾干。
[0016]
进一步地,细胞样本为血细胞样本或脱落细胞样本。
[0017]
进一步地,脱落细胞样本选自如下任一种样本:血液、尿液、宫颈样本、胸水、腹水及羊水。
[0018]
进一步地,负载细胞样本的载玻片通过如下方法制备得到:将细胞样本进行化学固定,并将固定后的细胞样本负载于载玻片上;优选地,化学固定包括采用甲醇、乙醇或丙酮进行脱水固定。
[0019]
应用本发明的技术方案,通过采用上述浓度范围的非离子型表面活性剂,一定程度上破坏细胞膜但又能保持细胞核的基本形态与结构。前处理液中上述浓度范围的碱液对细胞样本进行处理,使细胞中的dna及蛋白质变性,同时与蛋白质结合的核酸也被暴露出来。此外,非离子型表面活性剂也有助于增加细胞表面张力从而促进使整个细胞结构变得松散,便于后续使细胞核中的dna有效地与荧光探针杂交。
附图说明
[0020]
构成本申请的一部分的说明书附图用来提供对本发明的进一步理解,本发明的示意性实施例及其说明用于解释本发明,并不构成对本发明的不当限定。在附图中:
[0021]
图1示出了不同温度下,用100mm naoh,0.5%triton x-100溶液预处理后,正常人血细胞滴片在明场显微镜下的轮廓;其中,a示出的是预处理之前,细胞清晰可见;b示出的是25℃预处理之后,细胞轮廓隐约可见;c示出的是37℃预处理之后,细胞消失,仅有残渣可见;d示出的是65℃预处理之后,细胞完全消失,残渣极少。
[0022]
图2示出了100mm naoh,0.5%triton x-100溶液预处理后,正常人血细胞滴片在荧光显微镜下的fish信号;其中,a示出的是室温(25℃)预处理之后,dapi染色的细胞核清晰可见;b示出的是37℃预处理之后,dapi染色的细胞核消失,仅有残余的深浅不一的荧光背景信号;c示出的是室温(25℃)预处理之后,橘色的基因特异性探针的信号点,在每个细胞中,均有2个清晰可见的信号点;d示出的是室温(25℃)预处理之后,绿色的染色体cep探
针的信号点,在每个细胞中,均有2个清晰可见的信号点。
[0023]
图3示出了室温(25℃)下,不同配方的溶液对尿液脱落细胞进行预处理后,正常人尿液中的脱落细胞滴片在明场显微镜下的轮廓;其中,a示出的是0.5%triton x-100溶液预处理之后,细胞轮廓及细胞核清晰;b示出的是0.5%triton x-100+25mm naoh的溶液预处理之后,细胞轮廓清晰,但细胞核影像减弱;c示出的是0.5%triton x-100+50mm naoh的溶液预处理之后,细胞轮廓清晰,但细胞核影像很弱;d示出的是0.5%triton x-100+100mm naoh的溶液预处理之后,细胞轮廓清晰,但细胞核影像消失。
[0024]
图4示出了正常人尿液脱落细胞滴片经过0.5%triton+25mm naoh溶液预处理后,在荧光显微镜下的fish信号;其中,a示出的是0.5%triton x-100预处理之后,dapi染色的细胞核清晰可见;b示出的是0.5%triton x-100预处理之后,基因特异性探针(lsi)染色背景高,无明显信号点;c示出的是0.5%triton x-100预处理之后,染色体特异性探针(cep)染色背景高,无明显信号点;d示出的是0.5%triton x-100+25mm naoh预处理之后,dapi染色的细胞核清晰可见;e示出的是0.5%triton x-100+25mm naoh预处理之后,基因特异性探针(lsi)染色信号点清晰;f示出的是0.5%triton x-100+25mm naoh预处理之后,染色体特异性探针(cep)染色信号点清晰。
具体实施方式
[0025]
需要说明的是,在不冲突的情况下,本申请中的实施例及实施例中的特征可以相互组合。下面将结合实施例来详细说明本发明。
[0026]
如背景技术所提到的,现有的细胞样本在进行荧光原位杂交之前,都需要经过前处理,使细胞结构松散暴露目标dna。但现有方法包括高温老化、37℃蛋白酶消化等多个复杂步骤,时间长。并且,处理的程度受蛋白酶的浓度和活性影响较大,而不同批次的蛋白酶活性有差异,进而导致前处理的结果稳定性也较差。以目前传统的用于尿液脱落细胞的雅培urovysion fish实验所采用的前处理方法为例,具体包括如下7个步骤:
[0027]
1)溶液预热:将2x ssc在水浴中预热至73
±
1℃;
[0028]
2)老化:将玻片浸入温度为73
±
1℃的2x ssc,温育2-2.5min;
[0029]
3)酶消化:将玻片浸入温度为37
±
1℃的含有胃蛋白酶的酸性溶液,温育10
±
1min;
[0030]
4)洗涤:将玻片浸入室温下的1x pbs,温育5
±
1min;
[0031]
5)甲醛固定:将玻片浸入室温下的1%甲醛中,温育5
±
1min;
[0032]
6)洗涤:将玻片浸入室温下的1x pbs,温育5
±
1min;
[0033]
7)脱水:将玻片浸入室温下的70%、85%、100%乙醇,每一次温育1min,室温晾干。
[0034]
总体而言,该方法需要在73℃、37℃及室温多个不同温度下进行操作,且步骤繁多。
[0035]
为了改善现有方法中前处理时间长、步骤繁琐的问题,本申请通过多种改进尝试,比如调整老化步骤、采用不同类型的酶及缓冲液,调整甲醛固定步骤等等,最终提供了相应的改进方案。
[0036]
在一种典型的实施方式中,提供了一种细胞样本荧光原位杂交的前处理液,该前处理液的成分包括:20~110mm的naoh或koh;及0.1~1.0%的非离子型表面活性剂。通过采
用上述浓度范围的非离子型表面活性剂,一定程度上破坏细胞膜但又能保持细胞核的基本形态与结构。上述浓度范围的碱液对细胞样本进行处理,使细胞中的dna及蛋白质变性,同时与蛋白质结合的核酸也被暴露出来。此外,非离子型表面活性剂也有助于增加细胞表面张力从而促进使整个细胞结构变得松散,便于后续使细胞核中的dna有效地与荧光探针杂交。
[0037]
上述前处理液中各组分的浓度可以在上述范围内进一步优化选择,以便获得更好的处理效果。比如,在室温下,碱液的浓度从15mm~150mm,非离子型表面活性剂采用triton x-100时,从0.3%~0.8%的体积浓度范围,均能检测到适当的荧光信号,尽管在15mm和150mm下,部分信号不如在20~110mm下清晰。因此,碱液的浓度优选是20~110mm之间的任意浓度范围或任意浓度,比如可以是20~100mm、25~100mm、30~100mm、35~100mm、40~100mm、45~100mm、50~100mm、55~100mm、60~100mm、65~100mm、70~100mm、75~100mm、80~100mm、85~100mm、90~100mm或100~110mm,或者是25~75mm,或者是50~105mm等;也可以20mm、25mm、30mm、35mm、40mm、45mm、50mm、55mm、60mm、65mm、70mm、75mm、80mm、85mm、90mm、100mm或110mm。非离子型表面活性剂的体积浓度可以是0.1~0.5%、0.3~0.5%、0.5~0.8%或0.5~1.0%等,也可以是0.1%、0.2%、0.3%、0.4%、0.5%、0.6%、0.7%、0.8%、0.9%或1.0%。
[0038]
在一种优选的实施例中,上述前处理液包括:25~105mm的naoh或koh;及0.3~1%的非离子型表面活性剂;更优选地,前处理液包括0.3~0.5%的非离子型表面活性剂;更优选地,非离子型表面活性剂选自triton x-100、np-40、吐温20、吐温40及吐温80中的任意一种。
[0039]
非离子型表面活性剂能够增加细胞表面张力,促进细胞结构松散的作用,因而,上述几种均适用于本申请。其中,np-40及triton x-100的效果最优。在一种更优选的实施例中,前处理液包括25~100mm的naoh或koh,0.4~0.6%的np-40及triton x-100。在某些优选的实施例中,前处理液包括:25~100mm的naoh和0.4%体积的np-40。在某些优选的实施例中,前处理液包括:25~100mm的naoh和0.5%体积的np-40。在某些优选的实施例中,前处理液包括:25~100mm的naoh和0.6%体积的np-40。在某些优选的实施例中,前处理液包括:25~100mm的naoh和0.6%体积的triton x-100。在某些优选的实施例中,前处理液包括:25~100mm的naoh和0.4%体积的triton x-100。在某些优选的实施例中,前处理液包括:25~100mm的naoh和0.5%体积的triton x-100。
[0040]
在第二种典型的实施方式中,提供了一种细胞样本切片荧光原位杂交检测试剂盒,该试剂盒包括前处理液,前处理液为上述任一种。采用含有该前处理液的试剂盒对待进行荧光原位杂交的细胞样本进行前处理,不仅能够保持细胞的形态结构,利于杂交进行,而且处理时间短,成本低,处理效果稳定性好。
[0041]
在第三种典型的实施方式中,提供了一种细胞样本荧光原位杂交的前处理方法,该前处理方法在20-30℃下进行,且该前处理方法包括:将负载细胞样本的载玻片置于上述前处理液中处理3~10min,得到前处理玻片;对前处理玻片依次进行洗涤和脱水,得到待荧光原位杂交玻片。
[0042]
该前处理方法,通过采用含有碱液和非离子型表面活性剂的上述前处理液进行细胞预处理,能够在室温下使细胞在短时间内使整个细胞结构变得松散,同时与蛋白结合的
核酸也被暴露和释放出来,便于后续有效地与荧光探针杂交。整个前处理过程仅需要在室温下进行即可,且整个过程时长10多分钟,大幅度缩短了实验时间。且无需蛋白酶进行预处理,大幅度降低了实验成本,并且也减少了由于生物试剂不稳定带来的实验的不确定性。
[0043]
上述前处理方法,将负载细胞样本的载玻片置于前处理液中处理的时间可以根据细胞来源及类型的不同,进行合理调整,比如可以是3~5min,也可以是4~8min或4~6min,还可以是5~10min或5~9min等,具体地,可以是3min、4min、5min、6min、7min、8min、9min或10min。在一种优选的实施例中,前处理的时间是4~6min。
[0044]
采用上述前处理液进行处理后,后续的洗涤及脱水的步骤可以采用现有的洗涤和脱水方式。在本申请中,包括但不仅限于采用如下任一种(ph7.0-7.5的)中性缓冲液进行洗涤:1x pbs(phosphate buffered saline)及1xtbs(tris buffered saline)。
[0045]
上述脱水优选采用乙醇梯度脱水;更优选地,乙醇梯度脱水包括:采用体积浓度依次为60~70%、80~85%、95~100%的乙醇处理,每一梯度温育1~2min,优选为20~60s,自然晾干。在一种更具体的实施例中,依次采用体积浓度为70%、85%和100%的乙醇进行梯度脱水,每一梯度温育20-60s。
[0046]
上述前处理方法中,细胞样本为非组织样本、非石蜡包埋切片样本,指体液中直接获得的细胞样本,包括但不仅限于血细胞样本或脱落细胞样本。优选地,脱落细胞样本选自如下任一种样本:血液、尿液、宫颈样本(包括宫颈拭子或宫颈刷刮取的样本)、胸水、腹水及羊水。
[0047]
本申请的前处理方法,在进行上述前处理之前,还包括对从体液中获得的细胞进行固定和负载到载玻片上的制片步骤。具体地,可根据细胞类型和细胞来源的不同,制片步骤可能略有不同。在一种优选的实施例中,负载细胞样本的载玻片通过如下方法制备得到:将细胞样本进行化学固定,并将固定后的细胞样本负载于载玻片上;优选地,化学固定包括采用甲醇、乙醇或丙酮进行脱水固定(本申请中不包括福尔马林固定的样本)。
[0048]
下面将结合具体的实施例,对本发明进一步阐述。应理解,这些实施例仅用于本发明而不用于限制本发明的范围。实施例中未注明具体条件的实验方法,按照本领域技术人员熟知的常规条件,或者按照制造厂商建议的条件。
[0049]
实施例1
[0050]
用正常人血液进行细胞学制片后,按照本发明的方法(如表1所展示的步骤)进行预处理,本例中除了室温25℃温育外,还测试了室温37℃、65℃温育后的结果。预处理之后,在明场显微镜下观察是否还有细胞轮廓。然后进行fish杂交、及dapi染色。在荧光显微镜下观察是否有dapi染色的细胞核,以及橘色的基因特异性探针、绿色的染色体cep探针的信号点。
[0051]
检测结果如表1及图1和图2所示,其中,图1示出了不同温度下,用100mm naoh,0.5%triton x-100溶液预处理后,正常人血细胞滴片在明场显微镜下的轮廓;图2示出了100mm naoh,0.5%triton x-100溶液预处理后,正常人血细胞滴片在荧光显微镜下的fish信号。
[0052]
图1中,a示出的是预处理之前,细胞清晰可见;b示出的是25℃预处理之后,细胞轮廓隐约可见;c示出的是37℃预处理之后,细胞消失,仅有残渣可见;d示出的是65℃预处理之后,细胞完全消失,残渣极少。
[0053]
图2中,a示出的是室温即25℃预处理之后,dapi染色的细胞核清晰可见;b示出的是37℃预处理之后,dapi染色的细胞核消失,仅有残余的深浅不一的荧光背景信号;c示出的是室温(25℃)预处理之后,橘色的基因特异性探针的信号点,在每个细胞中,均有2个清晰可见的信号点;d示出的是室温(25℃)预处理之后,绿色的染色体cep探针的信号点,在每个细胞中,均有2个清晰可见的信号点。
[0054]
表1:
[0055][0056]
实施例2
[0057]
实施例2采用与实施例1相同的血液细胞样本进行荧光原位杂交,除了按照表2所展示的步骤进行预处理外,尝试了更多的实验条件。检测结果见表2。
[0058]
表2:
[0059]
[0060]
[0061][0062]
由表2可以看出,采用含有15~150mm的碱液与0.1%~1%的非离子型表面活性剂的前处理液处理血细胞后,均能检测到fish信号。其中,含有100mm koh与0.5%np-40的前处理液处理后的血液细胞的荧光原位检测效果,与实施例1含有100mm naoh与0.5%triton x-100的前处理液的处理效果相当,在25℃下的荧光图像都比较清晰。其次是含15mm naoh与0.8%triton x-100的前处理液,及含150mm naoh与0.3%triton x-100的前处理液,能检测到fish信号,但信号效果一般。再次是:100mm koh与1%的tween 20,与0.1%的tween 80的前处理液信号比较弱。
[0063]
实施例3
[0064]
按照常规方法,用正常人的尿液中的脱落细胞进行制片。制片后,按照本发明的方法(表3所示的)进行预处理。本例中测试了不同的处理液配方(如下表3所示)。预处理之后进行明场显微镜的观察。然后按照常规方法进行fish杂交、dapi染色,在荧光显微镜下观
察。
[0065]
表3:
[0066][0067]
检测结果如表3及图3和图4所示,其中,图3示出了室温下,不同配方的溶液对尿液脱落细胞进行预处理后,正常人尿液中的脱落细胞滴片在明场显微镜下的轮廓;图4示出了正常人尿液脱落细胞滴片经过0.5%triton+25mm naoh溶液预处理后,在荧光显微镜下的fish信号。
[0068]
图3中,a示出的是0.5%triton x-100溶液预处理之后,细胞轮廓及细胞核清晰;b示出的是0.5%triton x-100+25mm naoh的溶液预处理之后,细胞轮廓清晰,但细胞核影像减弱;c示出的是0.5%triton x-100+50mm naoh的溶液预处理之后,细胞轮廓清晰,但细胞核影像很弱;d示出的是0.5%triton x-100+100mm naoh的溶液预处理之后,细胞轮廓清晰,但细胞核影像消失。
[0069]
图4中,a示出的是0.5%triton x-100预处理之后,dapi染色的细胞核清晰可见;b示出的是0.5%triton x-100预处理之后,基因特异性探针(lsi)染色背景高,无明显信号点;c示出的是0.5%triton x-100预处理之后,染色体特异性探针(cep)染色背景高,无明显信号点;d示出的是0.5%triton x-100+25mm naoh预处理之后,dapi染色的细胞核清晰可见;e示出的是0.5%triton x-100+25mm naoh预处理之后,基因特异性探针(lsi)染色信号点清晰;f示出的是0.5%triton x-100+25mm naoh预处理之后,染色体特异性探针(cep)染色信号点清晰。
[0070]
从以上的描述中,可以看出,本发明上述的实施例实现了如下技术效果:本申请中
人尿液脱落细胞未进行酶消化,用0.5%triton x-100处理后,dapi染色下,可见细胞核边界清晰完整。但是在橘红色与绿色通道无明显的信号点,仅有背景荧光。而采用改进后的无酶消化的快速预处理方法,dapi染色下,可见细胞核边界模糊,显示出处理液可使细胞核一定程度的松散。在橘红色与绿色通道下,每个细胞有2个清晰的信号点。此样本为正常人的尿液中的脱落细胞样本,均为2倍体。由此可见,本发明的前处理液及前处理方法满足要求,且结果符合预期。而且,本发明的方法可以用于尿液脱落细胞、血液细胞等体液中直接获得的细胞样本的荧光原位杂交的前处理中,速度快,效果好,节约成本。
[0071]
以上所述仅为本发明的优选实施例而已,并不用于限制本发明,对于本领域的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询

tips


 商标分类
商标分类  商标转让
商标转让 



