结合CD39的抗体及其用途的制作方法
 2021-02-02 13:02:09|
2021-02-02 13:02:09| 295|
295| 起点商标网
起点商标网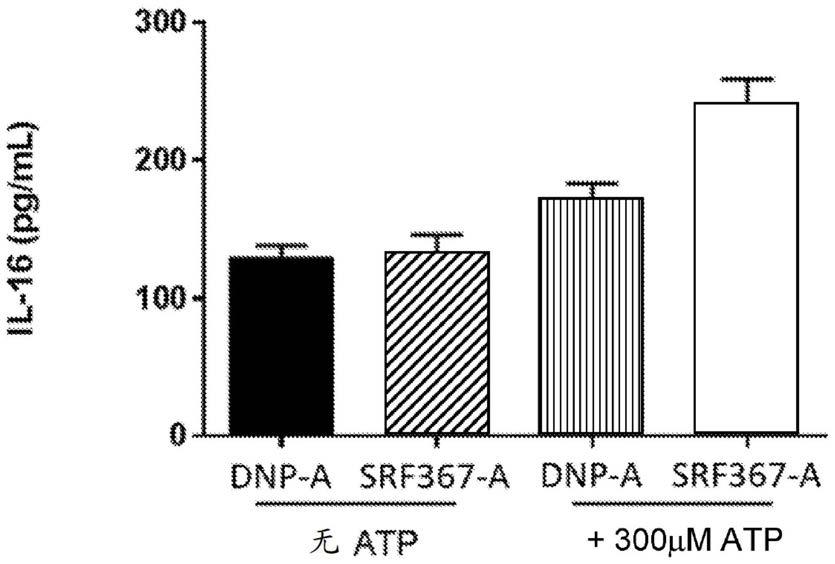
结合cd39的抗体及其用途
[0001]
本申请要求2018年3月14日提交的美国临时申请第62/642,938号和2019年2月8日提交的美国临时申请第62/803,235号的优先权的权益,并所述美国临时申请通过引用整体并入。序列表
[0002]
本申请包含以ascii格式以电子方式提交的序列表,其由此通过引用整体并入。所述ascii副本创建于2019年3月12日,名称为01219-0003-00pct_st25.txt,大小为178,244字节。发明背景
[0003]
癌症能够通过颠覆免疫抑制途径(以防止恶性细胞被识别为危险的或外来的)来生长。这种机制防止癌症被免疫系统消除,并使疾病从非常早期发展到致命状态。免疫疗法是新开发的干预措施,其通过直接刺激排斥型过程或阻断抑制性途径来改变患者的免疫系统以对抗癌症。由胞外核苷酸酶cd39和cd73产生的细胞外腺苷是新公认的干扰抗肿瘤免疫响应的“免疫检查点介质”。腺苷是肿瘤微环境(tme)中的免疫调节代谢产物。在一些癌症中,细胞外腺苷积累并随后抑制免疫细胞(包括t细胞、树突细胞(dc)和nk细胞)的功能,从而有助于抗肿瘤免疫的抑制和支持肿瘤生长。
[0004]
胞外核苷酸酶cd39水解细胞外三磷酸腺苷(atp)和二磷酸腺苷(adp),产生腺苷,所述腺苷与腺苷受体结合,并抑制免疫细胞诸如t细胞和天然杀伤(nk)细胞,从而抑制免疫系统。cd39的过表达与某些类型的癌症患者的不良预后相关。在tme内,腺苷途径是指atp向腺苷的细胞外转化,以及腺苷通过免疫细胞上的a2a/a2b腺苷受体的信号传导。在正常条件下,cd39维持免疫抑制性腺苷与免疫刺激性atp的细胞外水平的平衡。在健康组织中,atp在细胞外环境中几乎检测不到,因为atp被cd39快速分解生成腺苷一磷酸或amp,然后所述腺苷一磷酸被cd73转化为腺苷。在包括癌症在内的细胞应激条件下,细胞外atp水平显著升高,但由于atp被迅速分解,导致导致atp水平低,加上腺苷水平高,免疫系统对肿瘤的识别以及因此针对肿瘤的免疫响应受到阻碍。
[0005]
对于新型癌症疗法的开发,仍然存在未满足的需求。还需要与现有疗法和治疗方案的新颖组合来更有效地对抗各种癌症。
技术实现要素:
[0006]
本文公开了抗体或其抗原结合部分,其以高亲和力和特异性结合至并拮抗人cd39(分化簇39)。所公开的抗cd39抗体是cd39的非竞争性变构抑制剂。在一些实施方案中,抗cd39抗体允许底物(atp)结合,但阻止其转化为adp和/或腺苷,从而维持或提高肿瘤微环境(tme)中的atp水平和/或防止tme中不期望的腺苷水平。还提供了编码抗体分子的核酸分子、用于制备抗体分子的表达载体、宿主细胞和方法。还提供了包含抗体分子的药物组合物。本文公开的抗cd39抗体或其抗原结合部分可用于(单独或与其它治疗剂或程序组合施用)治疗、预防和/或诊断病症(包括免疫病症和癌症)。因此,本文公开了使用抗cd39抗体分子治疗和/或诊断各种病症(包括癌症和免疫病症)的组合物和方法。
[0007]
在一个方面,本公开提供了结合至并拮抗人cd39的抗cd39抗体(包括抗体或其抗原结合部分),其中抗体或其抗原结合部分表现出以下特性中的一种或多种:(a)与重组人cd39和/或膜结合的人cd39结合;(b)以小于10nm的平衡解离常数(k
d
)与人cd39结合;(c)抑制或降低人cd39的酶活性;(d)抑制或减少人cd39将细胞外三磷酸腺苷(eatp)或细胞外二磷酸腺苷(eadp)转化为细胞外一磷酸腺苷(eamp);(e)增加或提高eatp水平;(f)降低或减少细胞外腺苷水平;(g)维持、增加或提高eatp的免疫刺激水平;(h)增加或提高淋巴细胞的增殖;(i)增加或提高一种或多种树突细胞活化标志物的表达;(j)增加或提高一种或多种细胞因子从树突细胞的分泌;(k)增加或提高肿瘤中的巨噬细胞浸润;(l)增加或提高巨噬细胞吸引趋化因子的分泌;(m)拮抗组织的肿瘤微环境中的人cd39;(n)与食蟹猴cd39交叉反应;以及(o)(a)至(n)中任一项的组合。
[0008]
在一些实施方案中,提供了分离的抗cd39抗体,其包含以下序列、由以下序列组成或基本上由以下序列组成:i)分别包含seq id no:1、2和3的重链cdr1、cdr2和cdr3序列,以及分别包含seq id no:11、12和13的轻链cdr1、cdr2和cdr3序列;或者ii)分别包含seq id no:4、5和6的重链cdr1、cdr2和cdr3序列,以及分别包含seq id no:15、16和17的轻链cdr1、cdr2和cdr3序列;或者iii)与seq id no:7的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的可变重链,以及与seq id no:7的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的可变轻链;或者iv)与seq id no:9的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的重链,以及与seq id no:19的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的轻链;或者v)与seq id no:21的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的重链,以及与seq id no:19的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的轻链;或者vi)与seq id no:23的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的重链,以及与seq id no:19的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的轻链;或者vii)与seq id no:25的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的重链,以及与seq id no:19的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的轻链;或者
viii)分别包含seq id no:27、28和29的重链cdr1、cdr2和cdr3序列,以及分别包含seq id no:37、38和39的轻链cdr1、cdr2和cdr3序列;或者ix)分别包含seq id no:30、31和32的重链cdr1、cdr2和cdr3序列,以及分别包含seq id no:40、41和42的轻链cdr1、cdr2和cdr3序列;或者x)与seq id no:33的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的可变重链,以及与seq id no:43的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的可变轻链;或者xi)与seq id no:35的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的重链,以及与seq id no:45的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的轻链;或者xii)与seq id no:47的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的重链,以及与seq id no:45的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的轻链;或者xiii)与seq id no:49的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的重链,以及与seq id no:45的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的轻链;或者xiv)与seq id no:51的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的重链,以及与seq id no:45的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的轻链;或者xv)分别包含seq id no:53、54和55的重链cdr1、cdr2和cdr3序列,以及分别包含seq id no:63、64和65的轻链cdr1、cdr2和cdr3序列;或者xvi)分别包含seq id no:56、57和58的重链cdr1、cdr2和cdr3序列,以及分别包含seq id no:66、67和68的轻链cdr1、cdr2和cdr3序列;或者xvii)与seq id no:59的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的可变重链,以及与seq id no:69的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的可变轻链;或者xviii)与seq id no:61的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的重链,以及与seq id no:71的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的轻链;或者xix)与seq id no:73的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的重链,以及与seq id no:71的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的轻链;或者xx)与seq id no:75的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的重链,以及与seq id no:71的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的轻链;或者xxi)与seq id no:77的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的重链,以及与seq id no:71的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的轻链;或者
xxii)分别包含seq id no:79、80和81的重链cdr1、cdr2和cdr3序列,以及分别包含seq id no:89、90和91的轻链cdr1、cdr2和cdr3序列;或者xxiii)分别包含seq id no:82、83和84的重链cdr1、cdr2和cdr3序列,以及分别包含seq id no:92、93和94的轻链cdr1、cdr2和cdr3序列;或者xxiv)与seq id no:85的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的可变重链,以及与seq id no:95的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的可变轻链;或者xxv)与seq id no:87的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的重链,以及与seq id no:97的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的轻链;或者xxvi)与seq id no:99的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的重链,以及与seq id no:97的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的轻链;或者xxvii)与seq id no:101的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的重链,以及与seq id no:97的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的轻链;或者xxviii)与seq id no:103的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的重链,以及与seq id no:97的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的轻链;或者xxix)分别包含seq id no:105、106和107的重链cdr1、cdr2和cdr3序列,以及分别包含seq id no:115、116和117的轻链cdr1、cdr2和cdr3序列;或者xxx)分别包含seq id no:108、109、110的重链cdr1、cdr2和cdr3序列,以及分别包含seq id no:118、119和120的轻链cdr1、cdr2和cdr3序列;或者xxxi)与seq id no:111的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的可变重链,以及与seq id no:121的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的可变轻链;或者xxxii)与seq id no:113的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的重链,以及与seq id no:123的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的轻链;或者xxxiii)与seq id no:125的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的重链,以及与seq id no:123的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的轻链;或者xxxiv)与seq id no:127的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的重链,以及与seq id no:123的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的轻链;或者xxxv)与seq id no:129的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的重链,以及与seq id no:123的氨基酸序列具有至
少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的轻链。
[0009]
在一些实施方案中,抗cd39抗体包含段落[0008]中描述的结构特征和段落[0007]中描述的一个或多个功能特征。在一些实施方案中,抗cd39抗体或其抗原结合片段与段落[0007]或[0008]中描述的参考抗体结合基本上相同的表位。
[0010]
在一些实施方案中,本公开提供了抗cd39抗体或其抗原结合部分,其包含分别包含seq id no:27、28和29的重链cdr1、cdr2和cdr3序列以及分别包含seq id no:37、38和39的轻链cdr1、cdr2和cdr3序列,或由所述重链cdr1、cdr2和cdr3序列以及所述轻链cdr1、cdr2和cdr3序列组成。
[0011]
在一些实施方案中,本公开提供了抗cd39抗体或其抗原结合部分,其包含分别包含seq id no:30、31和32的重链cdr1、cdr2和cdr3序列以及分别包含seq id no:40、41和42的轻链cdr1、cdr2和cdr3序列,或由所述重链cdr1、cdr2和cdr3序列以及所述轻链cdr1、cdr2和cdr3序列组成。
[0012]
在一些实施方案中,本公开提供了抗cd39抗体或其抗原结合部分,其包含以下序列或由以下序列组成:与seq id no:33的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的可变重链和与seq id no:43的氨基酸具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的可变轻链。
[0013]
在一些实施方案中,本公开提供了抗cd39抗体或其抗原结合部分,其包含以下序列或由以下序列组成:与seq id no:49的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的重链和与seq id no:45的氨基酸具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的轻链。
[0014]
在一些实施方案中,本公开提供了结合至并拮抗人cd39的抗cd39抗体,其包含以下序列或由以下序列组成:分别包含seq id no:27、28和29的重链cdr1、cdr2和cdr3序列,以及分别包含seq id no:37、38和39的轻链cdr1、cdr2和cdr3序列;或分别包含seq id no:4、5和6的重链cdr1、cdr2和cdr3序列,以及分别包含seq id no:15、16和17的轻链cdr1、cdr2和cdr3序列,其中所述抗体:a.增加淋巴细胞的增殖,任选地其中所述淋巴细胞是肿瘤浸润性淋巴细胞或cd4+ t细胞,和/或b.提高一种或多种树突细胞活化标志物的表达,任选地其中所述树突细胞活化标志物是cd86、hla-dr,或cd86和hla-dr两者;和/或c.提高一种或多种细胞因子从树突细胞的分泌,任选地其中细胞因子是il-16、il-12/il-23p40、vegfa或其任何组合;和/或d.其中人cd39的拮抗作用发生在肿瘤微环境中,任选地其中所述拮抗作用是非竞争性的和/或变构的;和/或e.其中抗体或其抗原结合部分与食蟹猴cd39交叉反应。
[0015]
在一些实施方案中,抗cd39抗体或其抗原结合部分包含igg1、igg2、igg3、igg4、igm、iga1、iga2、ad igd或ige抗体。
[0016]
在一些实施方案中,抗cd39抗体或其抗原结合部分包含野生型或突变型igg1或igg4抗体。在一些实施方案中,抗cd39抗体或其抗原结合部分包含突变igg4重链恒定区,其
中突变i)降低igg4形成半分子的能力;和/或ii)使与fc受体的结合降至最低。
[0017]
在一些实施方案中,抗cd39抗体或其抗原结合部分包含突变igg4重链恒定区,该恒定区包含s228p突变。在一些实施方案中,抗cd39抗体或其抗原结合部分包含突变igg4重链恒定区,该恒定区包含s228p和l235e突变。
[0018]
在一些实施方案中,抗cd39抗体或其抗原结合部分包含seq id no:3中所示的重链cdr3序列。在一些实施方案中,抗cd39抗体或其抗原结合部分与参考抗体或其抗原结合部分结合基本上相同的表位,所述参考抗体或其抗原结合部分包含seq id no:3中所示的重链cdr3序列。
[0019]
先前已经描述了在抗-pd1/抗-pd-l1疗法的受试者中cd39增加。参见,例如,hotson/luke等人,oral presentation at society for immunotherapy of cancer(sitc)32nd annual meeting(2017)[于2019年3月13日检索的]。检索自互联网:<url:https://www.corvuspharma.com/file.cfm/23/docs/sitc_2017_slides.pdf>。在一些实施方案中,提供了治疗对抗-pd1或抗-pd-l1疗法有抗性的人受试者的方法,其包括施用本文所述的抗-cd39抗体中的任一种。对抗-pd1或抗-pd-l1具有抗性的受试者包括其从抗-pd1或抗-pd-l1疗法的获益与非抗性对照相比减少至少一个标准偏差(持续超过3个月)的受试者。
[0020]
一方面,本公开提供了与人重组cd39和/或膜结合的人cd39结合的抗体或其抗原结合部分。一方面,本公开提供了以小于10nm的平衡解离常数(k
d
)与人cd39结合的抗体或其抗原结合部分。一方面,本公开提供了抑制或降低人cd39酶活性的抗体或其抗原结合部分。在一个方面,本公开提供了抗体或其抗原结合部分,其以小于10nm的平衡解离常数(k
d
)与人重组cd39和/或膜结合的人cd39结合,并抑制或降低人cd39的酶活性。在一些方面,人cd39的酶活性是eatp或eadp的水解。
[0021]
在一些方面,本公开的抗体或抗原结合部分抑制或减少eatp或eadp向eamp的转化。在一些方面,抗体或其抗原结合部分以小于10nm的平衡解离常数(k
d
)与人重组cd39和/或膜结合的人cd39结合,并抑制或减少eatp或eadp向eamp的转化。
[0022]
在一些方面,本公开的抗体或抗原结合部分增加或提高eatp水平。在一些方面,抗体或其抗原结合部分以小于10nm的平衡解离常数(k
d
)与人重组cd39和/或膜结合的人cd39结合,并增加或提高eatp水平。
[0023]
在一些方面,本公开的抗体或抗原结合部分降低或减少细胞外腺苷水平。在一些方面,抗体或其抗原结合部分以小于10nm的平衡解离常数(k
d
)与人重组cd39和/或膜结合的人cd39结合,并降低或减少细胞外腺苷水平。评估腺苷水平的方法在本领域中是已知的,例如,在blay等人,1997,cancer research 57:2602-2605的材料和方法(通过引用整体并入本文)中是已知的。
[0024]
在一些方面,本公开的抗体或抗原结合部分维持、增加或提高eatp的免疫刺激水平。在一些方面,抗体或其抗原结合部分以小于10nm的平衡解离常数(k
d
)与人重组cd39和/或膜结合的人cd39结合,并维持、增加或提高eatp的免疫刺激水平。
[0025]
在一些方面,本公开的抗体或抗原结合部分增加淋巴细胞的增殖。在一些方面,抗体或其抗原结合部分以小于10nm的平衡解离常数(k
d
)与人重组cd39和/或膜结合的人cd39结合,并增加淋巴细胞的增殖。在一些方面,抗体或其抗原结合部分以小于10nm的平衡解离
常数(k
d
)与人重组cd39和/或膜结合的人cd39结合,抑制或降低人cd39的酶活性,并增加淋巴细胞的增殖。在一些方面,抗体或其抗原结合部分以小于10nm的平衡解离常数(k
d
)与人重组cd39和/或膜结合的人cd39结合,维持、增加或提高eatp水平,并增加淋巴细胞的增殖。在一些方面,抗体或其抗原结合部分以小于10nm的平衡解离常数(k
d
)与人重组cd39和/或膜结合的人cd39的结合,维持、增加或提高eatp水平,和/或降低或减少腺苷水平,并增加淋巴细胞的增殖。在一些方面,淋巴细胞是肿瘤浸润性淋巴细胞。在一些方面,淋巴细胞是t细胞。在一些方面,t细胞是cd4+ t细胞。
[0026]
在一些方面,本公开的抗体或抗原结合部分增加或提高一种或多种树突细胞活化标志物的表达和/或增加或提高一种或多种细胞因子从树突细胞的分泌。在一些方面,抗体或其抗原结合部分以小于10nm的平衡解离常数(k
d
)与人重组cd39和/或膜结合的人cd39结合,并增加或提高一种或多种树突细胞活化标志物的表达和/或增加或提高一种或多种细胞因子从树突细胞的分泌。在一些方面,抗体或其抗原结合部分以小于10nm的平衡解离常数(k
d
)与人重组cd39和/或膜结合的人cd39结合,抑制或降低人cd39的酶活性,并增加或提高一种或多种树突细胞活化标志物的表达和/或增加或提高一种或多种细胞因子从树突细胞的分泌。在一些方面,抗体或其抗原结合部分以小于10nm的平衡解离常数(k
d
)与人重组cd39和/或膜结合的人cd39结合,维持、增加或提高eatp水平,并增加或提高一种或多种树突细胞活化标志物的表达和/或增加或提高一种或多种细胞因子从树突细胞的分泌。在一些方面,抗体或其抗原结合部分以小于10nm的平衡解离常数(k
d
)与人重组cd39和/或膜结合的人cd39结合,维持、增加或提高eatp水平,和/或降低或减少腺苷水平,并增加或提高一种或多种树突细胞活化标志物的表达和/或增加或提高一种或多种细胞因子从树突细胞的分泌。在一些方面,一种或多种树突细胞活化标志物是cd86、hla-dr或其组合。在一些方面,一种或多种细胞因子是il-16、il-12/il-23p40、vegfa或其任何组合。
[0027]
在一些方面,本公开的抗体或抗原结合部分在组织的肿瘤微环境中引起人cd39的拮抗作用。
[0028]
在一些方面,本公开的抗体或抗原结合部分与食蟹猴cd39和/或小鼠cd39交叉反应。
[0029]
在一些方面,本公开的抗体或抗原结合部分选自igg1、igg2、和igg3、igg4、和igm、和iga1、和iga2、和igd、和ige抗体。在一些方面,本公开的抗体或抗原结合部分是igg1抗体或igg4抗体。在一些方面,本公开的抗体或抗原结合部分包含野生型igg1重链恒定区。在一些方面,本公开的抗体或抗原结合部分包含野生型igg4重链恒定区。在一些方面,本公开的抗体或抗原结合部分包含含有至少一个突变的fc结构域。在一些方面,本公开的抗体或抗原结合部分包含突变igg1重链恒定区。在一些方面,本公开的抗体或抗原结合部分包含突变igg4重链恒定区。在一些方面,本公开的抗体或抗原结合部分包含突变igg4重链恒定区,其中根据eu编号,突变igg4重链恒定区包含取代s228p、l235e、l235a中的任一种或其组合。在一些方面,本公开的抗体或抗原结合部分包含突变igg4重链恒定区,其中突变igg4重链恒定区包含s228p取代。在一些方面,本公开的抗体或抗原结合部分包含突变igg4重链恒定区,其中突变igg4重链恒定区包含s228p和l235e取代。在一些方面,本公开的抗体或抗原结合部分包含突变igg4重链恒定区,其中突变igg4重链恒定区包含s228p和l235a取代。
[0030]
在一些方面,本公开的抗体或抗原结合部分包含seq id no:3中所示的重链cdr3
序列。在一些方面,本公开的抗体或抗原结合部分与参考抗体或其抗原结合部分结合基本上相同的表位,所述参考抗体或其抗原结合部分包含seq id no:3中所示的重链cdr3序列。在一些方面,本公开的抗体或抗原结合部分与由参考抗体或其抗原结合部分结合的氨基酸残基中的至少一个结合,所述参考抗体或其抗原结合部分包含seq id no:3中所示的重链cdr3序列。在一些方面,本公开的抗体或抗原结合部分,其中由抗体结合的表位的突变抑制、减少或阻断与抗体以及参考抗体或其抗原结合部分的结合,所述参考抗体或其抗原结合部分包含seq id no:3中所示的重链cdr3序列。
[0031]
在一些方面,本公开的抗体或抗原结合部分与参考抗体或其抗原结合部分结合基本上相同的表位,所述参考抗体或其抗原结合部分包含分别示于seq id no:27、28和29的重链cdr1、cdr2和cdr3序列,以及分别示于seq id no:37、38和39的轻链cdr1、cdr2和cdr3序列。在一些方面,本公开的抗体或抗原结合部分与由参考抗体或其抗原结合部分结合的氨基酸残基中的至少一个结合,所述参考抗体或其抗原结合部分包含分别示于seq id no:27、28和29的重链cdr1、cdr2和cdr3序列,以及分别示于seq id no:37、38和39的轻链cdr1、cdr2和cdr3序列。在一些实施方案中,由本公开的抗体或抗原结合部分结合的表位的突变抑制、减少或阻断与抗体及参考抗体或其抗原结合部分的结合,所述参考抗体或抗原结合部分包含分别示于seq id no:27、28和29的重链cdr1、cdr2和cdr3序列,以及分别示于seq id no:37、38和39的轻链cdr1、cdr2和cdr3序列。
[0032]
在一些实施方案中,本公开的抗体或其抗原结合部分与参考抗体或其抗原结合部分结合基本上相同的表位,所述参考抗体或其抗原结合部分包含分别示于seq id no:30、31和32的重链cdr1、cdr2和cdr3序列,以及分别示于seq id no:40、41和42的轻链cdr1、cdr2和cdr3序列。
[0033]
在一些实施方案中,本公开的抗体或其抗原结合部分与由参考抗体或其抗原结合部分结合的氨基酸残基中的至少一个结合,所述参考抗体或其抗原结合部分包含分别示于seq id no:30、31和32的重链cdr1、cdr2和cdr3序列,以及分别示于seq id no:40、41和42的轻链cdr1、cdr2和cdr3序列。
[0034]
在一些实施方案中,由本公开的抗体或其抗原结合部分结合的表位的突变抑制、减少或阻断了与抗体或其抗原结合部分以及参考抗体或其抗原结合部分的结合,所述参考抗体或其抗原结合部分包含分别示于seq id no:30、31和32的重链cdr1、cdr2和cdr3序列,以及分别示于seq id no:40、41和42的轻链cdr1、cdr2和cdr3序列。
[0035]
在一些方面,本公开的抗体或抗原结合部分结合至并拮抗人cd39,并且包含选自由以下组成的组的重链和轻链cdr:(i)分别示于seq id no:27、28和29的重链cdr1、cdr2和cdr3序列,以及分别示于seq id no:37、38和39的轻链cdr1、cdr2和cdr3序列;(ii)分别示于seq id no:1、2和3的重链cdr1、cdr2和cdr3序列,以及分别示于seq id no:11、12和13的轻链cdr1、cdr2和cdr3序列;(iii)分别示于seq id no:53、54和55的重链cdr1、cdr2和cdr3序列,以及分别示于seq id no:63、64和65的轻链cdr1、cdr2和cdr3序列;(iv)分别示于seq id no:79、80和81的重链cdr1、cdr2和cdr3序列,以及分别示于seq id no:89、90和91的轻链cdr1、cdr2和cdr3序列;和
(v)分别示于seq id no:105、106和107的重链cdr1、cdr2和cdr3序列,以及分别示于seq id no:115、116和117的轻链cdr1、cdr2和cdr3序列。
[0036]
在一些实施方案中,本公开的抗体或其抗原结合部分结合至并拮抗人cd39,并且包含重链和轻链cdr,其中重链cdr1、cdr2和cdr3序列分别示于seq id no:27、28和29中,轻链cdr1、cdr2和cdr3序列分别示于seq id no:37、38和39中。
[0037]
在一些实施方案中,本公开的抗体或其抗原结合部分结合至并拮抗人cd39,并且包含选自由以下组成的组的重链和轻链cdr:(i)分别示于seq id no:30、31和32的重链cdr1、cdr2和cdr3序列,以及分别示于seq id no:40、41和42的轻链cdr1、cdr2和cdr3序列;(ii)分别示于seq id no:4、5和6的重链cdr1、cdr2和cdr3序列,以及分别示于seq id no:14、15和16的轻链cdr1、cdr2和cdr3序列;(iii)分别示于seq id no:56、57和58的重链cdr1、cdr2和cdr3序列,以及分别示于seq id no:66、67和68的轻链cdr1、cdr2和cdr3序列;(iv)分别示于seq id no:82、83和84的重链cdr1、cdr2和cdr3序列,以及分别示于seq id no:92、93和94的轻链cdr1、cdr2和cdr3序列;和(v)分别示于seq id no:108、109和110的重链cdr1、cdr2和cdr3序列,以及分别示于seq id no:118、119和120的轻链cdr1、cdr2和cdr3序列。
[0038]
在一些实施方案中,本公开的抗体或其抗原结合部分结合至并拮抗人cd39,并且包含重链和轻链cdr,其中重链cdr1、cdr2和cdr3序列分别示于seq id no:30、31和32中,轻链cdr1、cdr2和cdr3序列分别示于seq id no:40、41和42中;
[0039]
在一些方面,本公开的抗体或抗原结合部分结合至并拮抗人cd39,并且包含重链和轻链可变区,其中重链可变区包含选自由seq id no:33、7、59、85和111组成的组的氨基酸序列;并且其中轻链可变区包含选自由seq id no:43、17、69、95和121组成的组的氨基酸序列。
[0040]
在一些方面,本公开的抗体或其抗原结合部分结合至并拮抗人cd39,并且包含重链和轻链可变区,所述重链和轻链可变区分别包含选自由以下组成的组的氨基酸序列:(i)seq id no:33和43;(ii)seq id no:7和17;(iii)seq id no:59和69;(iv)seq id no:85和95;和(v)seq id no:111和121。
[0041]
在一些方面,本公开的抗体或其抗原结合部分结合至并拮抗人cd39,并且包含重链和轻链可变区,所述重链和轻链可变区分别包含seq id no:33和43中所示的氨基酸序列。
[0042]
在一些方面,本公开的抗体或抗原结合部分结合至并拮抗人cd39,并且包含重链和轻链可变区,其中重链可变区包含与选自由seq id no:33、7、59、85和111组成的组的氨基酸序列具有至少90%、至少95%、至少97%、至少98%、至少99%同一性的氨基酸序列;并且其中轻链可变区包含与选自由seq id no:43、17、69、95和121组成的组的氨基酸序列具有至少90%、至少95%、至少97%、至少98%、至少99%同一性的氨基酸序列。
[0043]
在一些方面,本公开的抗体或抗原结合部分结合至并拮抗人cd39,并且包含重链和轻链可变区,所述重链和轻链可变区分别包含与选自由以下组成的组的氨基酸序列具有至少90%、至少95%、至少97%、至少98%、至少99%同一性的氨基酸序列:(i)seq id no:33和43;(ii)seq id no:7和17;(iii)seq id no:59和69;(iv)seq id no:85和95;和(v)seq id no:111和121。在一些方面,本公开的抗体或其抗原结合部分结合至并拮抗人cd39,并且包含重链和轻链可变区,所述重链和轻链可变区包含分别与seq id no:33和43中所示的氨基酸序列具有至少90%、至少95%、至少97%、至少98%、至少99%同一性的氨基酸序列。
[0044]
在一些实施方案中,本公开的抗体或其抗原结合部分结合至并拮抗人cd39,并且包含重链和轻链,其中重链包含选自由seq id no:35、9、61、87和113组成的组的氨基酸序列;并且其中轻链包含选自由seq id no:45、19、71、97和123组成的组的氨基酸序列。
[0045]
在一些实施方案中,本公开的抗体或其抗原结合部分结合至并拮抗人cd39,并且包含重链和轻链,其中重链包含与选自由seq id no:35、9、61、87和113组成的组的氨基酸序列具有至少90%、至少95%、至少97%、至少98%、至少99%同一性的氨基酸序列;并且其中轻链包含与选自由seq id no:45、19、71、97和123组成的组的氨基酸序列具有至少90%、至少95%、至少97%、至少98%、至少99%同一性的氨基酸序列。
[0046]
在一些实施方案中,本公开的抗体或其抗原结合部分结合至并拮抗人cd39,并且包含重链和轻链,其中重链包含选自由seq id no:47、21、73、99和125组成的组的氨基酸序列;并且其中轻链包含选自由seq id no:45、19、71、97和123组成的组的氨基酸序列。
[0047]
在一些实施方案中,本公开的抗体或其抗原结合部分结合至并拮抗人cd39,并且包含重链和轻链,其中重链包含与选自由seq id no:47、21、73、99和125组成的组的氨基酸序列具有至少90%、至少95%、至少97%、至少98%、至少99%同一性的氨基酸序列;并且其中轻链包含与选自由seq id no:45、19、71、97和123组成的组的氨基酸序具有至少90%、至少95%、至少97%、至少98%、至少99%同一性的氨基酸序列。
[0048]
在一些实施方案中,本公开的抗体或其抗原结合部分结合至并拮抗人cd39,并且包含重链和轻链,其中重链包含选自由seq id no:49、23、75、101和127组成的组的氨基酸序列;并且其中轻链包含选自由seq id no:45、19、71、97和123组成的组的氨基酸序列。
[0049]
在一些实施方案中,本公开的抗体或其抗原结合部分结合至并拮抗人cd39,并且包含重链和轻链,其中重链包含与选自由seq id no:49、23、75、101和127组成的组的氨基酸序列具有至少90%、至少95%、至少97%、至少98%、至少99%同一性的氨基酸序列;并且其中轻链包含与选自由seq id no:45、19、71、97和123组成的组的氨基酸序具有至少90%、至少95%、至少97%、至少98%、至少99%同一性的氨基酸序列。
[0050]
在一些实施方案中,本公开的抗体或其抗原结合部分结合至并拮抗人cd39,并且包含重链和轻链,其中重链包含选自由seq id no:51、25、77、103和129组成的组的氨基酸序列;并且其中轻链包含选自由seq id no:45、19、71、97和123组成的组的氨基酸序列。
[0051]
在一些实施方案中,本公开的抗体或其抗原结合部分结合至并拮抗人cd39,并且
包含重链和轻链,其中重链包含与选自由seq id no:51、25、77、103和129组成的组的氨基酸序列具有至少90%、至少95%、至少97%、至少98%、至少99%同一性的氨基酸序列;并且其中轻链包含与选自由seq id no:45、19、71、97和123组成的组的氨基酸序具有至少90%、至少95%、至少97%、至少98%、至少99%同一性的氨基酸序列。
[0052]
在一些实施方案中,本公开的抗体或其抗原结合部分结合至并拮抗人cd39,并且包含重链和轻链,所述重链和轻链分别包含选自由以下组成的组的氨基酸序列:(i)seq id no:35和45;(ii)seq id no:9和19;(iii)seq id no:61和71;(iv)seq id no:87和97;和(v)seq id no:113和123。
[0053]
在一些实施方案中,本公开的抗体或其抗原结合部分结合至并拮抗人cd39,并且包含重链和轻链,所述重链和轻链分别包含与选自以下组成的组的氨基酸序列具有至少90%、至少95%、至少97%、至少98%、至少99%同一性的氨基酸序列:(i)seq id no:35和45;(ii)seq id no:9和19;(iii)seq id no:61和71;(iv)seq id no:87和97;和(v)seq id no:113和123。
[0054]
在一些实施方案中,本公开的抗体或其抗原结合部分结合至并拮抗人cd39,并且包含重链和轻链,所述重链和轻链分别包含选自由以下组成的组的氨基酸序列:(i)seq id no:47和45;(ii)seq id no:21和19;(iii)seq id no:73和71;(iv)seq id no:99和97;和(v)seq id no:125和123。
[0055]
在一些实施方案中,本公开的抗体或其抗原结合部分结合至并拮抗人cd39,并且包含重链和轻链,所述重链和轻链分别包含与选自以下组成的组的氨基酸序列具有至少90%、至少95%、至少97%、至少98%、至少99%同一性的氨基酸序列:(i)seq id no:47和45;(ii)seq id no:21和19;(iii)seq id no:73和71;(iv)seq id no:99和97;和(v)seq id no:125和123。
[0056]
在一些实施方案中,本公开的抗体或其抗原结合部分结合至并拮抗人cd39,并且包含重链和轻链,所述重链和轻链分别包含选自由以下组成的组的氨基酸序列:(i)seq id no:49和45;(ii)seq id no:23和19;(iii)seq id no:75和71;
(iv)seq id no:101和97;和(v)seq id no:127和123。
[0057]
在一些实施方案中,本公开的抗体或其抗原结合部分结合至并拮抗人cd39,并且包含重链和轻链,所述重链和轻链分别包含与选自以下组成的组的氨基酸序列具有至少90%、至少95%、至少97%、至少98%、至少99%同一性的氨基酸序列:(i)seq id no:49和45;(ii)seq id no:23和19;(iii)seq id no:75和71;(iv)seq id no:101和97;和(v)seq id no:127和123。
[0058]
在一些实施方案中,本公开的抗体或其抗原结合部分结合至并拮抗人cd39,并且包含重链和轻链,所述重链和轻链分别包含选自由以下组成的组的氨基酸序列:(i)seq id no:51和45;(ii)seq id no:25和19;(iii)seq id no:77和71;(iv)seq id no:103和97;和(v)seq id no:129和123。
[0059]
在一些实施方案中,本公开的抗体或其抗原结合部分结合至并拮抗人cd39,并且包含重链和轻链,所述重链和轻链分别包含与选自以下组成的组的氨基酸序列具有至少90%、至少95%、至少97%、至少98%、至少99%同一性的氨基酸序列:(i)seq id no:51和45;(ii)seq id no:25和19;(iii)seq id no:77和71;(iv)seq id no:103和97;和(v)seq id no:129和123。
[0060]
在一些实施方案中,本公开的抗体或其抗原结合部分结合至并拮抗人cd39,并且包含重链和轻链,所述重链和轻链分别包含seq id no:35和45中所示的氨基酸序列。
[0061]
在一些实施方案中,本公开的抗体或其抗原结合部分结合至并拮抗人cd39,并且包含重链和轻链,所述重链和轻链分别包含与seq id no:35和45中所示的氨基酸序列具有至少90%、至少95%、至少97%、至少98%、至少99%同一性的氨基酸序列。
[0062]
在一些实施方案中,本公开的抗体或其抗原结合部分结合至并拮抗人cd39,并且包含重链和轻链,所述重链和轻链分别包含seq id no:47和45中所示的氨基酸序列。
[0063]
在一些实施方案中,本公开的抗体或其抗原结合部分结合至并拮抗人cd39,并且包含重链和轻链,所述重链和轻链分别包含与seq id no:47和45中所示的氨基酸序列具有至少90%、至少95%、至少97%、至少98%、至少99%同一性的氨基酸序列。
[0064]
在一些实施方案中,本公开的抗体或其抗原结合部分结合至并拮抗人cd39,并且包含重链和轻链,所述重链和轻链分别包含seq id no:49和45中所示的氨基酸序列。
[0065]
在一些实施方案中,本公开的抗体或其抗原结合部分结合至并拮抗人cd39,并且包含重链和轻链,所述重链和轻链分别包含与seq id no:49和45中所示的氨基酸序列具有
至少90%、至少95%、至少97%、至少98%、至少99%同一性的氨基酸序列。
[0066]
在一些实施方案中,本公开的抗体或其抗原结合部分结合至并拮抗人cd39,并且包含重链和轻链,所述重链和轻链分别包含seq id no:51和45中所示的氨基酸序列。
[0067]
在一些实施方案中,本公开的抗体或其抗原结合部分结合至并拮抗人cd39,并且包含重链和轻链,所述重链和轻链分别包含与seq id no:51和45中所示的氨基酸序列具有至少90%、至少95%、至少97%、至少98%、至少99%同一性的氨基酸序列。
[0068]
在一些方面,本公开提供了药物组合物,其包含本公开的分离的抗cd39抗体或其抗原结合部分,以及药学上可接受的载剂。
[0069]
在一些方面,本公开提供了包含编码本公开的分离抗体的轻链、重链或轻链和重链两者或其抗原结合部分的核苷酸序列的核酸。在一些方面,本公开提供了包含本公开的核酸的表达载体。在一些方面,本公开提供了用本公开的表达载体转化的细胞。
[0070]
在一些方面,本公开提供了用于产生结合人cd39的抗体或其抗原结合部分的方法,所述方法包括在允许抗体或其抗原结合部分表达的条件下维持根据本公开的细胞。在一些方面,所述方法还包括获得抗体或其抗原结合部分。
[0071]
在一些实施方案中,本公开提供了刺激受试者的免疫响应的方法,所述方法包括向受试者施用有效量的由本公开提供的结合至并拮抗人cd39的分离的抗体或其抗原结合部分,或包含所述抗体或其抗原结合部分以及药学上可接受的载剂的药物组合物。
[0072]
在一些实施方案中,本公开提供了治疗受试者的癌症的方法,所述方法包括向受试者施用有效量的由本公开提供的结合至并拮抗cd39的分离的抗体或其抗原结合部分,或包含所述抗体或其抗原结合部分以及药学上可接受的载剂的药物组合物。
[0073]
在一些实施方案中,本公开提供了治疗受试者的癌症的方法,所述方法包括向受试者施用有效量的由本公开提供的结合至并拮抗人cd39的分离的抗体或其抗原结合部分,或包含所述抗体或其抗原结合部分以及药学上可接受的载剂的药物组合物,其中所述抗体或其抗原结合部分或者药物组合物抑制或降低肿瘤微环境中人cd39的酶活性,从而治疗癌症。
[0074]
在一些实施方案中,本公开提供了治疗受试者的癌症的方法,所述方法包括向受试者施用有效量的由本公开提供的结合至并拮抗人cd39的分离的抗体或其抗原结合部分,或包含所述抗体或其抗原结合部分和药学上可接受的载剂的药物组合物,其中所述抗体或其抗原结合部分,或所述药物组合物抑制或降低人cd39的酶活性,其中抑制或降低cd39的酶活性抑制或降低肿瘤微环境中细胞外三磷酸腺苷(eatp)或细胞外二磷酸腺苷(eadp)向细胞外一磷酸腺苷(amp)的转化,从而治疗癌症。
[0075]
在一些实施方案中,本公开提供了治疗受试者的癌症的方法,所述方法包括向受试者施用有效量的由本公开提供的结合至并拮抗cd39的分离的抗体或其抗原结合部分,或包含所述抗体或其抗原结合部分和药学上可接受的载剂的药物组合物,其中所述抗体或其抗原结合部分或者所述药物组合物抑制或降低人cd39的酶活性,其中抑制或降低cd39的酶活性增加或提高肿瘤微环境中细胞外三磷酸腺苷(eatp)的水平,从而治疗癌症。
[0076]
在一些实施方案中,抗cd39抗体是单克隆的。
[0077]
在一些实施方案中,本公开提供了治疗受试者癌症的方法,所述方法包括向受试者施用有效量的由本公开提供的结合至并拮抗人cd39的分离的抗cd39抗体或其抗原结合
部分,或包含所述抗体或其抗原结合部分和药学上可接受的载剂的药物组合物,其中所述抗体或其抗原结合部分或者所述药物组合物抑制或降低人cd39的酶活性,其中抑制或降低cd39的酶活性降低或减少肿瘤微环境中细胞外腺苷水平,从而治疗癌症。
[0078]
在一些实施方案中,本公开提供了治疗受试者的癌症的方法,所述方法包括向受试者施用有效量的由本公开提供的结合至并拮抗人cd39的分离的抗体或其抗原结合部分,或包含所述抗体或其抗原结合部分和药学上可接受的载剂的药物组合物,其中所述抗体或其抗原结合部分或者所述药物组合物抑制或降低人cd39的酶活性,其中抑制或降低人cd39的酶活性增加或提高细胞外三磷酸腺苷(eatp)的水平,并降低或减少肿瘤微环境中细胞外腺苷水平,从而治疗癌症。
[0079]
在一些实施方案中,本公开提供了治疗受试者的癌症的方法,所述方法包括向受试者施用有效量的由本公开提供的结合至并拮抗人cd39的分离的抗体或其抗原结合部分,或包含所述抗体或其抗原结合部分和药学上可接受的载剂的药物组合物,其中所述抗体或其抗原结合部分或者所述药物组合物抑制或降低人cd39的酶活性,其中抑制或降低人cd39的酶活性维持、增加或提高肿瘤微环境中细胞外三磷酸腺苷(eatp)的免疫刺激水平,从而治疗癌症。
[0080]
在一些实施方案中,本公开提供了治疗受试者的癌症的方法,所述方法包括向受试者施用有效量的由本公开提供的结合至并拮抗人cd39的分离的抗体或其抗原结合部分,或包含所述抗体或其抗原结合部分和药学上可接受的载剂的药物组合物,其中所述抗体或其抗原结合部分或者所述药物组合物抑制或降低人cd39的酶活性,其中抑制或降低人cd39的酶活性增加或提高肿瘤微环境中淋巴细胞的增殖,从而治疗癌症。
[0081]
在一些实施方案中,本公开提供了治疗受试者的癌症的方法,所述方法包括向受试者施用有效量的由本公开提供的结合至并拮抗人cd39的分离的抗体或其抗原结合部分,或包含所述抗体或其抗原结合部分和药学上可接受的载剂的药物组合物,其中所述抗体或其抗原结合部分或者所述药物组合物抑制或降低人cd39的酶活性,其中抑制或降低人cd39的酶活性提高一种或多种树突细胞活化标志物的表达。
[0082]
在一些实施方案中,本公开提供了治疗受试者的癌症的方法,该所述方法包括向受试者施用有效量的由本公开提供的结合至并拮抗人cd39的分离的抗体或其抗原结合部分,或包含所述抗体或其抗原结合部分和药学上可接受的载剂的药物组合物,其中所述抗体或其抗原结合部分或者所述药物组合物抑制或降低人cd39的酶活性,其中抑制或降低人cd39的酶活性提高一种或多种细胞因子从树突细胞的分泌。
[0083]
在一些实施方案中,本公开提供了治疗受试者的癌症的方法,其中所述癌症选自由以下组成的组:肺癌(例如,非小细胞肺癌)、卵巢癌、肾癌、睾丸癌、胰腺癌、乳腺癌(例如,三阴性乳腺癌)、黑素瘤、头颈癌(例如,鳞状头颈癌)、结直肠癌、膀胱癌、子宫内膜癌、前列腺癌、甲状腺癌、肝细胞癌、胃癌、脑癌、淋巴瘤或肾癌(例如,肾细胞癌)。
[0084]
在一些方面,本公开提供了由本公开提供的结合至并拮抗人cd39的分离的抗体或其抗原结合部分、包含所述抗体或其抗原结合部分和药学上可接受的载剂的药物组合物(任选地与一种或多种另外的治疗剂或程序组合)在刺激受试者的免疫响应或治疗受试者的癌症方面的用途。
[0085]
在一些方面,本公开提供了药盒,其包含由本公开提供的结合至并拮抗人cd39的
分离的抗体或其抗原结合部分,或包含所述抗体或其抗原结合部分和药学上可接受的载剂的药物组合物,以及刺激受试者的免疫响应或治疗受试者的癌症的使用说明书,任选地具有与一种或多种另外的治疗剂或程序组合的使用说明书。
[0086]
在一些实施方案中,本公开提供了治疗受试者的癌症的方法,所述方法包括向受试者施用有效量的与一种或多种另外的治疗剂或程序组合的、由本公开提供的结合至并拮抗cd39的分离的抗体或其抗原结合部分。在一些方面,第二治疗剂或程序选自由以下组成的组:化学疗法、靶向抗癌疗法、溶瘤药物、细胞毒性剂、基于免疫的疗法、细胞因子、手术程序、辐射程序、共刺激分子的激活剂、抑制性分子的抑制剂、疫苗或细胞免疫疗法或其组合。
[0087]
在一些实施方案中,一种或多种另外的治疗剂是pd-1拮抗剂、腺苷a2ar拮抗剂、cd73抑制剂、ctla-4抑制剂、tim-3抑制剂、lag-3抑制剂、嵌合抗原受体(car)细胞疗法或其组合。
[0088]
在一些实施方案中,一种或多种另外的治疗剂是cd73抑制剂和a2ar拮抗剂的组合。在一些实施方案中,一种或多种另外的治疗剂是pd-1拮抗剂和腺苷a2ar拮抗剂的组合。在一些实施方案中,一种或多种另外的治疗剂是pd-1拮抗剂。
[0089]
在一些实施方案中,pd-1拮抗剂选自由以下组成的组:pdr001、纳武单抗、培布罗珠单抗、皮地珠单抗(pidilizumab)、medi0680、regn2810、tsr-042、pf-06801591和amp-224。在一些实施方案中,pd-1拮抗剂选自由以下组成的组:faz053、阿特珠单抗(atezolizumab)、阿维单抗、德瓦鲁单抗和bms-936559。
[0090]
在一些实施方案中,一种或多种另外的治疗剂是腺苷a2ar拮抗剂。在一些实施方案中,腺苷a2ar拮抗剂选自由以下组成的组:nir178、cpi-444、azd4635、维帕德南(vipadenant)、gbv-2034和ab928。在一些实施方案中,腺苷a2ar拮抗剂是cpi-444。
[0091]
在一些实施方案中,一种或多种另外的治疗剂是cd73抑制剂。在一些实施方案中,cd73抑制剂选自由以下组成的组:ab421、medi9447和bms-986179。
[0092]
在一些实施方案中,一种或多种另外的治疗剂是ctla-4抑制剂。在一些实施方案中,ctla-4抑制剂是伊匹木单抗或曲美木单抗。
[0093]
在一些实施方案中,一种或多种另外的治疗剂是tim-3抑制剂。在一些实施方案中,tim-3抑制剂是mgb453或tsr-022。
[0094]
在一些实施方案中,一种或多种另外的治疗剂是lag-3抑制剂。在一些实施方案中,lag-3抑制剂选自由以下组成的组:lag525、bms-986016和tsr-033。
[0095]
在一些实施方案中,一种或多种另外的治疗剂是嵌合抗原受体(car)细胞疗法。在一些实施方案中,car细胞疗法是ctl019。
[0096]
在一些实施方案中,一种或多种另外的治疗剂是蒽环类药物。在一些实施方案中,蒽环类药物选自多柔比星、柔红霉素、表柔比星、伊达比星和戊柔比星。在一些实施方案中,蒽环类药物是多柔比星。
[0097]
在一些实施方案中,本公开提供了检测生物样品或受试者中cd39的方法,包括(i)在允许抗体分子和cd39发生相互作用的条件下,使样品或受试者(和任选的参考样品或受试者)与表1中的任何抗体接触,以及(ii)检测抗体分子与样品或受试者(和任选的参考样品或受试者)之间复合物的形成。
[0098]
提供了以下实施方案,并且所述实施方案是非限制性的:
实施方案1.一种特异性结合至并拮抗人cd39的分离的单克隆抗体或其抗原结合部分,其中所述抗体或其抗原结合部分表现出至少以下特性中的至少一种或多种:(i)与重组人cd39和/或膜结合的人cd39结合;(ii)以小于10nm的平衡解离常数(k
d
)与人cd39结合;(iii)抑制或降低人cd39的酶活性;(iv)抑制或减少人cd39将细胞外三磷酸腺苷(eatp)或细胞外二磷酸腺苷(eadp)转化为细胞外一磷酸腺苷(eamp);(v)增加或提高eatp水平;(vi)降低或减少细胞外腺苷水平;(vii)维持、增加或提高eatp的免疫刺激水平;(viii)增加或提高淋巴细胞的增殖;(ix)增加或提高一种或多种树突细胞活化标志物的表达;(x)增加或提高一种或多种细胞因子从树突细胞的分泌;(xi)增加或提高肿瘤中的巨噬细胞浸润;(xii)增加或提高巨噬细胞吸引趋化因子的分泌;(xiii)拮抗组织的肿瘤微环境中的人cd39;(xiv)与食蟹猴cd39和/或小鼠cd39交叉反应;或者(xv)(i)至(xiv)项中任一项的组合。实施方案2.实施方案1的分离的单克隆抗体或其抗原结合部分,其中所述抗体或其抗原结合部分与人重组cd39和/或膜结合的人cd39结合。实施方案3.实施方案1或2的分离的单克隆抗体或其抗原结合部分,其中所述抗体或其抗原结合部分以小于10nm的平衡解离常数(k
d
)与人cd39结合。实施方案4.实施方案1至3中任一项的分离的单克隆抗体或其抗原结合部分,其中所述抗体或其抗原结合部分抑制或降低人cd39的酶活性。实施方案5.实施方案4的分离的单克隆抗体或其抗原结合部分,其中人cd39的酶活性是eatp或eadp的水解。实施方案6.实施方案1至5中任一项的分离的单克隆抗体或其抗原结合部分,其中所述抗体或其抗原结合部分抑制或减少eatp或eadp向eamp的转化。实施方案7.实施方案1至6中任一项的分离的单克隆抗体或其抗原结合部分,其中所述抗体或其抗原结合部分增加或提高eatp水平。实施方案8.实施方案1至7中任一项的分离的单克隆抗体或其抗原结合部分,其中所述抗体或其抗原结合部分降低或减少细胞外腺苷水平。实施方案9.实施方案1至8中任一项的分离的单克隆抗体或其抗原结合部分,其中所述抗体或其抗原结合部分维持、增加或提高eatp的免疫刺激水平。实施方案10.实施方案1至9中任一项的分离的单克隆抗体或其抗原结合部分,其中所述抗体或其抗原结合部分增加淋巴细胞的增殖。实施方案11.实施方案10的分离的单克隆抗体或其抗原结合部分,其中所述淋巴细胞是肿瘤浸润性淋巴细胞。实施方案12.实施方案10或11的分离的单克隆抗体或其抗原结合部分,其中所述淋巴
细胞是t细胞。实施方案13.实施方案12的分离的单克隆抗体或其抗原结合部分,其中所述t细胞是cd4+ t细胞。实施方案14.实施方案1至13中任一项的分离的单克隆抗体或其抗原结合部分,其中所述抗体或其抗原结合部分提高一种或多种树突细胞活化标志物的表达。实施方案15.实施方案14的分离的单克隆抗体或其抗原结合部分,其中所述一种或多种树突细胞活化标志物是cd86、hla-dr或其组合。实施方案16.实施方案1至15中任一项的分离的单克隆抗体或其抗原结合部分,其中所述抗体或其抗原结合部分提高一种或多种细胞因子从树突细胞的分泌。实施方案17.实施方案16的分离的单克隆抗体或其抗原结合部分,其中所述一种或多种细胞因子是il-16、il-12/il-23p40、vegfa或其任何组合。实施方案18.实施方案1至17中任一项的分离的单克隆抗体或其抗原结合部分,其中人cd39的拮抗作用发生在组织的肿瘤微环境中。实施方案19.实施方案1至18中任一项的分离的单克隆抗体或其抗原结合部分,其中所述抗体或其抗原结合部分与食蟹猴cd39和/或小鼠cd39交叉反应。实施方案20.实施方案1至19中任一项的分离的单克隆抗体或其抗原结合部分,其中所述抗体选自由以下组成的组:igg1、igg2、和igg3、igg4、和igm、和iga1、和iga2、和igd、和ige抗体。实施方案21.根据实施方案20的分离的单克隆抗体或其抗原结合部分,其中所述抗体是igg1抗体或igg4抗体。实施方案22.根据实施方案20或21的分离的单克隆抗体或其抗原结合部分,其中所述抗体包含野生型igg1重链恒定区。实施方案23.实施方案20或21的分离的单克隆抗体或其抗原结合部分,其中所述抗体包含野生型igg4重链恒定区。实施方案24.实施方案1至21中任一项的分离的单克隆抗体或其抗原结合部分,其中所述抗体包含含有至少一个突变的fc结构域。实施方案25.实施方案24的分离的单克隆抗体或其抗原结合部分,其中所述抗体包含突变igg1重链恒定区。实施方案26.实施方案24的分离的单克隆抗体或其抗原结合部分,其中所述抗体包含突变igg4重链恒定区。实施方案27.实施方案26的分离的单克隆抗体或其抗原结合部分,其中根据eu编号,所述突变igg4重链恒定区包含取代s228p、l235e、l235a中的任一种或其组合。实施方案28.实施方案1至27中任一项的分离的单克隆抗体或其抗原结合部分,其中所述抗体或其抗原结合部分包含seq id no:3中所示的重链cdr3序列。实施方案29.实施方案1-28中任一项的分离的单克隆抗体或其抗原结合部分,其中所述抗体或其抗原结合部分与参考抗体或其抗原结合部分结合基本上相同的表位,所述参考抗体或其抗原结合部分包含seq id no:3中所示的重链cdr3序列。实施方案30.实施方案1至29中任一项的分离的单克隆抗体或其抗原结合部分,其中所述抗体或其抗原结合部分与由参考抗体或其抗原结合部分结合的氨基酸残基中的至少一
个结合,所述参考抗体或其抗原结合部分包含seq id no:3中所示的重链cdr3序列。实施方案31.实施方案1至30中任一项的分离的单克隆抗体或其抗原结合部分,其中由抗体结合的表位的突变抑制、减少或阻断与抗体以及参考抗体或其抗原结合部分的结合,所述参考抗体或其抗原结合部分包含seq id no:3中所示的重链cdr3序列。实施方案32.实施方案1至31中任一项的分离的单克隆抗体或其抗原结合部分,其中所述抗体或其抗原结合部分与参考抗体或其抗原结合部分结合基本上相同的表位,所述参考抗体或其抗原结合部分包含分别示于seq id no:27、28和29的重链cdr1、cdr2和cdr3序列,以及分别示于seq id no:37、38和39的轻链cdr1、cdr2和cdr3序列。实施方案33.实施方案1至32中任一项的分离的单克隆抗体或其抗原结合部分,其中所述抗体或其抗原结合部分与由参考抗体或其抗原结合部分结合的氨基酸残基中的至少一个结合,所述参考抗体或其抗原结合部分包含分别示于seq id no:27、28和29的重链cdr1、cdr2和cdr3序列,以及分别示于seq id no:37、38和39的轻链cdr1、cdr2和cdr3序列。实施方案34.实施方案1至33中任一项的分离的单克隆抗体或其抗原结合部分,其中由抗体结合的表位的突变抑制、减少或阻断与抗体以及参考抗体或其抗原结合部分的结合,所述参考抗体或其抗原结合部分包含分别示于seq id no:27、28和29的重链cdr1、cdr2和cdr3序列,以及分别示于seq id no:37、38和39的轻链cdr1、cdr2和cdr3序列。实施方案35.实施方案1至31中任一项的分离的单克隆抗体或其抗原结合部分,其中所述抗体或其抗原结合部分与参考抗体或其抗原结合部分结合基本上相同的表位,所述参考抗体或其抗原结合部分包含分别示于seq id no:30、31和32的重链cdr1、cdr2和cdr3序列,以及分别示于seq id no:40、41和42的轻链cdr1、cdr2和cdr3序列。实施方案36.实施方案1-31和35中任一项的分离的单克隆抗体或其抗原结合部分,其中所述抗体或其抗原结合部分结合至少一个由参考抗体或其抗原结合部分结合的氨基酸残基,所述参考抗体或其抗原结合部分包含分别示于seq id no:30、31和32的重链cdr1、cdr2和cdr3序列,以及分别示于seq id no:40、41和42的轻链cdr1、cdr2和cdr3序列。实施方案37.实施方案1至31、35和36中任一项的分离的单克隆抗体或其抗原结合部分,其中由所述抗体结合的表位的突变抑制、减少或阻断与抗体以及参考抗体或其抗原结合部分的结合,所述参考抗体或其抗原结合部分包含分别示于seq id no:30、31和32的重链cdr1、cdr2和cdr3序列,以及分别示于seq id no:40、41和42的轻链cdr1、cdr2和cdr3序列。实施方案38.一种特异性结合至并拮抗人cd39的分离的单克隆抗体或其抗原结合部分,其中所述抗体或其抗原结合部分包含选自由以下组成的组的重链和轻链cdr:(i)分别示于seq id no:27、28和29的重链cdr1、cdr2和cdr3序列,以及分别示于seq id no:37、38和39的轻链cdr1、cdr2和cdr3序列;(ii)分别示于seq id no:1、2和3的重链cdr1、cdr2和cdr3序列,以及分别示于seq id no:11、12和13的轻链cdr1、cdr2和cdr3序列;(iii)分别示于seq id no:53、54和55的重链cdr1、cdr2和cdr3序列,以及分别示于seq id no:63、64和65的轻链cdr1、cdr2和cdr3序列;(iv)分别示于seq id no:79、80和81的重链cdr1、cdr2和cdr3序列,以及分别示于seq id no:89、90和91的轻链cdr1、cdr2和cdr3序列;和
(v)分别示于seq id no:105、106和107的重链cdr1、cdr2和cdr3序列,以及分别示于seq id no:115、116和117的轻链cdr1、cdr2和cdr3序列。实施方案39.一种特异性结合至并拮抗人cd39的分离的单克隆抗体或其抗原结合部分,其中所述抗体或其抗原结合部分包含重链和轻链cdr,其中所述重链cdr1、cdr2和cdr3序列分别示于seq id no:27、28和29中,轻链cdr1、cdr2和cdr3序列分别示于seq id no:37、38和39中。实施方案40.一种特异性结合至并拮抗人cd39的分离的单克隆抗体或其抗原结合部分,其中所述抗体或其抗原结合部分包含选自由以下组成的组的重链和轻链cdr:(i)分别示于seq id no:30、31和32的重链cdr1、cdr2和cdr3序列,以及分别示于seq id no:40、41和42的轻链cdr1、cdr2和cdr3序列;(ii)分别示于seq id no:4、5和6的重链cdr1、cdr2和cdr3序列,以及分别示于seq id no:14、15和16的轻链cdr1、cdr2和cdr3序列;(iii)分别示于seq id no:56、57和58的重链cdr1、cdr2和cdr3序列,以及分别示于seq id no:66、67和68的轻链cdr1、cdr2和cdr3序列;(iv)分别示于seq id no:82、83和84的重链cdr1、cdr2和cdr3序列,以及分别示于seq id no:92、93和94的轻链cdr1、cdr2和cdr3序列;和(v)分别示于seq id no:108、109和110的重链cdr1、cdr2和cdr3序列,以及分别示于seq id no:118、119和120的轻链cdr1、cdr2和cdr3序列。实施方案41.一种特异性结合至并拮抗人cd39的分离的单克隆抗体或其抗原结合部分,其中所述抗体或其抗原结合部分包含重链和轻链cdr,其中所述重链cdr1、cdr2和cdr3序列分别示于seq id no:30、31和32中,轻链cdr1、cdr2和cdr3序列分别示于seq id no:40、41和42中。实施方案42.一种特异性结合至并拮抗人cd39的分离的单克隆抗体或其抗原结合部分,其中所述抗体或其抗原结合部分包含重链可变区和轻链可变区,其中所述重链可变区包含选自由seq id no:33、7、59、85和111组成的组的氨基酸序列;并且其中所述轻链可变区包含选自seq id no:43、17、69、95和121组成的组的氨基酸序列。实施方案43.一种特异性结合至并拮抗人cd39的分离的单克隆抗体或其抗原结合部分,其中所述抗体或其抗原结合部分包含重链和轻链可变区,所述重链和轻链可变区分别包含选自由以下组成的组的氨基酸序列:(i)seq id no:33和43;(ii)seq id no:7和17;(iii)seq id no:59和69;(iv)seq id no:85和95;和(v)seq id no:111和121。实施方案44.一种特异性结合至并拮抗人cd39的分离的单克隆抗体或其抗原结合部分,其中所述抗体或其抗原结合部分包含重链和轻链可变区,所述重链和轻链可变区分别包含seq id no:33和43中所示的氨基酸序列。实施方案45.一种特异性结合至并拮抗人cd39的分离的单克隆抗体或其抗原结合部分,其中所述抗体或其抗原结合部分包含重链可变区和轻链可变区,其中所述重链可变区
包含与选自由seq id no:33、7、59、85和111组成的组的氨基酸序列具有至少90%同一性的氨基酸序列;并且其中所述轻链可变区包含与选自由seq id no:43、17、69、95和121组成的组的氨基酸序列具有至少90%同一性的氨基酸序列。实施方案46.一种特异性结合至并拮抗人cd39的分离的单克隆抗体或其抗原结合部分,其中所述抗体或其抗原结合部分包含重链和轻链可变区,所述重链和轻链可变区分别包含与选自由以下组成的组的氨基酸序列具有至少90%同一性的氨基酸序列:(i)seq id no:33和43;(ii)seq id no:7和17;(iii)seq id no:59和69;(iv)seq id no:85和95;和(v)seq id no:111和121。实施方案47.一种特异性结合至并拮抗人cd39的分离的单克隆抗体或其抗原结合部分,其中所述抗体或其抗原结合部分包含重链和轻链可变区,所述重链和轻链可变区分别包含与seq id no:33和43中所示的氨基酸序列具有至少90%同一性的氨基酸序列。实施方案48.一种特异性结合至并拮抗人cd39的分离的单克隆抗体或其抗原结合部分,其中所述抗体或其抗原结合部分包含重链和轻链,其中所述重链包含选自由seq id no:35、9、61、87和113组成的组的氨基酸序列;并且其中所述轻链包含选自由seq id no:45、19、71、97和123组成的组的氨基酸序列。实施方案49.一种特异性结合至并拮抗人cd39的分离的单克隆抗体或其抗原结合部分,其中所述抗体或其抗原结合部分包含重链和轻链,其中所述重链包含与选自由seq id no:35、9、61、87和113组成的组的氨基酸序列具有至少90%同一性的氨基酸序列;并且其中所述轻链包含与选自由seq id no:45、19、71、97和123组成的组的氨基酸序列具有至少90%同一性的氨基酸序列。实施方案50.一种特异性结合至并拮抗人cd39的分离的单克隆抗体或其抗原结合部分,其中所述抗体或其抗原结合部分包含重链和轻链,其中所述重链包含选自由seq id no:47、21、73、99和125组成的组的氨基酸序列;并且其中所述轻链包含选自由seq id no:45、19、71、97和123组成的组的氨基酸序列。实施方案51.一种特异性结合至并拮抗人cd39的分离的单克隆抗体或其抗原结合部分,其中所述抗体或其抗原结合部分包含重链和轻链,其中所述重链包含与选自由seq id no:47、21、73、99和125组成的组的氨基酸序列具有至少90%同一性的氨基酸序列;并且其中所述轻链包含与选自由seq id no:45、19、71、97和123组成的组的氨基酸序列具有至少90%同一性的氨基酸序列。实施方案52.一种特异性结合至并拮抗人cd39的分离的单克隆抗体或其抗原结合部分,其中所述抗体或其抗原结合部分包含重链和轻链,其中所述重链包含选自由seq id no:49、23、75、101和127组成的组的氨基酸序列;并且其中所述轻链包含选自由seq id no:45、19、71、97和123组成的组的氨基酸序列。实施方案53.一种特异性结合至并拮抗人cd39的分离的单克隆抗体或其抗原结合部分,其中所述抗体或其抗原结合部分包含重链和轻链,其中所述重链包含与选自由seq id no:49、23、75、101和127组成的组的氨基酸序列具有至少90%同一性的氨基酸序列;并且其
中所述轻链包含与选自由seq id no:45、19、71、97和123组成的组的氨基酸序列具有至少90%同一性的氨基酸序列。实施方案54.一种特异性结合至并拮抗人cd39的分离的单克隆抗体或其抗原结合部分,其中所述抗体或其抗原结合部分包含重链和轻链,其中所述重链包含选自由seq id no:51、25、77、103和129组成的组的氨基酸序列;并且其中所述轻链包含选自由seq id no:45、19、71、97和123组成的组的氨基酸序列。实施方案55.一种特异性结合至并拮抗人cd39的分离的单克隆抗体或其抗原结合部分,其中所述抗体或其抗原结合部分包含重链和轻链,其中所述重链包含与选自由seq id no:51、25、77、103和129组成的组的氨基酸序列具有至少90%同一性的氨基酸序列;并且其中所述轻链包含与选自由seq id no:45、19、71、97和123组成的组的氨基酸序列具有至少90%同一性的氨基酸序列。实施方案56.一种特异性结合至并拮抗人cd39的分离的单克隆抗体或其抗原结合部分,其中所述抗体或其抗原结合部分包含重链和轻链,所述重链和轻链分别包含选自由以下组成的组的氨基酸序列:(i)seq id no:35和45;(ii)seq id no:9和19;(iii)seq id no:61和71;(iv)seq id no:87和97;和(v)seq id no:113和123。实施方案57.一种特异性结合至并拮抗人cd39的分离的单克隆抗体或其抗原结合部分,其中所述抗体或其抗原结合部分包含重链和轻链,所述重链和轻链分别包含与选自由以下组成的组的氨基酸序列具有至少90%同一性的氨基酸序列:(i)seq id no:35和45;(ii)seq id no:9和19;(iii)seq id no:61和71;(iv)seq id no:87和97;和(v)seq id no:113和123。实施方案58.一种特异性结合至并拮抗人cd39的分离的单克隆抗体或其抗原结合部分,其中所述抗体或其抗原结合部分包含重链和轻链,所述重链和轻链分别包含选自由以下组成的组的氨基酸序列:(i)seq id no:47和45;(ii)seq id no:21和19;(iii)seq id no:73和71;(iv)seq id no:99和97;和(v)seq id no:125和123。实施方案59.一种特异性结合至并拮抗人cd39的分离的单克隆抗体或其抗原结合部分,其中所述抗体或其抗原结合部分包含重链和轻链,所述重链和轻链分别包含与选自由以下组成的组的氨基酸序列具有至少90%同一性的氨基酸序列:(i)seq id no:47和45;
(ii)seq id no:21和19;(iii)seq id no:73和71;(iv)seq id no:99和97;和(v)seq id no:125和123。实施方案60.一种特异性结合至并拮抗人cd39的分离的单克隆抗体或其抗原结合部分,其中所述抗体或其抗原结合部分包含重链和轻链,所述重链和轻链分别包含选自由以下组成的组的氨基酸序列:(i)seq id no:49和45;(ii)seq id no:23和19;(iii)seq id no:75和71;(iv)seq id no:101和97;和(v)seq id no:127和123。实施方案61.一种特异性结合至并拮抗人cd39的分离的单克隆抗体或其抗原结合部分,其中所述抗体或其抗原结合部分包含重链和轻链,所述重链和轻链分别包含与选自由以下组成的组的氨基酸序列具有至少90%同一性的氨基酸序列:(i)seq id no:49和45;(ii)seq id no:23和19;(iii)seq id no:75和71;(iv)seq id no:101和97;和(v)seq id no:127和123。实施方案62.一种特异性结合至并拮抗人cd39的分离的单克隆抗体或其抗原结合部分,其中所述抗体或其抗原结合部分包含重链和轻链,所述重链和轻链分别包含选自由以下组成的组的氨基酸序列:(i)seq id no:51和45;(ii)seq id no:25和19;(iii)seq id no:77和71;(iv)seq id no:103和97;和(v)seq id no:129和123。实施方案63.一种特异性结合至并拮抗人cd39的分离的单克隆抗体或其抗原结合部分,其中所述抗体或其抗原结合部分包含重链和轻链,所述重链和轻链分别包含与选自由以下组成的组的氨基酸序列具有至少90%同一性的氨基酸序列:(i)seq id no:51和45;(ii)seq id no:25和19;(iii)seq id no:77和71;(iv)seq id no:103和97;和(v)seq id no:129和123。实施方案64.一种特异性结合至并拮抗人cd39的分离的单克隆抗体或其抗原结合部分,其中所述抗体或其抗原结合部分包含重链和轻链,所述重链和轻链分别包含seq id no:35和45中所示的氨基酸序列。
实施方案65.一种特异性结合至并拮抗人cd39的分离的单克隆抗体或其抗原结合部分,其中所述抗体或其抗原结合部分包含重链和轻链,所述重链和轻链分别包含与seq id no:35和45中所示的氨基酸序列具有至少90%同一性的氨基酸序列。实施方案66.一种特异性结合至并拮抗人cd39的分离的单克隆抗体或其抗原结合部分,其中所述抗体或其抗原结合部分包含重链和轻链,所述重链和轻链分别包含seq id no:47和45中所示的氨基酸序列。实施方案67.一种特异性结合至并拮抗人cd39的分离的单克隆抗体或其抗原结合部分,其中所述抗体或其抗原结合部分包含重链和轻链,所述重链和轻链分别包含与seq id no:47和45中所示的氨基酸序列具有至少90%同一性的氨基酸序列。实施方案68.一种特异性结合至并拮抗人cd39的分离的单克隆抗体或其抗原结合部分,其中所述抗体或其抗原结合部分包含重链和轻链,所述重链和轻链分别包含seq id no:49和45中所示的氨基酸序列。实施方案69.一种特异性结合至并拮抗人cd39的分离的单克隆抗体或其抗原结合部分,其中所述抗体或其抗原结合部分包含重链和轻链,所述重链和轻链分别包含与seq id no:49和45中所示的氨基酸序列具有至少90%同一性的氨基酸序列。实施方案70.一种特异性结合至并拮抗人cd39的分离的单克隆抗体或其抗原结合部分,其中所述抗体或其抗原结合部分包含重链和轻链,所述重链和轻链分别包含seq id no:51和45中所示的氨基酸序列。实施方案71.一种特异性结合至并拮抗人cd39的分离的单克隆抗体或其抗原结合部分,其中所述抗体或其抗原结合部分包含重链和轻链,所述重链和轻链分别包含与seq id no:51和45中所示的氨基酸序列具有至少90%同一性的氨基酸序列。实施方案72.一种药物组合物,其包含前述实施方案中任一项的分离的单克隆抗体或其抗原结合部分以及药学上可接受的载剂。实施方案73.一种核酸,其包含编码实施方案1至71中任一项的分离的单克隆抗体或其抗原结合部分的轻链、重链或轻链和重链两者的核苷酸序列。实施方案74.一种表达载体,其包含实施方案73的核酸。实施方案75.一种细胞,其用实施方案74的表达载体转化。实施方案76.一种产生与人cd39特异性结合的单克隆抗体或其抗原结合部分的方法,所述方法包括在允许所述单克隆抗体或其抗原结合部分表达的条件下维持根据实施方案75的细胞。实施方案77.实施方案76的方法,其还包括获得所述单克隆抗体或其抗原结合部分。实施方案78.一种刺激受试者中的免疫响应的方法,所述方法包括向所述受试者施用有效量的实施方案1-71中任一项的分离的单克隆抗体或实施方案72的药物组合物。实施方案79.一种治疗受试者的癌症的方法,所述方法包括向所述受试者施用有效量的实施方案1-71中任一项的分离的单克隆抗体或实施方案72的药物组合物。实施方案80.一种治疗受试者的癌症的方法,所述方法包括向所述受试者施用有效量的实施方案1-71中任一项的分离的单克隆抗体或其抗原结合部分或实施方案72的药物组合物,其中所述抗体或其抗原结合部分或药物组合物抑制或降低肿瘤微环境中人cd39的酶活性,从而治疗癌症。
实施方案81.一种治疗受试者的癌症的方法,所述方法包括向所述受试者施用有效量的实施方案1-71中任一项的分离的单克隆抗体或其抗原结合部分或实施方案72的药物组合物,其中所述抗体或其抗原结合部分或所述药物组合物抑制或降低人cd39的酶活性,其中抑制或降低人cd39的酶活性抑制或降低肿瘤微环境中eatp或eadp向amp的转化,从而治疗癌症。实施方案82.一种治疗受试者的癌症的方法,所述方法包括向所述受试者施用有效量的实施方案1-71中任一项的分离的单克隆抗体或其抗原结合部分或实施方案72的药物组合物,其中所述抗体或其抗原结合部分或所述药物组合物抑制或降低人cd39的酶活性,其中抑制或降低人cd39的酶活性增加或提高肿瘤微环境中的eatp水平,从而治疗癌症。实施方案83.一种治疗受试者的癌症的方法,所述方法包括向所述受试者施用有效量的实施方案1-71中任一项的分离的单克隆抗体或其抗原结合部分或实施方案72的药物组合物,其中所述抗体或其抗原结合部分或所述药物组合物抑制或降低人cd39的酶活性,其中抑制或降低人cd39的酶活性降低或减少肿瘤微环境中细胞外腺苷水平,从而治疗癌症。实施方案84.一种治疗受试者的癌症的方法,所述方法包括向所述受试者施用有效量的实施方案1-71中任一项的分离的单克隆抗体或其抗原结合部分或实施方案72的药物组合物,其中所述抗体或其抗原结合部分或所述药物组合物抑制或降低人cd39的酶活性,其中抑制或降低人cd39的酶活性增加或提高eatp水平,并降低或减少肿瘤微环境中细胞外腺苷水平,从而治疗癌症。实施方案85.一种治疗受试者的癌症的方法,所述方法包括向所述受试者施用有效量的实施方案1-71中任一项的分离的单克隆抗体或其抗原结合部分或实施方案72的药物组合物,其中所述抗体或其抗原结合部分或所述药物组合物抑制或降低人cd39的酶活性,其中抑制或降低人cd39的酶活性维持、增加或提高肿瘤微环境中eatp的免疫刺激水平,从而治疗癌症。实施方案86.一种治疗受试者的癌症的方法,所述方法包括向所述受试者施用有效量的实施方案1-71中任一项的分离的单克隆抗体或其抗原结合部分或实施方案72的药物组合物,其中所述抗体或其抗原结合部分或所述药物组合物抑制或降低人cd39的酶活性,其中抑制或降低人cd39的酶活性增加或提高肿瘤微环境中淋巴细胞的增殖,从而治疗癌症。实施方案87.一种治疗受试者的癌症的方法,所述方法包括向所述受试者施用有效量的实施方案1-71中任一项的分离的单克隆抗体或其抗原结合部分或实施方案72的药物组合物,其中所述抗体或其抗原结合部分或所述药物组合物抑制或降低人cd39的酶活性,其中抑制或降低人cd39的酶活性提高一种或多种树突细胞活化标志物的表达。实施方案88.一种治疗受试者的癌症的方法,所述方法包括向所述受试者施用有效量的实施方案1-71中任一项的分离的单克隆抗体或其抗原结合部分或实施方案72的药物组合物,其中所述抗体或其抗原结合部分或所述药物组合物抑制或降低人cd39的酶活性,其中抑制或降低人cd39的酶活性提高一种或多种细胞因子从树突细胞的分泌。实施方案89.实施方案79至88中任一项的方法,其中所述癌症选自由以下组成的组:肺癌(例如,非小细胞肺癌)、卵巢癌、肾癌、睾丸癌、胰腺癌、乳腺癌(例如,三阴性乳腺癌)、黑素瘤、头颈癌(例如,鳞状头颈癌)、结直肠癌、膀胱癌、子宫内膜癌、前列腺癌、甲状腺癌、肝细胞癌、胃癌、脑癌、淋巴瘤或肾癌(例如,肾细胞癌)。
实施方案90.实施方案79至89中任一项所述的方法,其中将所述分离的单克隆抗体或其抗原结合部分与一种或多种另外的治疗剂或程序组合施用,其中所述第二治疗剂或程序选自由以下组成的组:化学疗法、靶向抗癌疗法、溶瘤药物、细胞毒性剂、基于免疫的疗法、细胞因子、手术程序、辐射程序、共刺激分子的激活剂、抑制性分子的抑制剂、疫苗或细胞免疫疗法或其组合。实施方案91.实施方案90的方法,其中所述一种或多种另外的治疗剂是pd-1拮抗剂、腺苷a2ar拮抗剂、cd73抑制剂、ctla-4抑制剂、tim-3抑制剂、lag-3抑制剂、嵌合抗原受体(car)细胞疗法、蒽环类药物或其组合。实施方案92.实施方案91的方法,其中所述一种或多种另外的治疗剂是cd73抑制剂和a2ar拮抗剂的组合。实施方案93.实施方案91的方法,其中所述一种或多种另外的治疗剂是pd-1拮抗剂和腺苷a2ar拮抗剂的组合。实施方案94.实施方案91的方法,其中所述一种或多种另外的治疗剂是pd-1拮抗剂。实施方案95.实施方案91、93或94中任一项的方法,其中所述pd-1拮抗剂选自由以下组成的组:pdr001、纳武单抗、培布罗珠单抗、皮地珠单抗、medi0680、regn2810、tsr-042、pf-06801591和amp-224、faz053、特朱单抗、阿维单抗、德瓦鲁单抗和bms-936559。实施方案96.实施方案91的方法,其中所述一种或多种另外的治疗剂是腺苷a2ar拮抗剂。实施方案97.实施方案91至93或97中任一项的方法,其中所述腺苷a2ar拮抗剂选自由以下组成的组:nir178、cpi-444、azd4635、vipadenant、gbv-2034和ab928。实施方案98.实施方案97的方法,其中所述腺苷a2ar拮抗剂是cpi-444。实施方案99.实施方案91的方法,其中所述一种或多种另外的治疗剂是cd73抑制剂。实施方案100.实施方案91、92或99中任一项的方法,其中所述cd73抑制剂选自由以下组成的组:ab421、medi9447和bms-986179。实施方案101.实施方案91的方法,其中所述一种或多种另外的治疗剂是ctla-4抑制剂。实施方案102.实施方案101的方法,其中所述ctla-4抑制剂是伊匹木单抗或曲美木单抗。实施方案103.实施方案91的方法,其中所述一种或多种另外的治疗剂是tim-3抑制剂。实施方案104.实施方案103所述的方法,其中所述tim-3抑制剂是mgb453或tsr-022。实施方案105.实施方案91的方法,其中所述一种或多种另外的治疗剂是lag-3抑制剂。实施方案106.实施方案105的方法,其中所述lag-3抑制剂选自由以下组成的组:lag525、bms-986016和tsr-033。实施方案107.实施方案91的方法,其中所述一种或多种另外的治疗剂是嵌合抗原受体(car)细胞疗法。实施方案108.实施例107的方法,其中所述car细胞疗法是ctl019。实施方案109.一种检测生物样品或受试者中人cd39的方法,其包括(i)在允许所述抗体分子和人cd39发生相互作用的条件下,使所述样品或所述受试者(和任选的参考样品或受试者)与表1中的任何抗体接触,以及(ii)检测所述抗体分子与所述样品或所述受试者
(和任选的参考样品或受试者)之间复合物的形成。实施方案110.实施方案1至71中任一项的分离的单克隆抗体或其抗原结合部分或实施方案72的药物组合物用于刺激受试者中的免疫响应或用于治疗受试者的癌症、任选地用于与一种或多种另外的治疗剂或程序组合施用的用途。实施方案111.一种药盒,其包含实施方案1至71中任一项的分离的单克隆抗体或其抗原结合部分或实施方案72的药物组合物以及刺激受试者中的免疫响应或治疗受试者的癌症的使用说明书,任选地具有与一种或多种另外的治疗剂或程序组合的使用说明书。实施方案112.实施方案110的用途或实施方案111的药盒,其中所述第二治疗剂或程序选自由以下组成的组:化学疗法、靶向抗癌疗法、溶瘤药物、细胞毒性剂、基于免疫的疗法、细胞因子、手术程序、辐射程序、共刺激分子的激活剂、抑制性分子的抑制剂、疫苗或细胞免疫疗法或其组合。实施方案113.实施方案110的用途或实施方案111的药盒,其中所述一种或多种另外的治疗剂是pd-1拮抗剂、腺苷a2ar拮抗剂、cd73抑制剂、ctla-4抑制剂、tim-3抑制剂、lag-3抑制剂、嵌合抗原受体(car)细胞疗法、蒽环类药物或其组合。实施方案114.实施方案110的用途或实施方案111的药盒,其中所述一种或多种另外的治疗剂是cd73抑制剂和a2ar拮抗剂的组合。实施方案115.实施方案110的用途或实施方案111的药盒,其中所述一种或多种另外的治疗剂是pd-1拮抗剂和腺苷a2ar拮抗剂的组合。实施方案116.实施方案110的用途或实施方案111的药盒,其中所述一种或多种另外的治疗剂是pd-1拮抗剂。实施方案117.实施方案116的用途或实施方案116的药盒,其中所述pd-1拮抗剂选自由以下组成的组:pdr001、纳武单抗、培布罗珠单抗、皮地珠单抗、medi0680、regn2810、tsr-042、pf-06801591和amp-224。实施方案118.实施方案116的用途或实施方案116的药盒,其中所述pd-1拮抗剂选自由以下组成的组:faz053、阿特珠单抗、阿维单抗、德瓦鲁单抗和bms-936559。实施方案119.实施方案110的用途或实施方案111的药盒,其中所述一种或多种另外的治疗剂是腺苷a2ar拮抗剂。实施方案120.实施方案119的用途或实施方案119的药盒,其中所述腺苷a2ar拮抗剂选自由以下组成的组:nir178、cpi444、azd4635、vipadenant、gbv-2034和ab928。实施方案121.实施方案110的用途或实施方案111的药盒,其中所述一种或多种另外的治疗剂是cd73抑制剂。实施方案122.实施方案121的用途或实施方案121的药盒,其中所述cd73抑制剂选自由以下组成的组:ab421、medi9447和bms-986179。实施方案123.实施方案110的用途或实施方案111的药盒,其中所述一种或多种另外的治疗剂是ctla-4抑制剂。实施方案124.实施方案123的用途或实施方案123的药盒,其中所述ctla-4抑制剂是伊匹木单抗或曲美木单抗。实施方案125.实施方案110的用途或实施方案111的药盒,其中所述一种或多种另外的治疗剂是tim-3抑制剂。
实施方案126.实施例125的用途或实施例125的药盒,其中所述tim-3抑制剂为mgb453或tsr-022。实施方案127.实施方案110的用途或实施方案111的药盒,其中所述一种或多种另外的治疗剂是lag-3抑制剂。实施方案128.实施方案127的用途或实施方案127的药盒,其中所述lag-3抑制剂选自由以下组成的组:lag525、bms-986016和tsr-033。实施方案129.实施方案110的用途或实施方案111的药盒,其中所述一种或多种另外的治疗剂是嵌合抗原受体(car)细胞疗法。实施方案130.实施例129的用途或实施例129的药盒,其中所述car细胞疗法是ctl019。实施方案131.实施方案91的方法,其中所述一种或多种另外的治疗剂是蒽环类药物。实施方案132.实施方案131的方法,其中所述蒽环类药物选自多柔比星、柔红霉素、表柔比星、伊达比星和伐柔比星。实施方案133.实施方案132的方法,其中所述蒽环类药物是多柔比星。实施方案134.实施方案110的用途或实施方案111的药盒,其中所述一种或多种另外的治疗剂是蒽环类药物。实施方案135.实施方案134的用途或实施方案134的药盒,其中所述蒽环类药物选自多柔比星、柔红霉素、表柔比星、伊达比星和伐柔比星。实施方案136.实施方案135的用途或实施方案135的药盒,其中所述蒽环类药物是多柔比星。附图简述
[0099]
图1a提供了定量在atp存在或不存在的情况下,如所指示的,用抗cd39抗体或对照抗体处理的树突细胞上的cd86的表达的图。通过流式细胞术分析测定cd86的表达。图1b提供了定量在atp存在或不存在的情况下,如所指示的,用抗cd39抗体或对照抗体处理的树突状细胞上的cd86和hla-dr的表达的图。通过流式细胞术分析测定cd86和hla-dr的表达。图1c提供了定量在atp存在或不存在的情况下,如所指示的,用抗cd39抗体或对照抗体处理的树突细胞的细胞因子il-16分泌的图。il-16的定量由msd测定。图1d提供了定量在atp存在或不存在的情况下,如所指示的,用抗cd39抗体或对照抗体处理的树突细胞的细胞因子il-12/il-23p40的分泌的图。il-12/il-23p40的定量由msd测定。图1e提供了定量在atp存在或不存在的情况下,如所指示的,用抗cd39抗体或对照抗体处理的树突细胞的细胞因子vegfa的分泌的图。vegfa的定量由msd测定。
[0100]
图2提供了描绘在atp存在的情况下,如所指示的,用抗cd39抗体或对照抗体处理的cd4+ t细胞的增殖指数的图表。细胞用细胞跟踪紫(cell trace violet)染色,并通过流式细胞术分析测定增殖。
[0101]
图3a提供了描绘如所指示的用一系列浓度的抗cd39抗体或对照抗体处理的molp-8细胞表面上的cd39活性抑制百分比的图。通过孔雀石绿磷酸盐测定法测定对atp转化的抑制。图3b提供了描绘如所指示的用一定浓度范围的抗cd39抗体或对照抗体处理的人sk-mel-28细胞表面上的cd39活性抑制百分比的图。通过孔雀石绿磷酸盐测定法测定对atp转化的抑制。图3c提供了描绘如所指示的用一定浓度范围的抗cd39抗体或对照抗体处理的原代人b细胞表面上的cd39活性抑制百分比的图。通过孔雀石绿磷酸盐测定法测定对atp转化
的抑制。图3d提供了描绘如所指示的用一定浓度范围的抗cd39抗体或对照抗体处理的原代人单核细胞表面上的cd39活性抑制百分比的图。通过孔雀石绿磷酸盐测定法测定对atp转化的抑制。
[0102]
图4a提供了描绘如所指示的抗cd39抗体或对照抗体与sk-mel-28细胞表面结合的程度的图。如所指示的,用一定浓度范围的荧光标记的抗cd39抗体或对照抗体处理细胞。通过流式细胞术分析测定抗体结合的程度。图4b提供了描绘如所指示的抗cd39抗体或对照抗体与molp-8细胞表面结合的程度的图。如所指示的,用一定浓度范围的荧光标记的抗cd39抗体或对照抗体处理细胞。通过流式细胞术分析测定抗体结合的程度。
[0103]
图5a提供了描绘植入了sk-mel-28细胞并用同种型对照抗体处理的小鼠中的肿瘤体积测量值的图。图5b提供了描绘植入了sk-mel-28细胞并如所指示的用抗cd39抗体处理的小鼠中的肿瘤体积测量值的图。
[0104]
图6提供了描绘如通过流式细胞术分析测定的纳武单抗处理对来自5个人供体的免疫细胞上的cd39表达的影响的图。在3种不同的免疫细胞类型中,一条线将匹配的未经处理的供体与纳武单抗处理的cd39水平连接起来。
[0105]
图7提供了显示通过fortebio和msd分析测量的示例性抗cd39抗体与重组人cd39的亲和力(k
d
)的表格。
[0106]
图8a提供了,如所指示的,描绘在小鼠中随时间推移的肿瘤体积测量值的图,所述小鼠植入了molp-8人多发性骨髓瘤细胞,并用单独的抗cd39抗体(srf367-a)治疗或用抗cd39抗体与蒽环类药物多柔比星(dox)的组合治疗。黑色箭头表示利用抗体的治疗。灰色箭头表示利用多柔比星的治疗。将用同种型对照抗体或单独用多柔比星治疗的小鼠用作比较者。图8b提供了描绘在第19天如图8a中治疗的小鼠的平均肿瘤体积的图。
[0107]
图9提供了,如所指示的,描绘小鼠中随时间推移的肿瘤体积测量值的图,所述小鼠植入了molp-8人多发性骨髓瘤细胞,并用单独的抗cd39抗体(srf367-a)或用抗cd39抗体(srf367-a)与腺苷a2a受体(a2ar)拮抗剂(cpi-444)的组合治疗。高尔夫用同种型对照抗体或单独用cpi-444治疗的小鼠用作对照。
具体实施方式
[0108]
各种疾病的特征在于患者中出现进行性免疫抑制。恶性肿瘤患者中免疫响应受损的存在已有详细的文献记载。癌症患者表现出多种改变的免疫功能,诸如迟发型超敏反应降低,淋巴细胞溶解功能和增殖反应降低。增强癌症患者的免疫功能可对肿瘤控制具有有益的作用。
[0109]
一方面,本公开提供了抗cd39拮抗剂抗体。在其它方面,本公开提供了用于治疗与异常cd39表达相关的病症的方法。在一些实施方案中,本公开提供了结合人cd39并抑制或降低人cd39的酶活性的抗体或其抗原结合部分。不受理论限制,据信抑制或降低人cd39的酶活性维持、增加或提高细胞外三磷酸腺苷(eatp)的水平(例如,免疫刺激水平),并降低或减少患者肿瘤微环境中细胞外腺苷水平,从而为患者提供治疗益处。定义
[0110]
除非另有说明,否则如下所示定义权利要求书和说明书中使用的术语。
[0111]
必须注意的是,除非上下文另有明确规定,否则如说明书和所附权利要求书中所
使用的,单数形式“一个/种(a)”、“一个/种(an)”和“该(the)”包括复数指代物。
[0112]
如本文中所用,“约”将被普通技术人员理解,并且将根据其中使用其的上下文在一定程度上变化。如果该术语的使用对于普通技术人员来说不清楚,给出其中使用其的上下文,“约”将表示达到特定值的正负10%。
[0113]
在本申请中,除非另有说明,否则“或”的使用表示“和/或”。在多项从属权利要求的上下文中,“或”的使用仅在替代方案中指一项以上的在先独立或从属权利要求。术语“包含”、“包括”和“具有”在本文中可互换使用。根据本发明,“分离的”分子是已经从其自然环境中取出的分子。因此,术语“分离的”不一定反映分子被纯化的程度。
[0114]
如本文中所用,术语“细胞外三磷酸腺苷”或“细胞外atp”或“eatp”是指位于组织或组织样品中细胞外的组织或组织样品中的腺苷5
’-
三磷酸,其在嘌呤能信号传导中起作用。如本文中所用,术语“细胞外腺苷”是指位于组织或组织样品中细胞外的组织或组织样品中的腺苷,其在嘌呤能信号传导中起作用。在组织或组织样品中,细胞外atp的量、浓度或水平与细胞外腺苷的量、浓度或水平之间存在关系。在生理(即,正常)条件下,atp的稳态细胞溶胶(即,细胞内)浓度的范围为约3mm至约10mm,而细胞外atp的量、浓度或水平为约10nm。作为细胞外酶(例如,胞外核苷酸酶、cd39、cd79)将细胞外atp代谢或转化为细胞外5
’-
二磷酸腺苷(eadp)、细胞外5
’-
磷酸腺苷(eamp)和细胞外腺苷的活性的结果,维持细胞外atp的水平(trautmann(2009)sci signal 2(56):pe6)。
[0115]
细胞外核苷(例如,细胞外腺苷)和核苷酸(例如,细胞外atp)参与嘌呤能信号传导,所述信号传导参与介导正常生理细胞响应,包括但不限于刺激(或抑制)细胞死亡、细胞增殖、迁移和/或分化,以及细胞分泌生长因子和/或炎症介质。病理生理过程诸如组织稳态、伤口愈合、神经变性、抗肿瘤免疫、炎症和癌症也受嘌呤能信号传导调整(bours等人,(2011)front biosci(schol编辑)3:1443-1456;khakh等人,(2006)nature 442:527-532;idzko等人,(2014)509:310-317;antonioli等人,(2013)rev cancer 13:842-857)。组织中静息细胞周围的低浓度的细胞外atp标志着邻近活细胞的存在。此外,细胞外atp的瞬时增加与例如神经和血管系统中的正常的生理信号传导相关。然而,组织中细胞外atp水平的显著升高(例如,在免疫原性细胞死亡icd期间)用作导致炎症过程的诱导和免疫系统响应(例如,抗肿瘤响应)的调节的关键的“危险”信号(martins等人,(2014)cell death differ21(1):79-91)。
[0116]
与细胞外atp水平相对较低(约10nm)的健康组织相反,在组织损伤、炎症的部位和肿瘤微环境(tme)中细胞外atp水平升高可达到超过100μm的浓度(virgilio和adinolfi(2017)oncogene36:293-303)。受损组织或tme中细胞外atp水平的升高已被证明会导致免疫调节和免疫刺激作用(vijayan等人,(2017)nat rev cancer17:709-724)。如本文中所用,术语“atp的免疫刺激水平”是指诱导、刺激或提高免疫响应的细胞外atp的量、量、浓度、丰度或水平。
[0117]
在一些癌症中,由于升高的细胞外atp水平的加速水解,tme内的条件最终会导致细胞外腺苷的积累。与升高的细胞外atp水平的免疫刺激作用相反,已知细胞外腺苷例如在一些癌症的tme中会诱导免疫抑制作用(virgilio(2012)cancer res 72(21):5441-5447)。在tme中主要负责将细胞外atp转化为细胞外腺苷的酶是胞外核苷酸酶cd39和cd73。在tme中,已证明腺苷的免疫抑制作用至少部分通过调节性t细胞(treg)的扩增、效应t细胞响应
的抑制和髓源性抑制细胞(mdsc)的扩增来介导的(allard等人,(2016)curr opin pharmacol 29:7-16;allard等人,(2016)immunotherapy 8:145-163)。
[0118]
如本文中所用,术语“丙氨酸扫描”是指用于确定特定野生型残基对给定蛋白质或多肽的稳定性或一种或多种功能(例如,结合亲和力)的贡献的技术。该技术包括用丙氨酸残基取代多肽中的野生型残基,然后评估丙氨酸取代的衍生物或突变多肽的稳定性或一种或多种功能(例如,结合亲和力),并与野生型多肽进行比较。用丙氨酸取代多肽中的野生型残基的技术是本领域已知的。
[0119]
术语“改善”是指治疗疾病状态(例如,癌症)中的任何治疗上有益的结果,包括其预防、严重度或进展的减轻、缓解或治愈。
[0120]
如本文中所用,术语“氨基酸”指天然存在的和合成的氨基酸,以及以类似于天然存在的氨基酸的方式起作用的氨基酸类似物和氨基酸模拟物。天然存在的氨基酸是那些由遗传密码编码的氨基酸,以及那些后来被修饰的氨基酸,例如羟脯氨酸、γ-羧基谷氨酸和o-磷酸丝氨酸。氨基酸类似物是指具有与天然存在的氨基酸相同的基本化学结构(即与氢、羧基、氨基和r基团结合的碳)的化合物,例如高丝氨酸、正亮氨酸、甲硫氨酸亚砜、甲硫氨酸甲基锍。此类类似物具有经修饰的r基团(例如,正亮氨酸)或经修饰的肽主链,但保留了与天然存在的氨基酸相同的基本化学结构。氨基酸模拟物是指其结构不同于氨基酸的一般化学结构,但其功能与天然存在的氨基酸相似的化合物。
[0121]
氨基酸在本文中可通过它们通常已知的三个字母符号或由iupac-iub生化命名委员会推荐的一个字母符号来指代。同样,核苷酸也可用它们普遍接受的单字母代码来指代。
[0122]
如本文中所用,“氨基酸置换”是指用第二不同的“替换”氨基酸残基替换预定氨基酸序列(起始多肽的氨基酸序列)中的至少一个现存氨基酸残基。“氨基酸插入”是指将至少一个另外的氨基酸掺入预定的氨基酸序列中。虽然插入通常由一个或两个氨基酸残基的插入组成,但也可进行更大的“肽插入”,例如插入约3至约5个或甚至高达约10、15或20个氨基酸残基。如上所公开的,一个或多个插入的残基可以是天然存在的或非天然存在的。“氨基酸缺失”是指从预定的氨基酸序列中去除至少一个氨基酸残基。
[0123]
如本文中所用,术语“量”或“水平”在最广泛的意义上使用,并且是指物质(例如,代谢物、小分子、蛋白质、mrna、标志物)的量、浓度或丰度。当提到代谢物或小分子(例如三磷酸腺苷(atp))时,术语“量”、“水平”和“浓度”通常可互换使用,并且通常指生物样品中的可检测量。“升高的水平”或“提高的水平”是指样品中物质的数量、浓度或丰度相对于对照样品(诸如来自未患有疾病或病症(例如,癌症)的一个或多个个体)或内部对照的增加。在一些实施方案中,样品中物质(例如,atp)的升高的水平是指相对于对照样品中物质的量,物质的量增加约5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、96%、97%、98%、99%或100%,如通过本领域已知的技术(例如,孔雀绿测定)所测定的。“降低的水平”是指个体中物质(例如,atp)的数量、浓度或丰度相对于对照(诸如来自未患有疾病或病症(例如,癌症)的一个或多个个体)或内部对照的降低。在一些实施方案中,降低的水平很少或为不可检测的量、浓度或丰度。在一些实施方案中,样品中物质(例如,atp)的降低的水平是指相对于对照样品中物质的量,物质的量减少约5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、96%、97%、98%、99%或100%,如通过本领域已知的技
术(例如,孔雀石绿测定)所测定的。
[0124]
当提及蛋白质、mrna或标志物(诸如本文所述的那些)时,术语“表达的水平”或“表达水平”通常可互换使用,并且通常指生物样品中蛋白质、mrna或标记物的可检测量。在一些实施方案中,蛋白质、mrna或标志物的可检测量或可检测水平与对剂(诸如本文所述的那些)的响应可能性相关。“表达”通常是指籍以将基因中包含的信息转化为细胞中存在并起作用的结构(例如,蛋白质标志物,诸如cd86)的过程。因此,如本文中所用,“表达”可指转录成多核苷酸、翻译成多肽,或者甚至多核苷酸和/或多肽修饰(例如,多肽的翻译后修饰)。转录的多核苷酸、翻译的多肽、或多核苷酸和/或多肽修饰(例如,多肽的翻译后修饰)的片段也应被认为是表达的,无论它们来源于由选择性剪接或降解的转录物产生的转录物,还是来源于多肽的翻译后加工(例如通过蛋白水解)。“表达的基因”包括转录成多核苷酸(作为mrna)的基因,然后翻译成多肽的那些基因,也包括转录成核糖核酸但不翻译成多肽(例如,转运rna和核糖体rna)的那些基因。“升高的表达”、“升高的表达水平”或“升高的水平”是指样品中的物质相对于对照样品(诸如未患疾病或病症(例如,癌症)的一个或多个个体)或内部对照的表达增加或水平升高。在一些实施方案中,样品中物质(例如,蛋白质标志物,诸如cd86)的升高的表达是指相对于对照样品中物质的量,物质的量增加约5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、96%、97%、98%、99%或100%,如通过本领域已知的技术(例如,facs)测定的。“减少的表达”、“降低的表达水平”或“降低的水平”是指个体中的物质(例如,蛋白质标志物)相对于对照(诸如未患疾病或病症(例如,癌症)的一个或多个个体)或内部对照的减少的表达或降低的水平。在一些实施方案中,减少的表达是很少或没有表达。在一些实施方案中,样品中物质(例如,蛋白质标志物)的减少的表达是指相对于对照样品中物质的量,物质的量减少了约5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、96%、97%、98%、99%或100%,如通过本领域已知的技术(例如,facs)所测定的。
[0125]
如本文中所用,术语“拮抗(antagonize)”、“拮抗(antagonizes)”或当涉及名词“拮抗剂”等时,指部分或完全阻断、抑制或中和、消除或去除天然多肽(包括酶)的生物活性。如本文中所用,“拮抗人cd39”的抗体是部分或完全阻断、抑制、中和、消除或去除cd39酶的酶活性的抗体。在一些实施方案中,以剂量依赖的方式观察到拮抗活性。在一些实施方案中,测量的信号(例如,生物活性)比在可比较的条件下利用阴性对照测量的信号低至少约5%、至少约10%、至少约15%、至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%、至少约95%或至少约100%。本文还公开了鉴定适用于本公开方法的拮抗剂的方法。例如,这些方法包括鉴定与拮抗人cd39结合的抗体,例如结合试验,诸如酶联免疫吸附测定(elisa)、forte系统和放射免疫测定法(ria)。诸如此类的测定可用于测定抗体结合目标多肽(例如,cd39)的能力以及抗体拮抗多肽(例如,cd39)的能力。拮抗剂抗体的效力还可使用功能测定(诸如拮抗剂抑制多肽或激动剂功能的能力)来测定。例如,功能测定可包括将多肽与候选拮抗剂分子接触,并测量通常与多肽相关的一种或多种生物活性的可检测变化。拮抗剂的效力可由其ic
50
值(抑制50%激动剂响应所需的浓度)来定义。ic
50
值越低,拮抗剂的效力越大,抑制最大生物响应所需的浓
度越低。
[0126]
如本文中所用,术语“抗cd39拮抗剂抗体”(可互换地称为“抗cd39抗体”)是指本文所述的抗体,例如表1中的抗体。在一些实施方案中,抗cd39抗体与cd39(例如,人cd39)结合,并拮抗cd39生物活性和/或由cd39信号传导介导的一个或多个下游途径或其它cd39介导的功能,例如酶活性。抗cd39拮抗剂抗体包括阻断、拮抗、阻抑、抑制、消除或降低cd39生物活性(例如,配体结合、酶活性)(包括由cd39信号传导或功能介导的下游途径,诸如受体结合和/或引发对cd39或其代谢物的细胞响应)的抗体。在一些实施方案中,抗cd39抗体与cd39特异性结合。
[0127]
在一些实施方案中,抗cd39拮抗剂抗体与cd39结合,并阻止或抑制cd39与其同源或正常配体结合。在一些实施方案中,抗cd39拮抗剂抗体与cd39结合并抑制或减少三磷酸腺苷(atp)向一磷酸腺苷(amp)的酶促转化。在一些实施方案中,抗cd39拮抗剂抗体与cd39结合并抑制或减少二磷酸腺苷(adp)向一磷酸腺苷(amp)的酶促转化。在一些实施方案中,抗cd39拮抗剂抗体与cd39结合并维持或增加atp的免疫刺激量。在一些实施方案中,抗cd39拮抗剂抗体与cd39结合并使腺苷水平减少或降低。在一些实施方案中,抗cd39拮抗剂抗体与cd39结合并刺激或提高抗肿瘤响应。在一些实施方案中,抗cd39拮抗剂抗体以约5nm-20nm的亲和力与cd39结合。在一些实施方案中,抗cd39拮抗剂抗体与cd39结合,并且包含野生型或突变型igg1或野生型或突变型igg4重链恒定区。本文提供了抗cd39拮抗剂抗体的实例。
[0128]
如本文中所用,术语“抗体”是指包含两个轻链多肽和两个重链多肽的完整抗体。完整抗体包括不同的抗体同种型,包括igm、igg、iga、igd和ige抗体。术语“抗体”包括多克隆抗体、单克隆抗体、嵌合(chimerized)或嵌合(chimeric)抗体、人源化抗体、灵长类化抗体(primatized antibody)、去免疫化抗体和完全人抗体。抗体可以在多种物种中的任何一种中制备或源于多种物种中的任一种,所述物种是例如哺乳动物诸如人、非人灵长类动物(例如,猩猩、狒狒或黑猩猩)、马、牛、猪、绵羊、山羊、狗、猫、兔、豚鼠、沙鼠、仓鼠、大鼠和小鼠。抗体可以是分离的、纯化的或重组的抗体。
[0129]
如本文中所用,术语“抗体片段”、“抗原结合片段”或类似术语是指保留与靶抗原(例如,cd39)结合并抑制所述靶抗原活性的能力,但长度小于全长的抗体片段。此类片段包括例如单链抗体、单链fv片段(scfv)、fd片段、fab片段、fab
’
片段或f(ab
’
)
2
片段。scfv片段是单个多肽链,其包括scfv所源自的抗体的重链和轻链可变区两者。另外,抗体的定义中还包括胞内抗体、微型抗体、三抗体(triabody)和双抗体(diabody),所述抗体适用于本文所述的方法。参见,例如,todorovska等人,(2001)j.immunol.methods 248(1):47-66;hudson和kortt,(1999)j.immunol.methods 231(1):177-189;poljak,(1994)structure 2(12):1121-1123;rondon和marasco,(1997)annu.rev.microbiol.51:257-283,所述文献的每一篇的公开内容通过引用整体并入本文。
[0130]
如本文中所用,术语“抗体片段”还包括,例如,单结构域抗体,诸如骆驼化单结构域抗体。参见,例如,muyldermans等人,(2001)trends biochem.sci.26:230-235;nuttall等人,(2000)curr.pharm.biotech.1:253-263;reichmann等人,(1999)j.immunol.meth.231:25-38;pct申请公开号wo 94/04678和wo 94/25591以及美国专利第6,005,079号,其全部通过引用整体并入本文。在一些实施方案中,本公开提供了包含两个
具有修饰的vh结构域(使得能形成单结构域抗体)的单结构域抗体。
[0131]
在一些实施方案中,抗原结合片段包括重链多肽的可变区和轻链多肽的可变区。在一些实施方案中,本文所述的抗原结合片段包含抗体的轻链和重链多肽的cdr。
[0132]
双抗体是具有两个抗原结合位点的抗体片段,其可以是二价的或双特异性的。参见,例如,ep 404,097;wo 1993/01161;hudson等人,nat.med.9:129-134(2003)以及hollinger等人,proc.natl.acad.sci.usa 90:6444-6448(1993)。在hudson等人,nat.med.9:129-134(2003)中也描述了三抗体和四抗体。
[0133]
抗体片段可通过各种技术制备,包括但不限于完整抗体的蛋白水解消化以及通过重组宿主细胞(如大肠杆菌(e.coli)或噬菌体)产生,如本文所述。
[0134]
术语“抗原呈递细胞”或“apc”是在其表面显示与mhc复合的外来抗原的细胞。t细胞通过t细胞受体(tcr)识别这种复合物。apc细胞的实例包括但不限于:b细胞、树突细胞(dc)、外周血单核细胞(pbmc)、单核细胞(诸如thp-1)、b淋巴母细胞样细胞(诸如c1r.a2,1518b-lcl)和单核细胞来源的树突细胞(dc)。一些apc通过吞噬作用或受体介导的内吞作用将抗原内化。
[0135]
术语“抗原呈递”是指apc籍以捕获抗原并使其能被t细胞识别(例如,作为mhc-i和/或mhc-ii缀合物的组分)的过程。
[0136]
如本文中所用,术语“细胞凋亡”是指发生在多细胞生物(例如人)中的程序性细胞死亡过程。导致细胞凋亡的受高度调节的生化和分子事件可导致对细胞的可观察到的和特有的形态学变化,包括膜泡化、细胞体积皱缩、染色体dna凝缩和断裂以及mrna衰变。鉴定经历细胞凋亡的细胞(包括t细胞)的常用方法是将细胞暴露于缀合有荧光团的蛋白(膜联蛋白v)。膜联蛋白v通常用于通过其与质膜外小叶上的磷脂酰丝氨酸结合的能力来检测凋亡细胞,与质膜外小叶上的磷脂酰丝氨酸结合是细胞正在经历细胞凋亡过程的早期指标。
[0137]
如本文中所用,术语“b细胞”(或者“b淋巴细胞”)是指淋巴细胞亚型的一种类型的白细胞。b细胞通过分泌抗体在适应性免疫系统的体液免疫成分中发挥作用。b细胞也呈现抗原并分泌细胞因子。b细胞,与另外两类淋巴细胞(t细胞和天然杀伤细胞)不同,在它们的细胞膜上表达b细胞受体(bcr)。bcr允许b细胞与特定抗原结合,其将启动针对该抗原的抗体响应。
[0138]
如本文中所用,术语“与固定的cd39结合”是指本公开的抗体与cd39(例如,在细胞表面表达的或附着于固体支持物的cd39)结合的能力。
[0139]
如本文中所用,术语“双特异性”或“双功能抗体”是指具有两个不同重/轻链对和两个不同结合位点的人工杂交抗体。双特异性抗体可通过多种方法产生,包括杂交瘤的融合或fab
’
片段的连接。参见,例如,songsivilai&lachmann,(1990)clin.exp.immunol.79:315-321;kostelny等人,(1992)j.immunol.148:1547-1553。
[0140]
常规地,双特异性抗体的重组产生基于两个免疫球蛋白重链/轻链对的共表达,其中两个重链/轻链对具有不同的特异性(milstein和cuello,(1983)nature 305:537-539)。可将具有所需结合特异性(抗体-抗原结合性位点)的抗体可变结构域与免疫球蛋白恒定结构域序列融合。优选将重链可变区与免疫球蛋白重链恒定区(包括铰链区、ch2区和ch3区的至少一部分)融合。关于目前已知的用于产生双特异性抗体的说明性方法的进一步细节,参见例如suresh等人,(1986)methods enzymol.121:210;pct公开号wo 96/27011;brennan等
人,(1985)science 229:81;shalaby等人,j.exp.med.(1992)175:217-225;kostelny等人,(1992)j.immunol.148(5):1547-1553;hollinger等人,(1993)proc.natl.acad.sci.usa 90:6444-6448;gruber等人,(1994)j.immunol.152:5368以及tutt等人,(1991)j.immunol.147:60。双特异性抗体还包括交联或异源缀合的抗体。异源缀合的抗体可使用任何方便的交联方法制备。合适的交联剂是本领域公知的,并与许多交联技术一起公开于美国专利第4,676,980号中。
[0141]
还描述了直接从重组细胞培养物中制备和分离双特异性抗体片段的各种技术。例如,使用亮氨酸拉链已经产生了双特异性抗体。参见,例如,kostelny等人(1992)j immunol 148(5):1547-1553。可通过基因融合将来自fos和jun蛋白的亮氨酸拉链肽与两种不同抗体的fab
’
部分连接。可在铰链区将抗体同二聚体还原形成单体,然后再氧化形成抗体异二聚体。所述方法也可用于生产抗体同二聚体。hollinger等人(1993)proc natl acad sci usa 90:6444-6448描述的“双抗体”技术为制备双特异性抗体片段提供了替代机制。所述片段包含通过接头与轻链可变结构域(vl)连接的重链可变结构域(vh),所述接头太短而不能使同一链上的两个结构域之间配对。因此,一个片段的vh和vl结构域被迫与另一个片段的互补vl和vh结构域配对,从而形成两个抗原结合位点。还报道了用于通过使用单链fv(scfv)二聚体制备双特异性抗体片段的另一种策略。参见,例如,gruber等人(1994)j immunol 152:5368。或者,抗体可以是如zapata等人(1995)protein eng.8(10):1057-1062中所述的“线性抗体”。简言之,这些抗体包含一对串联fd区段(vh-ch1-vh-ch1),它们形成一对抗原结合区。线性抗体可以是双特异性的或单特异性的。
[0142]
在例如tutt等人(1991)j immunol 147:60中设想和描述具有两个以上效价的抗体(例如,三特异性抗体)。
[0143]
本公开还包括多特异性抗体的变体形式,诸如wu等人(2007)nat biotechnol 25(11):1290-1297中描述的双重可变结构域免疫球蛋白(dvd-ig)分子。dvd-ig分子被设计成使得来自两种不同亲本抗体的两个不同轻链可变结构域(vl)直接串联连接或通过重组dna技术经由短接头连接,随后是轻链恒定结构域。类似地,重链包含两个串联连接的不同重链可变结构域(vh),随后是恒定区ch1和fc区。从两种亲本抗体制备dvd-ig分子的方法在例如pct公开号wo 08/024188和wo 07/024715中有进一步描述。在一些实施方案中,双特异性抗体是fab串联免疫球蛋白,其中具有第二特异性的轻链可变区与完整抗体的重链可变区融合。此类抗体描述于例如国际专利申请公开号wo 2015/103072中。
[0144]
如本文中所用,“癌症抗原”或“肿瘤抗原”是指(i)肿瘤特异性抗原,(ii)肿瘤相关抗原,(iii)表达肿瘤特异性抗原的细胞,(iv)表达肿瘤相关抗原的细胞,(v)肿瘤上的胚胎抗原,(vi)自体肿瘤细胞,(vii)肿瘤特异性膜抗原,(viii)肿瘤相关膜抗原,(ix)生长因子受体,(x)生长因子配体,和(xi)与癌症相关的任何其它类型的抗原或抗原呈递细胞或材料。
[0145]
如本文中所用,术语“癌症特异性免疫响应”是指由肿瘤、癌细胞或癌症抗原的存在诱导的免疫响应。在某些实施方案中,响应包括癌症抗原特异性淋巴细胞的增殖。在某些实施方案中,响应包括抗体和t细胞受体的表达和上调以及淋巴因子、趋化因子和细胞因子的形成和释放。先天免疫系统和获得性免疫系统相互作用,以启动针对肿瘤、癌细胞或癌症抗原的抗原响应。在某些实施方案中,癌症特异性免疫响应是t细胞响应。
[0146]
术语“癌”是本领域承认的,指上皮或内分泌组织的恶性肿瘤,包括呼吸系统癌、胃肠系统癌、泌尿生殖系统癌、睾丸癌、乳腺癌、前列腺癌、内分泌系统癌和黑素瘤。本文所述的抗cd39抗体可用于治疗患有、怀疑患有任何类型的癌症(包括肾癌或黑素瘤)或任何病毒性疾病或可能有发生所述癌症或病毒性疾病的高风险的患者。示例性癌包括由子宫颈、肺、前列腺、乳房、头和颈、结肠和卵巢的组织形成的那些癌。该术语还包括癌肉瘤,其包括由癌瘤性组织和肉瘤组织组成的恶性肿瘤。“腺癌”是指来源于腺组织或其中肿瘤细胞形成可识别的腺体结构的癌。
[0147]
如本文中所用,术语“cd39”是指由entpd1基因在人体内编码的胞外核苷三磷酸二磷酸水解酶1多肽。cd39的其它名称包括entpd1、atpd酶、ntpd酶-1和spg64。cd39催化细胞外三磷酸核苷(ntp;例如三磷酸腺苷或atp)和二磷酸核苷(ndp;例如,二磷酸腺苷或adp)的γ-和β-磷酸残基水解,将这些分子转化为一磷酸核苷(nmp;例如,一磷酸腺苷或amp)衍生物。cd39的示例性氨基酸序列示于seq id no:138中,以及还有ncbi参考序列:np_001767.3中。本公开提供了结合至并拮抗人cd39的抗体。
[0148]
如本文中所用,术语“cd86”(b70/b7-2)是指约75kd的细胞表面蛋白,其为cd28和ctla-4的第二配体,并在早期免疫响应中对t细胞的共刺激中起重要作用(azuma m.等人,1993,nature366:76;nozawa y.等人,1993,j.pathology 169:309;engle,p.等人,1994,blood 84:1402;engel,p.等人,cd86 workshop report。于:leukocyte typing v.schlossman,s.f.等人编辑,1994,oxford university press;yang,x.f.等人,1994,upregulation of cd86 antigen on tpa stimulated u937 cells,1994,(摘要)。american society of hematology,nashville,tn;guesdon,j.-l.等人1979,j.histochem.cytochem.27:1131-1139)。
[0149]
如本文中所用,术语“cdr”意指互补决定区。术语“高变区”或“hvr”有时用来代替“cdr”,这两个术语都指抗体可变结构域中在序列上高度可变(“互补决定区”或“cdr”)和/或形成结构上确定的环(“高变环”)和/或包含抗原接触残基(“抗原接触”)的每一个区域。一般来说,抗体包含六个hvr/cdr:三个在vh中(h1、h2、h3),三个在vl中(l1、l2、l3)。
[0150]
如本文中所用,术语“细胞毒性t淋巴细胞(ctl)响应”是指由细胞毒性t细胞诱导的免疫响应。ctl响应主要由cd8
+ t细胞介导。
[0151]
如本文中所用,术语“化学治疗剂”(或者“细胞毒性化学治疗剂”)是指已知用于治疗癌症的化学或药物试剂。此外,如本文中所用,该术语意指通常为具有细胞毒性的非特异性细胞内毒物的那些药物试剂,尤其是那些起到抑制细胞分裂过程(称为有丝分裂)的作用的药物试剂,并且排除了更加选择性地靶向已知导致或促成癌症的形成、发展和/或维持的细胞组分的药物试剂。化学治疗剂可诱导一种或多种细胞死亡模式,包括可导致atp释放的免疫原性细胞死亡。
[0152]
如本文中所用,术语“竞争”,当在竞争对相同表位的结合的抗原结合蛋白(例如,免疫球蛋白、抗体或其抗原结合片段)的上下文中使用时,是指通过测定(例如,竞争性结合测定;交叉阻断测定)确定的抗原结合蛋白之间的相互作用),其中测试抗原结合蛋白(例如,测试抗体)抑制(例如,减少或阻断)参考抗原结合蛋白(例如,参考抗体,诸如srf367)与共同抗原(例如,cd39或其片段)的特异性结合。在一些实施方案中,本文所述的抗体与srf367(即,分别包含seq id no:33和43的重链和轻链可变序列的抗体)交叉竞争。
[0153]“源自”指定多肽或蛋白质的多肽或氨基酸序列是指多肽的来源。优选地,源自特定序列的多肽或氨基酸序列具有与该序列或其部分(其中所述部分由至少10-20个氨基酸,优选至少20-30个氨基酸,更优选至少30-50个氨基酸组成)基本相同,或者另外地可被本领域普通技术人员识别为源自该序列的氨基酸序列。源自另一种肽的多肽相对于起始多肽可具有一个或多个突变,例如,已被另一种氨基酸残基取代或者已具有一个或多个氨基酸残基插入或缺失的一个或多个氨基酸残基。
[0154]
多肽可包含非天然存在的氨基酸序列。此类变体必须与起始分子具有小于100%的序列同一性或相似性。在某些实施方案中,变体将具有例如在变体分子的长度上与起始多肽的氨基酸序列具有约75%至小于100%,更优选约80%至小于100%,更优选约85%至小于100%,更优选约90%至小于100%(例如,91%、92%、93%、94%、95%、96%、97%、98%、99%),最优选约95%至小于100%的氨基酸序列同一性或相似性的氨基酸序列。
[0155]
在某些实施方案中,起始多肽序列与源自其的序列之间具有一个氨基酸差异。相对于该序列的同一性或相似性在本文中被定义为:在比对序列并引入空位(如果需要的话)以实现最大百分比的序列同一性之后,候选序列中与初始序列相同(即,相同残基)的氨基酸残基的百分比。在某些实施方案中,多肽由选自表1中所示的序列的氨基酸序列组成、基本上由该氨基酸序列组成或包含该氨基酸序列。在某些实施方案中,多肽包括与选自表1中所示的序列的氨基酸序列具有至少80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的氨基酸序列。在某些实施方案中,多肽包括与选自表1中所示的序列的连续氨基酸序列具有至少80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的连续氨基酸序列。在某些实施方案中,多肽包括具有选自表1中所示的序列的氨基酸序列的至少10个、15个、20个、25个、30个、35个、40个、45个、50个、55个、60个、65个、70个、75个、80个、85个、90个、95个、100个、200个、300个、400个或500个(或这些数字中的任何整数)连续氨基酸的氨基酸序列。
[0156]
在某些实施方案中,本公开的抗体由核苷酸序列编码。本发明的核苷酸序列可用于多种应用,包括克隆、基因疗法、蛋白质表达和纯化、突变引入、有此需要的宿主的dna疫苗接种、抗体生成(对于,例如,被动免疫)、pcr、引物和探针生成等。在某些实施方案中,本发明的核苷酸序列包含选自表1中所示的序列的核苷酸序列,由所述核苷酸序列组成,或基本上由所述核苷酸序列组成。在某些实施方案中,核苷酸序列包括与选自表1中所示的序列的核苷酸序列具有至少80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的核苷酸序列。在某些实施方案中,核苷酸序列包括与选自表1中所示的序列的连续核苷酸序列具有至少80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的连续核苷酸序列。在某些实施方案中,核苷酸序列包括具有选自表1中所示的序列的核苷酸序列的至少10个、15个、20个、25个、30个、35个、40个、45个、50个、55个、60个、65个、70个、75个、80个、85个、90个、95个、100个、200个、300个、400个或500个(或这些数字中的任何整数)连续核苷酸的核苷酸序列。
[0157]
本领域普通技术人员还将理解,适用于本文公开的方法的抗体可以被改变,使得它们在序列上不同于它们所源自的天然存在的或天然的序列,同时保留天然序列的所需活
性。例如,可进行导致“非必需”氨基酸残基处的保守取代或改变的核苷酸或氨基酸取代。可通过标准技术(诸如定点诱变和pcr介导的诱变)引入突变。
[0158]
适用于本文公开的方法的抗体可在一个或多个氨基酸残基处,例如在必需或非必需氨基酸残基处包含保守氨基酸取代。“保守氨基酸取代”是其中氨基酸残基被具有相似侧链的氨基酸残基取代的氨基酸取代。本领域已经定义了具有相似侧链的氨基酸残基的家族,包括碱性侧链(例如,赖氨酸、精氨酸、组氨酸)、酸性侧链(例如,天冬氨酸、谷氨酸)、不带电荷的极性侧链(例如,甘氨酸、天冬酰胺、谷氨酰胺、丝氨酸、苏氨酸、酪氨酸、半胱氨酸)、非极性侧链(例如,丙氨酸、缬氨酸、亮氨酸、异亮氨酸、脯氨酸、苯丙氨酸、甲硫氨酸、色氨酸)、β-支链侧链(例如,苏氨酸、缬氨酸、异亮氨酸)和芳香族侧链(例如,酪氨酸、苯丙氨酸、色氨酸、组氨酸)。因此,结合多肽中的非必需氨基酸残基优选被来自相同侧链家族的另一种氨基酸残基替代。在某些实施方案中,一段氨基酸可被结构相似的段替代,所述段在顺序和/或侧链家族成员的组成上不同。或者,在某些实施方案中,可沿着编码序列的全部或部分随机引入突变,例如通过饱和诱变,并且可将所得的突变体掺入本发明的结合多肽中,并筛选它们与所需靶标结合的能力。
[0159]
如本文中所用,术语抗原“交叉呈递”是指通过apc上的mhc i类和ii类分子向t细胞呈递外源蛋白抗原。
[0160]
如本文中所用,术语“交叉反应”是指本公开的抗体与来自不同物种的cd39结合的能力。例如,结合人cd39的本公开的抗体也可结合另一物种的cd39。如本文中所用,通过在结合测定(例如,spr、elisa)中检测与纯化的抗原的特异性反应性,或通过检测与生理表达cd39的细胞的结合或以其它方式与所述细胞的功能性相互作用来测量交叉反应性。用于确定交叉反应性的方法包括本文所述的标准结合测定,例如,通过biacore
tm
表面等离子体共振(spr)分析,使用biacore
tm 2000spr仪(biacore ab,uppsala,sweden)或流式细胞技术。
[0161]
如本文中所用,术语“细胞毒性t淋巴细胞(ctl)响应”是指由细胞毒性t细胞诱导的免疫响应。ctl响应主要由cd8
+ t细胞介导。
[0162]
如本文中所用,术语“树突细胞”或“dc”是指为骨髓(bm)源性白细胞,并且为最强效的抗原呈递细胞类型的抗原呈递细胞的类型。dc捕获并处理抗原,将蛋白质转化为肽,呈现在t细胞所识别的主要组织相容性复合体(mhc)分子上。dc是异质性的,例如髓样和浆细胞样dc;尽管所有dc都能够摄取抗原、处理抗原并呈递给初始t细胞,但dc亚型具有不同的标志物,并在定位、迁移途径、详细的免疫功能以及对感染或炎症刺激(针对其生成)的依赖性方面有所不同。在适应性免疫响应的发展过程中,dc的表型和功能在启动耐受性、记忆和极化的t-辅助细胞1(th1)、th2和th17分化中起作用。
[0163]
如本文中所用,术语“树突细胞活化”是指从未成熟树突细胞向成熟树突细胞的转变;并且活化的树突细胞包括成熟的树突细胞和转变过程中的树突细胞,其中诱导共刺激信号的cd80和cd86的表达被活化刺激升高。成熟的人树突细胞是对cd40、cd80、cd86和hla-ii类(例如,hla-dr)的表达呈阳性的细胞。例如,基于选自由cd80和cd86组成的组的标志物,可以将未成熟树突细胞与成熟树突细胞区分开来。未成熟树突细胞对这些标志物呈弱阳性,优选为阴性,而成熟树突细胞呈阳性。成熟树突细胞的区别由本领域技术人员常规地进行,并且上述各自的标志物和测量其表达的方法也是本领域技术人员公知的。
[0164]
如本文中所用,术语“ec
50”是指抗体或其抗原结合部分在体外或体内测定中诱导
为最大响应的50%(即,在最大响应与基线之间的一半处)的响应的浓度。
[0165]
如本文中所用,术语“有效剂量(effective dose)”或“有效剂量(effective dosage)”被定义为足以实现或至少部分实现所需效果的量。术语“治疗有效剂量”被定义为足以治愈或至少部分阻止已经患有疾病的患者的疾病及其并发症的量。对于这种用途的有效的量取决于所治疗病症的严重程度和患者自身免疫系统的一般状态。
[0166]
如本文中所用,术语“表位”或“抗原决定簇”是指抗原上免疫球蛋白或抗体所特异性结合的位点。术语“表位作图”是指鉴定抗体或其抗原结合片段在其靶蛋白抗原上的结合位点或表位的过程或方法。本文提供了表位作图方法和技术。表位既可由连续氨基酸形成,也可由通过蛋白质的三级折叠而紧靠的非连续氨基酸形成。由连续氨基酸形成的表位在暴露于变性溶剂时通常得以保留,然而由三级折叠形成的表位在用变性溶剂处理时通常丢失。表位通常以独特的空间构象包括至少3个、4个、5个、6个、7个、8个、9个、10个、11个、12个、13个、14个或15个氨基酸。用于确定给定抗体结合哪些表位的方法(即,表位作图)在本领域中是公知的,包括例如免疫印迹和免疫沉淀测定,其中测试cd39的重叠或连续肽与给定抗cd39抗体的反应性。确定表位空间构象的方法包括本领域的技术和本文所述的技术,例如,x射线晶体学和二维核磁共振(参见,例如,epitope mapping protocols in methods in molecular biology,第66卷,g.e.morris,编辑(1996))。
[0167]
本公开还包括与cd39上的表位结合的抗体,所述表位包含本文所述的特定抗体所识别的表位的全部或部分(例如,相同或重叠的区域或所述区域之间或跨越所述区域的区域)。
[0168]
本公开还包括结合相同表位的抗体和/或与本文所述抗体竞争对人cd39的结合的抗体。识别相同表位或竞争结合的抗体可使用常规技术来进行鉴定。此类技术包括,例如,免疫测定,其显示一种抗体阻断另一种抗体与靶抗原结合的能力,即,竞争性结合测定。在其中所测试的免疫球蛋白抑制参考抗体与共同抗原(诸如cd39)的特异性结合的测定中测定竞争性结合。许多类型的竞争性结合测定是已知的,例如:固相直接或间接放射免疫测定(ria)、固相直接或间接酶免疫测定(eia)、夹心竞争测定(参见stahli等人,methods in enzymology 9:242(1983));solid phase direct biotin-avidin eia(see kirkland等人,j.immunol.137:3614(1986));固相直接标记测定、固相直接标记夹心测定(参见harlow和lane,antibodies:a laboratory manual,cold spring harbor press(1988));使用i-125标记物的固相直接标记ria(参见morel等人,mol.immunol.25(1):7(1988));固相直接生物素-抗生物素蛋白eia(cheung等人,virology 176:546(1990));和直接标记的ria。(moldenhauer等人,scand.j.immunol.32:77(1990))。典型地,这种测定包括使用与固体表面结合的纯化抗原或带有这两者之一的细胞、未标记的测试免疫球蛋白和标记的参考免疫球蛋白。通过在测试免疫球蛋白存在的情况下测定与固体表面或细胞结合的标记物的量来测量竞争性抑制。通常测试免疫球蛋白过量存在。通常,当竞争抗体过量存在时,其将抑制参考抗体与共同抗原的特异性结合至少50-55%、55-60%、60-65%、65-70%、70-75%或更多。
[0169]
其它技术包括,例如,表位作图方法,诸如,抗原:抗体复合物晶体的x射线分析,其提供表位的原子分辨率,以及与氢/氘(h/d)交换组合的质谱分析,其研究抗原:抗体相互作用的构象和动力学。其它方法监测抗体与抗原片段或抗原的突变形式的结合,其中由于抗
原序列中氨基酸残基的修饰而导致的结合丧失通常被认为是表位组分的指示。另外,还可使用用于表位作图的计算组合方法。这些方法依赖于目标抗体从组合噬菌体展示肽库中亲和分离特定短肽的能力。然后将肽视为对应于用于筛选肽文库的抗体的表位定义的前导。对于表位作图,也已开发了计算算法,所述算法已经被证明能对构象不连续的表位作图。
[0170]
如本文中所用,术语“fc介导的效应子功能”或“fc效应子功能”是指除抗体的主要功能和目的外的抗体的生物活性。例如,治疗性不可知抗体(therapeutic agnostic antibody)的效应子功能是除靶蛋白或途径的激活外的生物活性。抗体效应功能的实例包括c1q结合和补体依赖性细胞毒性;fc受体结合;抗体依赖性细胞介导的细胞毒性(adcc);吞噬作用;细胞表面受体(例如,b细胞受体)的下调;表达fc受体的血小板的活化的缺乏;和b细胞活化。许多效应子功能始于fc与fcγ受体的结合。在一些实施方案中,肿瘤抗原靶向抗体具有效应子功能,例如adcc活性。在一些实施方案中,本文所述的肿瘤抗原靶向抗体包含相对于恒定区的未修饰形式具有增强的效应子功能(例如,增强的介导adcc的能力)的变体恒定区。
[0171]
如本文中所用,术语“fc受体”是指在免疫效应细胞表面上发现的多肽,其被抗体的fc区结合。在一些实施方案中,fc受体是fcγ受体。fcγ受体有三个亚类:fcγri(cd64)、fcγrii(cd32)和fγcriii(cd16)。所有四种igg同种型(igg1、igg2、igg3和igg4)结合并激活fc受体fcγri、fcγriia和fcγriiia。fcγriib是抑制性受体,因此与该受体结合的抗体不会激活补体和细胞响应。fcγri是以单体形式与igg结合的高亲和力受体,而fcγriia和fcγriia是仅以多聚体形式结合igg且亲和力稍低的低亲和力受体。抗体与fc受体和/或c1q的结合受fc区内特定残基或结构域的控制。结合还取决于位于铰链区内和抗体的ch2部分内的残基。在一些实施方案中,本文所述抗体的激动和/或治疗活性依赖于fc区与fc受体(例如,fcγr)的结合。在一些实施方案中,本文所述抗体的激动和/或治疗活性通过fc区与fc受体(例如,fcγr)的结合而提高。
[0172]
如本文中所用,术语“人抗体”包括具有人种系免疫球蛋白序列的可变区和恒定区(如果存在的话)的抗体。本公开的人抗体可包括不由人种系免疫球蛋白序列编码的氨基酸残基(例如,通过体外随机或位点特异性诱变或通过体内体细胞突变引入的突变)(参见,例如,lonberg等人,(1994)nature 368(6474):856-859);lonberg,(1994)handbook of experimental pharmacology 113:49-101;lonberg&huszar,(1995)intern.rev.immunol.13:65-93,和harding&lonberg,(1995)ann.n.y.acad.sci.764:536-546)。然而,术语“人抗体”不包括其中来源于另一种哺乳动物物种(诸如小鼠)的种系的cdr序列已经被移植到人框架序列上的抗体(即人源化抗体)。
[0173]
如本文中所用,术语“异源抗体”是相对于产生这种抗体的转基因非人生物定义的。该术语是指具有氨基酸序列或编码核酸序列的抗体,所述氨基酸序列或编码核酸序列对应于在不由转基因非人动物组成的生物体中发现的氨基酸序列或编码核酸序列,并且通常来自除转基因非人动物外的物种。
[0174]
术语“诱导免疫响应”和“提高免疫响应”可互换使用,是指对特定抗原的免疫响应的刺激(即,被动或适应性的)。关于诱导cdc或adcc所使用的术语“诱导”是指特定直接细胞杀伤机制的刺激。
[0175]
如本文中所用,术语“免疫原性细胞死亡”(或者称为“免疫原性细胞凋亡”)是指一
种细胞死亡方式,其中肿瘤细胞与化学、生物或药物试剂的接触与一种或多种信号传导途径的激活相关,所述信号传导途径诱导来自肿瘤细胞的损伤相关分子模式(damp)分子(例如,三磷酸腺苷,atp)的死亡前表达和释放,导致肿瘤细胞免疫原性的增强和肿瘤细胞以免疫原性方式(例如,通过吞噬作用)死亡。icd是细胞死亡的一种形式,其诱导内质网(er)应激,并涉及细胞表面组成的变化以及增强濒死细胞的免疫原性潜能的damp的释放。damp包括钙网蛋白、热激蛋白、分泌型两性霉素(hmgb1)和atp。在icd诱导后,钙网蛋白被转移到濒死细胞的表面,在那里其充当专业吞噬细胞的“吃我”信号。hsp70和hsp90也被转移到质膜,在那里它们与抗原呈递细胞(apc)相互作用,并促进肿瘤抗原与mhc i类分子的交叉呈递,导致cd8+ t细胞反应。hmgb1被释放到细胞外空间,在那里其与apc上的toll样受体结合,并促进树突细胞(专业apc)向t细胞呈递肿瘤抗原。atp分泌将单核细胞募集到细胞死亡的部位。与肿瘤或癌细胞的icd相关的变化可通过受试者中树突细胞的活化、成熟和增强的抗原呈递以及特异性t细胞响应的激活来诱导有效的抗肿瘤免疫响应。
[0176]
如本文中所用,术语“免疫原性细胞死亡诱导剂”是指诱导免疫原性细胞死亡过程、途径或方式的化学、生物或药物试剂。
[0177]
如本文中所用,结合治疗性治疗使用的术语“联合”应理解为意指在受试者患有病症的过程中向受试者递送两种(或更多种)不同的治疗,例如两种(或更多种)治疗剂,使得治疗对患者的作用在某个时间点重叠。在某些实施方案中,一种治疗的递送在另一种治疗的递送开始之前结束(例如,第一治疗在第二或第三(后续)治疗之前)。在某些其它实施方案中,当第二种治疗开始时,仍在进行一种治疗的递送,使得在施用方面存在重叠。这在本文中有时被称为“同时的”或“同时递送”在某些实施方案中,在递送联合治疗后,症状或与相病症关的其它参数的减少大于在另一种治疗不存在的情况下对于递送的一种治疗所观察到的所述减少。
[0178]
如本文中所用,术语“抑制”或“阻断”(例如,指抑制/阻断人cd39介导的三磷酸核苷(例如,三磷酸腺苷,atp)或二磷酸核苷(例如,二磷酸腺苷,adp)向一磷酸核苷(例如,一磷酸腺苷,amp)的转化)可互换使用,并包括部分和完全抑制/阻断。cd39的抑制/阻断降低或改变了在没有抑制或阻断的情况下发生的活性的正常水平或类型。抑制和阻断也旨在包括与不与抗cd39抗体接触的cd39相比,当与抗cd39抗体接触时cd39的结合亲和力的任何可测量的降低,例如,抑制cd39的结合至少约10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、96%、97%、98%、99%或100%在一些实施方案中,抗cd39抗体抑制三磷酸核苷(例如,atp)的转化至少约70%。在一些实施方案中,抗cd39抗体抑制酸三磷酸核苷(例如atp)的转化至少80%。
[0179]
如本文中所用,术语“抑制生长”(例如,涉及细胞)旨在包括细胞生长的任何可测量的降低,例如抑制细胞生长至少约10%、20%、30%、40%、50%、60%、70%、80%、90%、99%或100%。
[0180]
如本文中所用,“需要预防的”、“需要治疗的”或“有此需要的”受试者是指根据适当的从业医生(例如,在人的情况下,医生、护士或护理人员;在非人哺乳动物的情况下,兽医)的断断将合理地受益于给定的治疗(诸如用包含抗cd39抗体的组合物治疗)的受试者。
[0181]
术语“体内”是指发生在活生物体中的过程。
[0182]
如本文中所用,术语“分离的抗体”是指基本上不含具有不同抗原特异性的其它抗
体的抗体(例如,与人cd39结合的分离的抗体基本上不含结合除cd39外的抗原的抗体)。然而,与表位结合的分离的抗体可与来自不同物种的其它cd39蛋白具有交叉反应性。然而,在本文所述的特异性结合测试中,抗体继续显示与人cd39的特异性结合。另外,分离的抗体通常基本上不含其它细胞物质和/或化学物质。在一些实施方案中,将具有不同cd39特异性的“分离的”抗体的组合组合在明确定义的组合物中。
[0183]
如本文中所用,术语“分离的核酸分子”是指编码与cd39结合的抗体或抗体部分(例如,vh、vl、cdr3)的核酸,旨在指其中编码抗体或抗体部分的核苷酸序列不含编码结合除cd39外的抗原的抗体或抗体部分的其它核苷酸序列的核酸分子,所述其它序列可天然地在人基因组dna中位于所述核酸的两侧。例如,选自表1中所示的序列的序列对应于包含本文所述抗cd39抗体的重链(vh)和轻链(vl)可变区的核苷酸序列。
[0184]
如本文中所用,“同种型”是指由重链恒定区基因编码的抗体类别(如igm或igg1)。在一些实施方案中,本公开的人抗体是igg1同种型。在一些实施方案中,本公开的人抗体是igg2同种型。在一些实施方案中,本公开的人抗体是igg3同种型。在一些实施方案中,本公开的人抗体是igg4同种型。在一些实施例中,同种型是野生型。在一些实施方案中,同种型是突变型。如本文中所用,根据eu编号,具有“a”名称的抗体具有包含s228p突变的igg4同种型。如本文中所用,根据eu编号,具有“b”名称的抗体具有包含s228p和l235e突变的igg4同种型。如本文中所用,具有“c”名称的抗体具有“c”名称具有野生型igg1同种型。如本文中所用,具有“d”名称的抗体具有野生型igg4同种型。关于s228p igg4突变的论述,参见,例如,vidarsson等人front immunol.(2014),5:520(通过引用整体并入本文),以及第6页,第2栏,第一个完整段落。关于s228p和l235e igg4突变的论述,参见,例如,newman等人clinical immunol.(2001)98(2):164-174(通过引用整体并入本文)。
[0185]
如本文中所用,术语“同种型转换”是指抗体的种类或同种型从一种ig种类变为另一种ig种类的现象。
[0186]
如本文中所用,术语“kd”或“k
d”是指抗体与抗原之间的结合反应的平衡解离常数。k
d
的值是抗体解离速率常数(kd)与抗体结合速率常数(ka)之比的数值表示。k
d
的值与抗体对抗原的结合亲和力成反比。k
d
值越小,抗体对其抗原的亲和力越大。亲和力是单个分子与其配体结合的强度,通常通过平衡解离常数(k
d
)来测量和报告,该常数用于评估和排列双分子相互作用的排序强度。
[0187]
如本文中所用,术语“kd”或“k
d”(或者“koff”或“k
off”)是指抗体从抗体/抗原复合物中解离的解离速率常数。kd的值每秒衰变或解离的复合物的分数的数值表示,以秒-1
为单位表示。
[0188]
如本文中所用,术语“ka”或“k
a”(或者“kon”或“k
on”)旨在指抗体与抗原缔合的结合速率常数。ka的值是在1摩尔(1m)抗体和抗原溶液中每秒钟形成的抗体/抗原复合物数量的数值表示,以m-1
sec-1
为单位表示。
[0189]
如本文中所用,术语“白细胞(leukocyte)”是指参与保护身体免受感染性生物体和外来物质侵害的一种类型的白血细胞。白细胞在骨髓中产生。白细胞有5种主要类型,分为两大类:多形核白细胞(中性粒细胞、嗜酸性粒细胞、嗜碱性粒细胞)和单核白细胞(单核细胞和淋巴细胞)。
[0190]
如本文中所用,术语“淋巴细胞”是指参与身体的免疫防御的一种类型的白细胞或
白血细胞。淋巴细胞有两种主要类型:b细胞和t细胞。
[0191]
如本文中所用,术语“连接的”、“融合的”或“融合”可互换使用。这些术语是指通过任何方式,包括化学缀合或重组方式,将两个或更多个元件或组分或结构域连接在一起。化学缀合的方法(例如,使用异双官能交联剂)是本领域已知的。
[0192]
如本文中所用,“局部施用”或“局部递送”是指不依赖于组合物或剂通过血管系统转运至其预定的靶组织或部位的递送药。例如,可通过注射或植入组合物或剂或通过注射或植入包含组合物或剂的装置来递送组合物。在靶组织或部位附近局部施用后,组合物或剂或其一种或多种组分可以扩散到预期的靶组织或部位。
[0193]
如本文中所用,“mhc分子”指两种类型的分子:mhc i类和mhc ii类。mhc i类分子向特异性cd8+ t细胞呈递抗原,mhc ii类分子向特异性cd4+ t细胞呈递抗原。外源性递送至apc的抗原主要被加工用于与mhc ii类缔合。相反地,内源性递送至apc的抗原主要被加工用于与mhc i类缔合。
[0194]
如本文中所用,术语“单克隆抗体”是指表现出对特定表位的单一结合特异性和亲和力的抗体。因此,术语“人单克隆抗体”是指表现出单一结合特异性并且具有来源于人种系免疫球蛋白序列的可变区和任选的恒定区的抗体。在一些实施方案中,人单克隆抗体由杂交瘤产生,所述杂交瘤包括与永生化细胞融合的获自转基因非人动物(例如,转基因小鼠)的b细胞,所述动物具有包含人重链转基因和轻链转基因的基因组。
[0195]
如本文中所用,术语“单核细胞”是指一种类型的白细胞,其可分化为巨噬细胞和树突细胞以实现免疫响应。
[0196]
如本文中所用,术语“天然杀伤(nk)细胞”是指一种类型的细胞毒性淋巴细胞。这些是大的、通常是颗粒状的非t、非b淋巴细胞,它们杀死某些肿瘤细胞,并在针对病毒和其它细胞内病原体的先天免疫方面以及在抗体依赖性细胞介导的细胞毒性(adcc)方面起着重要作用。
[0197]
如本文中所用,应用于物体的术语“天然存在的”是指物体可以存在于自然界中的事实。例如,存在于生物体(包括病毒)中的多肽或多核苷酸序列是天然存在的,所述多肽或多核苷酸序列可以从自然界的来源中分离出来,并且在实验室中未被人有意修饰过。
[0198]
如本文中所用,术语“非转换的同种型的”是指当没有发生同种型转换时产生的重链的同种型类别;编码非转换的同种型的ch基因通常是紧接在功能重排的vdj基因下游的第一个ch基因。同型转换分为经典同型转换和非经典同型转换。经典同种型转换通过涉及转基因中至少一个转换序列区的重组事件而发生。非经典同种型转换可通过例如人σμ与人∑μ之间的同源重组(δ-相关缺失)来发生。替代的非经典转换机制,诸如基因间和/或染色体间重组等,可以发生并实现同种型转换。
[0199]
如本文中所用,术语“核酸”是指以单链或双链形式存在的脱氧核糖核苷酸或核糖核苷酸及其聚合物。除非特别限定,否则该术语包括含有已知天然核苷酸类似物的核酸,所述核酸具有与参考核酸相似的结合特性,并且以与天然存在的核苷酸相似的方式代谢。除非另外指出,否则特定的核酸序列还隐含地包括其保守修饰的变体(例如,简并密码子替换)和互补序列以及明确指出的序列。具体而言,简并密码子替换可通过产生序列来实现,在所述序列中一个或多个选择的(或所有的)密码子的第三位被混合碱基和/或脱氧肌苷残基取代取代(batzer等人,nucleic acid res.19:5081,1991;ohtsuka等人,
biol.chem.260:2605-2608,1985;以及cassol等人,1992;rossolini等人,mol.cell.probes 8:91-98,1994)。对于精氨酸和亮氨酸,第二碱基处的修饰也可以是保守的。术语核酸可与基因、cdna和由基因编码的mrna互换使用。
[0200]
本文使用的多核苷酸可以由任何多核糖核苷酸或多脱氧核糖核苷酸组成,其可以是未修饰的rna或dna或经修饰的rna或dna。例如,多核苷酸可由单链和双链dna、为单链区和双链区的混合物的dna、单链和双链rna以及为单链区和双链区的混合物的rna、包含可为单链区或更常见地双链区或者单链区和双链区的混合物的dna和rna的杂交分子组成。另外,多核苷酸可由包含rna或dna或rna和dna的三链区组成。多核苷酸还可包含一个或多个经修饰的碱基或为了稳定性或其它原因而修饰的dna或rna骨架。“经修饰的”碱基包括,例如,三苯甲基化碱基和稀有碱基,诸如肌苷。可对dna和rna进行各种修饰;因此,“多核苷酸”包括化学、酶促或代谢修饰的形式。
[0201]
当核酸与另一种核酸序列处于功能关系中时,其为“可操作地连接的”。例如,如果启动子或增强子影响序列的转录,则其与编码序列可操作地连接。就转录调控序列而言,可操作地连接的意味着被连接的dna序列是连续的,并且在必要时连接两个蛋白质编码区(所述两个蛋白质编码区是连续的并且在读框中)。对于转换序列,可操作地连接表示该序列能够实现转换重组。
[0202]
如本文中所用,“肠胃外施用”、“肠胃外施用的”和其它语法上等同的短语是指除肠内和局部施用外的施用方式,通常通过注射,包括但不限于静脉内、鼻内、眼内、肌内、动脉内、鞘内、囊内、眶内、心内、皮内、腹膜内、经气管、皮下、表皮下、关节内、包膜下、蛛网膜下、脊柱内、硬膜外、大脑内、颅内、颈内动脉内和胸骨内注射和输注。
[0203]
如本文中所用,术语“患者”可与“受试者”和“个体”互换使用,包括接受预防性或治疗性治疗的人和其它哺乳动物受试者。
[0204]
如本文中所用,术语“pd-1拮抗剂”是指抑制pd-1信号传导途径或以其它方式抑制细胞(例如免疫细胞)中的pd-1功能的任何化合物或生物分子。在一些实施方案中,pd-1拮抗剂阻断pd-l1与pd-1和/或pd-l2与pd-1的结合。在一些实施方案中,pd-1拮抗剂结合pd-1。在一些实施方案中,pd-1拮抗剂结合pd-l1。
[0205]
在两个或更多个核酸或多肽序列的上下文中,术语“同一性百分比”是指当就最大一致性进行比较和比对时,具有如使用下述序列比较算法(例如,blastp和blastn或本领域技术人员可用的其它算法)之一或通过目测测量的特定百分比的相同的核苷酸或氨基酸的两个或更多个序列或子序列。取决于应用,“同一性百分比”可存在于被比较序列的区域上,例如,存在于功能结构域上,或者,存在于待比较的两个序列的全长上。对于序列比较,通常地,一个序列充当与测试序列进行比较的参考序列。当使用序列比较算法时,将测试和参考序列输入到计算机中,如果需要,指定子序列坐标,并且指定序列算法程序参数。然后,序列比较算法根据指定的程序参数,计算一个或多个测试序列相对于参考序列的序列同一性百分比。
[0206]
用于比较的序列的最佳比对可以例如通过smith&waterman,adv.appl.math.2:482(1981)的局部同源性算法,通过needleman&wunsch,j.mol.biol.48:443(1970)的同源性比对算法,通过pearson&lipman,proc.nat'l.acad.sci.usa 85:2444(1988)的相似性搜索方法,通过这些算法的计算机化执行(wisconsin genetics软件包中的gap、bestfit、
fasta和tfasta,genetics computer group,575science dr.,madison,wis.),或通过目测(通常参见ausubel等人,在下文中)来进行。
[0207]
适于测定序列同一性百分比和序列相似性的算法的一个实例是blast算法,所述算法描述于altschul等人,j.mol.biol.215:403-410(1990)中。用于进行blast分析的软件可通过国家生物技术信息中心网站公开获得。
[0208]
如本文中通常所用的,“药学上可接受的”是指在合理的医学判断范围内,适于与人类和动物的组织、器官和/或体液接触使用而没有过度毒性、刺激、过敏反应或与合理的效益/风险比相称的其它问题或并发症的那些化合物、材料、组合物和/或剂型。
[0209]
如本文中所用,“药学上可接受的载剂”是指并包括生理上相容的任何和所有的溶剂、分散介质、包衣、抗细菌和抗真菌剂、等渗剂和吸收延迟剂等。所述组合物可包括药学上可接受的盐,例如酸加成盐或碱加成盐(参见,例如,berge等人(1977)j pharm sci 66:1-19)。
[0210]
如本文中所用,术语“多肽”、“肽”和“蛋白质”可互换使用,指氨基酸残基的聚合物。所述术语适用于其中一个或多个氨基酸残基是相应的天然存在的氨基酸的人工化学模拟物的氨基酸聚合物,以及天然存在的氨基酸聚合物和非天然存在的氨基酸聚合物。
[0211]
如本文中所用,术语“预防”,当结合疾患使用时,是指相对于未接受组合物的受试者,降低受试者的疾患的症状的频率或延迟其发作的组合物的施用。
[0212]
如本文中所用,用于本文所述的任何蛋白质(抗体或片段)的术语“纯化的”或“分离的”是指从天然伴随其的组分(例如,蛋白质或其它天然存在的生物或有机分子)(例如,表达所述蛋白质的原核生物中的其它蛋白质、脂质和核酸)中分离或纯化的多肽。通常,当多肽构成按重量计至少60%(例如,至少65%、70%、75%、80%、85%、90%、92%、95%、97%或99%)的样品中的总蛋白质时,所述多肽被纯化。
[0213]
如本文中所用,术语“程序性细胞死亡蛋白1”或“pd-1”是指程序性细胞死亡蛋白1多肽(一种属于cd28家族的免疫抑制性受体),并且由人中的pdcd1基因编码。pd-1的替代名称或同义词包括:pdcd1、pd1、cd279和sleb2。pd-1主要在体内在先前活化的t细胞、b细胞和髓样细胞上表达,并与两种配体pd-l1和pd-l2结合。如本文中所用,术语“pd-1”包括人pd-1(hpd-1)、hpd-1的变体、同种型和物种同源物,以及与hpd-1具有至少一个共同表位的类似物。完整的hpd-1序列可在genbank登录号aac51773下找到。
[0214]
如本文中所用,术语“程序性死亡配体-1”或“pd-l1”是pd-1的两种细胞表面糖蛋白配体之一(另一种是pd-l2),其在与pd-1结合时下调t细胞活化和细胞因子分泌。pd-l1的替代名称和同义词包括:pdcd1l1、pdl1、b7h1、b7-4、cd274和b7-h。本文所用术语“pd-l1”包括人pd-l1(hpd-l1)、hpd-l1的变体、同种型和物种同源物,以及与hpd-l1具有至少一个共同表位的类似物。完整的hpd-l1序列可在genbank登录号q9nzq7下找到。
[0215]
pd-1被称为免疫抑制蛋白,其负向调节tcr信号(ishida,y.等人(1992)embo j.11:3887-3895;blank,c.等人(epub2006年12月29日)immunol.immunother.56(5):739-745)。pd-1与pd-l1之间的相互作用可充当免疫检查点,其可导致t细胞受体介导的增殖降低(dong等人(2003)j.mol.med.81:281-7;blank等人(2005)cancer immunol.immunother.54:307-314;konishi等人(2004)clin.cancer res.10:5094-100)。免疫抑制可通过抑制pd-1与pd-l1或pd-l2的局部相互作用来逆转;当pd-1与pd-l2的相互
作用也被阻断时,所述效应是累加的(iwai等人(2002)proc.nat'l.acad.sci.usa99:12293-7;brown等人(2003)j.immunol.170:1257-66)。
[0216]
对于几种癌症,肿瘤的存活和增殖是由肿瘤介导的免疫检查点调节维持的。这种调节可导致抗癌免疫系统功能的破坏。例如,最近的研究表明,肿瘤细胞表达免疫检查点受体配体,诸如pd-l1或pd-l2,可以特别地通过抑制t细胞来下调肿瘤微环境中的免疫系统活性并促进癌症免疫逃避。pd-l1在多种人癌症中大量表达(dong等人,(2002)nat med 8:787-789)。pd-l1受体pd-1在淋巴细胞(例如,活化的t细胞)上表达,通常参与下调(特别地通过抑制t细胞)免疫系统和促进自身耐受性。然而,当在t细胞上表达的pd-1受体与肿瘤细胞上的同源pd-l1配体结合时,所产生的t细胞抑制导致针对肿瘤的免疫响应受损(例如,肿瘤浸润性淋巴细胞降低或癌细胞建立免疫逃避)。
[0217]
在例如卵巢癌、肾癌、结直肠癌、胰腺癌、肝癌和黑素瘤的大样本组中,已表明,无论后续治疗如何,pd-l1表达均与预后不良和总生存率降低相关(参见,例如,dong等人,(2002)nat med8(8):793-800;yang等人,(2008)invest ophthalmol vis sci 49(6):2518-2525;ghebeh等人,(2006)neoplasia 8:190-198;hamanishi等人,(2007)proc nat acad sci usa 104:3360-3365;thompson等人,(2006)clin genitourin cancer 5:206-211;nomi等人,(2005)clin cancer res11:2947-2953;inman等人,(2007)cancer 109:1499-1505;shimauchi等人,(2007)int j cancer 121:2585-2590;gao等人,(2009)clin cancer res 15:971-979;nakanishi等人,(2007)cancer immunol immunother56:1173-1182;hino等人,(2010)cancer 116(7):1757-1766)。类似地,发现肿瘤淋巴细胞上的pd-1表达标志着乳腺癌(kitano等人,(2017)esmo open 2(2):e000150)和黑素瘤(kleffel等人,(2015)cell162(6):1242-1256)中的功能失调的t细胞。pd-1拮抗剂,诸如影响pd-1/pd-l1/pd-l2信号传导轴的功能和/或破坏pd-1与pd-l1和/或pd-l2之间相互作用的那些拮抗剂,已被开发出来,并且代表了一类新型的抗肿瘤抑制剂,其通过调节免疫细胞-肿瘤细胞相互作用发挥作用。
[0218]
如本文中所用,术语“重排的”是指重链或轻链免疫球蛋白基因座的构型,在所述构型中v区段以分别编码基本上完整的vh或vl结构域的构象紧邻d-j或j区段。通过与种系dna比较,可以鉴定重排的免疫球蛋白基因座;重排的基因座将具有至少一个重组的七聚体/九聚体同源元件。
[0219]
如本文中所用,术语“重组宿主细胞”(或简称为“宿主细胞”)旨在指已向其中引入了重组表达载体的细胞。应当理解,此类术语不仅指特定的受试细胞,还指这种细胞的后代。因为由于突变或环境影响,某些修饰可以在后续世代中发生,所以这样的后代实际上可能与亲代细胞不完全相同,但仍包括在本文所用的术语“宿主细胞”的范围内。
[0220]
如本文中所用,术语“重组人抗体”包括通过重组手段制备、表达、产生或分离的所有人抗体,诸如(a)从动物(例如,小鼠)或由其制备的杂交瘤中分离的抗体,所述动物对于人免疫球蛋白基因而言是转基因的或跨染色体的,(b)从经转化以表达所述抗体的宿主细胞,例如从转染瘤中分离的抗体,(c)从重组组合人抗体文库中分离的抗体,和(d)通过涉及将人免疫球蛋白基因序列剪接到其它dna序列的任何其它手段制备、表达、产生或分离的抗体。此类重组人抗体包含利用特定人种系免疫球蛋白序列的可变区和恒定区,所述可变区和恒定区序列由种系基因编码,但包括随后例如在抗体成熟过程中发生的重排和突变。如
本领域所知的(参见,例如,lonberg(2005)nature biotech.23(9):1117-1125),可变区包含抗原结合结构域,其由各种基因编码,所述基因重排形成对外来抗原特异的抗体。除了重排以外,可变区还可通过多个单个氨基酸变化(称为体细胞突变或超突变)被进一步修饰,以增加抗体对外来抗原的亲和力。恒定区将随着对抗原的进一步响反而改变(即,同种型转换)。因此,响应抗原而重排和体细胞突变的编码轻链和重链免疫球蛋白多肽的核酸分子可能与原始核酸分子不具有完全相同的序列,而是具有实质相同或相似(即,具有至少80%的同一性)。
[0221]
如本文中所用,术语“参考抗体”(可与“参考mab”互换使用)或“参考抗原结合蛋白”是与cd39上的特定表位结合并用于建立其自身与一种或多种不同抗体之间的关系的抗体或其抗原结合片段,其中所述关系是参考抗体和一种或多种不同抗体与cd39上相同表位的结合。如本文中所用,所述术语意指抗cd39抗体,其可用于测试或测定,诸如本文所述的那些测试或分析(例如,竞争性结合测定),用作竞争者,其中所述测定可用于发现、鉴定或开发一种或多种与相同表位结合的不同抗体。表1中提供了示例性参考抗体(srf367)的可变重(vh)和轻链(vl)氨基酸序列(vh,seq id no.33;vl,seq id no.43)。
[0222]
如本文中所用,术语“特异性结合(specific binding)”、“选择性结合(selective binding)”、“选择性结合(selectively binds)”和“特异性结合(specifically binds)”是指抗体与预定抗原上的表位的结合。通常而言,当使用重组人cd39作为分析物和抗体作为配体在biacore2000仪器中通过表面等离子体共振(spr)技术测定时,抗体以约小于10-6
m,诸如约小于10-7
、10-8
m、10-9
m或10-10
m或甚至更低的平衡解离常数(kd)结合,并且其与预定抗原结合的亲和力为其与除所述预定抗原或密切相关的抗原外的非特异性抗原(例如,bsa、酪蛋白)结合的亲和力的至少两倍。短语“识别抗原的抗体”、“对抗原具有特异性的抗体”和“结合的抗体”在本文中可与术语“与抗原(诸如cd39)特异性结合的抗体”互换使用。
[0223]
如本文中所用,术语“转换序列”是指负责转换重组的那些dna序列。“转换供体”序列,通常为μ转换区,将为在转换重组过程中被删除的构建体区域的5
’
(即,上游)。“转换受体”区域将在待删除的构建体区域与替换恒定区(例如,γ,ε,等)之间。由于不存在总是发生重组的特定位点,因此最终的基因序列通常不能从构建体中预测。
[0224]
如本文中所用,术语“受试者”包括任何人或非人动物。例如,本发明的方法和组合物可用于治疗患有免疫病症的受试者。术语“非人动物”包括所有脊椎动物,例如哺乳动物和非哺乳动物,诸如非人灵长类动物、绵羊、狗、牛、鸡、两栖动物、爬行动物等。
[0225]
对于核酸,术语“实质同源性”表示两个核酸或其指定的序列,当被最佳比对和比较时,在具有适当的核苷酸插入或缺失的情况下,在至少约80%的核苷酸中,通常至少约90%至95%,更优选至少约98%至99.5%的核苷酸中是相同的。或者,当区段在选择性杂交条件下与链的互补序列杂交时,存在实质同源性。
[0226]
两个序列之间的同一性百分比是序列所共享的相同位置的数量的函数(即,同源性%=相同位置的数量/位置总数
×
100),其中考虑了需要被引入以进行两个序列的最佳比对的缺口的数量和每个间隙的长度。序列的比较和两个序列之间同一性百分比的确定可使用如以下非限制性实例中所述的数学算法来完成。
[0227]
两个核苷酸序列之间的同一性百分比可使用gcg软件包(可在http://www.gcg.com上获得)中的gap程序,使用nwsgapdna.cmp矩阵以及为40、50、60、70或80的缺
口权重和为1、2、3、4、5或6的长度权重来确定。两个核苷酸或氨基酸序列之间的同一性百分比也可使用已并入align程序(2.0版)的e.meyers和w.miller(cabios,4:11-17(1989)的算法,使用pam120权重残基表、为12的缺口长度罚分、为4的缺口罚分来确定。另外,两个氨基酸序列之间的同一性百分比可使用已并入gcg软件包(可在http://www.gcg.com上获得)中的gap程序中的needleman和wunsch(j.mol.biol.(48):444-453(1970))算法,使用blossum 62矩阵或pam250矩阵、为16、14、12、10、8、6或4的缺口权重、为1、2、3、4、5或6的长度权重来确定。
[0228]
可将本公开的核酸和蛋白质序列进一步用作“查询序列”,以针对公共数据库执行搜索,以例如鉴定相关序列。此类搜索可使用altschul等人(1990)j.mol.biol.215:403-10的nblast和xblast程序(2.0版)来进行。可用nblast程序、得分=100、字长=12来进行blast核苷酸搜索,以获得与本发明核酸分子同源的核苷酸序列。可用xblast程序、得分=50、字长=3来进行blast蛋白质搜索,以获得与本发明蛋白质分子同源的氨基酸序列。为了获得用于比较目的的有缺口的比对,可如altschul等人,(1997)nucleic acids res.25(17):3389-3402中所述,使用有缺口的blast。当使用blast和有缺口的blast程序时,可使用相应程序(例如,xblast和nblast)的默认参数。参见http://www.ncbi.nlm.nih.gov。
[0229]
核酸可以以完整细胞、细胞裂解物或部分纯化或基本纯的形式存在。当通过标准技术(包括碱性/sds处理、cscl显带、柱层析、琼脂糖凝胶电泳和本领域公知的其它技术)从其它细胞组分或其它污染物(例如,其它细胞核酸或蛋白质)中纯化出来时,核酸被“分离”或“基本上纯化”。参见,f.ausubel等人,编辑current protocols in molecular biology,greene publishing and wiley interscience,new york(1987)。
[0230]
可根据提供基因序列的标准技术,对来自cdna、基因组dna或其混合物的本公开的核酸组合物(尽管通常是天然序列(除经修饰的限制性位点等外))进行突变。对于编码序列,这些突变可以根据需要影响氨基酸序列。特别地,设想了与天然v序列、d序列、j序列、恒定序列、转换序列和本文所述的其它此类序列基本同源或源自所述序列的dna序列(其中“源自”表示序列与另一个序列相同或从另一个序列修饰而来)。
[0231]
术语“t细胞”是指一种类型的白血细胞,其通过在细胞表面上存在t细胞受体而与其它白血细胞相区别。有几种t细胞亚组,包括但不限于t辅助细胞(也称为th细胞或cd4+ t细胞)和亚型,包括th1、th2、th3、th17、th9和tfh细胞、细胞毒性t细胞(也称为tc细胞、cd8+ t细胞、细胞毒性t淋巴细胞、t-杀伤细胞、杀伤t细胞)、记忆t细胞和亚型,包括中枢记忆t细胞(tcm细胞)、效应记忆t细胞(tem和temra细胞)和驻留记忆t细胞(trm细胞)、调节性t细胞(也称为treg细胞或抑制性t细胞)及其亚型,包括cd4+foxp3+ treg细胞、cd4+foxp3-treg细胞、tr1细胞、th3细胞和treg17细胞、天然杀伤t细胞(也称为nkt细胞)、粘膜相关非变异t细胞(mucosal associated invariant t cell,mait)和γδt细胞(γδt细胞),包括vγ9/vδ2t细胞。任何一种或多种前述或未提及的t细胞可以是用于本发明的使用方法的靶细胞类型。
[0232]
如本文中所用,术语“t细胞介导的响应”是指由t细胞(包括但不限于效应t细胞(例如,cd8+细胞)和辅助t细胞(例如,cd4+细胞))介导的任何响应。t细胞介导的响应包括,例如,t细胞的细胞毒性和增殖。
[0233]
如本文中所用,术语“治疗有效量”或“治疗有效剂量”或本文所用的类似术语旨在
表示将引发所需生物或医学响应(例如,癌症的一个或多个症状的改善)的剂(例如,抗cd39抗体或其抗原结合片段)的量。
[0234]
术语“治疗(treat)”、“治疗(treating)”和“治疗(treatment)”是指试图改变被治疗个体的自然病程的临床干预,并且可进行所述治疗以用于预防,或在临床病理过程中进行所述治疗。理想的治疗效果包括但不限于预防疾病的发生或复发、减轻症状、减少疾病的任何直接或间接病理后果、预防转移、降低疾病进展速度、改善或减轻疾病状态以及缓解或改善预后。在一些实施方案中,本发明的抗体用于延迟疾病的发展或减缓疾病的进展。在一些实施方案中,如本文中所用,治疗指的是治疗或预防措施。“治疗”的方法采用向需要这种治疗的受试者(例如,需要针对特定抗原的增强的免疫响应的受试者或最终可能获得这种病症的受试者)施用本公开的人抗体,以预防、治愈、延迟、降低所述病症或复发病症的严重程度或改善其一个或多个症状,或者延长受试者的生存期,使其超过没有这种治疗时所预期的生存期。
[0235]
如本文中所用,术语“肿瘤微环境”(或者“癌症微环境”;缩写为tme)是指肿瘤或赘生物存在于其中的细胞环境或背景,包括周围血管以及非癌细胞,包括但不限于免疫细胞、成纤维细胞、骨髓来源的炎症细胞和淋巴细胞。信号分子和细胞外基质也构成了tme。肿瘤和周围的微环境密切相关,并不断相互作用。肿瘤可通过释放细胞外信号、促进肿瘤血管生成和诱导外周免疫耐受来影响微环境,而微环境中的免疫细胞可影响肿瘤细胞的生长和进化。
[0236]
如本文中所用,术语“未重排的”或“种系构型”是指v区段的构型,在所述构型中v片段不重组从而与d或j区段紧密相邻。
[0237]
如本文中所用,术语“载体”旨在指能够转运与其相连的另一种核酸的核酸分子。一种类型的载体是“质粒”,其是指可将另外的dna区段连接至其中的环状双链dna环。另一种类型的载体是病毒载体,其中可将另外的dna片区段连接到病毒基因组中。某些载体能够在向其中引入它们的宿主细胞中自主复制(例如,具有细菌复制起始位点的细菌载体和游离型哺乳动物载体)。可将其它载体(例如,非游离型哺乳动物载体)在引入宿主细胞时整合到宿主细胞的基因组中,从而与宿主基因组一起复制。此外,某些载体能够指导与它们可操作地连接的基因表达。此类载体在本文中称为“重组表达载体”(或简称为“表达载体”)。通常,重组dna技术中有用的表达载体通常以质粒的形式存在。在本说明书中,“质粒”和“载体”可以互换使用,因为质粒是最常用的载体形式。然而,本发明旨在包括表达载体的此类其它形式,诸如病毒载体(例如,复制缺陷型逆转录病毒、腺病毒和腺相关病毒),其具有等同的功能。
[0238]
除非另有定义,否则本文所用的所有技术和科学术语具有与本公开所属领域的普通技术人员通常理解的含义相同的含义。下面描述了优选方法和材料,尽管与本文所述的方法和材料相似或等效的方法和材料也可用于目前公开的方法和组合物的实践或测试。本文提及的所有出版物、专利申请、专利和其它参考文献均通过引用整体并入。抗cd39抗体及其抗原结合片段
[0239]
本公开提供了结合至并拮抗cd39(特别是人cd39)的抗体及其抗原结合部分。本文提供了与人cd39结合的分离的抗体或其抗原结合部分,其包含如表1中所示的重链和轻链cdr以及可变序列。
[0240]
腺苷途径是信号传导系统,其作用是微调免疫细胞功能,诸如细胞间相互作用、细胞因子和趋化因子分泌、表面抗原脱落、细胞内病原体清除和产生活性氧种类(ros)。atp和adp通过激活受体在炎症、免疫系统调节和组织稳态中发挥基本作用(eltzschig等人,(2012)n engl j med 367:2322-2333)。介质,诸如atp和腺苷,响应于代谢紊乱或其它类型的损伤而被释放到细胞外空间,并且既作为感觉信号又作为传出信号起作用,以塑造免疫响应。atp通过细胞裂解或非裂解机制释放,所述非裂解机制包括:(i)含atp的小囊泡的胞吐,(ii)通过核苷酸可渗透的通道(连接蛋白/泛连接蛋白半通道、maxi-阴离子通道、体积调节阴离子通道或p2x7受体通道),(iii)通过将蛋白质递送到细胞膜的转运囊泡和(iv)通过溶酶体。cd39将水解细胞外三磷酸腺苷(atp)和二磷酸腺苷(adp)生成腺苷。
[0241]
p1腺苷受体家族包括a1、a2a(t细胞表达的主要腺苷受体)、a2b和a3 g蛋白偶联受体。腺苷-a2a受体轴提供了抑制炎症和保护正常组织免受免疫系统介导的损伤的免疫抑制机制(ohta等人,(2001)nature 414:916-920)。在一些癌症中,这种免疫抑制途径被异常激活,并保护癌细胞免受免疫系统攻击(sitkovsky等人,(2014)cancer immunol res)2:598-605)。该途径的激活和细胞外腺苷在肿瘤中的积累产生了有利于肿瘤生长的免疫抑制和促血管生成小生境(antonioli等人,(2013)nat rev cancer 13:842-857;stagg和smith(2010)oncogene 29:5346-5358;sitkovsky等人,(2008)clin cancer res14:5947-5952;muller-haegele等人,(2014)expert rev clin immunol10:897-914;antonioli等人,(2013)trends mol med 19:355-367)。a2ar缺陷型小鼠对大的免疫原性肿瘤的完全排斥(ohta等人,(2006)proc natl acad sci usa 103:13132-13137)以及cd39的肿瘤抗性表型(sun等人,(2010)gastroenterology 139:1030-1040)证明了该途径在促进癌症中的主要作用。
[0242]
在该途径中,cd39(也称为胞外-核苷三磷酸二磷酸水解酶1、e-ntpd酶1和分化簇39)和cd73(也称为胞外-5
’-
核苷酸酶、胞外5
’
核苷酸酶、5
’-
核苷酸酶(5
’-
nt)和分化簇73)是调节免疫和炎症的主要核苷酸代谢酶。cd39和cd73的活性代表细胞外腺苷的主要来源。cd39将细胞外atp和adp水解为一磷酸腺苷(amp)(deaglio等人,(2007)j exp med 204:1257-1265;borsellino等人,(2007)blood110:1225-1232)。然后主要通过胞外核苷酸酶cd73将amp被加工成抗炎腺苷。在与t细胞上的a2a受体结合时,腺苷诱导细胞内环amp的积累,从而防止tcr诱导的cd25上调并抑制效应t淋巴细胞增殖和炎性细胞因子分泌(huang等人,(1997)blood 90-1600-1610;lokshin等人,(2006)cancer res 66:7758-7765)。腺苷还阻断活化的天然杀伤(nk)细胞的细胞毒性活性和细胞因子产生。
[0243]
因此,本公开提供了结合至并拮抗人cd39的分离的抗体或其抗原结合部分,其中所述抗体或其抗原结合部分表现出至少以下特性中的至少一种或多种:(i)与重组人cd39和/或膜结合的人cd39结合;(ii)以小于10nm的平衡解离常数(kd)与cd39结合;(iii)抑制或降低cd39的酶活性;(iv)抑制或减少细胞外三磷酸腺苷(eatp)或细胞外二磷酸腺苷(eadp)向细胞外一磷酸腺苷(eamp)的转化;(v)增加或提高细胞外三磷酸腺苷(eatp)水平;(vi)降低或减少细胞外腺苷水平;(vii)维持、增加或提高细胞外三磷酸腺苷(eatp)的免疫刺激水平;(viii)增加或提高淋巴细胞的增殖;(ix)增加或提高一种或多种树突细胞活化标志物的表达;(x)增加或提高一种或多种细胞因子从树突细胞的分泌;(xi)增加或提高肿瘤中的巨噬细胞浸润;(xii)增加或提高巨噬细胞吸引趋化因子的分泌;(xiii)拮抗组织的
肿瘤微环境中的人cd39;(xiv)与食蟹猴cd39和/或小鼠cd39交叉反应;或(xv)(i)-(xiv)中任一项的组合。
[0244]
在一些实施方案中,分离的抗体或其抗原结合部分与重组cd39和/或膜结合的cd39结合。在一些实施方案中,分离的抗体或其抗原结合部分与重组人cd39和/或膜结合的人cd39结合。
[0245]
在一些实施方案中,分离的抗体或其抗原结合部分以小于10nm的平衡解离常数(kd)与cd39结合。
[0246]
在一些实施方案中,分离的抗体或其抗原结合部分抑制或降低cd39的酶活性。
[0247]
在一些实施方案中,分离的抗体或其抗原结合部分抑制或降低cd39的酶活性,其中cd39的酶活性是细胞外三磷酸腺苷(eatp)或细胞外二磷酸腺苷(eadp)的水解。
[0248]
在一些实施方案中,分离的抗体或其抗原结合部分抑制或减少细胞外三磷酸腺苷(eatp)或细胞外二磷酸腺苷(eadp)向胞外一磷酸腺苷(eamp)的转化。
[0249]
在一些实施方案中,分离的抗体或其抗原结合部分增加或提高细胞外三磷酸腺苷(eatp)的水平。
[0250]
在一些实施方案中,分离的抗体或其抗原结合部分降低或减少细胞外腺苷水平。
[0251]
在一些实施方案中,分离的抗体或其抗原结合部分增加或提高细胞外三磷酸腺苷(eatp)的免疫刺激水平。
[0252]
在一些实施方案中,分离的抗体或其抗原结合部分增加淋巴细胞的增殖。在一些实施方案中,淋巴细胞是肿瘤浸润性淋巴细胞。在一些实施方案中,淋巴细胞是t细胞。在一些实施方案中,t细胞是cd4+ t细胞。
[0253]
在一些实施方案中,分离的抗体或其抗原结合部分提高一种或多种树突细胞活化标志物的表达。在一些实施方案中,一种或多种树突细胞激活标志物是cd86、hla-dr或其组合。
[0254]
在一些实施方案中,分离的抗体或其抗原结合部分提高一种或多种细胞因子从树突细胞的分泌。在一些实施方案中,一种或多种细胞因子是il-16、il-12/il-23p40、vegfa或其任何组合。
[0255]
在一些实施方案中,分离的抗体或其抗原结合部分增加或提高肿瘤中的巨噬细胞浸润。
[0256]
在一些实施方案中,分离的抗体或其抗原结合部分增加或提高巨噬细胞吸引趋化因子的分泌。
[0257]
在一些实施方案中,分离的抗体或其抗原结合部分拮抗肿瘤微环境中的人cd39。
[0258]
在一些实施方案中,分离的抗体或其抗原结合部分与食蟹猴cd39和/或小鼠cd39交叉反应。
[0259]
在一些实施方案中,分离的抗体或其抗原结合部分选自由以下组成的组:igg1、gg2、和igg3、igg4、和igm、和iga1、和iga2、和igd、和ige抗体。
[0260]
在一些实施方案中,分离的抗体或其抗原结合部分是igg4抗体的igg1抗体。
[0261]
在一些实施方案中,分离的抗体或其抗原结合部分包含野生型igg1重链恒定区。
[0262]
在一些实施方案中,分离的抗体或其抗原结合部分包含野生型igg4重链恒定区。
[0263]
在一些实施方案中,分离的抗体或其抗原结合部分包含含有至少一个突变的fc结
构域。
[0264]
在一些实施方案中,分离的抗体或其抗原结合部分包含突变igg1重链恒定区。
[0265]
在一些实施方案中,分离的抗体或其抗原结合部分包含突变igg4重链恒定区。在一些实施方案中,根据eu编号,突变igg4重链恒定区包含取代s228p、l235e、l235a中的任一种或其组合。
[0266]
在一些方面,本公开的抗体或其抗原结合部分包含seq id no:3中所示的重链cdr3序列。在一些方面,本公开的抗体或抗原结合部分与参考抗体或其抗原结合部分结合基本上相同的表位,所述参考抗体或其抗原结合部分包含在seq id no:3中所示的重链cdr3序列。在一些方面,本公开的抗体或抗原结合部分与由参考抗体或其抗原结合部分结合的氨基酸残基中的至少一个结合,所述参考抗体或其抗原结合部分包含seq id no:3中所示的重链cdr3序列。在一些方面,本公开的抗体或抗原结合部分,其中由抗体结合的表位的突变抑制、减少或阻断与抗体以及参考抗体或其抗原结合部分的结合,所述参考抗体或其抗原结合部分包含seq id no:3中所示的重链cdr3序列。
[0267]
在一些实施方案中,本公开的抗体或抗原结合部分与参考抗体或其抗原结合部分结合基本相同的表位,所述参考抗体或其抗原结合部分包含分别示于seq id no:27、28和29的重链cdr1、cdr2和cdr3序列,以及分别示于seq id no:37、38和39的轻链cdr1、cdr2和cdr3序列。在一些实施方案中,本公开的抗体或抗原结合部分与由参考抗体或其抗原结合部分结合的氨基酸残基中的至少一个结合,所述参考抗体或其抗原结合部分包含分别示于seq id no:27、28和29的重链cdr1、cdr2和cdr3序列,以及分别示于seq id no:37、38和39的轻链cdr1、cdr2和cdr3序列。在一些实施方案中,由本公开的抗体或抗原结合部分结合的表位的突变抑制、减少或阻断与抗体以及参考抗体或其抗原结合部分的结合,所述参考抗体或其抗原结合部分包含分别示于seq id no:27、28和29的重链cdr1、cdr2和cdr3序列,以及分别示于seq id no:37、38和39的轻链cdr1、cdr2和cdr3序列。
[0268]
在一些实施方案中,本公开的抗体或其抗原结合部分与参考抗体或其抗原结合部分结合基本上相同的表位,所述参考抗体或其抗原结合部分包含分别示于seq id no:30、31和32的重链cdr1、cdr2和cdr3序列,以及分别示于seq id no:40、41和42的轻链cdr1、cdr2和cdr3序列。
[0269]
在一些实施方案中,本公开的抗体或其抗原结合部分与由参考抗体或其抗原结合部分结合的氨基酸残基中的至少一个结合,所述参考抗体或其抗原结合部分包含分别示于seq id no:30、31和32的重链cdr1、cdr2和cdr3序列,以及分别示于seq id no:40、41和42的轻链cdr1、cdr2和cdr3序列。
[0270]
在一些实施方案中,由本公开的抗体或其抗原结合部分结合的表位的突变抑制、减少或阻断与抗体以及参考抗体或其抗原结合部分的结合,所述参考抗体或其抗原结合部分包含分别示于seq id no:30、31和32的重链cdr1、cdr2和cdr3序列,以及分别示于seq id no:40、41和42的轻链cdr1、cdr2和cdr3序列。
[0271]
在一些方面,本公开的抗体或抗原结合部分结合至并拮抗人cd39,并且包含选自由以下组成的组的重链和轻链cdr:(i)分别示于seq id no:27、28和29的重链cdr1、cdr2和cdr3序列,以及分别示于seq id no:37、38和39的轻链cdr1、cdr2和cdr3序列;
(ii)分别示于seq id no:1、2和3的重链cdr1、cdr2和cdr3序列,以及分别示于seq id no:11、12和13的轻链cdr1、cdr2和cdr3序列;(iii)分别示于seq id no:53、54和55的重链cdr1、cdr2和cdr3序列,以及分别示于seq id no:63、64和65的轻链cdr1、cdr2和cdr3序列;(iv)分别示于seq id no:79、80和81的重链cdr1、cdr2和cdr3序列,以及分别示于seq id no:89、90和91的轻链cdr1、cdr2和cdr3序列;和(v)分别示于seq id no:105、106和107的重链cdr1、cdr2和cdr3序列,以及分别示于seq id no:115、116和117的轻链cdr1、cdr2和cdr3序列。
[0272]
在一些实施方案中,本公开的抗体或其抗原结合部分结合至并拮抗人cd39,并且包含重链和轻链cdr,其中重链cdr1、cdr2和cdr3序列分别示于seq id no:27、28和29中,轻链cdr1、cdr2和cdr3序列分别示于seq id no:37、38和39中。
[0273]
在一些实施方案中,本公开的抗体或其抗原结合部分结合至并拮抗人cd39,并且包含选自由以下组成的组的重链和轻链cdr:(i)分别示于seq id no:30、31和32的重链cdr1、cdr2和cdr3序列,以及分别示于seq id no:40、41和42的轻链cdr1、cdr2和cdr3序列;(ii)分别示于seq id no:4、5和6的重链cdr1、cdr2和cdr3序列,以及分别示于seq id no:14、15和16的轻链cdr1、cdr2和cdr3序列;(iii)分别示于seq id no:56、57和58的重链cdr1、cdr2和cdr3序列,以及分别示于seq id no:66、67和68的轻链cdr1、cdr2和cdr3序列;(iv)分别示于seq id no:82、83和84的重链cdr1、cdr2和cdr3序列,以及分别示于seq id no:92、93和94的轻链cdr1、cdr2和cdr3序列;和(v)分别示于seq id no:108、109和110的重链cdr1、cdr2和cdr3序列,以及分别示于seq id no:118、119和120的轻链cdr1、cdr2和cdr3序列。
[0274]
在一些实施方案中,本公开的抗体或其抗原结合部分结合至并拮抗人cd39,并且包含重链和轻链cdr,其中重链cdr1、cdr2和cdr3序列分别示于seq id no:30、31和32中,轻链cdr1、cdr2和cdr3序列分别示于seq id no:40、41和42中;
[0275]
在一些方面,本公开的抗体或抗原结合部分结合至并拮抗人cd39,并且包含重链和轻链可变区,其中重链可变区包含选自由seq id no:33、7、59、85和111组成的组的氨基酸序列;并且其中轻链可变区包含选自由seq id no:43、17、69、95和121组成的组的氨基酸序列。
[0276]
在一些实施方案中,本公开的抗体或其抗原结合部分结合至并拮抗人cd39,并且包含重链和轻链可变区,所述重链和轻链可变区分别包含选自由以下组成的组的氨基酸序列:(i)seq id no:33和43;(ii)seq id no:7和17;(iii)seq id no:59和69;(iv)seq id no:85和95;和(v)seq id no:111和121。
[0277]
在一些实施方案中,本公开的抗体或其抗原结合部分结合至并拮抗人cd39,并且
包含重链和轻链可变区,所述重链和轻链可变区分别包含seq id no:33和43中所示的氨基酸序列。
[0278]
在一些方面,本公开的抗体或抗原结合部分结合至并拮抗人cd39,并且包含重链和轻链可变区,其中重链可变区包含与选自由seq id no:33、7、59、85和111组成的组的氨基酸序列具有至少90%、至少95%、至少97%、至少98%、至少99%同一性的氨基酸序列;并且其中轻链可变区包含与选自由seq id no:43、17、69、95和121组成的组的氨基酸序列具有至少90%、至少95%、至少97%、至少98%、至少99%同一性的氨基酸序列。
[0279]
在一些实施方案中,本公开的抗体或抗原结合部分结合至并拮抗人cd39,并且包含重链和轻链可变区,所述重链和轻链可变区分别包含与选自由以下组成的组的氨基酸序列具有至少90%、至少95%、至少97%、至少98%、至少99%同一性的氨基酸序列:(i)seq id no:33和43;(ii)seq id no:7和17;(iii)seq id no:59和69;(iv)seq id no:85和95;和(v)seq id no:111和121。
[0280]
在一些实施方案中,本公开的抗体或其抗原结合部分结合至并拮抗人cd39,并且包含重链和轻链可变区,所述重链和轻链可变区分别包含与seq id no:33和43中所示的氨基酸序列具有至少90%、至少95%、至少97%、至少98%、至少99%同一性的氨基酸序列。
[0281]
在一些实施方案中,本公开的抗体或其抗原结合部分结合至并拮抗人cd39,并且包含重链和轻链,其中重链包含选自由seq id no:35、9、61、87和113组成的组的氨基酸序列;并且其中轻链包含选自由seq id no:45、19、71、97和123组成的组的氨基酸序列。
[0282]
在一些实施方案中,本公开的抗体或其抗原结合部分结合至并拮抗人cd39,并且包含重链和轻链,其中重链包含与选自由seq id no:35、9、61、87和113组成的组的氨基酸序列具有至少90%、至少95%、至少97%、至少98%、至少99%同一性的氨基酸序列;并且其中轻链包含与选自由seq id no:45、19、71、97和123组成的组的氨基酸序列具有至少90%、至少95%、至少97%、至少98%、至少99%同一性的氨基酸序列。
[0283]
在一些实施方案中,本公开的抗体或其抗原结合部分结合至并拮抗人cd39,并且包含重链和轻链,其中重链包含选自由seq id no:47、21、73、99和125组成的组的氨基酸序列;并且其中轻链包含选自由seq id no:45、19、71、97和123组成的组的氨基酸序列。
[0284]
在一些实施方案中,本公开的抗体或其抗原结合部分结合至并拮抗人cd39,并且包含重链和轻链,其中重链包含与选自由seq id no:47、21、73、99和125组成的组的氨基酸序列具有至少90%、至少95%、至少97%、至少98%、至少99%同一性的氨基酸序列;并且其中轻链包含与选自由seq id no:45、19、71、97和123组成的组的氨基酸序具有至少90%、至少95%、至少97%、至少98%、至少99%同一性的氨基酸序列。
[0285]
在一些实施方案中,本公开的抗体或其抗原结合部分结合至并拮抗人cd39,并且包含重链和轻链,其中重链包含选自由seq id no:49、23、75、101和127组成的组的氨基酸序列;并且其中轻链包含选自由seq id no:45、19、71、97和123组成的组的氨基酸序列。
[0286]
在一些实施方案中,本公开的抗体或其抗原结合部分结合至并拮抗人cd39,并且包含重链和轻链,其中所述重链包含与选自由seq id no:49、23、75、101和127组成的组的
氨基酸序列具有至少90%、至少95%、至少97%、至少98%、至少99%同一性的氨基酸序列;并且其中所述轻链包含与选自由seq id no:45、19、71、97和123组成的组的氨基酸序列具有至少90%、至少95%、至少97%、至少98%、至少99%同一性的氨基酸序列。
[0287]
在一些实施方案中,本公开的抗体或其抗原结合部分结合至并拮抗人cd39,并且包含重链和轻链,其中所述重链包含选自由seq id no:51、25、77、103和129组成的组的氨基酸序列;并且其中所述轻链包含选自由seq id no:45、19、71、97和123组成的组的氨基酸序列。
[0288]
在一些实施方案中,本公开的抗体或其抗原结合部分结合至并拮抗人cd39,并且包含重链和轻链,其中所述重链包含与选自由seq id no:51、25、77、103和129组成的组的氨基酸序列具有至少90%、至少95%、至少97%、至少98%、至少99%同一性的氨基酸序列;并且其中所述轻链包含与选自由seq id no:45、19、71、97和123组成的组的氨基酸序列具有至少90%、至少95%、至少97%、至少98%、至少99%同一性的氨基酸序列。
[0289]
在一些实施方案中,本公开的抗体或其抗原结合部分结合至并拮抗人cd39,并且包含重链和轻链,所述重链和轻链分别包含选自由以下组成的组的氨基酸序列:(i)seq id no:35和45;(ii)seq id no:9和19;(iii)seq id no:61和71;(iv)seq id no:87和97;和(v)seq id no:113和123。
[0290]
在一些实施方案中,本公开的抗体或其抗原结合部分结合至并拮抗人cd39,并且包含重链和轻链,所述重链和轻链分别包含与选自以下组成的组的氨基酸序列具有至少90%、至少95%、至少97%、至少98%、至少99%同一性的氨基酸序列:(i)seq id no:35和45;(ii)seq id no:9和19;(iii)seq id no:61和71;(iv)seq id no:87和97;和(v)seq id no:113和123。
[0291]
在一些实施方案中,本公开的抗体或其抗原结合部分结合至并拮抗人cd39,并且包含重链和轻链,所述重链和轻链分别包含选自由以下组成的组的氨基酸序列:(i)seq id no:47和45;(ii)seq id no:21和19;(iii)seq id no:73和71;(iv)seq id no:99和97;和(v)seq id no:125和123。
[0292]
在一些实施方案中,本公开的抗体或其抗原结合部分结合至并拮抗人cd39,并且包含重链和轻链,所述重链和轻链分别包含与选自以下组成的组的氨基酸序列具有至少90%、至少95%、至少97%、至少98%、至少99%同一性的氨基酸序列:(i)seq id no:47和45;(ii)seq id no:21和19;
(iii)seq id no:73和71;(iv)seq id no:99和97;和(v)seq id no:125和123。
[0293]
在一些实施方案中,本公开的抗体或其抗原结合部分结合至并拮抗人cd39,并且包含重链和轻链,所述重链和轻链分别包含选自由以下组成的组的氨基酸序列:(i)seq id no:49和45;(ii)seq id no:23和19;(iii)seq id no:75和71;(iv)seq id no:101和97;和(v)seq id no:127和123。
[0294]
在一些实施方案中,本公开的抗体或其抗原结合部分结合至并拮抗人cd39,并且包含重链和轻链,所述重链和轻链分别包含与选自以下组成的组的氨基酸序列具有至少90%、至少95%、至少97%、至少98%、至少99%同一性的氨基酸序列:(i)seq id no:49和45;(ii)seq id no:23和19;(iii)seq id no:75和71;(iv)seq id no:101和97;和(v)seq id no:127和123。
[0295]
在一些实施方案中,本公开的抗体或其抗原结合部分结合至并拮抗人cd39,并且包含重链和轻链,所述重链和轻链分别包含选自由以下组成的组的氨基酸序列:(i)seq id no:51和45;(ii)seq id no:25和19;(iii)seq id no:77和71;(iv)seq id no:103和97;和(v)seq id no:129和123。
[0296]
在一些实施方案中,本公开的抗体或其抗原结合部分结合至并拮抗人cd39,并且包含重链和轻链,所述重链和轻链分别包含与选自以下组成的组的氨基酸序列具有至少90%、至少95%、至少97%、至少98%、至少99%同一性的氨基酸序列:(i)seq id no:51和45;(ii)seq id no:25和19;(iii)seq id no:77和71;(iv)seq id no:103和97;和(v)seq id no:129和123。
[0297]
在一些实施方案中,本公开的抗体或其抗原结合部分结合至并拮抗人cd39,并且包含重链和轻链,所述重链和轻链分别包含seq id no:35和45中所示的氨基酸序列。
[0298]
在一些实施方案中,本公开的抗体或其抗原结合部分结合至并拮抗人cd39,并且包含重链和轻链,所述重链和轻链分别包含与seq id no:35和45中所示的氨基酸序列具有至少90%、至少95%、至少97%、至少98%、至少99%同一性的氨基酸序列。
[0299]
在一些实施方案中,本公开的抗体或其抗原结合部分结合至并拮抗人cd39,并且
包含重链和轻链,所述重链和轻链分别包含seq id no:47和45中所示的氨基酸序列。
[0300]
在一些实施方案中,本公开的抗体或其抗原结合部分结合至并拮抗人cd39,并且包含重链和轻链,所述重链和轻链分别包含与seq id no:47和45中所示的氨基酸序列具有至少90%、至少95%、至少97%、至少98%、至少99%同一性的氨基酸序列。
[0301]
在一些实施方案中,本公开的抗体或其抗原结合部分结合至并拮抗人cd39,并且包含重链和轻链,所述重链和轻链分别包含seq id no:49和45中所示的氨基酸序列。
[0302]
在一些实施方案中,本公开的抗体或其抗原结合部分结合至并拮抗人cd39,并且包含重链和轻链,所述重链和轻链分别包含与seq id no:49和45中所示的氨基酸序列具有至少90%、至少95%、至少97%、至少98%、至少99%同一性的氨基酸序列。
[0303]
在一些实施方案中,本公开的抗体或其抗原结合部分结合至并拮抗人cd39,并且包含重链和轻链,所述重链和轻链分别包含seq id no:51和45中所示的氨基酸序列。
[0304]
在一些实施方案中,本公开的抗体或其抗原结合部分结合至并拮抗人cd39,并且包含重链和轻链,所述重链和轻链分别包含与seq id no:51和45中所示的氨基酸序列具有至少90%、至少95%、至少97%、至少98%、至少99%同一性的氨基酸序列。
[0305]
在一些实施方案中,分离的抗体或其抗原结合部分包含突变igg4重链恒定区。在一些实施方案中,突变igg4重链恒定区包含s228p取代。在一些实施方案中,突变igg4重链恒定区包含s228p取代和l235e取代。在一些实施方案中,突变igg4重链恒定区包含s228p取代和l235a取代。根据eu编号进行编号。产生抗cd39抗体及其抗原结合片段的方法
[0306]
本公开还表征了产生本文所述的任何抗cd39抗体或其抗原结合片段的方法。在一些实施方案中,制备本文所述抗体的方法可包括用合适的免疫原免疫受试者(例如,非人哺乳动物)。本文阐述了用于产生本文所述的任何抗体的合适免疫原。例如,为了产生与cd39结合的抗体,技术人员可以用全长cd39多肽诸如全长人cd39多肽免疫合适的受试者(例如,非人哺乳动物诸如大鼠、小鼠、沙鼠、仓鼠、狗、猫、猪、山羊、马或非人灵长类动物),所述全长人cd39多肽包含seq id no:138中描述的氨基酸序列。
[0307]
可用合适的抗原对合适的受试者(例如,非人哺乳动物)进行免疫,同时随后进行足以引发哺乳动物产生抗体的多次加强免疫。可将免疫原与佐剂一起向受试者(例如,非人哺乳动物)施用。用于在受试者中产生抗体的佐剂包括但不限于蛋白质佐剂;细菌佐剂,例如完整细菌(bcg、厌氧短棒杆菌(corynebacterium parvum)或明尼苏达沙门菌(salmonella minnesota))和细菌组分,包括细胞壁骨架、海藻糖二霉菌酸酯、单磷酰基脂质a、结核杆菌(tubercle bacillus)的甲醇可提取残留物(mer)、完全或不完全弗氏佐剂;病毒佐剂;化学佐剂,例如氢氧化铝以及碘乙酸盐和胆固醇半琥珀酸酯。可用于诱导免疫响应的方法中的其它佐剂包括,例如,霍乱毒素和副痘病毒蛋白。还参见bieg等人(1999)autoimmunity 31(1):15-24。还参见,例如,lodmell等人(2000)vaccine 18:1059-1066;johnson等人(1999)j med chem42:4640-4649;baldridge等人(1999)methods 19:103-107;以及gupta等人(1995)vaccine 13(14):1263-1276。
[0308]
在一些实施方案中,所述方法包括制备分泌与免疫原结合的单克隆抗体的杂交瘤细胞系。例如,用上述cd39多肽免疫合适的哺乳动物诸如实验室小鼠。可在免疫原的至少一次强化免疫后2至4天分离免疫哺乳动物的抗体产生细胞(例如,脾脏的b细胞),然后将其在
与合适的骨髓瘤细胞系的细胞融合之前在培养中短暂生长。可将细胞在融合启动子(诸如痘苗病毒或聚乙二醇)存在下融合。克隆在融合中获得的杂交细胞,并选择分泌所需抗体的细胞克隆。例如,可将用合适的免疫原免疫的balb/c小鼠的脾细胞与骨髓瘤细胞系pai或骨髓瘤细胞系sp2/0-ag 14的细胞融合。融合后,将细胞在合适的培养基中扩增,以规则的间隔为所述培养基补充选择培养基,例如hat培养基,以防止正常骨髓瘤细胞生长超过所需的杂交瘤细胞。然后筛选获得的杂交细胞的所需抗体(例如与人cd39结合的抗体)的分泌,并且在一些实施方案中,技术人员可从美国专利第6,300,064号(属于knappik等人;morphosys ag)和schoonbroodt等人(2005)nucleic acids res 33(9):e81中描述的非免疫偏向的文库中鉴定抗cd39抗体。
[0309]
在一些实施方案中,本文所述的方法可涉及例如噬菌体展示技术、细菌展示、酵母表面展示、真核生物病毒展示、哺乳动物细胞展示和无细胞(例如,核糖体展示)抗体筛选技术或与所述技术结合使用(参见例如etz等人(2001)j bacteriol 183:6924-6935;cornelis(2000)curr opin biotechnol 11:450-454;klemm等人(2000)microbiology 146:3025-3032;kieke等人(1997)protein eng 10:1303-1310;yeung等人(2002)biotechnol prog 18:212-220;boder等人(2000)methods enzymology 328:430-444;grabherr等人(2001)comb chem high throughput screen 4:185-192;michael等人(1995)gene ther2:660-668;pereboev等人(2001)j virol 75:7107-7113;schaffitzel等人(1999)j immunol methods 231:119-135以及hanes等人(2000)nat biotechnol 18:1287-1292)。
[0310]
使用各种噬菌体展示方法鉴定抗体的方法是本领域已知的。在噬菌体展示方法中,将功能性抗体结构域展示在携带编码它们的多核苷酸序列的噬菌体颗粒的表面上。这种噬菌体可用于展示抗体的抗原结合结构域,例如fab、fv或二硫键稳定的fv抗体片段,其从文库或组合抗体文库(例如,人或鼠)中表达。这些方法中使用的噬菌体通常是丝状噬菌体,诸如fd和m13。抗原结合结构域表达为与噬菌体外壳蛋白piii、pviii或pix中的任一种重组融合的蛋白质。参见,例如,shi等(2010)jmb 397:385-396。本文所述的可用于制备免疫球蛋白或其片段的噬菌体展示方法的实例包括以下文献中公开的那些:brinkman等人(1995)j immunol methods 182:41-50;ames等人(1995)j immunol methods 184:177-186;kettleborough等人(1994)eur j immunol 24:952-958;persic等人(1997)gene 187:9-18;burton等人(1994)advances in immunology 57:191-280;以及pct公开号wo90/02809、wo 91/10737、wo 92/01047、wo 92/18619、wo 93/11236、wo 95/15982和wo 95/20401。合适的方法也描述在例如美国专利第5,698,426号、第5,223,409号、第5,403,484号、第5,580,717号、第5,427,908号、第5,750,753号、第5,821,047号、第5,571,698号、第5,427,908号、第5,516,637号、第5,780,225号、第5,658,727号、第5,733,743号和第5,969,108号中。
[0311]
在一些实施方案中,噬菌体展示抗体库可使用从免疫哺乳动物的b细胞收集的mrna来产生。例如,可从用上述cd39多肽免疫的小鼠中分离包含b细胞的脾细胞样品。可从细胞中分离出mrna,并使用标准分子生物学技术将其转化为cdna。参见,例如,sambrook等人(1989)“molecular cloning:a laboratory manual,第2版,”cold spring harbor laboratory press,cold spring harbor,n.y.;harlow和lane(1988),同上;benny k.c.lo
(2004),supra;以及borrebaek(1995),同上。将编码免疫球蛋白重链和轻链多肽的可变区的cdna用于构建噬菌体展示文库。产生这种文库的方法描述于,例如,merz等人(1995)j neurosci methods 62(1-2):213-9;di niro等人(2005)biochem j 388(pt 3):889
–
894以及engberg等人(1995)methods mol biol 51:355-376中。
[0312]
在一些实施方案中,选择和筛选的组合可用于从例如杂交瘤产生的抗体群体或噬菌体展示抗体文库中鉴定目标抗体。合适的方法在本领域中是已知的,并且描述于例如hoogenboom(1997)trends in biotechnology 15:62-70;brinkman等人(1995),同上;ames等人(1995),同上;kettleborough等人(1994),同上;persic,等人(1997),同上以及burton等人(1994),同上。例如,使用标准分子生物学技术产生多种噬菌粒载体(每种噬菌粒载体编码噬菌体外壳蛋白(例如,m13噬菌体的piii、pviii或pix)与不同抗原结合区的融合蛋白),然后将其引入细菌群体(例如,大肠杆菌)中。在一些实施方案中,细菌中噬菌体的表达可能需要使用辅助噬菌体。在一些实施方案中,不需要辅助噬菌体(参见,例如,chasteen等人,(2006)nucleic acids res34(21):e145)。回收从细菌产生的噬菌体,然后将其与例如与固体支持物结合的(固定的)靶抗原接触。还可将噬菌体与溶液中的抗原接触,随后使复合物结合到固体支持物上。
[0313]
可使用本领域已知的任何基于免疫学或生物化学的方法来表征使用上述方法筛选的抗体亚群的对特定抗原(例如,人cd39)的特异性和结合亲和力。例如,抗体与cd39的特异性结合可以例如使用基于免疫学或生物化学的方法来确定,所述方法是诸如但不限于,如上所述的elisa测定法、spr测定、免疫沉淀测定、亲和色谱和平衡透析。可用于分析抗体的免疫特异性结合和交叉反应性的免疫测定包括但不限于竞争性和非竞争性测定系统,其使用诸如蛋白质印迹、ria、elisa(酶联免疫吸附测定)、“夹心”免疫分析、免疫沉淀测定、免疫扩散测定、凝集测定、补体结合测定、免疫放射测定、荧光免疫测定和蛋白a免疫测定等技术。此类测定是常规的并且在本领域中是公知的。
[0314]
应当理解,上述方法也可用于确定,例如,抗cd39抗体是否不与全长人cd39和/或cd39蛋白结合。
[0315]
在其中选择的cdr氨基酸序列是短序列(例如,长度少于10-15个氨基酸)的实施方案中,可如例如shiraishi等人(2007)nucleic acids symposium series 51(1):129-130和美国专利第6,995,259号中所述,化学合成编码cdr的核酸。对于编码受者抗体的给定核酸序列,编码cdr的核酸序列的区域可使用标准分子生物学技术,利用化学合成的核酸来替换。可以合成化学合成的核酸的5
’
和3
’
末端以包含粘性末端限制性酶切位点,用于将核酸克隆到编码供体抗体的可变区的核酸中。
[0316]
在一些实施方案中,本文所述的抗cd39抗体包含改变的重链恒定区,所述改变的重链恒定区相对于其相应的未改变的恒定区具有降低的(或无)效应子功能。涉及抗cd39抗体的恒定区的效应子功能可通过改变恒定区或fc区的特性来调整。改变的效应子功能包括,例如,以下活性中的一种或多种的调节:抗体依赖性细胞毒性(adcc)、补体依赖性细胞毒性(cdc)、细胞凋亡、与一种或多种fc受体的结合以及促炎响应。调节是指与恒定区的未改变形式的活性相比,包含改变的恒定区的受试抗体所表现出的效应子功能活性的增强、降低或消除。在特定实施方案中,调节包括其中活性被消除或完全不存在的情况。
[0317]
在一个实施方案中,本文所述的抗cd39抗体包含igg4重链恒定区。在一个实施方
案中,igg4重链恒定区是野生型igg4重链恒定区。在另一个实施方案中,例如,根据eu编号(kabat,e.a.等人,同上),igg4恒定区包含突变,例如,s228p和l235e或l235a之一或两者。用于本公开的抗体的野生型和突变型igg4恒定区的代表性序列示于表1中。在一个实施方案中,本文所述的抗cd39抗体包含igg1恒定区。在一个实施方案中,igg1重链恒定区是野生型igg1重链恒定区。在另一个实施方案中,igg1重链恒定区包含突变。用于本公开的抗体的野生型和突变型igg4恒定区的代表性序列示于表1中。
[0318]
具有改变的fcr结合亲和力和/或adcc活性和/或改变的cdc活性的改变的恒定区是这样的多肽,所述多肽与恒定区的未改变形式相比具有提高或降低的fcr结合活性和/或adcc活性和/或cdc活性。显示与fcr结合增强的改变的恒定区以比未改变的多肽更大的亲和力结合至少一种fcr。显示与fcr结合降低的改变的恒定区以比恒定区的未改变形式更低的亲和力结合至少一种fcr。此类显示出与fcr的结合降低的变体可具有很少或不明显的与fcr的结合,例如,与天然序列免疫球蛋白恒定区或fc区与fcr的结合水平相比,0至50%(例如,小于50%、49%、48%、47%、46%、45%、44%、43%、42%、41%、40%、39%、38%、37%、36%、35%、34%、33%、32%、31%、30%、29%、28%、27%、26%、25%、24%、23%、22%、21%、20%、19%、18%、17%、16%、15%、14%、13%、12%、11%、10%、9%、8%、7%、6%、5%、4%、3%、2%或1%)的与fcr的结合。类似地,与未改变的恒定区相比,显示经调整的adcc和/或cdc活性的改变的恒定区可显示出增强的或降低的adcc和/或cdc活性。例如,在一些实施方案中,包含改变的恒定区的抗cd39抗体可以表现出约0至50%(例如,小于50%、49%、48%、47%、46%、45%、44%、43%、42%、41%、40%、39%、38%、37%、36%、35%、34%、33%、32%、31%、30%、29%、28%、27%、26%、25%、24%、23%、22%、21%、20%、19%、18%、17%、16%、15%、14%、13%、12%、11%、10%、9%、8%、7%、6%、5%、4%、3%、2%或1%)的恒定区的未改变形式的adcc和/或cdc活性。表现出降低的adcc和/或cdc的包含改变的恒定区的本文所述的抗cd39抗体,可表现出降低的adcc和/或cdc活性或无adcc和/或cdc活性。
[0319]
在一些实施方案中,本文所述的抗cd39抗体表现出降低的效应子功能或无效应子功能。在一些实施方案中,抗cd39抗体包含杂交恒定区或其部分,诸如g2/g4杂交恒定区(参见,例如,burton等人(1992)adv immun 51:1-18;canfield等人(1991)j exp med173:1483-1491以及mueller等人(1997)mol immunol 34(6):441-452)。参见上文。
[0320]
在一些实施方案中,抗cd39抗体可包含表现出增强或降低的补体依赖性细胞毒性(cdc)的改变的恒定区。可通过在抗体的fc区中引入一个或多个氨基酸取代、插入或缺失来调整cdc活性。参见,例如美国专利第6,194,551号。可选地或另外地,可在fc区中引入一个或多个半胱氨酸残基,从而允许在该区域中形成链间二硫键。如此产生的同二聚体抗体可能具有提高或降低的内化能力和/或增强或降低的补体介导的细胞杀伤。参见,例如,caron等人(1992)j exp med 176:1191-1195和shopes(1992)immunol 148:2918-2922;pct公开号wo 99/51642和wo 94/29351;duncan和winter(1988)nature322:738-40;以及美国专利第5,648,260号和5,624,821号。重组抗体的表达和纯化
[0321]
本文所述的抗体或其抗原结合片段可使用分子生物学和蛋白质化学领域中已知的多种技术来生产。例如,可将编码抗体的重链和轻链多肽中的一种或两种的核酸插入包
含转录和翻译调控序列的表达载体中,所述调控序列包括例如启动子序列、核糖体结合位点、转录起始和终止序列、翻译起始和终止序列、转录终止子信号、多腺苷酸化信号和增强子或激活子序列。调控序列包括启动子以及转录起始和终止序列。另外,表达载体可包括一个以上的复制系统,使得其可在两种不同的生物体中得以保持,例如在哺乳动物或昆虫细胞中进行表达,以及在原核宿主中进行克隆和扩增。
[0322]
几种可能的载体系统可用于在哺乳动物细胞中表达从核酸克隆的重链和轻链多肽。一类载体依赖于将所需基因序列整合到宿主细胞基因组中。具有稳定整合的dna的细胞可通过同时引入药物抗性基因诸如大肠杆菌gpt(mulligan和berg(1981)proc natl acad sci usa 78:2072)或tn5 neo(southern和berg(1982)mol appl genet1:327)来选择。可将选择标记基因与待表达的dna序列连接,或者可通过共转染将可选择标记基因引入同一细胞(wigler等人(1979)cell16:77)。第二类载体利用赋予染色体外质粒自主复制能力的dna元件。这些载体可来源于动物病毒,诸如牛乳头瘤病毒(sarver等人(1982)proc natl acad sci usa,79:7147)、巨细胞病毒、多瘤病毒(deans等人(1984)proc natl acad sci usa 81:1292)或sv40病毒(lusky和botchan(1981)nature 293:79)。
[0323]
可将表达载体以适合核酸后续表达的方式引入细胞。如下所论述的,引入方法主要由靶细胞类型决定。示例性方法包括capo4沉淀、脂质体融合、阳离子脂质体、电穿孔、病毒感染、葡聚糖介导的转染、凝聚胺介导的转染、原生质体融合和直接显微注射。
[0324]
用于表达抗体或其抗原结合片段的合适宿主细胞包括酵母、细菌、昆虫、植物和哺乳动物细胞。特别感兴趣的是细菌诸如大肠杆菌、真菌诸如酿酒酵母和毕赤酵母、昆虫细胞诸如sf9、哺乳动物细胞系(例如,人细胞系)以及原代细胞系。
[0325]
在一些实施方案中,抗体或其片段可以在转基因动物(例如,转基因哺乳动物)中表达并从其纯化。例如,如在例如houdebine(2002)curr opin biotechnol 13(6):625-629;van kuik-romeijn等人(2000)transgenic res 9(2):155-159以及pollock等人(1999)j immunol methods 231(1-2):147-157中所述,可在转基因非人哺乳动物(例如,啮齿动物)中产生抗体,并从乳汁中分离所述抗体。
[0326]
抗体及其片段可通过在足以允许蛋白质表达的条件下培养用含有编码抗体或片段的核酸的表达载体转化的宿主细胞,持续一定量的时间而从细胞中产生。用于蛋白质表达的此类条件将随表达载体和宿主细胞的选择而变化,并且将由本领域技术人员通过常规实验来容易地确定。例如,可将在大肠杆菌中表达的抗体从包涵体中重新折叠(例如,参见hou等人(1998)cytokine 10:319-30)。细菌表达系统及其使用方法在本领域中是公知的(参见current protocols in molecular biology,wiley&sons,and molecular cloning
--
a laboratory manual
--
第3版,cold spring harbor laboratory press,new york(2001))。密码子、合适的表达载体和合适的宿主细胞的选择将根据许多因素而变化,并且可以根据需要容易地进行优化。本文所述的抗体(或其片段)可在哺乳动物细胞或其它表达系统(包括但不限于酵母、杆状病毒)和体外表达系统(参见,例如,kaszubska等人(2000)protein expression and purification 18:213-220)中表达。
[0327]
表达后,可以分离抗体及其片段。抗体或其片段可用本领域技术人员已知的多种方法分离或纯化,这取决于样品中存在的其它组分。标准纯化方法包括电泳技术、分子技术、免疫学技术和色谱技术,包括离子交换色谱、疏水色谱、亲和色谱和反相hplc色谱。例
如,可使用标准抗-抗体柱(例如,蛋白-a或蛋白-g柱)纯化抗体。与蛋白质浓缩结合的超滤和渗滤技术也是有用的。参见,例如,scopes(1994)“protein purification,第3版,”springer-verlag,new york city,new york。必需的纯化程度将根据所需的用途而变化。在一些情况下,所表达的抗体或其片段的纯化不是必需的。
[0328]
测定纯化抗体或其片段的产率或纯度的方法在本领域中是已知的,包括例如bradford测定、紫外光谱学、双缩脲蛋白测定、lowry蛋白测定、氨基黑蛋白测定、高压液相色谱(hplc)、质谱(ms)和凝胶电泳方法(例如,使用蛋白染色剂诸如考马斯蓝或胶体银染色)。抗体或其抗原结合片段的修饰
[0329]
可在表达和纯化后修饰抗体或其抗原结合片段。修饰可以是共价或非共价修饰。此类修饰可通过例如多肽的靶向氨基酸残基与能够与选定的侧链或末端残基反应的有机衍生剂反应而引入抗体或片段中。可使用多个标准(包括例如抗体或片段的结构分析或氨基酸序列分析)中的任一个选择合适的修饰位点。
[0330]
在一些实施方案中,可将抗体或其抗原结合片段与异源部分缀合。异源部分可以是例如异源多肽、治疗剂(例如,毒素或药物)或可检测的标记物,诸如但不限于放射性标记物、酶促标记物、荧光标记物、重金属标记物、发光标记物或亲和标签诸如生物素或链霉抗生物素蛋白。合适的异源多肽包括,例如,抗原标签(flag(dykddddk(seq id no:135))、聚组氨酸(6-his;hhhhhh(seq id no:136)、血凝素(ha;ypydvpdya(seq id no:137))、谷胱甘肽-s-转移酶(gst)或麦芽糖结合蛋白(mbp),用于纯化抗体或片段。异源多肽还包括用作诊断或可检测标志物的多肽(例如酶),例如萤光素酶、荧光蛋白(例如,绿色荧光蛋白(gfp))或氯霉素乙酰转移酶(cat)。合适的放射性标记物包括例如32p、33p、14c、125i、131i、35s和3h。合适的荧光标记物包括但不限于荧光素、异硫氰酸荧光素(fitc)、绿色荧光蛋白(gfp)、dylight
tm
488、藻红蛋白(pe)、碘化丙锭(pi)、percp、pe-alexa700、cy5、别藻蓝蛋白和cy7。发光标记物包括,例如,多种发光镧系元素(例如,铕或铽)螯合物中的任一种。例如,合适的铕螯合物包括二乙烯三胺五乙酸(dtpa)或四氮杂环十二烷-1,4,7,10-四乙酸(dota)的铕螯合物。酶促标记物包括例如碱性磷酸酶、cat、萤光素酶和辣根过氧化物酶。
[0331]
两种蛋白质(例如,抗体和异源部分)可使用许多已知的化学交联剂中的任一种进行交联。此类交联剂的实例是通过包含“受阻的”二硫键的键联连接两个氨基酸残基的那些交联剂。在这些键联中,交联单元内的二硫键被保护(通过阻碍二硫键两侧上的基团)免受通过例如还原型谷胱甘肽或二硫化物还原酶的作用进行的还原。一种合适的试剂4-琥珀酰亚胺基氧基羰基
--
甲基-(2-吡啶基二硫代)甲苯(smpt)利用一种蛋白质上的末端赖氨酸和另一种蛋白质上的末端半胱氨酸在两种蛋白质之间形成这样的键联。还可使用通过每个蛋白质上不同的偶联部分交联的异双功能试剂。其它有用的交联剂包括但不限于连接两个氨基(例如,n-5-叠氮基-2-硝基苯甲酰基氧基琥珀酰亚胺)、两个巯基(例如,1,4-双-马来酰亚胺基丁烷)、氨基和巯基(例如,间-马来酰亚胺基苯甲酰基-n-羟基琥珀酰亚胺酯)、氨基和羧基(例如,4-[对-叠氮基水杨酰胺基]丁胺)以及氨基和存在于精氨酸的侧链中的胍基(例如,对-叠氮基苯基乙二醛一水合物)的试剂。
[0332]
在一些实施方案中,可将放射性标记物直接与抗体的氨基酸骨架直接缀合。或者,可将放射性标记物作为更大分子的一部分(例如,间-[125i]碘代苯基-n-羟基琥珀酰亚胺
([125i]mipnhs)中的125i)包含,其与游离氨基结合以形成相关蛋白质的间碘代苯基(mip)衍生物(参见,例如,rogers等人(1997)j nucl med 38:1221-1229)或螯合物(例如,与dota或dtpa的螯合物),然后又将其与蛋白质骨架结合。将放射性标记物或含有它们的更大的分子/螯合物与本文所述的抗体或抗原结合片段缀合的方法是本领域已知的。此类方法涉及在有利于放射性标记物或螯合剂与蛋白质结合的条件(例如,ph、盐浓度和/或温度)下将蛋白质与放射性标记物一起孵育(例如,参见美国专利第6,001,329号)。
[0333]
将荧光标记物(有时称为“荧光团”)与蛋白质(例如,抗体)缀合的方法在蛋白质化学领域中是已知的。例如,可使用连接到荧光团的琥珀酰亚胺(nhs)酯或四氟苯基(tfp)酯部分,将荧光团与蛋白质的游离氨基(例如,赖氨酸的)或巯基(例如,半胱氨酸的)缀合。在一些实施方案中,可将荧光团与异双官能交联剂部分(诸如磺基-smcc)缀合。合适的缀合方法涉及在促进荧光团与蛋白质结合的条件下,将抗体蛋白质或其片段与荧光团一起孵育。参见,例如,welch和redvanly(2003)“handbook of radiopharmaceuticals:radiochemistry and applications,”john wiley和sons(isbn 0471495603)。
[0334]
在一些实施方案中,可以例如用改善抗体在循环中(例如,在血液、血清或其它组织中)的稳定性和/或保留的部分修饰抗体或片段。例如,可如例如lee等人(1999)bioconjug chem 10(6):973-8;kinstler等人(2002)advanced drug deliveries reviews 54:477-485;以及roberts等人(2002)advanced drug delivery reviews 54:459-476中所述对抗体或片段进行聚乙二醇化,或者可对所述对抗体或片段进行羟乙基化(hesylated)(fresenius kabi,germany;参见,例如,等人(2010)int j pharm 387(1-2):110-119)。稳定化部分可将抗体(或片段)的稳定性或保留性提高至少1.5倍(例如,至少2倍、5倍、10倍、15倍、20倍、25倍、30倍、40倍或50倍或更多倍)。
[0335]
在一些实施方案中,可以糖基化本文所述的抗体或其抗原结合片段。在一些实施方案中,可将本文所述的抗体或其抗原结合片段进行酶促或化学处理,或者从细胞中产生所述抗体或其抗原结合片段,使得所述抗体或片段具有减少的糖基化或不存在糖基化。产生糖基化减少的抗体的方法是本领域已知的,并且描述于例如美国专利第6,933,368号;wright等人(1991)embo j 10(10):2717-2723;以及co等人(1993)mol immunol 30:1361中。药物组合物和制剂
[0336]
在某些实施方案中,本发明提供了包含抗cd39抗体和药学上可接受的稀释剂、载剂、增溶剂、乳化剂、防腐剂和/或佐剂的药物组合物。
[0337]
在某些实施方案中,可接受的制剂材料优选在所采用的剂量和浓度下对受者无毒。在某些实施方案中,一种或多种制剂材料用于皮下和/或静脉内施用。在某些实施方案中,药物组合物可包含用于改变、维持或保存例如组合物的ph、重量摩尔渗透压浓度、粘度、澄清度、颜色、等渗性、气味、无菌性、稳定性、溶出或释放速率、吸附或渗透的制剂材料。在某些实施方案中,合适的制剂材料包括但不限于氨基酸(诸如甘氨酸、谷氨酰胺、天冬酰胺、精氨酸或赖氨酸);抗菌剂;抗氧化剂(诸如抗坏血酸、亚硫酸钠或亚硫酸氢钠);缓冲剂(诸如硼酸盐、碳酸氢盐、tris-hcl、柠檬酸盐、磷酸盐或其它有机酸);填充剂(诸如甘露醇或甘氨酸);螯合剂(诸如乙二胺四乙酸(edta));络合剂(诸如咖啡因、聚乙烯吡咯烷酮、β-环糊精或羟基丙基-β-环糊精);填充物;单糖;二糖;和其它碳水化合物(诸如葡萄糖、甘露糖或
糊精);蛋白质(诸如血清白蛋白、明胶或免疫球蛋白);着色剂、调味剂和稀释剂;乳化剂;亲水聚合物(诸如聚乙烯吡咯烷酮);低分子量多肽;成盐抗衡离子(诸如钠);防腐剂(诸如苯扎氯铵、苯甲酸、水杨酸、硫柳汞、苯乙醇、对羟基苯甲酸甲酯、对羟基苯甲酸丙酯、氯己定、山梨酸或过氧化氢);溶剂(诸如甘油、丙二醇或聚乙二醇);糖醇(诸如甘露醇或山梨醇);悬浮剂;表面活性剂或湿润剂(诸如普流尼克、peg、脱水山梨醇酯、聚山梨醇酯诸如聚山梨醇酯20、聚山梨醇酯80、triton、氨丁三醇、卵磷脂、胆固醇、泰洛沙泊);稳定性增强剂(诸如蔗糖或山梨醇);张力增强剂(诸如碱金属卤化物,优选氯化钠或氯化钾,甘露醇山梨醇);递送媒介物;稀释剂;赋形剂和/或药物佐剂。(remington's pharmaceutical sciences,第18版,a.r.gennaro,编辑,mack publishing company(1995)。在某些实施方案中,制剂包含pbs;20mm naoac(ph 5.2)、50mm nacl;和/或10mm naoac(ph 5.2)、9%的蔗糖。在某些实施方案中,最佳药物组合物将由本领域技术人员根据例如预期的施用途径、递送形式和所需剂量来确定。参见,例如,remington's pharmaceutical sciences,同上。在某些实施方案中,此类组合物可以影响抗cd39抗体的物理状态、稳定性、体内释放速率和/或体内清除速率。
[0338]
在某些实施方案中,药物组合物中的主要媒介物或载剂本质上可以是水性或非水性的。例如,在某些实施方案中,合适的媒介物或载剂可以是注射用水、生理盐水溶液或人工脑脊液,其可能补充有用于肠胃外施用的组合物中常用的其它材料。在某些实施例中,盐水包含等渗磷酸盐缓冲盐水。在某些实施方案中,中性缓冲盐水或与血清白蛋白混合的盐水是进一步的示例性媒介物。在某些实施方案中,药物组合物包含ph为约7.0-8.5的tris缓冲液,或ph为约4.0-5.5的乙酸盐缓冲液,其还可包含山梨醇或其合适的替代物。在某些实施方案中,可通过将所选的具有所需纯度的组合物与任选的配制剂(remington's pharmaceutical sciences,同上)以冻干饼或水溶液的形式混合来制备包含抗cd39抗体的组合物以用于储存。另外,在某些实施方案中,可使用合适的赋形剂诸如蔗糖将包含抗cd39抗体的组合物配制成冻干物。
[0339]
在某些实施方案中,可选择药物组合物用于肠胃外递送。在某些实施方案中,可选择组合物用于吸入或通过消化道(诸如口服)递送。此类药学上可接受的组合物的制备在本领域技术人员的能力范围内。
[0340]
在某些实施方案中,制剂组分以施用部位可接受的浓度存在。在某些实施方案中,缓冲液用于将组合物保持在生理ph或稍低的ph下,通常在约5至约8的ph范围内。
[0341]
在某些实施方案中,当设想肠胃外施用时,治疗性组合物可以以无热原、肠胃外可接受的水溶液的形式存在于药学上可接受的媒介物中,所述水溶液包含抗cd39抗体。在某些实施方案中,用于肠胃外注射的媒介物是无菌蒸馏水,其中抗cd39抗体被配制成无菌等渗溶液,并被适当保存。在某些实施方案中,所述制备可涉及将所需分子与剂(诸如可注射微球、生物可侵蚀颗粒、聚合化合物(诸如聚乳酸或聚乙醇酸)、珠粒或脂质体)一起配制,所述剂可提供产品的受控或持续释放,所述产品然后可通过储库注射进行递送。在某些实施方案中,还可使用透明质酸,所述透明质酸可具有促进循环中的持续时间的作用。在某些实施方案中,可植入药物递送装置可用于引入所需的分子。
[0342]
在某些实施方案中,药物组合物可以被配制用于吸入。在某些实施方案中,抗cd39抗体可被配制成干粉用于吸入。在某些实施方案中,可用用于气雾剂递送的推进剂配制包
含抗cd39抗体的吸入溶液。在某些实施方案中,可将溶液雾化。在pct申请号pct/us94/001875(其描述了经化学修饰的蛋白质的肺部递送)中进一步描述了肺部施用。
[0343]
在某些实施方案中,设想了可以口服施用制剂。在某些实施方案中,可以用或可以不用通常用于配制固体剂型诸如片剂和胶囊剂的那些载剂来配制以这种方式施用的抗cd39抗体。在某些实施方案中,胶囊剂可被设计成在胃肠道中在生物利用度被最大化且体系前降解被最小化时的点释放制剂的活性部分。在某些实施方案中,可包括至少一种另外的剂以促进抗cd39抗体的吸收。在某些实施方案中,还可使用稀释剂、调味剂、低熔点蜡、植物油、润滑剂、悬浮剂、片剂崩解剂和粘合剂。
[0344]
在某些实施方案中,药物组合物可包含有效量的抗cd39抗体与适合于片剂生产的无毒赋形剂的混合物。在某些实施方案中,通过将片剂溶解在无菌水或另一种合适的媒介物中,可以以单位剂量形式制备溶液。在某些实施方案中,合适的赋形剂包括但不限于惰性稀释剂,诸如碳酸钙、碳酸钠或碳酸氢钠、乳糖或磷酸钙;或粘合剂,诸如淀粉、明胶或阿拉伯胶;或润滑剂,诸如硬脂酸镁、硬脂酸或滑石。
[0345]
其它药物组合物对本领域技术人员来说是显而易见的,包括在持续或受控释放制剂中包含抗cd39抗体的制剂。在某些实施方案中,用于配制多种其它持续或受控递送部件(诸如脂质体载剂、可生物消蚀的微粒或多孔珠粒和储库注射剂)的技术对于本领域技术人员来说也是已知的。参见例如描述用于递送药物组合物的多孔聚合物微粒的受控释放的pct申请号pct/us93/00829。在某些实施方案中,持续释放制剂可包括成型制品形式(例如薄膜或微胶囊)的半透性聚合物基质。持续释放基质可包括聚酯、水凝胶、聚丙交酯(美国专利第3,773,919和ep 058,481)、l-谷氨酸和γ-乙基-l-谷氨酸的共聚物(sidman等人,biopolymers,22:547-556(1983))、聚(2-羟基乙基-甲基丙烯酸酯)(langer等人,j.biomed.mater.res.,15:167-277(1981)和langer,chem.tech.,12:98-105(1982))、乙烯乙酸乙烯酯(langer等人,同上)或聚-d(-)-3-羟基丁酸(ep 133,988)。在某些实施方案中,持续释放组合物还可包含脂质体,其可通过本领域已知的几种方法中的任一种来制备。参见,例如,eppstein等人,proc.natl.acad.sci.usa,82:3688-3692(1985);ep 036,676;ep 088,046和ep 143,949。
[0346]
用于体内施用的药物组合物通常是无菌的。在某些实施方案中,这可以通过无菌过滤膜过滤来实现。在某些实施方案中,当冻干组合物时,使用该方法的灭菌可以在冻干和复原之前或之后进行。在某些实施方案中,用于肠胃外施用的组合物可以以冻干形式或溶液形式储存。在某些实施方案中,通常将肠胃外组合物置于具有无菌入口的容器中,例如,具有可被皮下注射针头刺穿的塞子的静脉内注射溶液袋或小瓶。
[0347]
在某些实施方案中,一旦配制了药物组合物,就可将其以溶液、悬浮液、凝胶、乳液、固体的形式或作为脱水或冻干粉末储存在无菌小瓶中。在某些实施方案中,可将此类制剂以即用型或施用复原的形式(例如,冻干的)储存。
[0348]
在某些实施方案中,提供了用于产生单剂量施用单位的药盒。在某些实施方案中,药盒可包含含有干燥蛋白质的第一容器和含有水性制剂的第二容器。在某些实施方案中,包括了包含单室和多室预填充注射器(例如,液体注射器和冻干注射器)的药盒。
[0349]
在某些实施方案中,待治疗性使用的包含抗cd39抗体的药物组合物的有效量将取决于例如治疗背景和目标。本领域技术人员将理解,根据某些实施方案,用于治疗的合适剂
量水平将因此部分取决于所递送的分子、对其使用抗cd39抗体的适应症、施用途径和患者的尺寸(体重、身体表面积或器官尺寸)和/或状况(年龄和一般健康状况)而变化。在某些实施方案中,临床医生可滴定剂量并修改施用途径以获得最佳治疗效果。
[0350]
在某些实施方案中,给药频率将考虑所用制剂中抗cd39抗体的药代动力学参数。在某些实施方案中,临床医生将施用该组合物,直至达实现期望效果的剂量。在某些实施方案中,所述组合物因此可以随时间以单剂量或两个或更多个剂量(其可以包含或可以不包含相同量的所需分子)施用,或者作为经由植入装置或导管的连续输注施用。适当剂量的进一步细化由本领域普通技术人员常规进行,并且在他们常规执行的任务的范围内。在某些实施例中,可通过使用适当的剂量-响应数据来确定适当的剂量。
[0351]
在某些实施方案中,药物组合物的施用途径依照已知的方法,例如口服,通过经由静脉内、腹膜内、脑内(实质内)、脑室内、肌内、皮下、眼内、动脉内、门静脉内或病变内途径的注射;通过持续释放系统或植入装置。在某些实施方案中,组合物可通过推注注射施用或通过输注连续施用,或通过植入装置施用。在某些实施方案中,组合疗法的单个成分可以通过不同的途径施用。
[0352]
在某些实施方案中,可通过植入其上已吸附或包封了所需分子的膜、海绵或另一种合适的材料来局部施用所述组合物。在某些实施方案中,在使用植入装置的情况下,可将所述装置植入任何合适的组织或器官中,并且所需分子的递送可通过扩散、定时释放推注或连续施用来进行。在某些实施方案中,可希望以离体方式使用包含抗cd39抗体的药物组合物。在此类情况下,将从患者取出的细胞、组织和/或器官暴露于包含抗cd39抗体的药物组合物中,之后将所述细胞、组织和/或器官植入回患者体内。
[0353]
在某些实施方案中,可通过使用方法(诸如本文所述的那些方法)植入某些已被遗传工程化的细胞以表达和分泌多肽来递送抗cd39抗体。在某些实施方案中,此类细胞可以是动物或人细胞,并且可以是自体的、异源的或异种的。在某些实施方案中,可使细胞永生化。在某些实施方案中,为了减少免疫响应的机会,可包封细胞以避免对周围组织的浸润。在某些实施方案中,包封材料通常是生物相容的、半透性的聚合物外壳或膜,其允许一种或多种蛋白质产物的释放,但防止细胞被患者的免疫系统或来自周围组织的其它有害因素破坏。应用
[0354]
本文所述的组合物可用于多种诊断和治疗应用。例如,可检测标记的抗原结合分子可用于检测靶抗原在样品(例如,生物样品)中的存在或量的测定。所述组合物可用于研究靶抗原功能的抑制的体外测定。在例如其中所述组合物与补体蛋白结合并抑制补体蛋白的一些实施方案中,所述组合物可在测定中用作阳性对照,所述测定被设计成鉴定抑制补体活性或以其它方式用于治疗补体相关病症的其它新型化合物。例如,cd39抑制组合物可在测定中用作阳性对照,以鉴定减少或消除cd39产生的其它化合物(例如,小分子、适体或抗体)。所述组合物也可用于下文详述的治疗方法。
[0355]
在一些实施方案中,本公开提供了检测生物样品或受试者中cd39的方法,包括(i)在允许抗体分子和cd39发生相互作用的条件下,使样品或受试者(和任选的参考样品或受试者)与表1中的任何抗体接触,以及(ii)检测抗体分子与样品或受试者(和任选的参考样品或受试者)之间复合物的形成。
药盒
[0356]
在一些实施方案中,本公开提供了包含本文公开的抗cd39抗体的药盒以及使用说明。在一些实施方案中,本公开提供了药盒,其包含结合人cd39的分离的抗体或其抗原结合部分(诸如本文所述的那些),或包含所述抗体或其抗原结合部分的药物组合物,以及刺激受试者中的免疫响应或治疗受试者的癌症的使用说明书,任选地具有与一种或多种另外的治疗剂或程序组合的使用说明书。在一些实施方案中,所述一种或多种另外的治疗剂或程序选自由以下组成的组:化学疗法、靶向抗癌疗法、溶瘤药物、细胞毒性剂、基于免疫的疗法、细胞因子、手术程序、放射程序、共刺激分子的激活剂、抑制性分子的抑制剂、疫苗或细胞免疫疗法或其组合。
[0357]
在一些实施方案中,所述药盒提供了与pd-1拮抗剂、腺苷a2ar拮抗剂、cd73抑制剂、ctla-4抑制剂、tim-3抑制剂、lag-3抑制剂、嵌合抗原受体(car)细胞疗法、蒽环类药物或其组合组合的使用说明书。
[0358]
在一些实施方案中,所述药盒提供了与cd73抑制剂和a2ar拮抗剂组合的使用说明书。在一些实施方案中,所述药盒提供了与pd-1拮抗剂和腺苷a2ar拮抗剂组合的使用说明书。
[0359]
在一些实施方案中,所述药盒提供了与pd-1拮抗剂组合的使用说明书。在一些实施方案中,pd-1拮抗剂选自由以下组成的组:pdr001、纳武单抗、培布罗珠单抗、皮地珠单抗、medi0680、regn2810、tsr-042、pf-06801591和amp-224。在一些实施方案中,pd-1拮抗剂选自由以下组成的组:faz053、阿特珠单抗、阿维单抗、德瓦鲁单抗和bms-936559。
[0360]
在一些实施方案中,所述药盒提供了与腺苷a2ar拮抗剂组合的使用说明书。在一些实施方案中,腺苷a2ar拮抗剂选自由以下组成的组:nir178、cpi-444、azd4635、维帕德南、gbv-2034和ab928。在一些实施方案中,腺苷a2ar拮抗剂是cpi-444。
[0361]
在一些实施方案中,所述药盒提供了与cd73抑制剂组合的使用说明书。在一些实施方案中,cd73抑制剂选自由以下组成的组:ab421、medi9447和bms-986179。
[0362]
在一些实施方案中,所述药盒提供了与ctla-4抑制剂组合的使用说明书。在一些实施方案中,ctla-4抑制剂是伊匹木单抗或曲美木单抗。
[0363]
在一些实施方案中,所述药盒提供了与tim-3抑制剂组合的使用说明书。在一些实施方案中,tim-3抑制剂是mgb453或tsr-022。
[0364]
在一些实施方案中,所述药盒提供了与lag-3抑制剂组合的使用说明书。在一些实施方案中,lag-3抑制剂选自由以下组成的组:lag525、bms-986016和tsr-033。
[0365]
在一些实施方案中,所述药盒提供了与嵌合抗原受体(car)细胞疗法组合的使用说明书。在一些实施方案中,car细胞疗法是ctl019。
[0366]
在一些实施方案中,所述药盒提供了与蒽环类药物组合的使用说明书。在一些实施方案中,蒽环类药物选自多柔比星、柔红霉素、表柔比星、伊达比星和戊柔比星。在一些实施方案中,蒽环类药物是多柔比星。
[0367]
药盒可包括本文公开的抗cd39抗体和使用说明书。药盒可在适当的容器中包含抗cd39抗体、一种或多种对照和各种缓冲液、试剂、酶以及本领域公知的其它标准成分。在一些方面,本公开提供了药盒,其包含本文公开的抗cd39抗体或抗原结合部分,以及刺激受试者中的免疫响应或治疗受试者的癌症的使用说明书,任选地具有与本文所述的一种或多种另外的治疗剂或程序组合的使用说明书。
[0368]
容器可包括至少一个可将抗cd39抗体放入其中以及在一些情况下适当地将抗cd39抗体在其中等分的小瓶、孔、试管、烧瓶、瓶子、注射器或其它容器装置。如果提供了另外的组件,药盒可包含可将该组件放入其中的另外的容器。所述药盒还可包括以密封方式容纳抗cd39抗体和任何其它试剂容器的装置以用于商业销售。此类容器可包括将所需小瓶保持在其中的注塑成型或吹塑成型塑料容器。容器和/或药盒可包括带有使用说明和/或警告的标签。使用方法
[0369]
本发明的组合物具有许多体外和体内用途,包括cd39和/或对cd39功能的拮抗的检测和/或定量。
[0370]
在一些实施方案中,本公开提供了刺激受试者中的免疫响应的方法和用途,所述方法包括向受试者施用有效量的由本公开提供的结合至并拮抗cd39的分离的抗体或其抗原结合部分,或包含所述抗体或其抗原结合部分和药学上可接受的载剂的药物组合物。
[0371]
在一些实施方案中,本公开提供了治疗受试者的癌症的方法和用途,所述方法包括向受试者施用有效量的由本公开提供的结合至并拮抗cd39的分离的抗体或其抗原结合部分,或包含所述抗体或其抗原结合部分和药学上可接受的载剂的药物组合物。
[0372]
在一些实施方案中,本公开提供了治疗受试者癌症的方法,所述方法包括向受试者施用有效量的由本公开提供的结合至并拮抗cd39的分离的抗体或其抗原结合部分,或包含所述抗体或其抗原结合部分和药学上可接受的载剂的药物组合物,其中所述抗体或其抗原结合部分或者药物组合物抑制或降低肿瘤微环境中cd39的酶活性,从而治疗癌症。
[0373]
在一些实施方案中,本公开提供了治疗受试者的癌症的方法,所述方法包括向受试者施用有效量的由本公开提供的结合至并拮抗cd39的分离的抗体或其抗原结合部分,或包含所述抗体或其抗原结合部分和药学上可接受的载剂的药物组合物,其中所述抗体或其抗原结合部分,或药物组合物抑制或降低cd39的酶活性,其中抑制或降低cd39的酶活性抑制或降低肿瘤微环境中细胞外三磷酸腺苷(eatp)或细胞外二磷酸腺苷(eadp)向细胞外一磷酸腺苷(amp)的转化,从而治疗癌症。
[0374]
在一些实施方案中,本公开提供了治疗受试者的癌症的方法,所述方法包向受试者施用有效量的由本公开提供的结合至并拮抗cd39的分离的抗体或其抗原结合部分,或包含所述抗体或其抗原结合部分和药学上可接受的载剂的药物组合物,其中所述抗体或其抗原结合部分,或药物组合物抑制或降低cd39的酶活性,其中抑制或降低cd39的酶活性增加或提高肿瘤微环境中细胞外三磷酸腺苷(eatp)的水平,从而治疗癌症。
[0375]
在一些实施方案中,本公开提供了治疗受试者的癌症的方法,所述方法包括向受试者施用有效量的由本公开提供的结合至并拮抗cd39的分离的抗体或其抗原结合部分,或包含所述抗体或其抗原结合部分和药学上可接受的载剂的药物组合物,其中所述抗体或其抗原结合部分或者药物组合物抑制或降低cd39的酶活性,其中抑制或降低cd39的酶活性降低或减少肿瘤微环境中细胞外腺苷水平,从而治疗癌症。
[0376]
在一些实施方案中,本公开提供了治疗受试者的癌症的方法,所述方法包括向受试者施用有效量的由本公开提供的结合至并拮抗cd39的分离的抗体或其抗原结合部分,或包含所述抗体或其抗原结合部分和药学上可接受的载剂的药物组合物,其中所述抗体或其抗原结合部分或所述药物组合物抑制或降低cd39的酶活性,其中抑制或降低cd39的酶活性
增加或提高细胞外三磷酸腺苷(eatp)的水平,并降低或减少肿瘤微环境中细胞外腺苷水平,从而治疗癌症。
[0377]
在一些实施方案中,本公开提供了治疗受试者的癌症的方法,所述方法包括向受试者施用有效量的由本公开提供的结合至并拮抗cd39的分离的抗体或其抗原结合部分,或包含所述抗体或其抗原结合部分和药学上可接受的载剂的药物组合物,其中所述抗体或其抗原结合部分,或者所述药物组合物抑制或降低cd39的酶活性,其中抑制或降低cd39的酶活性维持、增加或提高肿瘤微环境中细胞外三磷酸腺苷(eatp)的免疫刺激水平,从而治疗癌症。
[0378]
在一些实施方案中,本公开提供了治疗受试者癌症的方法,该方法包括向受试者施用有效量的由本公开提供的结合并拮抗cd39的分离的抗体或其抗原结合部分,或者包含抗体或其抗原结合部分和药学上可接受的载剂的药物组合物,其中所述抗体或其抗原结合部分或者药物组合物抑制或降低cd39的酶活性,其中抑制或降低cd39酶活性增加或提高肿瘤微环境中淋巴细胞的增殖,从而治疗癌症。
[0379]
在一些实施方案中,本公开提供了治疗受试者癌症的方法,所述方法包括向受试者施用有效量的由本公开提供的结合至并拮抗cd39的分离的抗体或其抗原结合部分,或包含所述抗体或其抗原结合部分和药学上可接受的载剂的药物组合物,其中所述抗体或其抗原结合部分,或者所述药物组合物抑制或降低cd39的酶活性,其中抑制或降低cd39的酶活性提高一种或多种树突细胞活化标志物的表达。
[0380]
在一些实施方案中,本公开提供了治疗受试者的癌症的方法,所述方法包括向受试者施用有效量的由本公开提供的结合至并拮抗cd39的分离的抗体或其抗原结合部分,或包含所述抗体或其抗原结合部分和药学上可接受的载剂的药物组合物,其中所述抗体或其抗原结合部分,或者所述药物组合物抑制或降低cd39的酶活性,其中抑制或降低cd39的酶活性提高一种或多种细胞因子从树突细胞的分泌。
[0381]
在一些实施方案中,本公开提供了治疗受试者的癌症的方法,其中所述癌症选自由以下组成的组:肺癌(例如,非小细胞肺癌)、卵巢癌、肾癌、睾丸癌、胰腺癌、乳腺癌(例如,三阴性乳腺癌)、黑素瘤、头颈癌(例如,鳞状头颈癌)、结直肠癌、膀胱癌、子宫内膜癌、前列腺癌、甲状腺癌、肝细胞癌、胃癌、脑癌、淋巴瘤或肾癌(例如,肾细胞癌)。
[0382]
上述组合物尤其可用于治疗或预防受试者的多种癌症的方法。可使用多种部分取决于施用途径的方法向受试者(例如人受试者)施用组合物。所述途径可以是例如静脉内注射或输注(iv)、皮下注射(sc)、腹膜内(ip)注射、肌内注射(im)或鞘内注射(it)。注射可以是推注或连续输注。
[0383]
施用可通过例如局部输注、注射或通过植入来实现。植入物可以是多孔的、无孔的或凝胶状的材料,包括膜,诸如唾液弹性膜或纤维。植入物可被配置用于向受试者持续或定期释放组合物。参见,例如美国专利申请公开号20080241223;美国专利第5,501,856号、第4,863,457号和第3,710,795号;ep488401;以及ep 430539,所述专利申请和专利中的每一项通过引用整体并入本文。可通过基于例如扩散系统、可侵蚀系统或对流系统的可植入装置(例如,渗透泵、生物可降解的植入物、电扩散系统、电渗系统、蒸汽压泵、电解泵、起泡泵、压电泵、基于侵蚀的系统或机电系统)向受试者递送组合物。
[0384]
在一些实施方案中,通过局部施用将抗cd39抗体或其抗原结合片段治疗性地递送给受试者。
[0385]
本文所述的抗体或其片段的合适剂量(所述剂量能够治疗或预防受试者的癌症)可取决于多种因素,包括例如待治疗的受试者的年龄、性别和体重以及所用的特定抑制剂化合物。例如,与治疗同一受试者所需的cd39结合fab
’
抗体片段的剂量相比,治疗患有癌症的受试者可能需要不同剂量的完整抗cd39抗体。影响向受试者施用的剂量的其它因素包括,例如,癌症的类型或严重程度。例如,与患有胶质母细胞瘤的受试者相比,患有转移性黑素瘤的受试者可能需要施用不同剂量的抗cd39抗体。其它因素可包括,例如,同时或之前影响受试者的其它医学病症、受试者的一般健康状况、受试者的遗传倾向、饮食、施用时间、排泄速率、药物组合以及向受试者施用的任何其它另外的治疗剂。还应当理解,任何特定对象的具体剂量和治疗方案也将取决于从业医生(例如,医生或护士)的判断。本文描述了合适的剂量。
[0386]
药物组合物可包含治疗有效量的本文所述的抗cd39抗体或其抗原结合片段。如果使用一种以上的剂,本领域普通技术人员可以部分地基于所施用的抗体的效果或者抗体与一种或多种另外的活性剂的组合效果,来容易地确定这样的有效量。本文所述的抗体或其片段的治疗有效量也可以根据诸如个体的疾病状态、年龄、性别和体重以及抗体(和一种或多种另外的活性剂)在个体中引发期望的响应(例如,肿瘤生长减少)的能力等因素而变化。例如,治疗有效量的抗cd39抗体可以抑制(减轻其严重程度或消除其发生)和/或预防特定病症和/或本领域已知或本文所述的特定病症的任一种症状。治疗有效量也是其中组合物的任何毒性或有害作用被治疗有益效果所超过的量。
[0387]
可在例如i期剂量升级研究中进一步评估本文所述的任何抗体或其片段的合适的人剂量。参见,例如,van gurp等人(2008)am j transplantation 8(8):1711-1718;hanouska等人(2007)clin cancer res 13(2,part 1):523-531;以及hetherington等人(2006)antimicrobial agents and chemotherapy 50(10):3499-3500。
[0388]
在一些实施方案中,组合物包含本文所述的任何抗体或其抗原结合片段以及一种或多种(例如,两种、三种、四种、五种、六种、七种、八种、九种、十种或十一种或更多种)另外的治疗剂,使得组合物整体上是治疗有效的。例如,组合物可包含本文所述的抗cd39抗体和烷化剂,其中抗体和剂各自的浓度在组合时对治疗或预防受试者的癌症(例如,黑素瘤)是治疗上有效的。
[0389]
此类组合物的毒性和治疗效果可通过细胞培养物或实验动物(例如,本文所述的任何癌症的动物模型)中的已知制药程序来确定。这些程序可用于,例如,确定ld50(50%群体的致死剂量)和ed50(50%群体的治疗有效剂量)。毒性与治疗效果之间的剂量比率是治疗指数,其可表示为ld50/ed50的比率。表现出高治疗指数的抗体或其抗原结合片段是优选的。虽然可使用显示出毒副作用的组合物,但应当注意设计将此类化合物靶向到受累组织部位并使对正常细胞的潜在损伤降至最低,从而减小副作用的递送系统。
[0390]
从细胞培养测定和动物研究中获得的数据可用于配制在人中使用的一系列剂量。此类抗体或其抗原结合片段的剂量通常在包括ed50的抗体或片段的循环浓度范围内,且毒性很小或没有毒性。剂量可在这个范围内变化,这取决于所用的剂型和所用的施用途径。对于本文所述的抗cd39抗体,治疗有效剂量可以最初从细胞培养测定中估计。可在动物模型中配制剂量,以达到包括如在细胞培养物中确定的ic50(即,达到症状的半最大抑制的抗体浓度)的循环血浆浓度范围。此类信息可用于更准确地确定人体内的有用剂量。血浆中的水
平可以例如通过高效液相色谱来测量。在一些实施方案中,例如,在需要局部施用(例如,至眼睛或关节)的情况下,可将细胞培养或动物建模用于确定在局部部位内达到治疗有效浓度所需的剂量。
[0391]
在一些实施方案中,可将所述方法与癌症的其它治疗剂结合进行。例如,可将组合物在进行放射、手术、靶向或细胞毒性化学疗法、化学放射疗法、激素疗法、免疫疗法、基因疗法、细胞移植疗法、精准医学、基因组编辑疗法或其它药物疗法的同时、之前或之后向受试者施用。
[0392]
如上所述,本文所述的组合物(例如,抗cd39组合物)可用于治疗多种癌症,诸如但不限于:卡波西氏肉瘤、白血病、急性淋巴细胞白血病、急性髓细胞白血病、成髓细胞早幼粒细胞髓单核细胞红白血病(myeloblasts promyelocyte myelomonocytic monocytic erythroleukemia)、慢性白血病、慢性髓细胞性(粒细胞)白血病、慢性淋巴细胞性白血病、套细胞淋巴瘤、原发性中枢神经系统淋巴瘤、伯基特淋巴瘤和边缘区b细胞淋巴瘤、真性红细胞增多性淋巴瘤、霍奇金病、非霍奇金病、多发性骨髓瘤、沃尔登斯特伦巨球蛋白血症、重链疾病、实体瘤、肉瘤和癌、纤维肉瘤、粘液肉瘤、脂肪肉瘤、软骨肉瘤、成骨肉瘤、骨肉瘤、脊索瘤、血管肉瘤、内皮肉瘤、淋巴管肉瘤、淋巴管内皮肉瘤、滑膜瘤、间皮瘤、尤因氏瘤、平滑肌肉瘤、横纹肌肉瘤、结肠肉瘤、结直肠癌、胰腺癌、乳腺癌、卵巢癌、前列腺癌、鳞状细胞癌、基底细胞癌、腺癌、汗腺癌、皮脂腺癌、乳头状癌、乳头状腺癌、囊腺癌、髓样癌、支气管癌、肾细胞癌、肝细胞癌、胆管癌、绒毛膜癌、精原细胞瘤、胚胎性癌、肾母细胞瘤、宫颈癌、子宫癌、睾丸肿瘤、肺癌、小细胞肺癌、非小细胞肺癌、膀胱癌、上皮癌、神经胶质瘤、星形细胞瘤、髓母细胞瘤、颅咽管瘤、室管膜瘤、松果体瘤、血管母细胞瘤、听神经瘤、少突神经胶质瘤、脑膜瘤、黑素瘤、神经母细胞瘤、视网膜母细胞瘤、鼻咽癌、食道癌、基底细胞癌、胆道癌、膀胱癌、骨癌、脑和中枢神经系统(cns)癌、宫颈癌、绒毛膜癌、结直肠癌、结缔组织癌、消化系统癌、子宫内膜癌、食道癌、眼癌、头颈癌、胃癌、上皮内肿瘤、肾癌、喉癌、肝癌、肺癌(小细胞、大细胞)、黑素瘤、神经母细胞瘤;口腔癌(例如唇、舌、口和咽)、卵巢癌、胰腺癌、视网膜母细胞瘤、横纹肌肉瘤、直肠癌;呼吸系统癌症、肉瘤、卡波西氏肉瘤、皮肤癌、胃癌、睾丸癌、甲状腺癌、子宫癌和泌尿系统癌。
[0393]
可根据以下多种蛋白质表达模式选择优先适应症:1)正常组织中cd39表达可忽略,肿瘤组织(肺癌、卵巢癌、胰腺癌、肾癌、睾丸癌)中cd39表达上调,2)造血系统癌症(b细胞淋巴瘤、急性骨髓性白血病、急性髓细胞样白血病)中cd39表达维持,以及3)富含骨髓或富含treg的癌症(乳腺癌、胃癌、头颈癌、食道癌)中cd39表达呈阳性。组合疗法
[0394]
在一些实施方案中,可将由本公开提供的抗cd39抗体或其抗原结合部分与一种或多种另外的治疗剂或治疗(例如癌症的另一种治疗剂或治疗)组合。例如,可将抗cd39抗体或其抗原结合部分与一种或多种另外的治疗剂组合向受试者(例如,人患者)施用,其中所述组合为患有癌症或有患癌风险的受试者提供治疗益处。
[0395]
在一些实施方案中,在同一时间(例如,同时地)施用抗cd39抗体或其抗原结合部分和一种或多种另外的治疗剂。在其它实施方案中,在第一时间施用抗cd39抗体或其抗原结合部分,在第二时间(例如,顺次地)施用一种或多种另外的治疗剂。在一些实施方案中,在第一时间施用一种或多种另外的治疗剂,在第二时间施用抗cd39抗体。
[0396]
本文所述的抗cd39抗体或其抗原结合片段可替代或增强先前或当前施用的疗法。例如,在用抗cd39抗体或其抗原结合片段治疗后,可停止或减少一种或多种另外的治疗剂的施用,例如,以较低的水平施用一种或多种另外的治疗剂。在一些实施方案中,可以维持先前疗法的施用。在一些实施方案中,将维持先前的疗法,直至抗cd39抗体的水平达到足以提供治疗效果的水平。
[0397]
在一些实施方案中,本公开提供了治疗受试者的癌症的方法,所述方法包括向受试者施用有效量的与一种或多种另外的治疗剂或程序组合的由本公开提供的结合至并拮抗cd39的分离的抗cd39抗体或其抗原结合部分,其中第二治疗剂或程序选自由以下组成的组:化学疗法、靶向抗癌治疗、溶瘤药物、细胞毒性剂、基于免疫的疗法、细胞因子、手术程序、放射程序、共刺激分子的激活剂、抑制分子的抑制剂、疫苗或细胞免疫疗法或其组合。
[0398]
在一些实施方案中,一种或多种另外的治疗剂是pd-1拮抗剂、腺苷a2ar拮抗剂、cd73抑制剂、ctla-4抑制剂、tim-3抑制剂、lag-3抑制剂、嵌合抗原受体(car)细胞疗法、蒽环类药物或其组合。
[0399]
在一些实施方案中,一种或多种另外的治疗剂是cd73抑制剂和a2ar拮抗剂的组合。在一些实施方案中,一种或多种另外的治疗剂是pd-1拮抗剂和腺苷a2ar拮抗剂的组合。在一些实施方案中,一种或多种另外的治疗剂是pd-1拮抗剂。
[0400]
在一些实施方案中,pd-1拮抗剂选自由以下组成的组:pdr001、纳武单抗、培布罗珠单抗、皮地珠单抗、medi0680、regn2810、tsr-042、pf-06801591和amp-224。在一些实施方案中,pd-1拮抗剂选自由以下组成的组:faz053、阿特珠单抗、阿维单抗、德瓦鲁单抗和bms-936559。
[0401]
在一些实施方案中,一种或多种另外的治疗剂是腺苷a2ar拮抗剂。在一些实施方案中,腺苷a2ar拮抗剂选自由以下组成的组:nir178、cpi-444、azd4635、维帕德南、gbv-2034和ab928。在一些实施方案中,腺苷a2ar拮抗剂是cpi-444。
[0402]
在一些实施方案中,一种或多种另外的治疗剂是cd73抑制剂。在一些实施方案中,cd73抑制剂选自由以下组成的组:ab421、medi9447和bms-986179。
[0403]
在一些实施方案中,一种或多种另外的治疗剂是ctla-4抑制剂。在一些实施方案中,ctla-4抑制剂是伊匹木单抗或曲美木单抗。
[0404]
在一些实施方案中,一种或多种另外的治疗剂是tim-3抑制剂。在一些实施方案中,tim-3抑制剂是mgb453或tsr-022。
[0405]
在一些实施方案中,一种或多种另外的治疗剂是lag-3抑制剂。在一些实施方案中,lag-3抑制剂选自由以下组成的组:lag525、bms-986016和tsr-033。
[0406]
在一些实施方案中,一种或多种另外的治疗剂是嵌合抗原受体(car)细胞疗法。在一些实施方案中,car细胞疗法是ctl019。
[0407]
在一些实施方案中,一种或多种另外的治疗剂是蒽环类药物。在一些实施方案中,蒽环类药物选自多柔比星、柔红霉素、表柔比星、伊达比星和戊柔比星。在一些实施方案中,蒽环类药物是多柔比星。与化学治疗剂的组合
[0408]
在一些实施方案中,将化学治疗与本文所述的抗cd39抗体组合使用。示例性的化学治疗剂包括但不限于蒽环类药物(例如,多柔比星、伊达比星、柔红霉素、阿糖胞苷、表柔
比星、戊柔比星和米托蒽醌)(参见,例如,minotti等人,(2004)pharmacol rev 56(2):185-229)、拓扑异构酶抑制剂(例如,拓扑替康;盐酸拓扑替康、喜树碱、依托泊苷)(参见,例如pommier等人,(2010)chem biol 17(5):421-433;其通过引用整体并入本文)、博莱霉素(kimura等人,(1972)cancer29(1):58-60)、吉西他滨(plunkett等人,(1995)semin oncol 22(4增刊11):3-10)、铂(例如,卡铂、顺铂、奥沙利铂、赛特铂、吡铂)(kelland(2007)nat rev cancer 7(8):573-584)、紫杉烷类(例如,多西紫杉醇、紫杉醇、阿巴紫杉醇(abraxane))(abal等人,(2003)curr cancer drug targets 3(3):193-203)、dna烷化剂(例如环磷酰胺、苯达莫司汀)(leoni等人,(2008)clin cancer res 14(1):309-317)、chop(环磷酰胺、盐酸多柔比星、长春新碱和泼尼松的药物组合)(dunleavy(2014)hematology am soc hematol educ program 2014(1):107-112)和氟尿嘧啶及其衍生物)(alvarez等人,(2012)expert opin ther pat 22(2):107-123,其通过引用整体并入本文)。
[0409]
最近的研究表明,特定化学治疗剂(例如蒽环类药物)的治疗效果与其在癌细胞中诱导免疫原性细胞死亡(icd)的过程的能力密切相关。该过程产生一系列信号,刺激免疫系统识别并清除肿瘤细胞。大量研究表明,化学疗法诱导的icd通过钙网蛋白(calr)、atp、趋化因子(c
–
x
–
c基序)配体10(cxcl10)和高迁移率族盒1(hmgb1)的暴露/释放而发生(gebremeskel和johnston(2015)6(39):41600-41619)。在一些实施方案中,化学治疗剂诱导免疫原性细胞死亡(icd)。在一些实施方案中,诱导icd的剂是蒽环类药物。在一些实施方案中,蒽环类药物选自多柔比星、柔红霉素、表柔比星、伊达比星和戊柔比星。在一些实施方案中,蒽环类药物是多柔比星。在一些实施方案中,诱导icd的剂是铂衍生物。在一些实施方案中,铂衍生物选自奥沙利铂、卡铂和顺铂。在一些实施方案中,铂衍生物是奥沙利铂。
[0410]
适用于与本发明的组合物组合和/或共施用的其它化学治疗剂包括,例如:紫杉醇、细胞松弛素b、短杆菌肽d、溴化乙锭、依米丁、丝裂霉素、依托泊苷、替诺泊苷、长春新碱、长春碱、秋水仙碱、多柔比星、柔红霉素、二羟基蒽二酮(dihydroxyanthrancindione)、米托蒽醌、光神霉素、放线菌素d、1-去氢睾酮、糖皮质激素、普鲁卡因、丁卡因、利多卡因、普萘洛尔和嘌呤霉素及其类似物或同系物。其它剂包括,例如,抗代谢物(例如,甲氨蝶呤、6-巯基嘌呤、6-硫代鸟嘌呤、阿糖胞苷、5-氟尿嘧啶氨烯咪胺)、烷化剂(例如,氮芥、噻替派、苯丁酸氮芥、美法仑、卡莫司汀(bsnu)、洛莫司汀(ccnu)、环磷酰胺、白消安、二溴甘露醇、链佐霉素、丝裂霉素c、顺式-二氯二胺铂(ii)(ddp)、丙卡巴肼(procarbazine)、六甲蜜胺、顺铂、卡铂、奥沙利铂、奈达铂、赛特铂或三铂四硝酸酯)、蒽环类药物(例如柔红霉素(原称道诺霉素)和多柔比星)、抗生素(例如更生霉素(原称放线菌素)、博莱霉素、光神霉素和氨茴霉素(amc))和抗有丝分裂剂(例如长春新碱和长春碱)和替莫唑胺。与pd-1/pd-l1拮抗剂的组合
[0411]
在一些实施方案中,由本公开提供的抗cd39抗体或其抗原结合部分与一种或多种pd-1拮抗剂组合(例如,组合施用),所述pd-1拮抗剂与人pd-1或pd-l1结合并抑制pd-1/pd-l1生物活性和/或一个或多个下游途径和/或由人pd-1/pd-l1信号传导介导的细胞加工或其它人pd-1/pd-l1介导的功能。
[0412]
因此,本文提供了pd-1拮抗剂,其可直接或变构阻断、拮抗、阻抑、抑制或降低pd-1/pd-l1生物活性,包括由pd-1/pd-l1信号传导介导的下游途径和/或细胞过程,诸如受体结合和/或引发对pd-1/pd-l1的细胞响应。本文还提供了减少细胞或受试者产生的人pd-1
或pd-l1的数量或量的pd-1拮抗剂。
[0413]
在一些实施方案中,本公开提供了结合人pd-1并防止、抑制或减少pd-l1与pd-1的结合的pd-1拮抗剂。在一些方面,pd-1拮抗剂与编码pd-1或pd-l1的mrna结合并阻止翻译。在一些实施方案中,pd-1拮抗剂与编码pd-1或pd-l1的mrna结合,并导致降解和/或周转。
[0414]
在一些实施方案中,pd-1拮抗剂抑制pd-1信号传导或功能。在一些实施方案中,pd-1拮抗剂阻断pd-1与pd-l1、pd-l2或pd-l1和pd-l2的结合。在一些实施方案中,pd-1拮抗剂阻断pd-1与pd-l1的结合。在一些实施方案中,pd-1拮抗剂阻断pd-1与pd-l2的结合。在一些实施方案中,pd-1拮抗剂阻断pd-1与pd-l1和pd-l2的结合。在一些实施方案中,pd-1拮抗剂结合pd-1。在一些实施方案中,pd-1拮抗剂结合pd-l1。在一些实施方案中,pd-1拮抗剂结合pd-l2。
[0415]
在一些实施方案中,pd-1拮抗剂抑制pd-1与其同源配体的结合。在一些实施方案中,pd-1拮抗剂抑制pd-1与pd-l1、pd-1与pd-l2或pd-1与pd-l1和pd-l2的结合。在一些实施方案中,pd-1拮抗剂不抑制pd-1与其同源配体的结合。
[0416]
在一些实施方案中,pd-1拮抗剂是与pd-1或pd-l1结合的分离的抗体(mab)或其抗原结合片段。在一些实施方案中,pd-1拮抗剂是与人pd-1结合的抗体或其抗原结合片段。在一些实施方案中,pd-1拮抗剂是与人pd-l1结合的抗体或其抗原结合片段。在一些实施方案中,pd-1拮抗剂是与人pd-l1结合并抑制pd-l1与pd-1结合的抗体或抗原结合片段。在一些实施方案中,pd-1拮抗剂是与人pd-1结合并抑制pd-l1与pd-1结合的抗体或抗原结合片段。
[0417]
几种抑制或破坏pd-1与其配体pd-l1和pd-l2之一或两者之间的相互作用的免疫检查点拮抗剂正在临床开发中,或目前可由临床医生用来治疗癌症。
[0418]
可在由本公开提供的组合物、方法和用途中的任一项中包含pd-1拮抗剂的抗人pd-1抗体或其抗原结合片段的实例包括但不限于:(培布罗珠单抗、mk-3475、h409a11;参见us8952136、us8354509、us8900587和ep2170959,其全部通过引用整体并入本文;merck),(纳武单抗、bms-936558,mdx-1106,ono-4538;参见us7595048、us8728474、us9073994、us9067999、ep1537878、us8008449、us8779105和ep2161336,其全部通过引用整体并入本文;bristol myers squibb)、medi0680(amp-514)、bgb-a317和bgb-108(beigene)、244c8和388d4(参见wo2016106159,其通过引用整体并入本文;enumeral biomedical)、pdr001(novartis)和regn2810(regeneron)。因此,在一些实施方案中,pd-1拮抗剂是培布罗珠单抗。在一些实施方案中,pd-1拮抗剂是纳武单抗。
[0419]
可在由本公开提供的组合物、方法和用途中的任一项中包含pd-1拮抗剂的抗人pd-l1抗体或其抗原结合片段的实例包括但不限于:(阿维单抗、msb0010718c,参见wo2013/79174,其通过引用整体并入本文;merck/pfizer)、(德瓦鲁单抗、medi4736)、(阿特珠单抗、mpdl3280a、rg7446;参见wo2010/077634,其通过引用整体并入本文;roche)、mdx-1105(bms-936559、12a4;参见us7943743和wo2013/173223,这两者通过引用整体并入本文;medarex/bms)和faz053(novartis)。因此,在一些实施方案中,pd-1拮抗剂是阿维单抗。在一些实施方案中,pd-1拮抗剂是德瓦鲁单抗。在一些实施方案中,pd-1拮抗剂是阿特珠单抗。
[0420]
在一些实施方案中,pd-1拮抗剂是与人pd-1或人pd-l1结合的免疫粘附素,例如,
b2;成纤维细胞活化蛋白α(fap);胰岛素样生长因子1受体(igf-1受体)、碳酸酐酶ix(caix);蛋白酶体(prosome,macropain)亚单位,β类型9(lmp2);糖蛋白100(gp100);由断点簇区域(bcr)和abelson鼠白血病病毒病毒癌基因同源物1(abl)组成的癌基因融合蛋白(bcr-abl);酪氨酸酶;肝配蛋白a型受体2(epha2);岩藻糖基gm1;唾液酸基lewis粘附分子(sle);神经节苷脂gm3(aneu5ac(2-3)bdgalp(l-4)bdglcp(l-l)cer);转谷氨酰胺酶5(tgs5);高分子量-黑素瘤相关抗原(hmwmaa);邻乙酰基-gd2神经节苷脂(oacgd2);叶酸受体β;肿瘤内皮标志物1(tem1/cd248);肿瘤内皮标志物7相关的(tem7r);紧密连接蛋白6(cldn6);甲状腺刺激激素受体(tshr);g蛋白偶联受体c类5组,成员d(gprc5d);x染色体开放阅读框架61(cxorf61);cd97;cd179a;间变性淋巴瘤激酶(alk);多唾液酸;胎盘特异性1(plac1);globoh糖神经酰胺的六糖部分(globoh);乳腺分化抗原(ny-br-1);尿斑素2(upk2);甲型肝炎病毒细胞受体1(havcr1);肾上腺素受体β3(adrb3);泛连接蛋白3(panx3);g蛋白偶联受体20(gpr20);淋巴细胞抗原6复合体、基因座k 9(ly6k);嗅觉受体51e2(or51e2);tcrγ读框替代蛋白(tarp);wilms肿瘤蛋白(wt1);癌症/睾丸抗原1(ny-eso-1);癌症/睾丸抗原2(lage-la);黑素瘤相关抗原1(mage-a1);位于12p染色体上的ets易位变异基因6(etv6-aml);精子蛋白17(spa17);x抗原家族成员1a(xage1);血管生成素结合细胞表面受体2(tie2);黑素瘤睾丸抗原-1(mad-ct-1);黑素瘤睾丸抗原-2(mad-ct-2);fos相关抗原1;肿瘤蛋白p53(p53);p53突变体;前列腺素;生存素(surviving);端粒酶;前列腺癌肿瘤抗原-1(pcta-1或半乳糖凝集素8)、被t细胞1识别的黑素瘤抗原(melana或marti);大鼠肉瘤(ras)突变体;人端粒酶逆转录酶(htert);肉瘤易位断点;黑素瘤凋亡抑制剂(ml-iap);erg(跨膜蛋白酶、丝氨酸2(tmprss2)ets融合基因);n-乙酰氨基葡糖胺基转移酶v(na17);配对盒蛋白pax-3(pax3);雄激素受体;细胞周期蛋白b l;v-myc禽类髓质番茄sis病毒癌基因神经母细胞瘤衍生同源物(mycn);ras同源物家庭成员c(rhoc);酪氨酸酶相关蛋白2(trp-2);细胞色素p450 1b 1(cyp1b1);ccctc结合因子(锌指蛋白)样(boris或印迹位点调节物兄弟(boris or brother of the regulator of imprinted sites))、t细胞识别的鳞状细胞癌抗原3(sart3);配对盒蛋白pax-5(pax5);顶体蛋白酶原结合蛋白sp32(oy-tes 1);淋巴细胞特异性蛋白酪氨酸激酶(lck);激酶锚蛋白4(akap-4);滑膜肉瘤x断点2(ssx2);高级糖化终产物受体(rage-1);肾泛在1(ru1);肾泛在2(ru2);豆荚蛋白;人乳头瘤病毒e6(hpv e6);人乳头瘤病毒e7(hpv e7);肠羧基酯酶;突变的热激蛋白70-2(mut hsp70-2);cd79a;cd79b;cd72;白细胞相关免疫球蛋白样受体1(lair1);iga受体的fc片段(fcar或cd89);白细胞免疫球蛋白样受体亚家族a成员2(lilra2);cd300分子样家族成员f(cd300lf);c型凝集素结构域家族12成员a(clec12a);骨髓基质细胞抗原2(bst2);含egf样模块的粘蛋白样激素受体样2(emr2);淋巴细胞抗原75(ly75);磷脂酰基醇蛋白聚糖-3(gpc3);fc受体样5(fcrl5);和免疫球蛋白λ样多肽1(igll1)。
[0433]
在一些实施方案中,car的抗原结合结构域与cd19结合。在us2015/0283178(其通过引用整体并入本文)中描述了与cd19结合的示例性car(例如,ctl019)。在一些实施方案中,cd19 car包含us2015/0283178中所示的氨基酸序列或与其基本相同的序列(例如,与其具有至少约85%、90%或95%序列同一性的序列)。
[0434]
在一个实施方案中,car包含源自选自由以下组成的组的蛋白质的跨膜结构域:t细胞受体的α、β或ζ链、cd28、cd3ε、cd45、cd4、cd5、cd8、cd9、cd16、cd22、cd33、cd37、cd64、
cd80、cd86、cd134、cd137和cd154。
[0435]
在一些实施方案中,car包含胞内信号传导结构域,所述胞内信号传导结构域来源于选自由以下组成的组的蛋白质:mhc i类分子、tnf受体蛋白、免疫球蛋白样蛋白、细胞因子受体、整联蛋白、信号传导淋巴细胞活化分子(slam蛋白)、活化nk细胞受体、btla、toll配体受体、ox40、cd2、cd7、cd27、cd28、cd30、cd40、cds、icam-1、lfa-1(cdl la/cd18)、4-1bb(cd137)、b7-h3、cds、icam-1、icos(cd278)、gitr、baffr、light、hvem(lightr)、kirds2、slamf7、nkp80(klrf1)、nkp44、nkp30、nkp46、cd19、cd4、cd8α、cd8β、il2rβ、il2rγ、il7rα、itga4、vla1、cd49a、itga4、ia4、cd49d、itga6、vla-6、cd49f、itgad、cdl ld、itgae、cd103、itgal、cdl la、lfa-1、itgam、cdl lb、itgax、cdl lc、itgb 1、cd29、itgb2、cd 18、lfa-1、itgb7、nkg2d、nkg2c、tnfr2、trance/rankl、dnam1(cd226)、slamf4(cd244、2b4)、cd84、cd96(tactile)、ceacaml、crt am、ly9(cd229)、cd160(by55)、psgl1、cd100(sema4d)、cd69、slamf6(ntb-a、lyl08)、slam(slamf1、cd150、ipo-3)、blame(slamf8)、selplg(cd162)、ltbr、lat、gads、slp-76、pag/cbp和cd19a。
[0436]
在本文所述的任何方法和组合物的实施方案中,包含car的细胞包含编码car的核酸。在一个实施方案中,编码car的核酸是慢病毒载体。在一个实施方案中,通过慢病毒转导将编码car的核酸引入细胞。在一个实施方案中,编码car的核酸是rna,例如,体外转录的rna。在一个实施方案中,将编码car的核酸通过电穿孔引入细胞。
[0437]
免疫效应细胞诸如t细胞通常可使用如例如以下专利和专利申请中所述的方法来进行活化和扩增:美国专利第6,352,694号、6,534,055号、6,905,680号、6,692,964号、5,858,358号、6,887,466号、6,905,681号、7,144,575号、7,067,318号、7,172,869号、7,232,566号、7,175,843号、5,883,223号、6,905,874号、6,797,514号、6,867,041号和美国专利申请公开号2006/0121005,通过引用并入本文。
[0438]
免疫效应细胞的实例包括t细胞,例如α/βt细胞和γ/δt细胞、b细胞、天然杀伤(nk)细胞、自然杀伤t(nkt)细胞、肥大细胞和髓源性吞噬细胞。
[0439]
例如,在us 2016/0185861(通过引用并入本文)中描述了制备表达car的细胞的方法。
[0440]
如本文所定义的,监测受试者(例如,人患者)的癌症改善意味着评估受试者的疾病参数的变化,例如肿瘤生长的减少。在一些实施方案中,在施用后至少一(1)小时,例如至少2小时、4小时、6小时、8小时、12小时、24小时或48小时,或至少1天、2天、4天、10天、13天、20天或更长时间,或至少1周、2周、4周、10周、13周、20周或更长时间,进行评估。可在以下时期中的一个或多个时期评估受试者:治疗开始前;治疗期间;或者在已经施用了一种或多种治疗成分之后。评估可包括评估对进一步治疗的需要,例如,评估是否应该改变剂量、施用频率或治疗持续时间。其还可包括评估对添加或撤消所选治疗方式的需要,例如添加或撤消本文所述的任何癌症治疗。
[0441]
在一些实施方案中,本文所述的抗cd39抗体或其抗原结合片段可用于检测和/或定量生物样品中人cd39的方法。例如,cd39已被鉴定为疾病的潜在诊断、预后和进展生物标志物(pulte等人,(2011)clin lymphoma myeloma leuk 11:367-372;fan等人,(2017)biomark med 11:107-116;zhao等人,(2017)front immunol 8:727)
[0442]
因此,本文所述的抗cd39抗体或其抗原结合片段可用于诊断、预后患者的疾病(例如,癌症)和/或确定所述疾病的进展。
实施例
[0443]
虽然已经参照本公开的具体实施方案描述了本公开,但本领域技术人员应该理解,在不脱离本公开的真实精神和范围的情况下,可进行各种改变,并且可以替换等同物。另外,可进行许多修改以使特定情况、材料、物质组成、过程、过程步骤适应本公开的目标、精神和范围。所有此类修改都旨在本公开的范围内。实施例1:方法抗原制备
[0444]
使用来自pierce的ez-link磺基-nhs-生物素化试剂盒将cd39抗原(重组cd39;r&d systems目录号4397-en)生物素化。山羊f(ab
’
)
2
抗人κ-fitc(lc-fitc)、extravidin-pe(ea-pe)和链霉抗生物素蛋白-af633(sa-633)分别获自southern biotech、sigma和molecular probes。链霉抗生物素蛋白微珠(streptavidin microbead)和macs lc分离柱购自miltenyi biotec。山羊抗人igg-pe(human-pe)获自southern biotech。初步发现
[0445]
如前所述繁殖了8个初始人合成酵母文库(每个具有~10
9
种多样性)(参见,例如,y.xu等人,addressing polyspecificity of antibodies selected from an in vitro yeast presentation system:a facs-based,high-throughput selection and analytical tool.peds 26.10,663-70(2013);wo2009036379;wo2010105256;和wo2012009568.)。对于前两轮选择,如前所述,使用miltenyi macs系统进行磁珠分选技术(参见,例如,siegel等人,high efficiency recovery and epitope-specific sorting of an scfv yeast display library.”j immunol methods 286(1-2),141-153(2004).)。简言之,在30℃将酵母细胞(~10
10
个细胞/文库)与5ml100nm生物素化抗原于洗涤缓冲液(磷酸盐缓冲盐水(pbs)/0.1%的牛血清白蛋白(bsa))中一起孵育30分钟。用40ml冰冷的洗涤缓冲液洗涤一次后,将细胞沉淀重悬于20ml洗涤缓冲液中,并将链霉抗生物素蛋白微珠(500μl)加入酵母中,并在4℃孵育15分钟。接下来,将酵母沉淀,重悬于20ml洗涤缓冲液中,并装载到miltenyi ls柱上。装载20ml后,用3ml洗涤缓冲液洗涤柱子3次。然后将柱从磁场中移走,用5ml生长培养基洗脱酵母,然后生长过夜。使用流式细胞术进行以下轮选择。将约2
×
10
7
个酵母沉淀,用洗涤缓冲液洗涤三次,并在30℃下于平衡条件下与浓度递减的生物素化抗原(200至5nm)、200nm小鼠物种的生物素化抗原一起孵育,以获得物种交叉反应性,或者与多特异性耗尽试剂(psr)一起孵育,以从选择中去除非特异性抗体。对于psr耗尽,如先前所述,将文库与生物素化的psr试剂的1∶10稀释物一起孵育(参见,例如,y.xu等人,addressing polyspecificity of antibodies selected from an in vitro yeast presentation system:a facs-based,high-throughput selection and analytical tool.peds 26.10,663-70(2013))。然后用洗涤缓冲液洗涤酵母两次,用lc-fitc(以1∶100稀释的)和sa-633(以1∶500稀释的)或eape(以1∶50稀释的)次级试剂在4℃下染色15分钟。用洗涤缓冲液洗涤两次后,将细胞沉淀重悬于0.3ml洗涤缓冲液中,并转移到带滤网的分选管中。使用facs aria分选仪(bd biosciences)进行分选,并确定分选门以选择具有所需特征的抗体。重复选择轮次,直至获得具有所有期望特征的群体。在最后一轮分选后,将酵母铺板,挑选出单个集落进行表征。轻链批量改组(light chain batch shuffle)
[0446]
在初步发现阶段使用轻链多样化方案,以进一步发现和改进抗体。
[0447]
轻链批量多样化方案:通过粉碎和抓取从酵母中提取来自初始选择输出(selection output)的重链质粒,将所述重链质粒在大肠杆菌中繁殖并随后从大肠杆菌纯化,然后转化到具有5x10
6
种多样性的轻链文库中。如初始发现中所述,利用一轮macs和三轮facs进行选择。在不同的facs轮次中,通过抗原滴定,观察文库的psr结合、物种交叉反应性和亲和压力。进行分选以获得具有所需特征的群体。抗体优化
[0448]
如下所述,通过将多样性引入重链可变区来优化抗体。
[0449]
cdrh1和cdrh2选择:将单个抗体的cdrh3重组到多样性为1x10
8
的具有cdrh1和cdrh2变体的预制文库中,并且如初始发现中所述,用一轮macs和四轮facs进行选择。在不同的facs轮次中,通过滴定观察文库的psr结合、物种交叉反应性和亲和压力,并进行分选以获得具有所需特征的群体。抗体的产生和纯化
[0450]
将酵母克隆生长至饱和,然后在30℃下振荡诱导48小时。诱导后,将酵母细胞沉淀,收集上清液以进行纯化。使用蛋白a柱纯化igg,并用乙酸(ph 2.0)洗脱。通过木瓜蛋白酶消化产生fab片段,然后通过kappaselect(ge healthcare lifesciences)纯化所述fab片段。fortebio k
d
测量
[0451]
如前所述,通常对octet red384进行fortebio亲和力测量(参见,例如,estep等人,high throughput solution-based measurement of antibody-antigen affinity and epitope binning.mabs 5(2),270-278(2013))。简言之,通过将igg在线加载到ahc传感器上来进行fortebio亲和力测量。将传感器在测定缓冲液中离线平衡30分钟,然后在线监测60秒以建立基线。将装载有igg的传感器暴露于100nm抗原3分钟,然后转移到测定缓冲液中3分钟,以测量解离速率。使用1:1结合模型分析所有动力学。fortebio表位分组(epitope binning)/配体阻断
[0452]
使用标准夹心式交叉阻断测定进行表位分组/配体阻断。将对照抗靶igg装载到ahq传感器上,用不相关的人igg1抗体阻断传感器上未被占据的fc-结合位点。然后将传感器暴露于100nm靶抗原,接着暴露于第二抗靶抗体或配体。抗原缔合后第二抗体或配体的额外结合表示未被占据的表位(非竞争者),而没有结合表示表位阻断(竞争者或配体阻断)。msd-set动力学测定
[0453]
如前所述进行平衡亲和力测量(estep等人,2013年)。在pbs+0.1%不含igg的bsa(pbsf)中进行溶液平衡滴定(set),其中将抗原保持恒定在10-100pm并与始于5-100nm的抗体的3-5倍系列稀释液一起孵育(实验条件取决于样品)。将抗体(于pbs中的20nm)涂布在标准结合msd-ecl板上,在4℃下过夜或在室温下持续30分钟。然后在以700rpm摇动的条件下将板封闭30分钟,接着用洗涤缓冲液(pbsf+0.05%tween 20)洗涤三次。施加set样品,在以700rpm摇动的条件下于板上孵育150s,然后进行一次洗涤。通过在板上孵育3分钟,用在pbsf中的250ng/ml磺基标签标记的链霉抗生物素蛋白检测捕获在板上的抗原。用洗涤缓冲液将板洗涤三次,然后在msd sector imager 2400仪上使用含表面活性剂的1x读取缓冲液t(read buffer t)进行读取。在prism中将游离抗原百分比绘制为滴定的抗体的函数,并将其与二次方程拟合以推断出k
d
。为了提高通量,在整个msd-set实验(包括set样品制备)中
使用了液体处理机器人。细胞结合分析
[0454]
将约100,000个过表达抗原的细胞用洗涤缓冲液洗涤,并在室温下与100ul 100nm igg一起孵育5分钟。然后用洗涤缓冲液洗涤细胞两次,并在冰上与100ul 1:100的人-pe一起孵育15分钟。然后用洗涤缓冲液洗涤细胞两次,并在facs canto ii分析仪(bd biosciences)上进行分析。实施例2:抗cd39抗体对树突细胞的影响
[0455]
为了确定抗cd39抗体对树突细胞的影响,测定了cd86的表达水平,cd86是一种提供t细胞活化和存活所必需的共刺激信号的跨膜蛋白。在37c下于rpmi-1640+10%fbs+1%青霉素-链霉素(r10)(life technologies)中用gm-csf(50ng/ml)(r&d systems)和il-4(10ng/ml)(r&d systems)处理3名健康供体的单核细胞4天,以产生未成熟的树突细胞。用补充有gm-csf(50ng/ml)和il-4(10ng/ml)的r10洗涤树突细胞,并将所述树突细胞重悬于所述r10中。将5x10
4
个树突细胞添加到96孔u形底板的每个孔中。如图1a所指示的,将树突细胞与同种型对照抗体或抗cd39抗体(10ug/ml)一起在37℃孵育1小时。1小时后,向细胞中加入含有或未含atp补充剂的r10,并进一步孵育24小时。树突细胞用针对cd86和cd11c的抗体(biolegend)染色。使用lsrfortessa x-20(bd biosciences)获取细胞,并用flowjo软件(tree star)进行分析。显示了来源于每个供体的树突细胞上的cd86表达的定量(geomean)。
[0456]
如图1a所示,在atp存在的情况下,用抗cd39抗体srf370-a、srf367-a、srf365-a和srf367-b处理树突细胞导致cd86的表达增加,其高于利用同种型对照抗体dnp-a和dnp-b的处理。这些结果表明,用抗cd39抗体处理树突细胞提高atp诱导的cd86表达。
[0457]
为了进一步评估抗cd39抗体对树突细胞的影响,基本上如上所述,测定cd86和人白细胞抗原-相关的抗原d(hla-dr)(一种mhc ii类细胞表面受体)的表达水平。如图1b所示,在atp存在或不存在的情况下,用抗cd39抗体srf367-a或同种型对照抗体(dnp-a)处理树突细胞。
[0458]
如图1b所示,在atp存在的情况下,用抗cd39抗体srf367-a处理树突状细胞,导致hla-dr和cd86的表达增加,其高于利用同种型对照抗体dnp-a的处理。与图1a所示的结果一致,图1b所示的这些结果表明,用抗cd39抗体srf367-a处理树突细胞提高atp诱导的cd86和hla-dr的表达。
[0459]
为了确定抗cd39抗体对细胞因子分泌的影响,测定了来自与图1b中相同的树突细胞的细胞因子il-16、il-12/il-23p40和vegfa的分泌。将处理过的树突细胞培养物的上清液以1:2稀释,并按照制造商的说明进行meso scale discovery(msd)u-plex试剂盒方案。根据制造商的说明,使用msd软件对vegfa-a、il-12/il-23p40和il-16的分泌进行定量。
[0460]
如图1c、图1d和图1e所示,在atp存在的情况下,用抗cd39抗体srf367-a处理树突细胞,导致il-16(图1c)、il-12/il-23p40(图1d)和il-16(图1e)的分泌增加,其高于利用同种型对照抗体dnp-a的处理。图1c、图1d和图1e中显示的这些结果表明,用抗cd39抗体srf367-a处理树突状细胞分别提高atp诱导的细胞因子il-16、il-12/il-23p40和vegfa的分泌。实施例3:抗cd39抗体对cd4+ t细胞增殖的影响
[0461]
为了确定利用抗cd39抗体的处理对cd4+ t细胞的影响,测定了cd4+ t细胞在体外
响应于利用一系列浓度的抗cd39抗体(srf367-a、srf367-b和srf370-a)或同种型对照抗体(dnp-a和dnp-b)的处理而增殖的量。在接种到96孔板之前,用细胞跟踪紫染色法对来自人供体血液的新鲜pbmc的cd4+细胞进行染色。如图2所示,将细胞与250μm atp、抗cd3/cd28珠粒(以刺激t细胞)和抗cd39或同种型对照抗体一起孵育3天,并且通过测量细胞中残留的细胞跟踪紫的量,通过流式细胞术定量每种抗体处理的增殖指数。还对细胞进行cd4染色,以确认t细胞谱系。如图2所示,在抗cd39抗体存在的情况下,cd4+t细胞响应于atp的增殖指数增加。实施例4:抗cd39抗体对恶性和免疫细胞上的cd39活性的影响
[0462]
cd39是膜结合的胞外核苷酶(ectonucleosidase),其将三磷酸腺苷(atp)和二磷酸腺苷(adp)转化为一磷酸腺苷(amp)。使用孔雀石绿磷酸盐测定法测量抗cd39抗体抑制恶性细胞系和初级免疫细胞上的cd39的酶活性的能力。简言之,用抗cd39抗体或对照抗体和25μm atp处理细胞60分钟。使用孔雀石绿磷酸盐检测试剂盒(enzo life sciences,目录号bml-ak111)测量无机磷酸盐从atp的释放。使用“零时对照”代表100%抑制以及使用“无抗体对照”代表0%inh来测定标准化的抑制百分比(inh%)。“零时对照”是其中立即停止反应以模拟其中无磷酸盐生成且cd39被完全抑制的条件的具有所有试剂的孔。“无抗体对照”是其中加入所有试剂和细胞但不存在抗体的孔。这很好地模拟了其中释放最大量的磷酸盐并且对cd39无抑制作用的条件。确定抑制百分比:从测定值中减去“无抗体对照”值,再除以从“时间零点对照”值中减去的“无抗体对照”值。将所得值乘以100,得出百分比值。molp-8(人多发性骨髓瘤细胞系)、sk-mel-28、原代人b细胞(从全血中分离的)或原代人单核细胞(从全血中分离的)用于该测定。
[0463]
如图3a所示,在atp存在的情况下,如所指示的,用一系列浓度的抗cd39抗体(srf360-a、srf360-b、srf365-a、srf367-a、srf367-b和srf370-a)或对照抗体处理molp-8细胞(人多发性骨髓瘤细胞系)导致所有测试的抗cd39抗体对cd39活性的剂量依赖性抑制。cd39活性的抑制由无机磷酸盐释放的程度决定,并表示为抑制%(inh%)。
[0464]
如图3b所示,在atp存在的情况下,如所指示的,用一系列浓度的抗cd39抗体(srf360-a、srf360-b、srf365-a、srf367-a、srf367-b和srf370-a)或对照抗体处理sk-mel-28细胞(人黑素瘤细胞系)导致所有测试的抗cd39抗体对cd39活性的剂量依赖性抑制,这与图3a所示的结果一致。cd39活性的抑制由无机磷酸盐释放的程度决定,并表示为抑制%(inh%)。
[0465]
如图3c所示,在atp存在的情况下,如所指示的,用一系列浓度的抗cd39抗体(srf360-c、srf365-c、srf367-c和srf370-c)或对照抗体处理从全血中分离的原代人b细胞,导致所有测试的抗cd39抗体对cd39活性产生剂量依赖性抑制,这与图3a和图3b中看到的结果一致。cd39活性的抑制由无机磷酸盐释放的程度决定,并表示为抑制%(inh%)。
[0466]
如图3d所示,在atp存在的情况下,如所指示的,用一系列浓度的抗cd39抗体(srf360-c、srf365-c、srf367-c和srf370-c)或对照抗体处理从全血中分离的原代人单核细胞,导致所有测试的抗cd39抗体对cd39活性的剂量依赖性抑制,这与图3a和图3b中看到的结果一致。cd39活性的抑制由无机磷酸盐释放的程度决定,并表示为抑制%(inh%)。
[0467]
综上所述,这些结果表明用抗cd39抗体处理恶性和免疫细胞抑制了cd39的酶活性。实施例5:抗cd39抗体与人癌细胞结合
[0468]
为了确定抗cd39抗体与细胞结合的相对程度,如图4b和图4b所示,用一系列浓度的荧光标记的抗cd39抗体(srf360-a、srf360-b、srf365-a、srf367-a、srf367-b和srf370-a)或同型对照抗体(dnp-a和dnp-b)处理molp-8或sk-mel-28细胞。测定与细胞结合的程度,并表示为平均荧光强度(mfi)。用facs缓冲液(2mm edta,2%fbs)洗涤细胞,然后通过离心沉淀细胞。将细胞重悬于含有一定剂量范围的用荧光团alexa fluor 488(af488)直接标记的抗cd39或同种型对照抗体的facs缓冲液,并在室温下孵育30分钟。然后用facs缓冲液洗涤细胞两次,随后在4%多聚甲醛(pfa)中固定,再重悬于facs缓冲液中,并在facs canto ii分析仪(bd biosciences)上进行分析。
[0469]
如图4a所示,抗cd39抗体srf360-a和srf360-b以剂量依赖性方式与sk-mel-28细胞结合。相对于srf360-a和srf360-b,抗cd39抗体srf365-a、srf367-a、srf367-b和srf370-a与sk-mel-28的结合程度较低,但相对于同型对照抗体所述结合程度较高。如图4b所示,抗cd39抗体srf360-a和srf360-b以剂量依赖性方式与molp-8细胞结合。相对于srf360-a和srf360-b,抗cd39抗体srf365-a、srf367-a、srf367-b和srf370-a与sk-mel-28的结合程度较低,但相对于同型对照抗体所述结合程度较高,这与图4a所示的结果一致。实施例6:抗cd39抗体在荷瘤小鼠中的功效
[0470]
考虑到抗cd39抗体在体外对恶性和免疫细胞的作用,如实施例1-4中所示,在体内测试抗cd39抗体针对已建立的肿瘤的抗肿瘤活性。如图5a和图5b中所示,用srf367-b或同型对照抗体处理荷有sk-mel-28肿瘤的小鼠,并测量肿瘤生长。选择sk-mel-28人异种移植模型是因为其表达大量的cd39。在cb17scid小鼠(n=每组9只)(charles river labs)的右侧肋腹皮下植入于50%基质胶(thermo fisher)中的5x106个sk-mel-28肿瘤细胞。通过测量垂直肿瘤直径(mm)每周测量肿瘤异种移植物三次,并使用方程式v=((lxwxw)x0.52)计算肿瘤体积,其中v为肿瘤体积(mm3),l为长直径,w为短直径。当sk-mel-28肿瘤达到100mm3的平均尺寸时,将动物分成两组(每组9只小鼠),以用srf367-b或多克隆人igg同种型对照抗体给药。在总共5次注射(第1天、第5天、第8天、第12天和第15天)中,将所有抗体以400μg/小鼠biw的剂量在100μl pbs中腹膜内(i.p.)给药。
[0471]
用srf367-b(图5b)处理的小鼠的sk-mel-28肿瘤的平均生长速率与用同种型对照(图5a)处理的动物的肿瘤的平均生长速率相比一直较慢。这些结果表明用抗cd39抗体处理荷瘤小鼠延迟了已建立的表达cd39的人异种移植肿瘤的生长。实施例7:抗pd-1抗体对人pbmc中的cd39表达的影响
[0472]
为了确定pd-1抑制对pbmc来源的免疫细胞群中的cd39表达的影响,从5个单独的人供体的全血中分离出pbmc。将pbmc在完全细胞培养基(10%fbs、rpmi或补充有10ug/ml抗pd-1抗体纳武单抗的完全细胞培养基)中孵育96小时。对细胞进行洗涤、染色和固定,用于流式细胞术分析,以测定cd39阳性细胞的百分比。谱系标志物用于区分treg(cd3、cd4和foxp 3)、单核细胞(cd14)和b细胞(cd19)。如图6所示,在纳武单抗存在的情况下,cd39在所有细胞类型和所有供体中的表达都增加,这表明用抗pd-1抗体处理增加cd39在人细胞上的表达。因此,在用抗pd1(或抗pd-l1)治疗的受试者中cd39表达增加可能是受试者对抗pd1疗法产生抗性的机制。提供了用本文公开的抗cd39抗体治疗这些受试者。实施例8:抗cd39抗体的结合亲和力的分布
[0473]
通常如先前所述(estep等人(2013)mabs 5(2):270-278,其通过引用整体并入本
文),通过使用fortebio otectet red 384(pall forte bio corporation,menlo park,ca)测量抗cd39抗体(srf360、srf365、srf367、srf370、srf399)的动力学常数(k
a
、k
d
、k
d
)来测定它们的结合亲和力。
[0474]
简言之,通过将igg在线装载到ahq传感器上来进行fortebio亲和力测量。将传感器在测定缓冲液中离线平衡30分钟,然后在线监测60秒以建立基线。将装载有igg的传感器暴露于100nm抗原3分钟,然后转移到测定缓冲液中进行3分钟,以测量解离速率。使用1:1结合模型分析所有动力学。将缺乏跨膜结构域的不含载剂的人cd39-his用作抗原(r&d systems目录号:4397-en-010)。
[0475]
如前所述(estep等人,(2013)mabs 5(2):270-278)进行平衡亲和力测量。在pbs+0.1%不含igg的bsa(pbsf)中进行溶液平衡滴定(set),其中将抗原保持恒定在10-100pm并与始于5-100nm的抗体的3-5倍系列稀释液一起孵育(实验条件取决于样品)。将抗体(于pbs中的20nm)涂布在标准结合msd-ecl板上,在4℃下过夜或在室温下持续30分钟。然后在以700rpm摇动的条件下将板封闭30分钟,接着用洗涤缓冲液(pbsf+0.05%tween 20)洗涤三次。施加set样品,在以700rpm摇动的条件下于板上孵育150秒,然后进行一次洗涤。通过在板上孵育3分钟,用在pbsf中的250ng/ml磺基标签标记的链霉抗生物素蛋白检测捕获在板上的抗原。用洗涤缓冲液将板洗涤三次,然后使用含表面活性剂的1x读取缓冲液在msd sector imager 2400仪上进行读取。在graphpad prism中将游离抗原百分比绘制为滴定的抗体的函数,并将其与二次方程拟合以提取kd。为了提高通量,在整个msd-set实验(包括set样品制备)中使用了液体处理机器人。将缺乏跨膜结构域的不含载体的人cd39-his生物素化并用作抗原(r&d systems目录号:4397-en-010)。图7提供了针对抗cd39抗体的fortebio和msd亲和力测量值。实施例9:抗cd39抗体和多柔比星在人多发性骨髓瘤的molp-8鼠模型中的协同作用
[0476]
为了确定将cd39抑制与免疫原性细胞死亡剂组合的一种或多种抗肿瘤作用,在严重联合免疫缺陷(scid)小鼠的皮下异种移植molp-8人多发性骨髓瘤模型中评估了抗cd39抗体srf367-a与多柔比星的组合。简言之,通过用0.1ml的与基质胶混合(1:1)的pbs中的1x107个molp-8肿瘤细胞皮下注射到右肋腹中来接种6-8周龄的scid小鼠(charles river labs),并且当肿瘤达到约100mm3的平均体积时将小鼠随机分成4个治疗组。每周2次持续3周用同种型对照抗体(dnp-a)、单独的抗cd39抗体(srf367-a)(400μg或20mg/kg)、每周1次持续3周用单独的阿尔多柔比星(aldoxorubicin)(一种在肿瘤环境中释放游离多柔比星的多柔比星前药)(200μg或10mg/kg)或用srf367-a和阿尔多柔比星两者的组合腹膜内治疗所述组(n=每组10只小鼠)。所有测试的抗体都在pbs(gibco)中配制。在dmso中制备阿尔多柔比星原液(100mg/ml),并将其在pbs中稀释至1mg/ml。抗肿瘤活性部分通过使用游标卡尺测量肿瘤尺寸(长度和宽度)来测定,肿瘤体积使用以下公式计算:(l*w*w)/2。体重(数据未显示)和肿瘤体积每周测定两次,直至第19天。对于肿瘤体积分析,进行单因素方差分析以检验各组与对照组相比的统计显著性(p<0.005)。
[0477]
图8a显示了在如所示的治疗后一段时间内小鼠的平均肿瘤体积。黑色箭头表示用srf367-a治疗,灰色箭头表示用阿尔多柔比星治疗。图8b显示了如所示治疗后第19天小鼠的平均肿瘤体积。
[0478]
与在第19天利用同种型对照抗体dnp-a治疗相比,用抗cd39抗体srf367-a治疗(单
独的或与多柔比星组合),显示出肿瘤体积的统计学上显著的减小,如图8b所示(p<0.005)。在单独的多柔比星组中进行3个剂量后观察到体重有所减轻,但与单独的多柔比星相比,在治疗组中未观察到明显的体重减轻,单独的抗cd39抗体治疗未导致任何体重减轻(数据未显示)。
[0479]
这些数据表明,用抗cd39抗体与多柔比星的组合治疗可产生协同抗肿瘤作用,与单独的抗cd39抗体或多柔比星治疗相比,可在更大程度上减小肿瘤体积。实施例10:抗cd39抗体和腺苷a2a受体(a2ar)拮抗剂在人多发性骨髓瘤的molp-8异种移植模型中的协同作用
[0480]
为了确定将cd39抑制与另一种阻断腺苷途径的试剂组合的一种或多种抗肿瘤作用,在严重联合免疫缺陷(scid)小鼠的皮下异种移植molp-8人多发性骨髓瘤模型中评估了抗cd39抗体srf367-a与a2ar拮抗剂cpi-444组合的抗肿瘤活性。简言之,通过用0.1ml的与基质胶混合(1:1)的pbs中的1x107个molp-8肿瘤细胞皮下注射到右肋腹中来接种6-8周龄的scid小鼠(charles river labs),并且当肿瘤达到约100mm3的平均体积时将小鼠随机分成4个治疗组。每周2次持续3周用同种型对照抗体(dnp-a)、单独的抗cd39抗体(400μg或20mg/kg)或与cpi-444组合使用抗cd39抗体腹膜内(i.p)治疗所述组(n=每组8只小鼠)。每周5天持续3周以100mg/kg的剂量口服施用cpi-444。所有测试的抗体都在pbs(gibco)中配制。在于0.1n盐酸中的40%羟基丙基b-环糊精中制备cpi-444原液(10mg/ml),将其在搅拌板上混合,并通过0.45-mm过滤器过滤。用1.0n氢氧化钠和1.0mol/l柠檬酸将溶液调节至ph 3-4。抗肿瘤活性部分通过使用游标卡尺测量肿瘤尺寸(长度和宽度)来测定,肿瘤体积使用以下公式计算:(l*w*w)/2。体重(数据未显示)和肿瘤体积每周测定三次,直至第28天。对于肿瘤体积分析,进行单因素方差分析以检验各组与对照以及与单独的单一试剂治疗组相比的统计显著性(p<0.005)。
[0481]
图9显示了治疗的小鼠的平均肿瘤体积。这些数据表明,抗cd39抗体(srf367-a)与a2ar拮抗剂(cpi-444)联合治疗可产生协同抗肿瘤作用,当与用单独的抗cd39抗体或cpi-444治疗相比时,减小肿瘤体积。与同型对照相比,单独或组合使用所有测试剂(抗cd39抗体和cpi-444)的治疗显示出统计学上显著的抗肿瘤效果(p<0.005)。在cpi-444单独给药一周后,观察到体重有所减轻,但与cpi-444单独给药相比,组合组未观察到体重显著减轻,且抗cd39抗体单独治疗未导致任何体重减轻(数据未显示)。表1:序列表nt=非常规
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
相关标签:
 热门咨询
热门咨询

tips


 商标分类
商标分类  商标转让
商标转让 



