一种微流控细胞分选芯片的制作方法
 2021-02-02 13:02:56|
2021-02-02 13:02:56| 321|
321| 起点商标网
起点商标网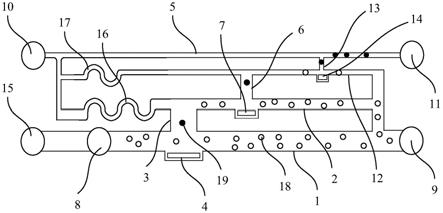
[0001]
本实用新型属于微流控和细胞分选领域,涉及一种微流控细胞分选芯片。
背景技术:
[0002]
循环肿瘤细胞(circulating tumor cells,简称ctc)是从原发灶或转移灶中脱落并侵入到外周血中的癌细胞,是肿瘤转移的基础。ctc的检测在病情监测、预后评价和复发转移的监测等方面具有积极的临床意义。但ctc在血液中的含量极少,每毫升血液约有几个到几十个,这为其有效的检测提出了巨大的技术挑战。目前ctc主要是根据免疫吸附和与白细胞间的物理特性差异,将其从血液中分选出来。由于ctc的异质性以及白细胞的多样性,当前的分选方法往往会造成ctc的损失和纯度偏低,不利于后续分析。因此,为了实现ctc的有效检测,临床上亟需一种分选纯度高、细胞损失少且兼容多种分析方法的ctc检测平台。
技术实现要素:
[0003]
鉴于以上所述现有技术的缺点,本实用新型的目的在于提供一种微流控细胞分选芯片,用于解决现有细胞分选检测平台分选纯度低、细胞损失多、兼容性差的问题。
[0004]
为实现上述目的及其他相关目的,本实用新型提供一种微流控细胞分选芯片,包括:
[0005]
第一分选通道,在所述第一分选通道的延伸方向上,所述第一分选通道依次与一第一细胞进样口及一第一细胞出样口连通;
[0006]
第二分选通道,在所述第二分选通道的延伸方向上,所述第二分选通道依次与一液体进样口及所述第一细胞出样口连通;
[0007]
第一连接通道,两端分别与所述第一分选通道的管壁及所述第二分选通道的管壁连通,所述第一连接通道相对位于所述第一细胞进样口及所述第一细胞出样口之间;
[0008]
第一液体驱动装置,设于所述第一分选通道的管壁上,所述第一液体驱动装置对准所述第一连接通道,用于将流经所述第一液体驱动装置的细胞推送至所述第一连接通道;
[0009]
分选细胞输送管道,在所述分选细胞输送管道的延伸方向上,所述分选细胞输送管道依次与所述液体进样口及一第二细胞出样口连通;
[0010]
第二连接通道,所述第二连接通道的一端与所述第二分选通道的管壁连通,另一端与所述分选细胞输送管道的管壁直接连通或间接连通;
[0011]
第二液体驱动装置,设于所述第二分选通道的管壁上,所述第二液体驱动装置对准所述第二连接通道,用于将流经所述第二液体驱动装置的细胞推送至所述第二连接通道。
[0012]
可选地,所述第一分选通道还与一前置液体进样口连通,所述前置液体进样口、所述第一细胞进样口及所述第一细胞出样口在所述第一分选通道的延伸方向上依次排列。
[0013]
可选地,所述第一分选通道的管径大于所述第二分选通道的管径。
[0014]
可选地,所述第一液体驱动装置及所述第二液体驱动装置分别包括热泡打印头、微阀及电磁阀中的任意一种。
[0015]
可选地,所述微流控细胞分选芯片还包括第三分选通道、第三连接通道及第三液体驱动装置,所述第二连接通道通过所述第三分选通道及所述第三连接通道与所述分选细胞输送管道的管壁间接连通,其中,在所述第三分选通道的延伸方向上,所述第三分选通道依次与所述液体进样口及所述第一细胞出样口连通,所述第三连接通道的两端分别与所述第三分选通道的管壁及所述分选细胞输送管道的管壁连通,所述第三连接通道相对位于所述第二连接通道与所述第二细胞出样口之间,所述第三液体驱动装置设于所述第三分选通道的管壁上,所述第三液体驱动装置对准所述第三连接通道,用于将流经所述第三液体驱动装置的细胞推送至所述第三连接通道。
[0016]
可选地,所述第二分选通道的管径大于所述第三分选通道的管径。
[0017]
可选地,所述第三分选通道的管径小于待选细胞直径的两倍。
[0018]
可选地,所述第二分选通道包括一第一蛇形段,所述第一蛇形段相对位于所述液体进样口与所述第一连接通道之间;所述第三分选通道包括一第二蛇形段,所述第二蛇形段相对位于所述液体进样口与所述第二连接通道之间;所述第一蛇形段的流阻大于所述第二蛇形段的流阻。
[0019]
可选地,所述第三液体驱动装置包括热泡打印头、微阀及电磁阀中的任意一种。
[0020]
如上所述,本实用新型的微流控细胞分选芯片采用多级分选结构,分选通道由宽到细,保证了分选的高通量和高精度。结合热泡打印头或其它驱动装置,使细胞分选更加便捷高效。前置缓冲液进样口的设计避免了细胞在进样口的沉降,减少了细胞损失。本实用新型的微流控芯片可用于循环肿瘤细胞或其它细胞的分选,具有高通量、分选纯度高、细胞损失少且兼容多种分析方法的优点。
附图说明
[0021]
图1显示为本实用新型的微流控细胞分选芯片的剖面结构示意图
[0022]
元件标号说明
[0023]
1
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
第一分选通道
[0024]
2
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
第二分选通道
[0025]
3
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
第一连接通道
[0026]
4
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
第一液体驱动装置
[0027]
5
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
分选细胞输送管道
[0028]
6
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
第二连接通道
[0029]
7
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
第二液体驱动装置
[0030]
8
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
第一细胞进样口
[0031]
9
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
第一细胞出样口
[0032]
10
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
液体进样口
[0033]
11
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
第二细胞出样口
[0034]
12
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
第三分选通道
[0035]
13
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
第三连接通道
[0036]
14
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
第三液体驱动装置
[0037]
15
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
前置液体进样口
[0038]
16
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
第一蛇形段
[0039]
17
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
第二蛇形段
[0040]
18
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
待剔除细胞
[0041]
19
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
待选细胞
具体实施方式
[0042]
以下通过特定的具体实例说明本实用新型的实施方式,本领域技术人员可由本说明书所揭露的内容轻易地了解本实用新型的其他优点与功效。本实用新型还可以通过另外不同的具体实施方式加以实施或应用,本说明书中的各项细节也可以基于不同观点与应用,在没有背离本实用新型的精神下进行各种修饰或改变。
[0043]
请参阅图1。需要说明的是,本实施例中所提供的图示仅以示意方式说明本实用新型的基本构想,遂图式中仅显示与本实用新型中有关的组件而非按照实际实施时的组件数目、形状及尺寸绘制,其实际实施时各组件的型态、数量及比例可为一种随意的改变,且其组件布局型态也可能更为复杂。
[0044]
实施例一
[0045]
本实施例中提供一种微流控细胞分选芯片,请参阅图1,显示为该微流控细胞分选芯片的剖面结构示意图,包括第一分选通道1、第二分选通道2、第一连接通道3、第一液体驱动装置4、分选细胞输送管道5、第二连接通道6及第二液体驱动装置7,其中,在所述第一分选通道1的延伸方向上,所述第一分选通道1依次与一第一细胞进样口8及一第一细胞出样口9连通;在所述第二分选通道2的延伸方向上,所述第二分选通道2依次与一液体进样口10及所述第一细胞出样口9连通;所述第一连接通道3两端分别与所述第一分选通道1的管壁及所述第二分选通道2的管壁连通,所述第一连接通道3相对位于所述第一细胞进样口8及所述第一细胞出样口9之间;所述第一液体驱动装置4设于所述第一分选通道1的管壁上,所述第一液体驱动装置4对准所述第一连接通道3,用于将流经所述第一液体驱动装置4的细胞推送至所述第一连接通道3;在所述分选细胞输送管道5的延伸方向上,所述分选细胞输送管道5依次与所述液体进样口10及一第二细胞出样口11连通;所述第二连接通道6的一端与所述第二分选通道2的管壁连通,另一端与所述分选细胞输送管道5的管壁直接连通或间接连通;所述第二液体驱动装置7设于所述第二分选通道2的管壁上,所述第二液体驱动装置7对准所述第二连接通道6,用于将流经所述第二液体驱动装置7的细胞推送至所述第二连接通道6。
[0046]
具体的,当所述第二连接通道6的另一端与所述分选细胞输送管道5的管壁直接连通时,所述微流控细胞分选芯片呈两级分选结构,当所述第二连接通道6的另一端通过另外一个或多个分选通道及连接通道与所述分选细胞输送管道5的管壁间接连通时,所述微流控细胞分选芯片呈多级分选结构,例如3-10级分选通道,其中,随着分选通道的级别上升,分选通道由宽到细。采用宽度不同的多级分选通道对细胞进行由粗分到细分的筛选,可以在保证分选精度的同时又能够兼顾分选的高通量。
[0047]
本实施例中以三级分选结构为例,请回头参见图1,所述微流控细胞分选芯片还包
括第三分选通道12、第三连接通道13及第三液体驱动装置14,所述第二连接通道6通过所述第三分选通道12及所述第三连接通道13与所述分选细胞输送管道5的管壁间接连通,其中,在所述第三分选通道12的延伸方向上,所述第三分选通道12依次与所述液体进样口10及所述第一细胞出样口9连通,所述第三连接通道13的两端分别与所述第三分选通道12的管壁及所述分选细胞输送管道5的管壁连通,所述第三连接通道13相对位于所述第二连接通道6与所述第二细胞出样口11之间,所述第三液体驱动装置14设于所述第三分选通道12的管壁上,所述第三液体驱动装置14对准所述第三连接通道13,用于将流经所述第三液体驱动装置14的细胞推送至所述第三连接通道13。
[0048]
具体的,所述第一分选通道1的管径大于所述第二分选通道2的管径,所述第二分选通2道的管径大于所述第三分选通道12的管径。本实施例中,所述第三分选通道12的管径小于待选细胞直径的两倍,以仅允许单细胞流动,从而将单个待选细胞分选出来,实现单细胞精度的分选,确保分选的高纯度。本实施例中,所述分选细胞输送管道5的管径也可以小于待选细胞直径的两倍。
[0049]
作为示例,所述第一分选通道1还与一前置液体进样口15连通,所述前置液体进样口15、所述第一细胞进样口8及所述第一细胞出样口9在所述第一分选通道1的延伸方向上依次排列。所述前置液体进样口15可以增加细胞横向的流速,用于防止细胞进样时在细胞进样口的沉降,避免或减少细胞的损失。
[0050]
作为示例,所述第二分选通道2包括一第一蛇形段16,所述第一蛇形段16相对位于所述液体进样口10与所述第一连接通道3之间;所述第三分选通道12包括一第二蛇形段17,所述第二蛇形段17相对位于液体进样口10与所述第二连接通道6之间;所述第一蛇形段16的流阻大于所述第二蛇形段17的流阻。其中,分选通道中的蛇形通道用于对各级通道的流阻进行匹配,确保未分选时缓冲液只能由高级分选通道流向低级分选通道,保证分选中细胞流动的可控性。
[0051]
具体的,所述第一液体驱动装置4、所述第二液体驱动装置7及所述第三液体驱动装置14用于为细胞流动方向的改变提供驱动力,本实施例中,所述第一液体驱动装置4、所述第二液体驱动装置7及所述第三液体驱动装置14优选采用热泡打印头,热泡打印头是基于微纳加工工艺制作而成,并集成在微通道的底部,位于各级的连接通道正下方。热泡打印头是利用加热膜的瞬间高温使上方的液体气化,从而产生气泡推动液体流动。这里将这一作用力用于改变细胞的流动方向,完成分选。热泡打印头具有响应快、驱动力强、便于控制、易于集成和微型化的优点,为待选细胞的便捷高效的分选提供了保障。
[0052]
当然,在其它实施例中,所述第一液体驱动装置4、所述第二液体驱动装置7及所述第三液体驱动装置14也可以采用其他能够产生驱动力的装置替代,如pdms(聚二甲基硅氧烷)微阀、电磁阀等,此处不应过分限制本实用新型的保护范围。
[0053]
本实施例的微流控细胞分选芯片采用多级分选结构,分选通道由宽到细,保证了分选的高通量和高精度。结合热泡打印头或其它驱动装置,使细胞分选更加便捷高效。前置缓冲液进样口的设计避免了细胞在进样口的沉降,减少了细胞损失。
[0054]
实施例二
[0055]
本实施例中提供一种采用如实施例一中所述的微流控细胞分选芯片进行细胞分选的方法,包括以下步骤:
[0056]
s1:提供包含待剔除细胞18及待选细胞19的液体样本,分别所述待剔除细胞及所述待选细胞进行染色标记;
[0057]
s2:由所述液体进样口10通入缓冲液;
[0058]
s3:由所述前置液体进样口15通入缓冲液;
[0059]
s4:由所述第一细胞进样口8通入完成了所述染色标记的所述液体样本;
[0060]
s5:当所述第一液体驱动装置4处出现所述待选细胞时,由所述第一液体驱动装置4将所述待选细胞及其附近第一数量的所述待剔除细胞推送至所述第一连接通道3中;
[0061]
s6:当所述第二液体驱动装置7处出现所述待选细胞时,由所述第二液体驱动装置7将所述待选细胞及其附近第二数量的所述待剔除细胞推送进所述第二连接通道6中;
[0062]
s7:由所述第二细胞出样口11收集所述待选细胞。
[0063]
作为示例,当所述微流控细胞分选芯片的分选通道级数超过两个时,于所述步骤s6之后,还进一步包括采用与步骤s6基本相同的步骤,由其它分选通道中的液体驱动装置对细胞进行进一步分选,最终再执行所述步骤s7以收集待选细胞。
[0064]
作为示例,所述待选细胞包括循环肿瘤细胞(ctc),当ctc夹杂在上百万的白细胞中,采用常规的分选平台很难对其进行精确地筛选,而本实施例中,可以将细胞染色标记后通入所述微流控细胞分选芯片中,先利用第一级通道结合热泡打印头对ctc进行初筛,将夹杂在上百万白细胞中的ctc局限在视野内几十甚至十几个白细胞中。然后利用第二级通道进一步缩小白细胞的范围至几个细胞,最后在第三级通道中,通道宽度仅能允许ctc和白细胞呈单细胞流动,从而将单个ctc富集到最后的出样口,并进行导出收集。最宽的第一级通道控制分选流量,最窄的第三级通道控制分选精度,从而实现ctc的高通量高纯度分选。
[0065]
下面以三级分选通道的微流控细胞分选芯片进行肺循环肿瘤细胞分选为例进行具体说明,具体的,在取得肺癌患者临床血样后,采用密度梯度离心法获得单核细胞层(包括大量白细胞和稀少量的ctc)。然后利用anti-cd45-fitc(fitc标记的cd45抗体)和anti-ck-pe(pe标记的ck抗体)分别对白细胞和ctc进行染色标记。接在所述微流控细胞分选芯片中通入缓冲液,然后启动前置缓冲液并将标记后的细胞通入分选芯片中。在第一级通道中,当ctc出现后,驱动热泡打印头将ctc和附近的一些白细胞分选到第二级通道中。然后利用第二级通道的热泡打印头将ctc和有限的几个白细胞分选到第三级通道中。最后在仅能允许单细胞流动的第三级通道中将单个ctc分选出来。分选后的细胞可在片外收集,并可用常规的细胞分析手段如免疫荧光、定量pcr和单细胞测序对ctc进行基因突变检测和异质性分析等,为患者的个性化治疗、疗效评估和预后评价提供依据。
[0066]
当然,在其它实施例中,还可以利用所述微流控细胞分选芯片进行其它类型细胞的分选,此处不应过分限制本实用新型的保护范围。
[0067]
综上所述,本实用新型的微流控细胞分选芯片采用多级分选结构,分选通道由宽到细,保证了分选的高通量和高精度。结合热泡打印头或其它驱动装置,使细胞分选更加便捷高效。前置缓冲液进样口的设计避免了细胞在进样口的沉降,减少了细胞损失。本实用新型的微流控芯片可用于循环肿瘤细胞或其它细胞的分选,具有高通量、分选纯度高、细胞损失少且兼容多种分析方法的优点。所以,本实用新型有效克服了现有技术中的种种缺点而具高度产业利用价值。
[0068]
上述实施例仅例示性说明本实用新型的原理及其功效,而非用于限制本实用新
型。任何熟悉此技术的人士皆可在不违背本实用新型的精神及范畴下,对上述实施例进行修饰或改变。因此,举凡所属技术领域中具有通常知识者在未脱离本实用新型所揭示的精神与技术思想下所完成的一切等效修饰或改变,仍应由本实用新型的权利要求所涵盖。
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询

tips


 商标分类
商标分类  商标转让
商标转让 



