生物颗粒纯化装置及纯化方法与流程
 2021-02-02 13:02:53|
2021-02-02 13:02:53| 363|
363| 起点商标网
起点商标网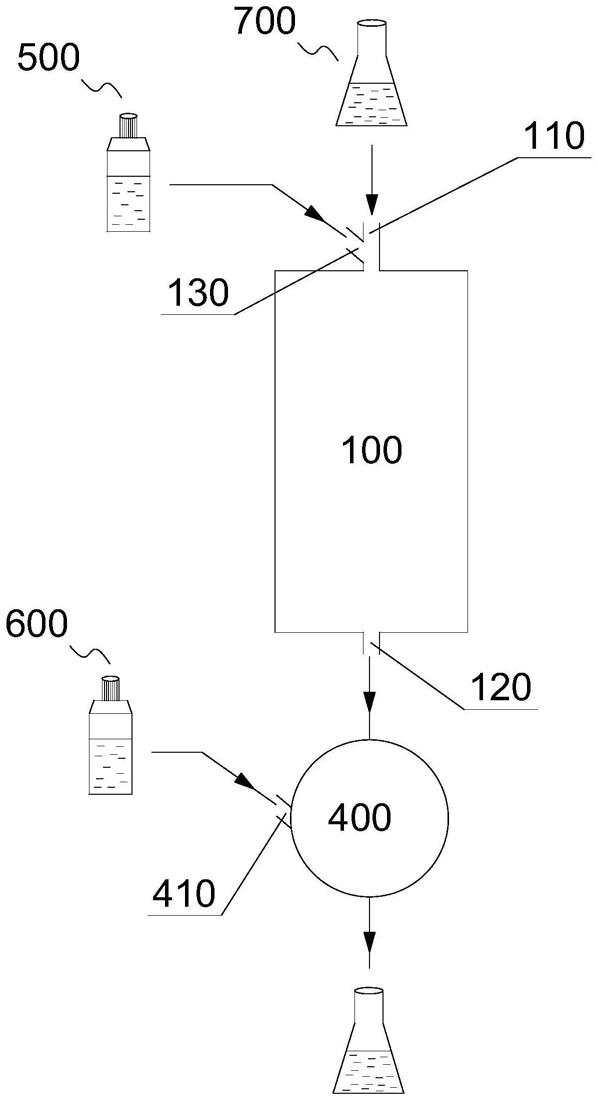
[0001]
本发明属于生化分析领域,具体涉及一种生物颗粒的纯化装置及纯化方法。
背景技术:
[0002]
目前,随着医学的进步,我们可以利用一些生物颗粒来治疗某些疾病或进行某些研究,生物颗粒包括但不限于细胞、抗体、抗原、病毒、朊病毒等等。其中,细胞治疗是在癌症、神经性疾病,组织损伤、糖尿病等疾病的治疗上显示了巨大的应用价值。免疫细胞(t细胞)和干细胞是目前最常用的两类用于治疗目的的细胞。一般来说,用于治疗的细胞要经过分离纯化,体外扩增和其它处理方法,才能输回患者体内。在这个过程中,细胞(或其他生物颗粒)的分离纯化经常是一个必不可少的步骤。
[0003]
市场上现有的细胞分离试剂大多是结合有某种抗体的磁性微珠(磁珠)。之所以使用磁珠是因为它便于收集(即利用磁场的吸附)。纳米到微米级别的磁珠可以和细胞悬浮液孵育混匀(在试管中搅拌或震动混均匀),结合在磁珠上的抗体可以捕获细胞,然后利用磁场收集磁珠(将磁珠从试管中转移出来)。最后再把细胞从磁珠上剥离。这个方法有几个缺点。一是采用试管的方式,需要手工完成,不适合大规模的生产和操作。二是磁场的作用距离有限,如果细胞样品的体积很大,就不适合用这个方法收集细胞。三是磁珠的非特异性结合(本底结合)往往较高,分离的细胞等纯度受到影响。四是这个方法适合batch的操作,自动化程度低,容易被污染。目前市场上有不同原理的细胞分离方法,以及传统的离心收集方法,二者是分开来操作的,而且操作过程中必须有人为介入,人工操作工作量大。
技术实现要素:
[0004]
基于此,本发明在于克服现有技术的缺陷,提供一种生物颗粒的纯化装置及纯化方法,纯化装置构成一个封闭的自动化流程,避免污染,可以自动化连续纯化作业,纯化方法生产效率高。
[0005]
其技术方案如下:
[0006]
一种生物颗粒纯化装置,包括:纯化系统,所述纯化系统包括至少一组亲和层析柱,其中:所述亲和层析柱内设有填料,所述填料用于吸附生物颗粒,所述填料具有层析通道,所述亲和层析柱设有进液口和出液口,所述进液口与所述层析通道连通,所述出液口与所述层析通道连通;离心系统,所述离心系统与所述出液口对接,所述离心系统能自动收集和处理出口液中的生物颗粒。
[0007]
在其中一个实施例中,所述亲和层析柱还设有第一入口,所述亲和层析柱还设有第一入口,所述第一入口与所述层析通道连通。
[0008]
在其中一个实施例中,所述填料上附着有至少一种特异性抗体。所述特异性抗体能够特异性地识别和结合至少一种生物颗粒的表面分子。
[0009]
进一步,所述填料能够特异性地捕获至少一种生物颗粒。
[0010]
在其中一个实施例中,所述特异性抗体可以以某种方法从填料上脱离下来,比如
所述特异性抗体与所述填料可逆结合。
[0011]
进一步,所述填料可以和所捕获的生物颗粒以某种方式脱离。
[0012]
在其中一个实施例中,所述填料由生物相容性材料制成。
[0013]
在其中一个实施例中,所述填料采用琼脂糖、或羟基磷灰石-磷酸三钙、或β-磷酸三钙、或α-磷酸三钙、或生物活性玻璃陶瓷、或硫酸钙、或骨水泥、或明胶、或胶原蛋白、或聚乳酸-甘醇酸、或聚己内酯多元醇、或弹性蛋白制成。
[0014]
在其中一个实施例中,所述填料为若干微粒载体,若干所述微粒载体之间的缝隙构成层析通道。
[0015]
在其中一个实施例中,所述填料为膜载体,所述膜载体卷曲成松散的卷轴状:所述膜载体卷曲而成的缝隙构成层析通道;或者,所述膜载体设有空洞,所述空洞构成所述层析通道。
[0016]
在其中一个实施例中,所述膜载体包括层叠的衬膜和微孔膜,所述微孔膜设有所述空洞。
[0017]
在其中一个实施例中,所述微粒载体的粒径为10-1000μm。
[0018]
在其中一个实施例中,所述离心系统包括直透膜离心机,所述离心机设有可供缓冲液注入的第二入口。
[0019]
本发明还提供一种纯化方法包括以下步骤:特异性结合:含有待纯化的生物颗粒的原液通入纯化系统,所述待纯化原液从进液口进入层析通道,待纯化原液中至少一种生物颗粒与填料上附着的特异性抗体结合,剩余的非结合生物颗粒从出液口流出;
[0020]
离心-:将所述“特异性结合”步骤中从所述出液口流出的剩余的非结合生物颗粒通入离心系统进行处理,并收集目标生物颗粒。
[0021]
还可包括步骤离心-:将所述“特异性结合”步骤中结合在填料上的生物颗粒进行脱离,并将脱离后的生物颗粒通过所述出液口通入离心系统进行处理,并收集。
[0022]
在其中一个实施例中,纯化方法还包括:在“离心
ⅱ”
步骤中,由第二入口向离心机中注入一种缓冲剂用以洗脱被捕获在前述填料上的生物颗粒,将脱离后的目标生物颗粒通入离心机进行处理,并收集目标生物颗粒产物。
[0023]
上述两个离心和收集方法描述了两种纯化方式,即步骤离心-是负向纯化(i)方式,步骤离心-是正向纯化(ii)方式。
[0024]
本发明的有益效果在于:
[0025]
1、生物颗粒纯化装置包括:纯化系统和离心系统。其中,所述纯化系统包括至少一组亲和层析柱,其中:所述亲和层析柱内设有填料,所述填料用于吸附生物颗粒,所述填料具有层析通道,所述亲和层析柱设有进液口和出液口,所述进液口与所述层析通道连通,所述出液口与所述层析通道连通,所述离心系统与所述出液口对接。待纯化原液从进液口进入,流经层析通道:正筛选时,目标生物颗粒被填料吸附,目标生物颗粒就被亲和层析柱提取出来;负筛选时,杂质生物颗粒被填料吸附,待纯化原液被净化,目标生物颗粒遗留在剩余的待纯化原液中从出液口流出,一些情况下,剩余的待纯化原液可以直接用于细胞治疗。通过利用动态离心的方法,将亲和层析柱联系起来,做到整个分离和收集自动化,和全闭封,由此减少或消除操作过程中的人为介入。
[0026]
离心系统可采用行业中常用的从原液中提取分离细胞的装置,常用的有过滤膜分
离、离心沉淀等方式,包括但不限于us5431814a、cn201280063057、us2012156177a1所述的装置均可。离心系统和纯化系统对接,待纯化原液经过亲和层析柱处理后直接进入离心系统进行处理(正筛选时将目标生物颗粒通入离心系统进行处理、负筛选时将包含目标生物颗粒的剩余原液通入离心系统进行处理),形成一个封闭的流程,适用于快速自动生产,同时可以避免交叉污染。
[0027]
如果采用两组以上的亲和层析柱,可以是并联、或者串联、或者先串联后并联。并联时,每组亲和层析柱单独对接到各自的离心系统,或者多个亲和层析柱共同对接到一个离心系统。
[0028]
优选的,亲和层析柱可以是耗材或者一次性的,针对不同的目标生物颗粒,制造对应的亲和层析柱,使用完后可以更换纯化装置的亲和层析柱,然后进行下一轮纯化操作,方便使用。
[0029]
其中,所谓正筛选就是吸附目标生物颗粒,再把目标生物颗粒收集起来。而负筛选就是吸附杂质生物颗粒,把杂质生物颗粒清除掉,而剩下的就是需要收集的目标生物颗粒。
[0030]
其中,填料、包含填料的亲和层析柱可作为单独产品保存或出售,操作简便,易于掌握和传播,使用范围光,利于推广。
[0031]
2、所述填料是若干微粒载体,若干所述微粒载体之间的缝隙构成层析通道。微粒载体堆积在一起时,微粒载体之间并不会完全贴合,微粒载体与微粒载体之间具有缝隙,所述微粒载体之间的缝隙构成层析通道,优选的,微粒载体外形为球形、椭球、或类球形。因为微粒载体粒径很小,且实际生产中很难保证是严格的球形、表面也不是完全光滑。因此,只要能流出空隙构成层析通道的颗粒都属于本专利讨论的微粒载体范围,类似球形的结构属于本专利优选范围。层析通道供给待纯化原液通过,待纯化原液可以从层析通道流过,并且微粒载体堆积在一起,层析通道路线狭小繁多,待纯化原液可以和微粒载体充分接触,所述亲和层析柱设有进液口和出液口,所述进液口与所述层析通道连通,所述出液口与所述层析通道连通;
[0032]
或者,所述填料是膜载体,所述膜载体卷曲成松散的卷轴状设于所述亲和层析柱内,所述膜载体卷曲而成的缝隙构成层析通道,所述亲和层析柱设有进液口和出液口,所述进液口与所述层析通道连通,所述出液口与所述层析通道连通;膜载体卷曲成卷轴状能够极大地扩展了接触面积,待纯化原液可依次通过若干层透膜,使得组织不均一、存在偏析的难处理原液中的所需成分亦能充分地被结合捕获;
[0033]
或者,所述填料是膜载体,所述膜载体卷曲成松散的卷轴状设于所述亲和层析柱内,所述膜载体设有空洞,所述空洞构成所述层析通道,待纯化原液被细化分流进过空洞,更利于结合捕获。
[0034]
3、所述亲和层析柱还设有第一入口,所述第一入口与所述层析通道连通,在正筛选中,从第一入口向亲和层析柱内通入洗脱试剂,洗脱试剂将目标生物颗粒从微粒载体或膜载体上洗下来,从而获得目标生物颗粒。
[0035]
4、所述微粒载体或膜载体上附着有至少一种特异性抗体。所述特异性抗体用于与所述待分离生物颗粒上的特异性分子或靶蛋白结合。
[0036]
可以是,亲和层析柱所含的微粒载体提供了层析通道,但是微粒载体不带有特异性抗体,使用者可以根据需要选择所需的特异性抗体,并将特异性抗体附着于微粒载体或
膜载体上,从而实现一种亲和层析介质。也可以是,亲和层析柱所含的微粒载体或膜载体就已经附着有特异性抗体,经过消毒杀菌处理封装好,此时亲和层析柱相当于一次性耗材,亲和层析柱可拆卸地设置于纯化系统上,使用者可以根据需要,选择附着有所需特异性抗体的亲和层析柱,在完成附着提取后,即可更换、抛弃纯化装置中的亲和层析柱,快捷方便,且可以避免污染。
[0037]
5、所述特异性抗体与所述微粒载体或膜载体可逆结合。某种洗脱试剂可以将特异性抗体从微粒载体或膜载体上洗脱下来,从而将与特异性抗体结合的生物颗粒从微粒载体或膜载体上洗脱下来。所述特异性抗体与所述微粒载体或膜载体也可以是不可逆结合,某种物质比如酶可以将特异性抗体从微粒载体或膜载体上剪切下来,从而将与特异性抗体结合的生物颗粒从微粒载体或膜载体上脱离下来。所述特异性抗体包含有针对自然杀伤(nk)细胞、cd3+t细胞、cd4+t细胞、cd8+t细胞的其中一种或其中两种以上抗体组合而成。
[0038]
6、所述膜载体或微粒载体由生物相容性材料制成,生物相容性材料具有亲水性、多孔性、电中性、易衍生性,不改变待纯化原液、目标生物颗粒的生物特性。
[0039]
7、所述填料采用琼脂糖、或羟基磷灰石-磷酸三钙、或β-磷酸三钙、或α-磷酸三钙、或生物活性玻璃陶瓷、或硫酸钙、或骨水泥、或明胶、或胶原蛋白、或聚乳酸-甘醇酸、或聚己内酯多元醇、或弹性蛋白制成,这些材料具有低温柔韧性、回弹性、耐磨性、耐候性、水解稳定性、亲水性、多孔性、电中性、易衍生性等优点,不会改变待纯化原液、目标生物颗粒的生物特性,也利于待纯化原液的通过。并且,这些材料制作粒径为10-1000μm微粒载体,容易控制微粒载体的粒径、且其上容易附着特异性抗体。
[0040]
8、所述微粒载体的粒径为10-1000μm。一方面,该范围粒径大于传统的磁珠,其缝隙大,足以使生物颗粒通过,利于进行连续自动化的纯化。另一方面,该范围粒径使得微粒载体的表面积相对于微粒载体之间的缝隙足够大,能够更好的将生物颗粒吸附于微粒载体的表面。
[0041]
9、膜载体包括层叠的衬膜和微孔膜,衬膜用于为微孔膜提供支撑,微孔膜设有空洞,这些空洞构成层析通道,优选的,衬膜为网状,待纯化原液可以轻松穿过衬膜的网孔。
[0042]
10、所述离心系统包括离心机,所述离心机设有可供缓冲液注入的第二入口。可以从第二入口向离心机中通入缓冲液,使离心提纯后的生物颗粒处于缓冲液中,一些情况下,生物颗粒混与缓冲液中构成的悬浮液可以直接用于生物治疗或研究。其中,洗脱试剂和缓冲液可以是同一种试剂,也可以是不同试剂。
[0043]
11、纯化方法包括正筛选和负筛选,其中“负筛选”包括以下步骤:
[0044]
特异性结合:含有待纯化的生物颗粒的原液通入纯化系统,所述待纯化原液从进液口进入层析通道,待纯化原液中至少一种生物颗粒与填料上附着的特异性抗体结合,剩余的非结合生物颗粒从出液口流出;
[0045]
离心-:将所述“特异性结合”步骤中从所述出液口流出的剩余的非结合生物颗粒通入离心系统进行处理,并收集目标生物颗粒。目标细胞或其它生物颗粒悬浮液可以直接用于生物治疗或研究实验。
[0046]
其中,亲和层析柱上设置两种以上的特异性抗体时,可以同时吸附两种以上的杂质生物颗粒,即同时过滤掉待纯化原液中的多种杂质,一次性纯化待纯化原液;或者,可以设置两组以上的亲和层析柱,多组亲和层析柱之间串联,待纯化原液依次流经串联亲和层
析柱,每组亲和层析柱可以吸附不同的杂质生物颗粒,一次性纯化待纯化原液。
[0047]
12、“正筛选”包括以下步骤:
[0048]
离心-:将所述“特异性结合”步骤中结合在填料上的生物颗粒进行脱离,并将脱离后的生物颗粒通过所述出口液通入离心系统进行处理,并收集。
[0049]
在“离心
ⅱ”
步骤中,由第二入口向离心机中注入一种缓冲液洗脱剂用以洗脱被捕获在前述填料上的生物颗粒,将脱离后的目标生物颗粒通入离心机进行处理,并收集目标生物颗粒产物。
[0050]
13、“正筛选”纯化方法还包括:在“离心
ⅱ”
步骤中,由第二入口向离心机中注入缓冲剂,将“洗脱”后的目标生物颗粒通入离心机进行处理(洗脱后产物通常包括洗脱试剂、生物颗粒,可以将洗脱后的产物通入离心系统),并收集目标生物颗粒产物。优选的,可以通过第二入口向离心系统中通入缓冲剂,进行缓冲交换清洗,使目标细胞或其它生物颗粒处于一种合适的缓冲液中,目标细胞或其它生物颗粒悬浮液可以直接用于生物治疗或研究实验。
附图说明
[0051]
图1为本发明实施例一生物颗粒纯化装置的结构图;
[0052]
图2为本发明实施例一亲和层析柱内设有微粒载体的结构示意图;
[0053]
图3为本发明实施例二亲和层析柱内设有膜载体的结构示意图一;
[0054]
图4为本发明实施例二亲和层析柱内设有膜载体的部分拆解图;
[0055]
图5为本发明实施例二亲和层析柱内设有膜载体的爆炸图;
[0056]
图6为本发明实施例二待纯化原液在膜载体内流动的示意图;
[0057]
图7为本发明实施例三膜载体的结构示意图;
[0058]
图8为本发明实施例四亲和层析柱串联的结构示意图;
[0059]
图9为本发明实施例五亲和层析柱并联的结构示意图;
[0060]
图10为本发明实施例六亲和层析柱并联的结构示意图。
[0061]
附图标记说明:
[0062]
100、亲和层析柱,110、进液口,120、出液口,130、第一入口,200、微粒载体,210、膜载体,211、衬膜,212、微孔膜,213、空洞,300、层析通道,400、离心机,410、第二入口,500、洗脱试剂,600、缓冲液,700、待纯化原液。
具体实施方式
[0063]
下面对本发明作进一步详细说明,但本发明的实施方式不限于此。
[0064]
实施例一
[0065]
如图1、2所示,生物颗粒纯化装置包括至少一组亲和层析柱100、离心系统。生物颗粒纯化装置包括:纯化系统和离心系统。亲和层析柱100内设有填料,填料用于吸附生物颗粒,填料具有层析通道300,亲和层析柱100设有进液口110和出液口120,进液口110与层析通道300连通,出液口120与层析通道300连通,离心系统包括离心机和其他辅助设备,离心机400与出液口120对接。待纯化原液700从进液口110进入,流经层析通道300进行纯化。
[0066]
本实施例中,亲和层析柱100内设有若干微粒载体200,若干微粒载体200之间的缝
隙构成层析通道300,亲和层析柱100设有进液口110和出液口120,进液口110与层析通道300连通,出液口120与层析通道300连通。离心机400与出液口120对接。微粒载体200堆积在一起时,微粒载体200之间并不会完全贴合,微粒载体200与微粒载体200之间具有缝隙,微粒载体200之间的缝隙构成层析通道300,优选的,微粒载体200外形为球形、椭球、或类球形。因为微粒载体200粒径很小,且实际生产中很难保证是严格的球形、表面也不是完全光滑。因此,只要能流出空隙构成层析通道300的颗粒都属于本专利讨论的微粒载体200范围,类似球形的结构属于本专利优选范围。层析通道300供给待纯化原液700通过,待纯化原液700可以从层析通道300流过,并且微粒载体200堆积在一起,层析通道300路线狭小繁多,待纯化原液700可以和微粒载体200充分接触。
[0067]
膜载体210或微粒载体200由生物相容性材料制成。本实施例中,微粒载体200采用琼脂糖材料制成。琼脂糖制成的微粒载体200由于具有亲水性、多孔性、电中性、易衍生性等优点,且制造成本远低于现有技术中使用的微型磁珠,可作为一次性耗材,无需人工操作,实现流程自动化。但不限于本实施例,也可以根据实际的待纯化原液700特性、特异性分子特性、靶蛋白特性采用其他适宜的材料。优选的,微粒载体200采用琼脂糖、或羟基磷灰石-磷酸三钙、或β-磷酸三钙、或α-磷酸三钙、或生物活性玻璃陶瓷、或硫酸钙、或骨水泥、或明胶、或胶原蛋白、或聚乳酸-甘醇酸、或聚己内酯多元醇、或弹性蛋白制成,考虑到生产工艺和使用成本,的膜载体210或微粒载体200可以采用以上材料中的一种或一种以上的组合制成,亦即载体不必须是由单一成分构成,只要性能足以实现本专利的吸附处理即可;在一次使用中,若干微粒载体200亦不必须由相同材料制成。
[0068]
本实施例中,亲和层析柱100容器大致为圆筒状,但不限于本实施例,也可以是棱柱或其他柱体、或不规则体,只要能够在其内设置微粒载体200即可。亲和层析柱100容器可以由生理相容的聚合物组合构成,例如丙交酯和乙交酯的共聚物,丙交酯和乙交酯的共聚物对于后续将详述的特异性抗体具有更好的亲和性,使得特异性抗体的物理吸附更加均匀,进而提升与待纯化生物颗粒的总体结合效果。为了便于从外部观察纯化过程的状况,亲和层析柱100容器亦可采用透明材料制成。
[0069]
其中,“附着”包括但不限于物理作用或因生物相容性作用而发生的结合状态,该结合不必须是对象之间的直接结合,为了取得更好的附着效果或改变附着的形态、附着物的性质等而添加相应的催化剂、改性剂、增强剂/强化剂等,亦应当认为属于本专利讨论的范围。
[0070]
亲和层析柱100还设有第一入口130,第一入口130与层析通道300连通。
[0071]
本实施例中,微粒载体200的粒径为10-1000μm。一方面,该范围粒径大于传统的磁珠,其缝隙大,足以使生物颗粒通过,利于进行连续自动化的纯化。另一方面,该范围粒径使得微粒载体200的表面积相对于微粒载体200之间的缝隙足够大,不会堵塞或积留,特异性结合效果更好,能够更好的将生物颗粒吸附于微粒载体200的表面。但不限于本实施例,也可以根据实际的待纯化原液700特性、特异性抗体特性、靶蛋白特性采用其他适宜的粒径。
[0072]
离心系统包括直透膜离心机400,离心机400设有可供缓冲液600注入的第二入口410。离心系统可采用行业中常用的从原液中提取分离细胞的装置,常用的有过滤膜分离、离心沉淀等方式,包括但不限于us5431814a、cn201280063057、us2012156177a1的装置均可。其中,洗脱试剂500和缓冲液600可以是同一种试剂,也可以是不同试剂。
[0073]
待纯化原液700中还有待纯化的生物颗粒(比如外泌体,病毒等),本实施例的纯化系统可以将生物颗粒纯化出来。其原理是,根据待纯化的生物颗粒(比如外泌体,病毒等)表面具有的某种特异性分子或靶蛋白,例如t细胞(具有cd3或tcr等靶蛋白),nk细胞(具有cd56等靶蛋白),该特异性分子或靶蛋白可以与相应的特异性抗体结合,以该特异性分子或靶蛋白作为结合受体,如此,微粒载体200的表面即被附着有特异性抗体。并且,这种附着是可逆的,特异性抗体可以被洗脱试剂500温和地洗脱下来。待纯化原液700从微粒载体200缝隙间通过时,生物颗粒上的特异性分子或靶蛋白与微粒载体200表面的特异性抗体发生特异性结合,微粒载体200捕获相应的生物颗粒。如前,特异性抗体附着于微粒载体200表面是可逆的,特异性抗体可以被洗脱试剂500温和地洗脱下来,当特异性抗体被从微粒载体200上洗脱下来时,与之结合的生物颗粒也就被洗脱下来。
[0074]
利用本实施例的纯化装置,可以进行正筛选或负筛选。所谓正筛选,就是微粒载体200吸附目标生物颗粒;所谓负筛选,就是杂质生物颗粒被微粒载体200吸附,目标生物颗粒遗留在剩余的待纯化原液700中从出液口120流出,待纯化原液700被净化。具体的:
[0075]
(一)负筛选
[0076]
选备试剂-:根据待纯化原液700中杂质生物颗粒表面的特异性分子/靶蛋白选备包含对应特异性抗体的亲和层析柱100;或者,根据待纯化原液700中杂质生物颗粒选备包含对应特异性抗体的亲和层析柱100。
[0077]
特异性结合:含有待纯化的生物颗粒的原液通入纯化系统,所述待纯化原液从进液口进入层析通道,待纯化原液中至少一种生物颗粒与填料上附着的特异性抗体结合,剩余的非结合生物颗粒从出液口流出;
[0078]
离心-:将所述“特异性结合”步骤中从所述出液口流出的剩余的非结合生物颗粒通入离心系统进行处理,并收集目标生物颗粒。目标细胞或其它生物颗粒悬浮液可以直接用于生物治疗或研究实验。
[0079]
其中,亲和层析柱上设置两种以上的特异性抗体时,可以同时吸附两种以上的杂质生物颗粒,即同时过滤掉待纯化原液中的多种杂质,一次性纯化待纯化原液;或者,可以设置两组以上的亲和层析柱,多组亲和层析柱之间串联,待纯化原液依次流经串联亲和层析柱,每组亲和层析柱可以吸附不同的杂质生物颗粒,一次性纯化待纯化原液。
[0080]
(二)正筛选
[0081]
选备试剂:根据待纯化原液700中杂质生物颗粒表面的特异性分子/靶蛋白选备包含对应特异性抗体的亲和层析柱100。
[0082]
特异性结合:含有待纯化的生物颗粒的原液通入纯化系统,所述待纯化原液从进液口进入层析通道,待纯化原液中至少一种生物颗粒与填料上附着的特异性抗体结合,剩余的非结合生物颗粒从出液口流出;
[0083]
离心-:将所述“特异性结合”步骤中结合在填料上的生物颗粒进行脱离,可以是洗脱过程,并将脱离后的生物颗粒通过所述出口液通入离心系统进行处理,并收集。
[0084]
在“离心
ⅱ”
步骤中,将“洗脱”后的目标生物颗粒通入离心机400进行处理(洗脱后产物通常包括洗脱试剂500、生物颗粒,可以将洗脱后的产物通入离心机400),并收集目标生物颗粒产物。在离心过程前、或离心过程中、或离心过程后,由第二入口向离心机中注入一种缓冲剂用以洗脱被捕获在前述填料上的生物颗粒,进行缓冲交换清洗,将脱离后的目
标生物颗粒通入离心机进行处理,并收集目标生物颗粒产物。
[0085]
优选的,亲和层析柱100可以是耗材或者一次性的,针对不同的目标生物颗粒,制造对应的亲和层析柱100,亲和层析柱100出厂时,微粒载体200或膜载体210就已经附着有特异性抗体,经过消毒杀菌处理封装好,使用完后即可更换、抛弃纯化装置中的亲和层析柱100,然后进行下一轮纯化操作,方便使用,且可以避免交叉污染。
[0086]
本实施例中,填料是若干微粒载体200,但不限于本实施例,也可以采用其他能够提供多空隙的材料作为填料。例如,可以采用纤维作为填料,单根纤维或多根纤维扭转缠绕,形成疏松多孔结构(可以类似毛衣、羽绒服填充物、棉絮、或其他领域常见纤维堆积结构),其形成的孔隙构成层析通道300。
[0087]
实施例二
[0088]
实施例二与实施例一的区别在于:
[0089]
如图3-6所示,填料为膜载体210,亲和层析柱100内设有膜载体210替代微粒载体200(实施例一当中描述微粒载体200的技术特征均可替换到膜载体210上使用,在本实施例不再赘述。),膜载体210卷曲成松散的卷轴状设于亲和层析柱100内,膜载体210卷曲而成的缝隙构成层析通道300,如图4、5所示,可以采用常用的支架、卡扣、焊接、粘接或其他方式将膜材提固定为卷轴状。亲和层析柱100设有进液口110和出液口120,进液口110与层析通道300连通,出液口120与层析通道300连通;离心系统,离心系统包括离心机400,离心机400与出液口120对接。进液口110与卷轴中心对接、出液口120设于亲和层析柱100的侧壁,待纯化原液700从卷轴的中心进入层析通道300,如图5、6所示沿着卷轴状的路线流经膜载体210表面,最后从侧面流出。但不限于本实施例,可以以将进液口110和出液口120分别设置在卷轴的两端;或者其他适宜的位置。
[0090]
实施例三
[0091]
实施例三与实施例二的区别在于:
[0092]
如图7所示,填料为膜载体210,膜载体210设有空洞213,这些空洞213构成层析通道300,待纯化原液700从卷轴的中心进入,穿过空洞状的层析通道300后流出,膜载体210上设有特异性抗体,待纯化原液700中的目标生物颗粒与膜载体210上附着的特异性抗体结合。本实施例中,膜载体210包括层叠的衬膜211和微孔膜212,衬膜211为网状,衬膜211用于为微孔膜212提供支撑,待纯化原液700可以轻松穿过衬膜211的网孔。微孔膜212设有空洞213,这些空洞213构成层析通道300。本实施例中,微孔膜212设有特异性抗体,特异性抗体集中于空洞213周围,这样的话,当待纯化原液进过微孔膜212的空洞213时,待分离原液700被分流为细小流体流经空洞213,更利于待分离原液700中的目标颗粒和特异性蛋白结合;但不限于本实施例,可以在衬膜211和微孔膜212上均设置特异性抗体,特异性抗体也不一定集中于空洞213周围。
[0093]
实施例四
[0094]
实施例四与实施例一的区别在于:
[0095]
如图8所示,设置两组以上的亲和层析柱100,亲和层析柱100内可以是膜载体210、或微粒载体200、或二者混用,多组亲和层析柱100之间串联,待纯化原液700依次流经串联亲和层析柱100。
[0096]
其中,每组亲和层析柱100内的微粒载体200或膜载体210附着有同样的特异性抗
体,待纯化原液700依次流经各个亲和层析柱100时,被连续纯化,加强纯化效果,特别是当需要被微粒载体200或膜载体210吸附的生物颗粒浓度较大时,可以通过设置多组串联亲和层析柱100的方式来加强纯化效果;或者每组亲和层析柱100内的微粒载体200或膜载体210附着有不同的特异性抗体,待纯化原液700依次流经各个亲和层析柱100时,被不同的亲和层析柱100吸附不同的生物颗粒,一次性纯化待纯化原液700。
[0097]
实施例五
[0098]
实施例五与实施例一的区别在于:
[0099]
如图9所示,设置两组以上的亲和层析柱100,亲和层析柱100内可以是膜载体210、或微粒载体200、或二者混用,每组亲和层析柱100内的膜载体210或微粒载体200附着有同种特异性抗体,多组亲和层析柱100之间并联,并联后统一连接到同一离心系统的离心机400上。
[0100]
多组亲和层析柱100并联可以扩大待纯化原液700流量,提高处理能力。
[0101]
实施例六
[0102]
实施例六与实施例五的区别在于:
[0103]
如图10所示,设置两组以上的亲和层析柱100,亲和层析柱100内可以是膜载体210、或微粒载体200、或二者混用,多组亲和层析柱100之间并联,各组亲和层析柱100连接至各自对应的离心机400。
[0104]
各组亲和层析柱100相对独立,每组亲和层析柱100内的膜载体210或微粒载体200附着有不同特异性抗体,每组亲和层析柱100吸附各自对应的生物颗粒,从而经过不同的亲和层析柱100处理后获得不同的产物。
[0105]
以上实施例的各技术特征可以进行任意的组合,为使描述简洁,未对上述实施例中的各个技术特征所有可能的组合都进行描述,然而,只要这些技术特征的组合不存在矛盾,都应当认为是本说明书记载的范围。
[0106]
以上实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询

tips


 商标分类
商标分类  商标转让
商标转让 



