作为大麻素受体2的抑制剂的新型吡啶和吡嗪化合物的制作方法
 2021-02-02 13:02:18|
2021-02-02 13:02:18| 390|
390| 起点商标网
起点商标网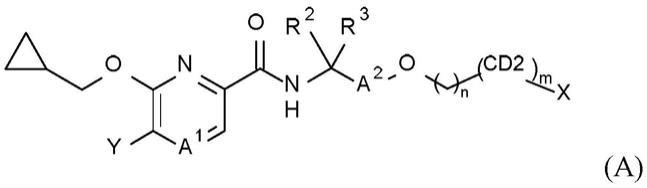
作为大麻素受体2的抑制剂的新型吡啶和吡嗪化合物
[0001]
本发明涉及可用于哺乳动物的治疗和/或预防的有机化合物,并且特别地涉及作为大麻素受体2的优先激动剂的化合物。
[0002]
本发明特别涉及式(i)的化合物
[0003][0004]
其中
[0005]
r
1
是烷氧基氮杂环丁基、二卤代氮杂环丁基或吡咯烷基;
[0006]
r
2
和r
3
独立地选自氢和烷基;
[0007]
a
1
是-ch-或氮;
[0008]
a
2
是-ch
2-或羰基;
[0009]
x是卤素;
[0010]
n是0至3;并且
[0011]
m是0或1;
[0012]
条件是,m和n不同时都是0;
[0013]
或其药用盐。
[0014]
已经发现了对于大麻素cb2受体具有高亲和力和极大选择性的新型吡啶和吡嗪衍生物。这些化合物对于cb2受体的活性具有调节作用。术语
‘
调节作用
’
尤其意指激动剂、拮抗剂和/或反向激动剂作用。
[0015]
大麻素受体2的激动剂可用于哺乳动物的治疗和/或预防。式(i)的化合物特别可用于治疗或预防例如疼痛(pain)、动脉粥样硬化(atherosclerosis)、老年性黄斑变性(age-related macular degeneration)、糖尿病性视网膜病变(diabetic retinopathy)、青光眼(glaucoma)、糖尿病(diabetes mellitus)、炎症(inflammation)、炎性肠病(inflammatory bowel disease)、缺血-再灌注损伤(ischemia-reperfusion injury)、急性肝功能衰竭(acute liver failure)、肝纤维化(liver fibrosis)、肺纤维化(lung fibrosis)、肾纤维化(kidney fibrosis)、系统性纤维化(systemic fibrosis)、急性同种异体移植排斥(acute allograft rejection)、慢性同种异体移植肾病(chronic allograft nephropathy)、糖尿病性肾病(diabetic nephropathy)、肾小球性肾病(glomerulonephropathy)、心肌病(cardiomyopathy)、心力衰竭(heart failure)、心肌缺血/梗死(myocardial ischemia/infarction)、系统性硬化病(systemic sclerosis)、热伤(thermal injury)、烧伤(burning)、增生性瘢痕(hypertrophic scars)、瘢痕瘤(keloids)、牙龈炎发热(gingivitis pyrexia)、肝硬化或肿瘤(liver cirrhosis or tumors)、骨量调节(regulation of bone mass)、神经变性(neurodegeneration)、卒中(stroke)、暂时性局部缺血发作(transient ischemic attack)或葡萄膜炎(uveitis)。
[0016]
大麻素受体2的反向激动剂可用于哺乳动物的治疗和/或预防。
[0017]
式(i)的化合物特别可用于治疗或预防疼痛、神经性疼痛、哮喘、骨质疏松、炎症、精神疾病、精神病、肿瘤、脑炎、疟疾、变态反应、免疫性病症、关节炎、胃肠道病症、精神异常、类风湿性关节炎、精神病和变态反应。
[0018]
大麻素受体是一类细胞膜受体,属于g蛋白-偶联受体超家族。目前存在两种已知亚型,称为大麻素受体1(cb1)和大麻素受体2(cb2)。cb1受体主要表达在中枢神经(即杏仁核小脑,海马体)系统中并且在外周中以较少量表达。由cnr2基因编码的cb2主要在免疫系统的细胞,如巨噬细胞和t-细胞上(ashton,j.c.等curr neuropharmacol 2007,5(2),73-80;miller,a.m.等br j pharmacol 2008,153(2),299-308;centonze,d.,等curr pharm des 2008,14(23),2370-42),和在胃肠系统中(wright,k.l.等br j pharmacol 2008,153(2),263-70)外周表达。cb2受体还广泛分布于脑中,其中它主要发现于小胶质细胞而非神经元上(cabral,g.a.等br j pharmacol 2008,153(2):240-51)。
[0019]
大麻素受体2的调节剂可用于哺乳动物的治疗和/或预防。
[0020]
在过去十年对cb2受体激动剂的兴趣稳步上升(目前30-40件专利申请/年),这是由于以下事实所致,即早期化合物中的多种已显示在大量人类疾病的临床前模型中具有有益作用,这些疾病包括慢性疼痛(beltramo,m.mini rev med chem 2009,9(1),11-25),动脉粥样硬化(mach,f.等j neuroendocrinol 2008,20suppl 1,53-7),骨量调节(bab,i.等br j pharmacol 2008,153(2),182-8),神经性炎症(cabral,g.a.等j leukoc biol2005,78(6),1192-7),缺血/再灌注损伤(pacher,p.等br j pharmacol 2008,153(2),252-62),系统性纤维化(akhmetshina,a.等artritis rheum 2009,60(4),1129-36;garcia-gonzalez,e.等rheumatology(oxford)2009,48(9),1050-6),肝纤维化(julien,b.等gastroenterology 2005,128(3),742-55;munoz-luque,j.等j pharmacol exp ther 2008,324(2),475-83)。
[0021]
缺血/再灌注(i/r)损伤是在病症如卒中、心肌梗死、心肺分流术(cardiopulmonary bypass)及其他血管外科手术和器官移植中发生的组织损伤的主要原因,以及使得多种病因学的循环性休克的过程复杂化的终末器官损伤的主要机制。所有这些病症的特征在于正常血压供应破坏,这导致不足的组织氧合。再氧合例如再灌注是用于恢复正常组织氧合的终极治疗。然而,来自血液的氧和营养的缺乏产生其中循环恢复导致进一步组织损伤的病况。再灌注损伤的损害部分地是由于受损组织的炎性反应。由新回血携带至该区域的白血球响应于组织损伤而释放许多炎性因子如白介素以及自由基。恢复的血流在细胞内重新引入氧,其损害细胞蛋白、dna和质膜。
[0022]
远端缺血预处理(ripc)代表利用身体内源性保护能力对抗由于缺血和再灌注引起的损伤的策略。其描述了其中一个器官或组织的短暂非致死性缺血和再灌注对于远端器官或组织中的“致死性”缺血-再灌注损伤的后续发作(subsequent episode)提供抗性的一种非常有趣的现象。尽管已经提出多种假说,但是器官或组织的短暂缺血和再灌注借以提供保护的确切机制在当前是未知的。
[0023]
体液假说提出,在远端器官或组织中产生的内源性物质(如腺苷、缓激肽、阿片类、cgrp、内源性大麻素、血管紧缩素i或一些还没有被鉴别的体液因子的其他物质)进入血流并在靶组织中激活其相应受体,并由此募集在缺血预适应中涉及的心肌保护的各种细胞内
途径。
[0024]
近期数据表明,内源性大麻素及其受体,特别是cb2可能涉及预适应并且通过下调炎性反应而有助于预防再灌注损伤(pacher,p.等br j pharmacol 2008,153(2),252-62)。具体地,利用cb2工具激动剂的近期研究证实了此构思对于减少心脏(defer,n.等faseb j 2009,23(7),2120-30)、大脑(zhang,m.等j cereb blood flow metab 2007,27(7),1387-96)、肝脏(batkai,s.等faseb j 2007,21(8),1788-800)和肾脏(feizi,a.等exp toxicol pathol 2008,60(4-5),405-10)中的i/r损伤的功效。
[0025]
此外,在过去的几年内,越来越多的文献表明,cb2在亚慢性和慢性情形中也可以令人感兴趣。cb1和cb2的特异性上调已经显示在与纤维化相关的慢性疾病的动物模型(garcia-gonzalez,e.等rheumatology(oxford)2009,48(9),1050-6;yang,y.y.等liver int 2009,29(5),678-85)中与肌纤维母细胞(负责纤维化进展的细胞)中的cb2的相关表达是有关的。
[0026]
cb2受体通过选择性cb2激动剂的激活事实上已经显示在扩散性系统硬化病中发挥抗纤维化作用(garcia-gonzalez,e.等rheumatology(oxford)2009,48(9),1050-6)并且cb2受体已经在实验性皮肤纤维化(akhmetshina,a.等arthritis rheum 2009,60(4),1129-36)和肝脏病理生理学,包括与慢性肝病相关的纤维发生(fibrogenesis)(lotersztajn,s.等gastroenterol clin biol 2007,31(3),255-8;mallat,a.等expert opin ther targets 2007,11(3),403-9;lotersztajn,s.等br j pharmacol 2008,153(2),286-9)中作为关键靶标出现。
[0027]
大麻素受体2的反向激动剂可用于哺乳动物的治疗和/或预防。
[0028]
式(i)的化合物特别可用于治疗或预防疼痛、神经性疼痛、哮喘、骨质疏松、炎症、精神疾病、精神病、肿瘤、脑炎、疟疾、变态反应、免疫性病症、关节炎、胃肠道病症、精神异常、类风湿性关节炎、精神病和变态反应。
[0029]
在过去十年对cb2受体配体的兴趣稳步上升(目前30-40件专利申请/年)。不同来源的证据支持这样的观点:通过cb2受体的脂内源性大麻素信号传导代表哺乳动物保护性医疗设备的一个方面(pacher,p.prog lipid res 2011,50,193)。通过选择性cb2受体激动剂或反向激动剂/拮抗剂(取决于疾病及其阶段)对其的调节在大量疾病中保持唯一的治疗潜能。对于cb2反向激动剂/拮抗剂,对于很多病理状况显示了治疗可能性:所述病理状况包括疼痛(pasquini,s.j med chem 2012,55(11):5391),神经性疼痛(garcia-gutierrez,m.s.br j pharmacol 2012,165(4):951),精神病症(garcia-gutierrez,m.s.br j pharmacol 2012,165(4):951),精神病(garcia-gutierrez,m.s.br j pharmacol 2012,165(4):951),骨质疏松和炎症(sophocleous,a.calcif tissue int 2008,82(suppl.1):abst oc18),精神疾病和精神病(garcia-gutierrez,m.s.br j pharmacol 2012,165(4):951),肿瘤(preet,a.cancer prev res 2011,4:65),脑炎和疟疾(zimmer,a.wo2011045068),变态反应和炎症(ueda,y.life sci 2007,80(5):414),脑炎和疟疾(zimmer,wo 2011045068),哮喘(lunn,c.a.j pharmacol exp ther2006,316(2):780),免疫性病症(fakhfouri,g.neuropharmacology 2012,63(4):653),类风湿性关节炎(chackalamannil,s.us 7776889),关节炎(lunn,c.a.j pharmacol exp ther 2006,316(2):780),和胃肠道病症(barth,f.fr 2887550)。
[0030]
本发明的化合物结合和调节cb2受体并且具有较低的cb1受体活性。
[0031]
在本说明书中,术语“烷基”,单独或组合地,表示具有1至8个碳原子的直链或支链烷基,特别是具有1至6个碳原子的直链或支链烷基,更特别是具有1至4个碳原子的直链或支链烷基。直链和支链c
1-c
8
烷基的实例为甲基、乙基、丙基、异丙基、丁基、异丁基、叔丁基、异构的戊基、异构的己基、异构的庚基和异构的辛基,特别是甲基、乙基、丙基、丁基和戊基。烷基的特别的实例是甲基、乙基、异丙基、丁基、异丁基、叔丁基和戊基。甲基、乙基和丙基是式(i)的化合物中的“烷基”的特别实例。
[0032]
术语“烷氧基”或“烷基氧基”,单独或组合地,表示式烷基-o-的基团,其中术语"烷基"具有之前给出的含义,如甲氧基、乙氧基、正丙氧基、异丙氧基、正丁氧基、异丁氧基、仲丁氧基和叔丁氧基。“烷氧基”的一个特别实例是甲氧基。
[0033]
术语“氧基”,单独或组合地,表示-o-基团。
[0034]
术语“卤素”或“卤代”,单独或组合地,表示氟、氯、溴或碘,并特别是氟、氯或溴,更特别是氟。术语“卤代”,与另一基团组合地表示所述基团被至少一个卤素取代,特别是被一至五个卤素,特别是一至四个卤素,即一、二、三或四个卤素取代。氟是特别的卤素。
[0035]
术语“羰基”,单独或组合地,表示-c(o)-基团。
[0036]
术语“药用盐”是指保持游离碱或游离酸的生物有效性和性质的那些盐,它们不是生物学上或其他方面不适宜的。所述盐用无机酸如盐酸、氢溴酸、硫酸、硝酸、磷酸,特别是盐酸,以及有机酸如乙酸、丙酸、羟基乙酸、丙酮酸、草酸、马来酸、丙二酸、琥珀酸、富马酸、酒石酸、柠檬酸、苯甲酸、肉桂酸、扁桃酸、甲磺酸、乙磺酸、对甲苯磺酸、水杨酸、n-乙酰基半胱氨酸形成。此外,这些盐可以通过将无机碱或有机碱加入游离酸而制备。得自无机碱的盐包括,但是不限于,钠、钾、锂、铵、钙、镁盐。得自有机碱的盐包括,但是不限于以下物质的盐:伯、仲和叔胺,取代的胺,包括天然存在的取代的胺、环状胺和碱性离子交换树脂,如异丙胺、三甲胺、二乙胺、三乙胺、三丙胺、乙醇胺、赖氨酸、精氨酸、n-乙基哌啶、哌啶、聚胺树脂。式(i)的化合物也可以以两性离子的形式存在。特别优选的式(i)的化合物的药用盐是盐酸、氢溴酸、硫酸、磷酸和甲磺酸的盐。
[0037]
如果原料之一或式(i)化合物含有一个或多个在一个或多个反应步骤的反应条件下不稳定或具有反应性的官能团,则可以应用本领域公知的方法在关键步骤之前引入合适的保护基(如例如t.w.greene和p.g.m.wuts在“protective groups in organic chemistry”,第3版,1999,wiley,new york中所述)。这样的保护基可以在合成的稍后阶段使用文献中所述的标准方法除去。保护基的实例是叔丁氧羰基(boc),氨基甲酸9-芴基甲酯(fmoc),氨基甲酸2-三甲基甲硅烷基乙酯(teoc),苄氧羰基(cbz)和对甲氧基苄氧基羰基(moz)。
[0038]
式(i)化合物可以含有几个不对称中心,并且其存在形式可以是光学纯对映异构体,对映异构体的混合物,如例如外消旋物,非对映异构体的混合物,非对映异构体外消旋物或非对映异构体外消旋物的混合物。
[0039]
术语“不对称碳原子”表示具有四个不同取代基的碳原子。根据cahn-ingold-prelog协定,不对称碳原子可以为“r”或“s”构型。
[0040]
本发明特别涉及:
[0041]
根据本发明的一种化合物,其中r
1
是甲氧基氮杂环丁基、二氟氮杂环丁基或吡咯
烷基。
[0042]
根据本发明的一种化合物,其中r
2
和r
3
独立地选自氢、乙基和丁基。
[0043]
根据本发明的一种化合物,其中r
2
和r
3
同时都是乙基,或者r
2
和r
3
中的一个是氢而另一个是丁基。
[0044]
根据本发明的一种化合物,其中a
1
是-ch-。
[0045]
根据本发明的一种化合物,其中x是氟;和
[0046]
根据本发明的一种化合物,其中n是1、2或3。
[0047]
本发明还涉及式(i)的化合物,其选自:
[0048]
2-{[6-(环丙基甲氧基)-5-(3-甲氧基氮杂环丁-1-基)吡啶-2-羰基]氨基}-2-乙基丁酸氟甲酯;
[0049]
2-{[6-(环丙基甲氧基)-5-(3-甲氧基氮杂环丁-1-基)吡啶-2-羰基]氨基}-2-乙基丁酸2-氟乙酯;
[0050]
2-{[6-(环丙基甲氧基)-5-(3-甲氧基氮杂环丁-1-基)吡啶-2-羰基]氨基}-2-乙基丁酸3-氟丙酯;
[0051]
2-{[6-(环丙基甲氧基)-5-(3,3-二氟氮杂环丁-1-基)吡啶-2-羰基]氨基}-2-乙基丁酸氟甲酯;
[0052]
2-{[6-(环丙基甲氧基)-5-(3,3-二氟氮杂环丁-1-基)吡啶-2-羰基]氨基}-2-乙基丁酸2-氟乙酯;
[0053]
2-{[6-(环丙基甲氧基)-5-(3,3-二氟氮杂环丁-1-基)吡啶-2-羰基]氨基}-2-乙基丁酸3-氟丙酯;
[0054]
2-{[6-(环丙基甲氧基)-5-(吡咯烷-1-基)吡啶-2-羰基]氨基}-2-乙基丁酸3-氟丙酯;
[0055]
2-{[6-(环丙基甲氧基)-5-(吡咯烷-1-基)吡啶-2-羰基]氨基}-2-乙基丁酸氟甲酯;
[0056]
2-{[6-(环丙基甲氧基)-5-(吡咯烷-1-基)吡啶-2-羰基]氨基}-2-乙基丁酸2-氟乙酯;
[0057]
n-[6-(环丙基甲氧基)-5-(3-甲氧基氮杂环丁-1-基)吡啶-2-羰基]-l-亮氨酸氟甲酯;
[0058]
n-[6-(环丙基甲氧基)-5-(3-甲氧基氮杂环丁-1-基)吡啶-2-羰基]-l-亮氨酸2-氟乙酯;
[0059]
n-[6-(环丙基甲氧基)-5-(3-甲氧基氮杂环丁-1-基)吡啶-2-羰基]-l-亮氨酸3-氟丙酯;
[0060]
n-[6-(环丙基甲氧基)-5-(吡咯烷-1-基)吡啶-2-羰基]-l-亮氨酸氟甲酯;
[0061]
n-[6-(环丙基甲氧基)-5-(吡咯烷-1-基)吡啶-2-羰基]-l-亮氨酸2-氟乙酯;
[0062]
n-[6-(环丙基甲氧基)-5-(吡咯烷-1-基)吡啶-2-羰基]-l-亮氨酸3-氟丙酯;
[0063]
6-(环丙基甲氧基)-n-[(2s)-1-(氟甲氧基)-4-甲基戊-2-基]-5-(吡咯烷-1-基)吡啶-2-甲酰胺;
[0064]
6-(环丙基甲氧基)-n-[(2r)-1-(2-氟乙氧基)-4-甲基戊-2-基]-5-(吡咯烷-1-基)吡啶-2-甲酰胺;
2-甲酰胺;
[0085]
6-(环丙基甲氧基)-n-{3-[(3-氟丙氧基)甲基]戊-3-基}-5-(吡咯烷-1-基)吡啶-2-甲酰胺;
[0086]
6-(环丙基甲氧基)-n-{3-[(氟甲氧基)甲基]戊-3-基}-5-(3-甲氧基氮杂环丁-1-基)吡啶-2-甲酰胺;
[0087]
6-(环丙基甲氧基)-n-{3-[(2-氟乙氧基)甲基]戊-3-基}-5-(3-甲氧基氮杂环丁-1-基)吡啶-2-甲酰胺;
[0088]
6-(环丙基甲氧基)-n-{3-[(3-氟丙氧基)甲基]戊-3-基}-5-(3-甲氧基氮杂环丁-1-基)吡啶-2-甲酰胺;
[0089]
2-{[6-(环丙基甲氧基)-5-(3-甲氧基氮杂环丁-1-基)吡嗪-2-羰基]氨基}-2-乙基丁酸氟甲酯;
[0090]
2-{[6-(环丙基甲氧基)-5-(3-甲氧基氮杂环丁-1-基)吡嗪-2-羰基]氨基}-2-乙基丁酸2-氟乙酯;
[0091]
2-{[6-(环丙基甲氧基)-5-(3-甲氧基氮杂环丁-1-基)吡嗪-2-羰基]氨基}-2-乙基丁酸3-氟丙酯;
[0092]
2-{[6-(环丙基甲氧基)-5-(3-甲氧基氮杂环丁-1-基)吡啶-2-羰基]氨基}-2-乙基丁酸氟(二氘代)甲酯;
[0093]
2-{[6-(环丙基甲氧基)-5-(3-甲氧基氮杂环丁-1-基)吡啶-2-羰基]氨基}-2-乙基丁酸2-氟(2,2-二氘代)乙酯;
[0094]
2-{[6-(环丙基甲氧基)-5-(3-甲氧基氮杂环丁-1-基)吡啶-2-羰基]氨基}-2-乙基丁酸3-氟(3,3-二氘代)丙酯;
[0095]
2-{[6-(环丙基甲氧基)-5-(3,3-二氟氮杂环丁-1-基)吡啶-2-羰基]氨基}-2-乙基丁酸氟(二氘代)甲酯;
[0096]
2-{[6-(环丙基甲氧基)-5-(3,3-二氟氮杂环丁-1-基)吡啶-2-羰基]氨基}-2-乙基丁酸2-氟(2,2-二氘代)乙酯;
[0097]
2-{[6-(环丙基甲氧基)-5-(3,3-二氟氮杂环丁-1-基)吡啶-2-羰基]氨基}-2-乙基丁酸3-氟(3,3-二氘代)丙酯;
[0098]
2-{[6-(环丙基甲氧基)-5-(吡咯烷-1-基)吡啶-2-羰基]氨基}-2-乙基丁酸3-氟(3,3-二氘代)丙酯;
[0099]
2-{[6-(环丙基甲氧基)-5-(吡咯烷-1-基)吡啶-2-羰基]氨基}-2-乙基丁酸氟(二氘代)甲酯;
[0100]
2-{[6-(环丙基甲氧基)-5-(吡咯烷-1-基)吡啶-2-羰基]氨基}-2-乙基丁酸2-氟(2,2-二氘代)乙酯;
[0101]
6-(环丙基甲氧基)-n-[(2s)-1-{[氟(二氘代)甲基]氧基}-4-甲基戊-2-基]-5-(吡咯烷-1-基)吡啶-2-甲酰胺;
[0102]
6-(环丙基甲氧基)-n-[(2s)-1-{[2-氟(2,2-二氘代)乙基]氧基}-4-甲基戊-2-基]-5-(吡咯烷-1-基)吡啶-2-甲酰胺;
[0103]
6-(环丙基甲氧基)-n-[(2s)-1-{[3-氟(3,3-二氘代)丙基]氧基}-4-甲基戊-2-基]-5-(吡咯烷-1-基)吡啶-2-甲酰胺;
(3-甲氧基氮杂环丁-1-基)吡啶-2-甲酰胺;
[0124]
2-{[6-(环丙基甲氧基)-5-(3-甲氧基氮杂环丁-1-基)吡啶-2-羰基]氨基}-2-乙基-4-氟(4,4-二氘代)丁酸乙酯;
[0125]
2-{[6-(环丙基甲氧基)-5-(3-甲氧基氮杂环丁-1-基)吡啶-2-羰基]氨基}-2-乙基-4-氟(4,4-二氘代)丁酸乙酯;
[0126]
6-(环丙基甲氧基)-5-(3-氟-3-甲基氮杂环丁-1-基)-n-(3-(3-氟丙基氨基甲酰基)戊-3-基)吡啶酰胺;
[0127]
2-{[6-(环丙基甲氧基)-5-(3-甲氧基氮杂环丁-1-基)吡啶-2-羰基]氨基}-2-乙基-4-氟丁酸乙酯;
[0128]
2-{[6-(环丙基甲氧基)-5-(3-甲氧基氮杂环丁-1-基)吡啶-2-羰基]氨基}-2-乙基-3-氟丁酸乙酯;
[0129]
2-{[6-(环丙基甲氧基)-5-(3-甲氧基氮杂环丁-1-基)吡啶-2-羰基]氨基}-2-乙基-4-氟丁酸乙酯;和
[0130]
2-{[6-(环丙基甲氧基)-5-(3-甲氧基氮杂环丁-1-基)吡啶-2-羰基]氨基}-2-乙基-3-氟丁酸乙酯。
[0131]
本发明还涉及根据本发明的化合物,其选自:
[0132]
2-{[6-(环丙基甲氧基)-5-(3-甲氧基氮杂环丁-1-基)吡啶-2-羰基]氨基}-2-乙基丁酸2-氟乙酯;
[0133]
2-{[6-(环丙基甲氧基)-5-(3-甲氧基氮杂环丁-1-基)吡啶-2-羰基]氨基}-2-乙基丁酸3-氟丙酯;
[0134]
n-[6-(环丙基甲氧基)-5-(3-甲氧基氮杂环丁-1-基)吡啶-2-羰基]-l-亮氨酸2-氟乙酯;
[0135]
n-[6-(环丙基甲氧基)-5-(吡咯烷-1-基)吡啶-2-羰基]-l-亮氨酸2-氟乙酯;
[0136]
6-(环丙基甲氧基)-n-[(2s)-1-(氟甲氧基)-4-甲基戊-2-基]-5-(吡咯烷-1-基)吡啶-2-甲酰胺;
[0137]
6-(环丙基甲氧基)-n-[(2s)-1-(2-氟乙氧基)-4-甲基戊-2-基]-5-(吡咯烷-1-基)吡啶-2-甲酰胺;
[0138]
6-(环丙基甲氧基)-n-[(2s)-1-(氟甲氧基)-4-甲基戊-2-基]-5-(3-甲氧基氮杂环丁-1-基)吡啶-2-甲酰胺;
[0139]
6-(环丙基甲氧基)-5-(3,3-二氟氮杂环丁-1-基)-n-[(2s)-1-(2-氟乙氧基)-4-甲基戊-2-基]吡啶-2-甲酰胺;和
[0140]
6-(环丙基甲氧基)-n-[(2s)-1-(2-氟乙氧基)-4-甲基戊-2-基]-5-(3-甲氧基氮杂环丁-1-基)吡啶-2-甲酰胺。
[0141]
本发明还特别涉及6-(环丙基甲氧基)-n-[(2s)-1-(2-氟乙氧基)-4-甲基戊-2-基]-5-(吡咯烷-1-基)吡啶-2-甲酰胺。
[0142]
具有通式结构i的化合物的合成可以例如根据以下方案实现。
[0143]
依照根据方案1的程序,化合物aa(r
’
=h、甲基、乙基、异丙基、叔丁基或另外的合适保护基,例如描述于t.w.greene等人,protective groups in organic chemistry(有机化学中的保护基),john wiley和sons inc.new york 1999,第3版)可以用作起始材料。aa
可商购获得、描述于文献或可以通过本领域技术人员合成。
[0144]
方案1
[0145][0146]
在本领域技术人员已知的条件下,通过用合适的氧化剂氧化,可以由aa制备化合物ab(步骤a),例如通过在环境温度下在二氯甲烷中用3-氯过苯甲酸处理。
[0147]
例如在没有额外溶剂的情况下或者在合适的溶剂如氯仿中,在20℃至溶剂的沸点的温度下,或者通过使用文献中已知的其他条件,通过用磷酰三氯或磷酰三溴处理,可以实现化合物ab向6-氯或6-溴-甲基吡啶ac(x=cl、br)的转化(步骤b)。
[0148]
在碱例如氢化钠的存在下,在有或没有惰性溶剂例如二甲基甲酰胺的情况下,在室温至溶剂的回流温度范围内的温度下,特别是在室温下,通过与合适的取代伯醇或仲醇ad如环丙基甲醇反应,6-氯-或溴-甲基吡啶ac(x=cl、br)可以转化为化合物ae(步骤c)。
[0149]
通过本领域技术人员熟知的方法
–
使用例如含水lioh、naoh或koh在四氢呋喃/乙醇或者另外的合适溶剂中,在0℃至所采用溶剂的回流温度的温度下-通式ae(r
’
≠h)的酯的皂化,得到通式ii的酸ii(步骤d)。
[0150]
通过合适的酰胺键形成反应,化合物i(r”=环丙基甲基氧基)可以由ii和相应的式iii的胺制备(步骤e)。这些反应在本领域是已知的。例如,可以采用偶联剂如n,n
’-
羰基-二咪唑(cdi)、n,n
’-
二环己基碳二亚胺(dcc)、1-(3-二甲基氨基丙基)-3-乙基碳二亚胺盐酸盐(edci)、1-[双(二甲基氨基)-亚甲基]-1h-1,2,3-三唑并[4,5-b]吡啶-3-氧化物六氟磷酸盐(hatu)、1-羟基-1,2,3-苯并三唑(hobt)、o-苯并三唑-1-基-n,n,n
’
,n
’-
四甲基脲四氟硼酸盐(tbtu)和o-苯并三唑-n,n,n
’
,n
’-
四甲基-脲-六氟-磷酸盐(hbtu)来实现这样的转化。一种方便的方法是例如在惰性溶剂如例如二甲基甲酰胺中,在室温下,使用hbtu和碱,例如n-甲基吗啉。
[0151]
备选地,化合物ac(r
’
=甲基、乙基、异丙基、叔丁基或另外的合适保护基,例如描述于t.w.greene等人,protective groups in organic chemistry(有机化学中的保护基),john wiley和sons inc.new york 1999,第3版的保护基)可以:i)如步骤d中所述转化为其酸同类物ac(r
’
=h);ii)如步骤e中所述通过用胺iii处理而转化为相应的酰胺;和iii)如步骤c中所述与醇ad反应而得到化合物i。
[0152]
胺iii和醇ad可商购获得、描述于文献、可以由本领域技术人员或如实验部分中所
述合成。
[0153]
如果起始材料式aa、ad或iii的化合物中的一种含有一个或多个在一个或多个反应步骤的反应条件下不稳定或具有反应性的官能团,则可以利用本领域公知方法在关键步骤之前引入适当的保护基团(p)(如例如描述于t.w.greene等人,protective groups in organic chemistry(有机化学中的保护基),john wiley和sons inc.new york 1999,第3版)。这样的保护基团可以在合成的较后阶段使用本领域中已知的标准方法去除。
[0154]
如果式aa至ae、ad、ii或iii的一种或多种化合物含有手性中心,则可以作为非对映异构体或对映异构体的混合物获得式i的甲基吡啶,其可以通过本领域中公知的方法,例如(手性)hplc或结晶来分离。外消旋化合物可以例如经由非对映异构体盐通过结晶或通过特定色谱方法,使用手性吸附剂或手性洗脱剂分离对映体而分离为其对映体。
[0155]
依照根据方案2的程序,化合物ba(r
’
=h、甲基、乙基、异丙基、叔丁基或另外的合适保护基,例如描述于t.w.greene等人,protective groups in organic chemistry(有机化学中的保护基),john wiley和sons inc.new york 1999,第3版的保护基)可以用作起始材料。ba商购可得(例如,对于r
’
=甲基:5-溴-6-氯-吡啶-2-甲酸甲酯can1214353-79-3)、描述于文献或可以通过本领域技术人员合成。
[0156]
方案2
[0157][0158]
通过本领域技术人员熟知的方法,例如使用钯催化剂如三(二亚苄基丙酮)二钯/二甲基双二苯基-膦基夹氧杂蒽(phosphinoxanthene)和碱如碳酸铯,在溶剂如1,4-二烷中,优先地在溶剂的沸点下,通过与胺bb(m是h)偶联,可以由ba制备化合物ac
’
(步骤a)。
[0159]
通过以下方式,化合物ac
’
可以进一步转化为化合物i(r”=环丙基甲基氧基):i)如方案1的步骤c中所述,与化合物ad反应而形成化合物ae;ii)如方案1的步骤d中所述的皂化;和iii)如方案1的步骤e中所述的酰胺键形成。
[0160]
此外,如方案1的步骤c中所述,通过用化合物ad处理,化合物ba可以转化为化合物
bc(步骤b)。
[0161]
如对于ba转化为ac
’
(步骤a)所述及的,可以实现随后化合物bc向化合物ae的转化。
[0162]
通过以下方式,化合物ae可以进一步转化为化合物i(r”=环丙基甲基氧基):i)如方案1的步骤d中所述的皂化;ii)如方案1的步骤e中所述的酰胺键形成。
[0163]
备选地,化合物bc(r
’
=甲基、乙基、异丙基、叔丁基或另外的合适保护基,例如描述于t.w.greene等人,protective groups in organic chemistry(有机化学中的保护基),john wiley和sons inc.new york 1999,第3版的保护基)可以:i)如方案1的步骤d中所述转化为其酸同类物bc(r
’
=h);ii)如方案1的步骤e中所述通过用胺iii处理而转化为相应的酰胺bd;和iii)如步骤a中所述与bb反应而得到化合物i(r”=环丙基甲基氧基)。
[0164]
此外,采用以下反应顺序,也可以合成化合物i:i)如方案1的步骤d中所述,化合物ba(r
’
=甲基、乙基、异丙基、叔丁基或另外的合适保护基,例如描述于t.w.greene等人,protective groups in organic chemistry(有机化学中的保护基),john wiley和sons inc.new york 1999,第3版的保护基)皂化为其酸同类物ba(r
’
=h);ii)如方案1的步骤e中所述通过用胺iii处理而转化为相应的酰胺;iii)如步骤a中所述与bb反应;和iv)如步骤b中所述与化合物ad反应。任选地,步骤iii)和步骤iv)可以互换。
[0165]
如果起始材料式ca、cb或bc的化合物中的一种含有一个或多个在一个或多个反应步骤的反应条件下不稳定或具有反应性的官能团,则可以利用本领域公知方法在关键步骤之前引入适当的保护基团(p)(如例如描述于t.w.greene等人,protective groups in organic chemistry(有机化学中的保护基),john wiley和sons inc.new york 1999,第3版)。这样的保护基团可以在合成的较后阶段使用本领域中已知的标准方法去除。
[0166]
如果式ba、bb或ad的一种或多种化合物含有手性中心,则式ac
’
和ae的甲基吡啶可以以非对映异构体或对映异构体的混合物获得,其可以通过本领域中公知的方法,例如(手性)hplc或结晶来分离。外消旋化合物可以例如经由非对映异构体盐通过结晶或通过特定色谱方法,使用手性吸附剂或手性洗脱剂分离对映体而分离为其对映体。
[0167]
本发明还涉及用于制备式(i)的化合物的方法,其包括以下步骤中的一个:
[0168]
(a)使式(a)的化合物
[0169][0170]
在r
1-h、钯催化剂和碱的存在下反应;
[0171]
(b)使式(b)的化合物
[0172]
[0173]
在nh
2-c(r
2
r
3
)-a
2-o-(ch
2
)
n-(cd
2
)
m-x、偶联剂和碱的存在下反应;
[0174]
其中a
1
、a
2
、x、r
1-r
3
、m和n如上所定义,并且y是卤素。
[0175]
步骤(b)的偶联剂方便地是酰胺键形成剂,如例如n,n
’-
羰基-二咪唑(cdi)、n,n
’-
二环己基碳二亚胺(dcc)、1-(3-二甲基氨基丙基)-3-乙基碳二亚胺盐酸盐(edci)、1-[双(二甲基氨基)-亚甲基]-1h-1,2,3-三唑并[4,5-b]吡啶-3-氧化物六氟磷酸盐(hatu)、1-羟基-1,2,3-苯并三唑(hobt)、o-苯并三唑-1-基-n,n,n
’
,n
’-
四甲基脲四氟硼酸盐(tbtu)和o-苯并三唑-n,n,n
’
,n
’-
四甲基-脲-六氟-磷酸盐(hbtu)。
[0176]
n-甲基吗啉是方便用于步骤(b)的碱。
[0177]
在步骤(b)中,hbtu可以有利地与n-甲基吗啉组合使用。
[0178]
步骤(b)的溶剂可以有利地是二甲基甲酰胺。
[0179]
在步骤(a)中,钯催化剂可以例如是三(二亚苄基丙酮)二钯/二甲基双二苯基-膦基夹氧杂蒽。
[0180]
在步骤(a)中,碱可以是例如碳酸铯。
[0181]
在步骤(a)中,溶剂有利地是1,4-二烷。
[0182]
在步骤(a)中,y可以方便地是溴。
[0183]
本发明还涉及通过根据本发明的方法制备的根据本发明的化合物。
[0184]
本发明的另一实施方案提供药物组合物或药物,其包含本发明的化合物和治疗惰性载体、稀释剂或赋形剂,以及使用本发明的化合物制备这种组合物和药物的方法。在一个实例中,式(i)化合物可以通过在环境温度在合适的ph,并以期望的纯度程度,与生理学上可接受的载体即在所采用的剂量和浓度对接受者无毒的载体混合成盖仑给药形式。制剂的ph主要取决于具体的用途和化合物的浓度,但是优选在约3至约8范围内的任意处。在一个实例中,将式(i)化合物在乙酸盐缓冲液中在ph 5配制。在另一个实施方案中,式(i)化合物是无菌的。可以将化合物例如作为固体或无定形组合物,作为冻干的制剂或作为水溶液储存。
[0185]
以与良好医疗实践相一致的方式将组合物配制,定剂量,和给药。在这方面要考虑的因素包括所治疗的具体病症,所治疗的具体哺乳动物,个体患者的临床状况,病症的原因,药剂的输送位置,给药方法,给药的时间安排,和执业医师已知的其他因素。
[0186]
本发明的化合物可以通过任何合适的方式给药,包括口服、局部(包括经颊和舌下)、直肠、阴道、经皮、肠胃外、皮下、腹膜内、肺内、皮内、鞘内和硬膜外和鼻内,并且,如果需要局部治疗,则病灶内给药。肠胃外输液包括肌肉内、静脉内、动脉内、腹膜内或皮下给药。
[0187]
本发明的化合物可以以任何方便的给药形式给药,例如,片剂、散剂、胶囊、溶液剂、分散剂、混悬剂、糖浆剂、喷雾剂、栓剂、凝胶、乳剂、贴剂等。这样的组合物可以含有药物制剂中的常规组分,例如,稀释剂、载体、ph调节剂、甜味剂、填充剂及其他活性剂。
[0188]
典型的制剂通过混合本发明的化合物和载体或赋形剂来制备。合适的载体和赋形剂是本领域技术人员公知的并详述于,例如,ansel,howard c.等,ansel
’
s pharmaceutical dosage forms and drug delivery systems(ansel的药物剂型和药物输送系统).philadelphia:lippincott,williams&wilkins,2004;gennaro,alfonso r.,等
remington:the science and practice of pharmacy(药学的科学与实践).philadelphia:lippincott,williams&wilkins,2000;和rowe,raymond c.handbook of pharmaceutical excipients(药品辅料手册).chicago,pharmaceutical press,2005中。制剂还可以包括一种或多种缓冲剂、稳定剂、表面活性剂、润湿剂、润滑剂、乳化剂、助悬剂、防腐剂、抗氧化剂、遮光剂(opaquing agent)、助流剂、加工助剂、着色剂、甜味剂、芳香剂、增味剂、稀释剂及其他已知添加剂,以提供药物(即,本发明的化合物或其药物组合物)的精致呈现或协助制备药物产品(即,药品)。
[0189]
本发明还特别涉及:
[0190]
式(i)的化合物用于治疗或预防疼痛、动脉粥样硬化、老年性黄斑变性、糖尿病性视网膜病变、青光眼、糖尿病、炎症、炎性肠病、缺血-再灌注损伤、急性肝功能衰竭、肝纤维化、肺纤维化、肾纤维化、系统性纤维化、急性同种异体移植排斥、慢性同种异体移植肾病、糖尿病性肾病、肾小球性肾病、心肌病、心力衰竭、心肌缺血、心肌梗死、系统性硬化病、热伤、烧伤、增生性瘢痕、瘢痕瘤、牙龈炎发热、肝硬化或肿瘤、骨量调节、神经变性、卒中、暂时性局部缺血发作或葡萄膜炎的用途;
[0191]
根据式(i)的化合物用于制备药物的用途,所述药物用于治疗或预防疼痛、动脉粥样硬化、老年性黄斑变性、糖尿病性视网膜病变、青光眼、糖尿病、炎症、炎性肠病、缺血-再灌注损伤、急性肝功能衰竭、肝纤维化、肺纤维化、肾纤维化、系统性纤维化、急性同种异体移植排斥、慢性同种异体移植肾病、糖尿病性肾病、肾小球性肾病、心肌病、心力衰竭、心肌缺血、心肌梗死、系统性硬化病、热伤、烧伤、增生性瘢痕、瘢痕瘤、牙龈炎发热、肝硬化或肿瘤、骨量调节、神经变性、卒中、暂时性局部缺血发作或葡萄膜炎;
[0192]
一种式(i)的化合物,其用于治疗或预防疼痛、动脉粥样硬化、老年性黄斑变性、糖尿病性视网膜病变、青光眼、糖尿病、炎症、炎性肠病、缺血-再灌注损伤、急性肝功能衰竭、肝纤维化、肺纤维化、肾纤维化、系统性纤维化、急性同种异体移植排斥、慢性同种异体移植肾病、糖尿病性肾病、肾小球性肾病、心肌病、心力衰竭、心肌缺血、心肌梗死、系统性硬化病、热伤、烧伤、增生性瘢痕、瘢痕瘤、牙龈炎发热、肝硬化或肿瘤、骨量调节、神经变性、卒中、暂时性局部缺血发作或葡萄膜炎;和
[0193]
一种用于治疗或预防疼痛、动脉粥样硬化、老年性黄斑变性、糖尿病性视网膜病变、青光眼、糖尿病、炎症、炎性肠病、缺血-再灌注损伤、急性肝功能衰竭、肝纤维化、肺纤维化、肾纤维化、系统性纤维化、急性同种异体移植排斥、慢性同种异体移植肾病、糖尿病性肾病、肾小球性肾病、心肌病、心力衰竭、心肌缺血、心肌梗死、系统性硬化病、热伤、烧伤、增生性瘢痕、瘢痕瘤、牙龈炎发热、肝硬化或肿瘤、骨量调节、神经变性、卒中、暂时性局部缺血发作或葡萄膜炎的方法,所述方法包括向有需要的患者施用有效量的式(i)的化合物。
[0194]
本发明特别涉及一种式(i)的化合物,其用于治疗或预防缺血、再灌注损伤、肝纤维化或肾纤维化,特别是缺血或再灌注损伤。
[0195]
现在将通过以下实施例描述本发明,所述实施例不具有限制特性。
实施例
[0196]
缩写
[0197]
can=化学文摘服务编号;dipea=n-乙基-n-异丙基丙-2-胺;dmf=二甲基甲酰
胺;etoac=乙酸乙酯;hept.=庚烷;hplc=lc=高效液相色谱;isp=离子喷射,对应于esi(电喷射);ms=质谱;nmr数据以相对于内标物四甲基硅烷的百万分一为单位(δ)报告,并且参比来自样品溶剂(d
6-dmso,除非另有说明)的氘锁场信号;偶合常数(j)以赫兹(hertz)记;rt=室温;tbtu=o-(苯并三唑-1-基)-n,n,n
’
,n
’-
四甲基-脲-四氟硼酸盐;thf=四氢呋喃;tlc=薄层色谱。
[0198]
实施例1
[0199]
2-{[6-(环丙基甲氧基)-5-(3-甲氧基氮杂环丁-1-基)吡啶-2-羰基]氨基}-2-乙基丁酸氟甲酯
[0200][0201]
a)2-(6-(环丙基甲氧基)-5-(3-甲氧基氮杂环丁-1-基)吡啶酰胺基)-2-乙基丁酸
[0202][0203]
在25ml圆底烧瓶中,将2-(6-(环丙基甲氧基)-5-(3-甲氧基氮杂环丁-1-基)吡啶酰胺基)-2-乙基丁酸乙酯(can 1778678-14-0,210mg,501μmol,eq:1)与thf(3ml)和meoh(3.3ml)合并,得到无色溶液。加入溶解在水(3ml)中的koh(140mg,2.5mmol,eq:5)并将反应混合物在100℃搅拌19h。加入koh(75mg)和1ml thf、meoh和水并继续在100℃搅拌3h。将有机溶剂在减压下除去并将水相酸化(1n hcl)。所得的白色悬浮液用etoac(3x 25ml)萃取。合并的有机层用盐水(1x 20ml)洗涤,用na
2
so
4
干燥并在真空中浓缩,得到粗制标题化合物,为浅褐色油状物,将在未经进一步纯化下用于下一步骤,ms(isp):392.314[mh
+
]。
[0204]
b)2-{[6-(环丙基甲氧基)-5-(3-甲氧基氮杂环丁-1-基)吡啶-2-羰基]氨基}-2-乙基丁酸氟甲酯
[0205]
在10ml圆底烧瓶中,将2-(6-(环丙基甲氧基)-5-(3-甲氧基氮杂环丁-1-基)吡啶酰胺基)-2-乙基丁酸(37mg,94.5μmol,eq:1)与dmf(500μl)合并,得到浅褐色溶液。加入k
2
co
3
(65.3mg,473μmol,eq:5)和氟-碘-甲烷(76.3mg,32.2μl,473μmol,eq:5)。将反应混合物在室温搅拌30min,用etoac稀释并用饱和nacl(3x 10ml)洗涤。有机层用na
2
so
4
干燥并在真空中浓缩。粗产物通过柱色谱(sio
2
,5g,hept./etoac)纯化,得到标题化合物(27mg,68%),为无色油状物,ms(isp):424.341[mh
+
]。
[0206]
实施例2
[0207]
2-{[6-(环丙基甲氧基)-5-(3-甲氧基氮杂环丁-1-基)吡啶-2-羰基]氨基}-2-乙
基丁酸2-氟乙酯
[0208][0209]
类似于实施例1b中所描述的程序,使2-(6-(环丙基甲氧基)-5-(3-甲氧基氮杂环丁-1-基)吡啶酰胺基)-2-乙基丁酸(实施例1a)与氟-碘-甲烷反应,得到标题化合物,为无色油状物,ms(isp):438.346[mh
+
]。
[0210]
实施例3
[0211]
2-{[6-(环丙基甲氧基)-5-(3-甲氧基氮杂环丁-1-基)吡啶-2-羰基]氨基}-2-乙基丁酸3-氟丙酯
[0212][0213]
类似于实施例1b中所描述的程序,使2-(6-(环丙基甲氧基)-5-(3-甲氧基氮杂环丁-1-基)吡啶酰胺基)-2-乙基丁酸(实施例1a)与1-碘-3-氟丙烷反应,得到标题化合物,为无色油状物,ms(isp):452.4[mh
+
]。
[0214]
实施例4
[0215]
2-{[6-(环丙基甲氧基)-5-(3,3-二氟氮杂环丁-1-基)吡啶-2-羰基]氨基}-2-乙基丁酸氟甲酯
[0216][0217]
类似于实施例1b中所描述的程序,使2-(6-(环丙基甲氧基)-5-(3,3-二氟氮杂环丁-1-基)吡啶酰胺基)-2-乙基丁酸(can 1415896-50-2)与氟-碘-甲烷反应,得到标题化合物,为无色油状物,lc-ms(uv峰面积/esi)100%,430.1952[mh
+
]。
[0218]
实施例5
[0219]
2-{[6-(环丙基甲氧基)-5-(3,3-二氟氮杂环丁-1-基)吡啶-2-羰基]氨基}-2-乙基丁酸2-氟乙酯
[0220][0221]
类似于实施例1b中所描述的程序,使2-(6-(环丙基甲氧基)-5-(3,3-二氟氮杂环丁-1-基)吡啶酰胺基)-2-乙基丁酸(can 1415896-50-2)与氟-碘-乙烷反应,得到标题化合物,为无色油状物,lc-ms(uv峰面积/esi)100%,444.2109[mh
+
]。
[0222]
实施例6
[0223]
2-{[6-(环丙基甲氧基)-5-(3,3-二氟氮杂环丁-1-基)吡啶-2-羰基]氨基}-2-乙基丁酸3-氟丙酯
[0224][0225]
类似于实施例1b中所描述的程序,使2-(6-(环丙基甲氧基)-5-(3,3-二氟氮杂环丁-1-基)吡啶酰胺基)-2-乙基丁酸(can 1415896-50-2)与1-碘-3-氟丙烷反应,得到标题化合物,为无色油状物,lc-ms(uv峰面积/esi)100%,458.2263[mh
+
]。
[0226]
实施例7
[0227]
2-{[6-(环丙基甲氧基)-5-(吡咯烷-1-基)吡啶-2-羰基]氨基}-2-乙基丁酸3-氟丙酯
[0228][0229]
类似于实施例1b中所描述的程序,使2-(6-(环丙基甲氧基)-5-(吡咯烷-1-基)吡啶酰胺基)-2-乙基丁酸(can 1415897-34-5)与1-碘-3-氟丙烷反应,得到标题化合物,为无色油状物,lc-ms(uv峰面积/esi)98%,436.2615[mh
+
]。
[0230]
实施例8
[0231]
2-{[6-(环丙基甲氧基)-5-(吡咯烷-1-基)吡啶-2-羰基]氨基}-2-乙基丁酸氟甲酯
[0232][0233]
类似于实施例1b中所描述的程序,使2-(6-(环丙基甲氧基)-5-(吡咯烷-1-基)吡啶酰胺基)-2-乙基丁酸(can 1415897-34-5)与氟-碘-甲烷反应,得到标题化合物,为无色油状物,lc-ms(uv峰面积/esi)96%,408.2301[mh+]。
[0234]
实施例9
[0235]
2-{[6-(环丙基甲氧基)-5-(吡咯烷-1-基)吡啶-2-羰基]氨基}-2-乙基丁酸2-氟乙酯
[0236][0237]
类似于实施例1b中所描述的程序,使2-(6-(环丙基甲氧基)-5-(吡咯烷-1-基)吡啶酰胺基)-2-乙基丁酸(can 1415897-34-5)与氟-碘-乙烷反应,得到标题化合物,为无色油状物,lc-ms(uv峰面积/esi)97%,422.2463[mh+]。
[0238]
实施例10
[0239]
n-[6-(环丙基甲氧基)-5-(3-甲氧基氮杂环丁-1-基)吡啶-2-羰基]-l-亮氨酸氟甲酯
[0240][0241]
a)(s)-2-(5-溴-6-(环丙基甲氧基)吡啶酰胺基)-4-甲基戊酸甲酯
[0242][0243]
在100ml圆底烧瓶中,将5-溴-6-(环丙基甲氧基)吡啶甲酸(can1415898-37-1,850mg,3.12mmol,eq:1)与dmf(15ml)合并,得到浅黄色溶液。加入tbtu(1.1g,3.44mmol,eq:1.1)、dipea(1.61g,2.18ml,12.5mmol,eq:4)和l-亮氨酸甲酯盐酸盐(can 7517-19-3,
794mg,4.37mmol,eq:1.4)并将混合物在室温搅拌30min。将溶剂在减压下除去并将剩余物溶解在etoac中。将有机层合并,用饱和nahco
3
(3x 20ml)、1m hcl(3x 20ml)和饱和nacl(3x 20ml)洗涤。有机层用na
2
so
4
干燥并在真空中浓缩,得到粗标题产物(1.1g,88%),为浅褐色油状物,将其在未经进一步纯化下用于下一反应步骤,ms(isp):399.162[mh
+
]。
[0244]
b)(s)-2-(6-(环丙基甲氧基)-5-(3-甲氧基氮杂环丁-1-基)吡啶酰胺基)-4-甲基戊酸甲酯
[0245][0246]
在20ml密封试管中,将(s)-2-(5-溴-6-(环丙基甲氧基)吡啶酰胺基)-4-甲基戊酸甲酯(385mg,964μmol,eq:1)与甲苯(10ml)合并,得到无色溶液。加入3-甲氧基氮杂环丁烷盐酸盐(can 148644-09-1,179mg,1.45mmol,eq:1.5)和cs
2
co
3
(943mg,2.89mmol,eq:3)。外消旋-2,2
′-
二(二苯基膦基)-1,1
′-
联萘(120mg,193μmol,eq:0.2)和乙酸钯(ii)(43.3mg,193μmol,eq:0.2)。将白色悬浮液加热至110℃持续1h,用etoac稀释并通过硅藻土过滤。将有机层合并,用1m hcl(3x 50ml)和饱和nacl(1x100ml)洗涤。有机层用na
2
so
4
干燥并在真空中浓缩。粗产物通过柱色谱(sio
2
,50g,hept./etoac)纯化,得到标题化合物(287mg,73%),为浅黄色油状物,ms(isp):406.319[mh
+
]。
[0247]
c)(s)-2-(6-(环丙基甲氧基)-5-(3-甲氧基氮杂环丁-1-基)吡啶酰胺基)-4-甲基戊酸
[0248][0249]
在25ml圆底烧瓶中,将(s)-2-(6-(环丙基甲氧基)-5-(3-甲氧基氮杂环丁-1-基)吡啶酰胺基)-4-甲基戊酸甲酯(270mg,666μmol,eq:1)与thf(2ml)、水(2ml)和meoh(2ml)合并,得到浅黄色溶液。加入koh(112mg,2mmol,eq:3)并将混合物在室温搅拌1h。将有机溶剂在减压下除去。将水相用1m hcl调节至ph 2并用etoac(3x 20ml)和盐水(1x 25ml)萃取。有机层用na
2
so
4
干燥并在真空中浓缩,得到粗制标题化合物(定量),为浅褐色油状物,将其在未经进一步纯化下用于下一反应步骤,ms(isp):392.316[mh
+
]。
[0250]
d)n-[6-(环丙基甲氧基)-5-(3-甲氧基氮杂环丁-1-基)吡啶-2-羰基]-l-亮氨酸氟甲酯
[0251]
类似于实施例1b中所描述的程序,使(s)-2-(6-(环丙基甲氧基)-5-(3-甲氧基氮
杂环丁-1-基)吡啶酰胺基)-4-甲基戊酸与氟-碘-甲烷反应,得到标题化合物,为无色油状物,ms(isp):424.289[mh
+
]。
[0252]
实施例11
[0253]
n-[6-(环丙基甲氧基)-5-(3-甲氧基氮杂环丁-1-基)吡啶-2-羰基]-l-亮氨酸2-氟乙酯
[0254][0255]
类似于实施例1b中所描述的程序,使(s)-2-(6-(环丙基甲氧基)-5-(3-甲氧基氮杂环丁-1-基)吡啶酰胺基)-4-甲基戊酸(实施例10c)与氟-碘-乙烷反应,得到标题化合物,为无色油状物,ms(isp):438.294[mh
+
]。
[0256]
实施例12
[0257]
n-[6-(环丙基甲氧基)-5-(3-甲氧基氮杂环丁-1-基)吡啶-2-羰基]-l-亮氨酸3-氟丙酯
[0258][0259]
类似于实施例1b中所描述的程序,使(s)-2-(6-(环丙基甲氧基)-5-(3-甲氧基氮杂环丁-1-基)吡啶酰胺基)-4-甲基戊酸(实施例10c)与1-氟-3-碘丙烷反应,得到标题化合物,为无色油状物,ms(isp):452.351[mh
+
]。
[0260]
实施例13
[0261]
n-[6-(环丙基甲氧基)-5-(吡咯烷-1-基)吡啶-2-羰基]-l-亮氨酸氟甲酯
[0262][0263]
a)(s)-2-(6-(环丙基甲氧基)-5-(吡咯烷-1-基)吡啶酰胺基)-4-甲基戊酸甲酯
[0264][0265]
类似于实施例10b中所描述的程序,使(s)-2-(5-溴-6-(环丙基甲氧基)吡啶酰胺基)-4-甲基戊酸甲酯(实施例10a)与吡咯烷反应,得到标题化合物,为浅黄色油状物,lc-ms(uv峰面积/esi)95%,390.2403[mh
+
]。
[0266]
b)(s)-2-(6-(环丙基甲氧基)-5-(吡咯烷-1-基)吡啶酰胺基)-4-甲基戊酸
[0267][0268]
类似于实施例10c中所描述的程序,将(s)-2-(6-(环丙基甲氧基)-5-(吡咯烷-1-基)吡啶酰胺基)-4-甲基戊酸甲酯用koh水解,得到标题化合物,为褐色油状物,将其在未经进一步纯化下用于下一反应步骤,ms(isp):376.307[mh
+
]。
[0269]
c)n-[6-(环丙基甲氧基)-5-(吡咯烷-1-基)吡啶-2-羰基]-l-亮氨酸氟甲酯
[0270]
类似于实施例1b中所描述的程序,使(s)-2-(6-(环丙基甲氧基)-5-(吡咯烷-1-基)吡啶酰胺基)-4-甲基戊酸与氟-碘-甲烷反应,得到标题化合物,为浅黄色油状物,ms(isp):408.276[mh
+
]。
[0271]
实施例14
[0272]
n-[6-(环丙基甲氧基)-5-(吡咯烷-1-基)吡啶-2-羰基]-l-亮氨酸2-氟乙酯
[0273][0274]
类似于实施例1b中所描述的程序,使(s)-2-(6-(环丙基甲氧基)-5-(吡咯烷-1-基)吡啶酰胺基)-4-甲基戊酸(实施例13b)与氟-碘-乙烷反应,得到标题化合物,为浅褐色油状物,ms(isp):422.332[mh
+
]。
[0275]
实施例15
[0276]
n-[6-(环丙基甲氧基)-5-(吡咯烷-1-基)吡啶-2-羰基]-l-亮氨酸3-氟丙酯
基)吡啶-2-甲酰胺
[0301][0302]
类似于实施例16中所描述的程序,使(s)-6-(环丙基甲氧基)-n-(1-羟基-3-甲基丁-2-基)-5-(吡咯烷-1-基)吡啶酰胺(实施例19a)与1-氟-2-碘乙烷反应,得到标题化合物,为无色油状物,ms(isp):394.326[mh
+
]。
[0303]
实施例21
[0304]
6-(环丙基甲氧基)-n-[(2s)-1-(3-氟丙氧基)-3-甲基丁-2-基]-5-(吡咯烷-1-基)吡啶-2-甲酰胺
[0305][0306]
类似于实施例16中所描述的程序,使(s)-6-(环丙基甲氧基)-n-(1-羟基-3-甲基丁-2-基)-5-(吡咯烷-1-基)吡啶酰胺(实施例19a)与1-碘-3-氟丙烷反应,得到标题化合物,为无色油状物,ms(isp):408.391[mh
+
]。
[0307]
实施例22
[0308]
6-(环丙基甲氧基)-n-[(2s)-1-(氟甲氧基)丙-2-基]-5-(吡咯烷-1-基)吡啶-2-甲酰胺
[0309][0310]
a)(s)-6-(环丙基甲氧基)-n-(1-羟基丙-2-基)-5-(吡咯烷-1-基)吡啶酰胺
[0311][0312]
类似于实施例19a中所描述的程序,使6-(环丙基甲氧基)-5-(吡咯烷-1-基)吡啶甲酸(can 1415898-45-1)与l-丙氨醇(can 2749-11-3)反应,得到标题化合物,为浅黄色油状物,ms(isp):320.209[mh
+
]。
[0313]
b)6-(环丙基甲氧基)-n-[(2s)-1-(氟甲氧基)丙-2-基]-5-(吡咯烷-1-基)吡啶-2-甲酰胺
[0314]
类似于实施例16中所描述的程序,使(s)-6-(环丙基甲氧基)-n-(1-羟基丙-2-基)-5-(吡咯烷-1-基)吡啶酰胺与氟-碘-甲烷反应,得到标题化合物,为无色油状物,ms(isp):352.204[mh
+
]。
[0315]
实施例23
[0316]
6-(环丙基甲氧基)-n-[(2s)-1-(2-氟乙氧基)丙-2-基]-5-(吡咯烷-1-基)吡啶-2-甲酰胺
[0317][0318]
类似于实施例16中所描述的程序,使(s)-6-(环丙基甲氧基)-n-(1-羟基丙-2-基)-5-(吡咯烷-1-基)吡啶酰胺(实施例22a)与1-氟-2-碘乙烷反应,得到标题化合物,为无色油状物,ms(isp):366.298[mh
+
]。
[0319]
实施例24
[0320]
6-(环丙基甲氧基)-n-[(2s)-1-(3-氟丙氧基)丙-2-基]-5-(吡咯烷-1-基)吡啶-2-甲酰胺
[0321][0322]
类似于实施例16中所描述的程序,使(s)-6-(环丙基甲氧基)-n-(1-羟基丙-2-基)-5-(吡咯烷-1-基)吡啶酰胺(实施例22a)与1-碘-3-氟丙烷反应,得到标题化合物,为无色油状物,ms(isp):380.265[mh
+
]。
[0323]
实施例25
[0324]
6-(环丙基甲氧基)-n-[(2s)-1-(氟甲氧基)-4-甲基戊-2-基]-5-(3-甲氧基氮杂环丁-1-基)吡啶-2-甲酰胺
[0325][0326]
a)(s)-6-(环丙基甲氧基)-n-(1-羟基-4-甲基戊-2-基)-5-(3-甲氧基氮杂环丁-1-基)吡啶酰胺
[0327][0328]
类似于实施例19a中所描述的程序,使6-(环丙基甲氧基)-5-(3-甲氧基氮杂环丁-1-基)吡啶甲酸(can 1613292-59-3)与l-亮氨醇(can 7533-40-6)反应,得到标题化合物,为浅黄色油状物,ms(isp):378.309[mh
+
]。
[0329]
b)6-(环丙基甲氧基)-n-[(2s)-1-(氟甲氧基)-4-甲基戊-2-基]-5-(3-甲氧基氮杂环丁-1-基)吡啶-2-甲酰胺
[0330]
类似于实施例16中所描述的程序,使(s)-6-(环丙基甲氧基)-n-(1-羟基-4-甲基戊-2-基)-5-(3-甲氧基氮杂环丁-1-基)吡啶酰胺与氟-碘-甲烷反应,得到标题化合物,为无色油状物,lc-ms(uv峰面积/esi)100%,380.265[mh
+
]。
[0331]
实施例26
[0332]
6-(环丙基甲氧基)-5-(3,3-二氟氮杂环丁-1-基)-n-[(2s)-1-(2-氟乙氧基)-4-甲基戊-2-基]吡啶-2-甲酰胺
[0333][0334]
a)(s)-6-(环丙基甲氧基)-5-(3,3-二氟氮杂环丁-1-基)-n-(1-羟基-4-甲基戊-2-基)吡啶酰胺
[0335][0336]
类似于实施例19a中所描述的程序,使6-(环丙基甲氧基)-5-(3,3-二氟氮杂环丁-1-基)吡啶甲酸(can 1415898-88-2)与l-亮氨醇(can 7533-40-6)反应,得到标题化合物,为浅黄色油状物,ms(isp):384.279[mh
+
]。
[0337]
b)6-(环丙基甲氧基)-5-(3,3-二氟氮杂环丁-1-基)-n-[(2s)-1-(2-氟乙氧基)-4-甲基戊-2-基]吡啶-2-甲酰胺
[0338]
类似于实施例16中所描述的程序,使(s)-6-(环丙基甲氧基)-5-(3,3-二氟氮杂环
丁-1-基)-n-(1-羟基-4-甲基戊-2-基)吡啶酰胺与1-氟-2-碘乙烷反应,得到标题化合物,为无色油状物,ms(isp):430.338.[mh
+
]。
[0339]
实施例27
[0340]
6-(环丙基甲氧基)-n-[(2s)-1-(2-氟乙氧基)-4-甲基戊-2-基]-5-(3-甲氧基氮杂环丁-1-基)吡啶-2-甲酰胺
[0341][0342]
类似于实施例16中所描述的程序,使(s)-6-(环丙基甲氧基)-n-(1-羟基-4-甲基戊-2-基)-5-(3-甲氧基氮杂环丁-1-基)吡啶酰胺(实施例25a)与1-氟-2-碘乙烷反应,得到标题化合物,为无色油状物,ms(isp):424.362[mh
+
]。
[0343]
实施例28
[0344]
6-(环丙基甲氧基)-n-[(2s)-1-(3-氟丙氧基)-4-甲基戊-2-基]-5-(3-甲氧基氮杂环丁-1-基)吡啶-2-甲酰胺
[0345][0346]
类似于实施例16中所描述的程序,使(s)-6-(环丙基甲氧基)-n-(1-羟基-4-甲基戊-2-基)-5-(3-甲氧基氮杂环丁-1-基)吡啶酰胺(实施例25a)与1-碘-3-氟丙烷反应,得到标题化合物,为无色油状物,ms(isp):438.375[mh
+
]。
[0347]
实施例29
[0348]
6-(环丙基甲氧基)-n-[(2s)-1-(氟甲氧基)-3-甲基丁-2-基]-5-(3-甲氧基氮杂环丁-1-基)吡啶-2-甲酰胺
[0349][0350]
a)(s)-6-(环丙基甲氧基)-n-(1-羟基-3-甲基丁-2-基)-5-(3-甲氧基氮杂环丁-1-基)吡啶酰胺
[0351][0352]
类似于实施例19a中所描述的程序,使6-(环丙基甲氧基)-5-(3-甲氧基氮杂环丁-1-基)吡啶甲酸(can 1613292-59-3)与l-缬氨醇(can 2026-48-4)缩合,得到标题化合物,为浅黄色油状物,ms(isp):364.252[mh
+
]。
[0353]
b)6-(环丙基甲氧基)-n-[(2s)-1-(氟甲氧基)-3-甲基丁-2-基]-5-(3-甲氧基氮杂环丁-1-基)吡啶-2-甲酰胺
[0354]
类似于实施例16中所描述的程序,使(s)-6-(环丙基甲氧基)-n-(1-羟基-3-甲基丁-2-基)-5-(3-甲氧基氮杂环丁-1-基)吡啶酰胺与氟-碘-甲烷反应,得到标题化合物,为无色油状物,ms(isp):396.3[mh
+
]。
[0355]
实施例30
[0356]
6-(环丙基甲氧基)-n-[(2s)-1-(2-氟乙氧基)-3-甲基丁-2-基]-5-(3-甲氧基氮杂环丁-1-基)吡啶-2-甲酰胺
[0357][0358]
类似于实施例16中所描述的程序,使(s)-6-(环丙基甲氧基)-n-(1-羟基-3-甲基丁-2-基)-5-(3-甲氧基氮杂环丁-1-基)吡啶酰胺(实施例29b)与1-氟-2-碘乙烷反应,得到标题化合物,为无色油状物,ms(isp):410.335[mh
+
]。
[0359]
实施例31
[0360]
6-(环丙基甲氧基)-n-[(2s)-1-(3-氟丙氧基)-3-甲基丁-2-基]-5-(3-甲氧基氮杂环丁-1-基)吡啶-2-甲酰胺
[0361][0362]
类似于实施例16中所描述的程序,使(s)-6-(环丙基甲氧基)-n-(1-羟基-3-甲基丁-2-基)-5-(3-甲氧基氮杂环丁-1-基)吡啶酰胺(实施例29b)与1-碘-3-氟丙烷反应,得到标题化合物,为无色油状物,ms(isp):424.362[mh
+
]。
[0363]
实施例32
[0364]
6-(环丙基甲氧基)-n-[(2s)-1-(2-氟乙氧基)丙-2-基]-5-(3-甲氧基氮杂环丁-1-基)吡啶-2-甲酰胺
[0365][0366]
a)6-(环丙基甲氧基)-n-[(1s)-2-羟基-1-甲基-乙基]-5-(3-甲氧基氮杂环丁-1-基)吡啶-2-甲酰胺
[0367][0368]
类似于实施例19a中所描述的程序,使6-(环丙基甲氧基)-5-(3-甲氧基氮杂环丁-1-基)吡啶甲酸(can 1613292-59-3)与l-丙氨醇(can 2749-11-3)缩合,得到标题化合物,为浅黄色油状物,ms(isp):336.242[mh
+
]。
[0369]
b)6-(环丙基甲氧基)-n-[(2s)-1-(2-氟乙氧基)丙-2-基]-5-(3-甲氧基氮杂环丁-1-基)吡啶-2-甲酰胺
[0370]
类似于实施例16中所描述的程序,使6-(环丙基甲氧基)-n-[(1s)-2-羟基-1-甲基-乙基]-5-(3-甲氧基氮杂环丁-1-基)吡啶-2-甲酰胺与1-氟-2-碘乙烷反应,得到标题化合物,为无色油状物,ms(isp):382.270[mh
+
]。
[0371]
实施例33
[0372]
6-(环丙基甲氧基)-n-[(2s)-1-(3-氟丙氧基)丙-2-基]-5-(3-甲氧基氮杂环丁-1-基)吡啶-2-甲酰胺
[0373][0374]
类似于实施例16中所描述的程序,使6-(环丙基甲氧基)-n-[(1s)-2-羟基-1-甲基-乙基]-5-(3-甲氧基氮杂环丁-1-基)吡啶-2-甲酰胺(实施例32a)与1-碘-3-氟丙烷反应,得到标题化合物,为无色油状物,ms(isp):396.279[mh
+
]。
[0375]
实施例34
[0376]
6-(环丙基甲氧基)-n-{3-[(氟甲氧基)甲基]戊-3-基}-5-(3-甲氧基氮杂环丁-1-基)吡啶-2-甲酰胺
[0377][0378]
a)6-(环丙基甲氧基)-n-(3-(羟基甲基)戊-3-基)-5-(3-甲氧基氮杂环丁-1-基)吡啶酰胺
[0379][0380]
类似于实施例19a中所描述的程序,使6-(环丙基甲氧基)-5-(3-甲氧基氮杂环丁-1-基)吡啶甲酸(can 1613292-59-3)与2-氨基-2-乙基丁-1-醇(can 19792-52-0)缩合,得到标题化合物,为浅黄色油状物,ms(isp):378.303[mh
+
]。
[0381]
b)6-(环丙基甲氧基)-n-{3-[(氟甲氧基)甲基]戊-3-基}-5-(3-甲氧基氮杂环丁-1-基)吡啶-2-甲酰胺
[0382]
类似于实施例16中所描述的程序,使6-(环丙基甲氧基)-n-(3-(羟基甲基)戊-3-基)-5-(3-甲氧基氮杂环丁-1-基)吡啶酰胺与氟-碘-甲烷反应,得到标题化合物,为无色油状物,ms(isp):410.348[mh
+
]。
[0383]
实施例35
[0384]
6-(环丙基甲氧基)-n-{3-[(2-氟乙氧基)甲基]戊-3-基}-5-(3-甲氧基氮杂环丁-1-基)吡啶-2-甲酰胺
[0385][0386]
类似于实施例16中所描述的程序,使6-(环丙基甲氧基)-n-(3-(羟基甲基)戊-3-基)-5-(3-甲氧基氮杂环丁-1-基)吡啶酰胺(实施例34a)与1-氟-2-碘乙烷反应,得到标题化合物,为浅褐色油状物,ms(isp):424.362[mh
+
]。
[0387]
实施例36
[0388]
6-(环丙基甲氧基)-n-{3-[(3-氟丙氧基)甲基]戊-3-基}-5-(3-甲氧基氮杂环丁-1-基)吡啶-2-甲酰胺
[0389][0390]
类似于实施例16中所描述的程序,使6-(环丙基甲氧基)-n-(3-(羟基甲基)戊-3-基)-5-(3-甲氧基氮杂环丁-1-基)吡啶酰胺(实施例34a)与1-碘-3-氟丙烷反应,得到标题化合物,为浅褐色油状物,ms(isp):438.346[mh
+
]。
[0391]
实施例37
[0392]
6-(环丙基甲氧基)-n-[(2r)-1-(2-氟乙氧基)-4-甲基戊-2-基]-5-(吡咯烷-1-基)吡啶-2-甲酰胺
[0393][0394]
a)(r)-6-(环丙基甲氧基)-n-(1-羟基-4-甲基戊-2-基)-5-(吡咯烷-1-基)吡啶酰胺
[0395][0396]
类似于实施例19a中所描述的程序,使6-(环丙基甲氧基)-5-(吡咯烷-1-基)吡啶甲酸(can 1415898-45-1)与d-亮氨醇(can 53448-09-2)缩合,得到标题化合物,为无色油状物,ms(isp):362.725.[mh
+
]。
[0397]
b)6-(环丙基甲氧基)-n-[(2r)-1-(2-氟乙氧基)-4-甲基戊-2-基]-5-(吡咯烷-1-基)吡啶-2-甲酰胺
[0398]
类似于实施例16中所描述的程序,使(r)-6-(环丙基甲氧基)-n-(1-羟基-4-甲基戊-2-基)-5-(吡咯烷-1-基)吡啶酰胺与1-氟-2-碘乙烷反应,得到标题化合物,为无色油状物,ms(isp):408.359[mh
+
]。
[0399]
实施例38
[0400]
6-(环丙基甲氧基)-n-[(2r)-1-(2-氟乙氧基)-4-甲基戊-2-基]-5-(3-甲氧基氮杂环丁-1-基)吡啶-2-甲酰胺
[0401][0402]
a)(r)-6-(环丙基甲氧基)-n-(1-羟基-4-甲基戊-2-基)-5-(3-甲氧基氮杂环丁-1-基)吡啶酰胺
[0403][0404]
类似于实施例19a中所描述的程序,使6-(环丙基甲氧基)-5-(3-甲氧基氮杂环丁-1-基)吡啶甲酸(can 1613292-59-3)与d-亮氨醇(can 53448-09-2)缩合,得到标题化合物,为浅黄色油状物,ms(isp):378.3[mh
+
]。
[0405]
b)6-(环丙基甲氧基)-n-[(2r)-1-(2-氟乙氧基)-4-甲基戊-2-基]-5-(3-甲氧基氮杂环丁-1-基)吡啶-2-甲酰胺
[0406]
类似于实施例16中所描述的程序,使(r)-6-(环丙基甲氧基)-n-(1-羟基-4-甲基戊-2-基)-5-(3-甲氧基氮杂环丁-1-基)吡啶酰胺与1-氟-2-碘乙烷反应,得到标题化合物,为无色油状物,ms(isp):424.327[mh
+
]。
[0407]
实施例39
[0408]
6-(环丙基甲氧基)-5-(3-氟-3-甲基氮杂环丁-1-基)-n-(3-(3-氟丙基氨基甲酰基)戊-3-基)吡啶酰胺
[0409][0410]
在5ml梨形烧瓶中,将6-(环丙基甲氧基)-5-(3-氟-3-甲基氮杂环丁-1-基)吡啶甲酸(can 1812888-92-8,5mg,17.8μmol,eq:1.0)、2-氨基-2-乙基-n-(3-氟丙基)丁酰胺盐酸盐(can 1613239-88-5,4.45mg,19.6μmol,eq:1.10)、2-溴-1-乙基吡啶四氟硼酸盐(5.37mg,19.6μmol,eq:1.10)和dipea(8.07mg,10.7μl,62.4μmol,eq:3.50)与1,4-二烷(100μl)合并,得到浅黄色溶液。将反应混合物在环境温度下搅拌16h并使其至干。粗制品通
过制备型tlc(硅胶,etoac,用ch
2
cl
2
/etoac 1:1洗脱)纯化,得到标题化合物(5mg,62%),为白色固体,ms(esi):453.3[mh
+
]。
[0411]
实施例40
[0412]
药理学试验
[0413]
进行以下试验以确定式i的化合物的活性:
[0414]
放射性配体结合测定
[0415]
使用建议量的表达人cnr1或cnr2受体的人胚胎肾(hek)细胞的膜制品(perkinelmer)各自分别结合1.5或2.6nm[3h]-cp-55,940(perkin elmer)作为放射性配体来确定本发明化合物对大麻素cb1受体的亲和性。在总体积为0.2ml的结合缓冲液(对于cb1受体:50mm tris,5mm mgcl
2
、2.5mm edta,和0.5%(wt/vol)无脂肪酸bsa,ph 7.4,而对于cb2受体:50mm tris,5mm mgcl2、2.5mm egta,和0.1%(wt/vol)无脂肪酸bsa,ph 7.4)中进行结合,在30℃振荡1h。通过经涂布有0.5%聚乙撑亚胺的微过滤板(unifilter gf/b过滤板;packard)快速过滤将反应终止。对于ki使用非线性回归分析(activity base,id business solution,limited)来分析结合的放射性,从饱和试验确定对于[3h]cp55,940的kd值。式(i)化合物显示对于cb2受体的优异亲和性。
[0416]
在上述测定(ki)中,根据式(i)的化合物具有的活性为0.5nm至10μm。在上述测定(ki)中,式(i)的特别化合物具有的活性为0.5nm至3μm。在上述测定(ki)中,式(i)的其他特别化合物具有的活性为0.5nm至100nm。
[0417]
camp测定
[0418]
将表达人cb1或cb2受体的cho细胞在实验之前17-24小时以50.000细胞/孔接种在具有透明平底的黑色96孔平板(corning costar#3904)中、在dmem(invitrogen no.31331)中(补充1x ht,具有10%胎牛血清)并在湿润的培养箱中在5%co
2
和37℃温育。将培养基用具有1mm ibmx的krebs ringer bicarbonate缓冲液交换,并且在30℃温育30分钟。加入化合物至最终测定体积为100μl,并且在30℃温育30分钟。使用camp-nano-trf检测试剂盒(roche diagnostics),通过加入50μl裂解试剂(tris,nacl,1.5%triton x100,2.5%np40,10%nan
3
)和50μl检测溶液(20μm mab alexa700-camp 1:1,和48μm钌-2-aha-camp)终止测定,并且室温振荡2h。通过装备有nd:yag激光器作为激发源的trf读出器(evotec technologies gmbh)测量时间分辨能量转移。将平板测量两次,在355nm激发和分别在730(带宽30nm)或645nm(带宽75nm)以100ns的延迟和100ns的栅极(gate)发射,总暴露时间是10s。fret信号的计算如下:fret=t730-alexa730-p(t645-b645),p=ru730-b730/ru645-b645,其中t730是在730nm测量的测试孔,t645是在645nm测量的测试孔,b730和b645是分别在730nm和645nm的缓冲液对照。camp含量从跨度为10μm至0.13nm camp的标准曲线的函数来测定。
[0419]
使用activity base分析(id business solution,limited)测定ec
50
值。对于参比化合物,从该测定产生的宽范围的大麻素激动剂的ec
50
值与科学文献中公开的值相吻合。
[0420]
在前述测定中,根据本发明的化合物具有为0.5nm至10μm的人cb2ec
50
。根据本发明的特别化合物具有为0.5nm至1μm的人cb2 ec
50
。根据本发明的进一步特别的化合物具有为0.5nm至100nm的人cb2 ec
50
。在放射性配体和camp测定二者中或者在这两种测定之一中,它们相对于人cb1受体表现出至少10倍的选择性。
[0421]
对于本发明的代表性化合物所获得的结果在下表中给出。
[0422]
[0423]
[0424]
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询

tips


 商标分类
商标分类  商标转让
商标转让 



