葡萄糖转运蛋白及其在提高有机酸生产中的应用的制作方法
 2021-02-02 13:02:50|
2021-02-02 13:02:50| 360|
360| 起点商标网
起点商标网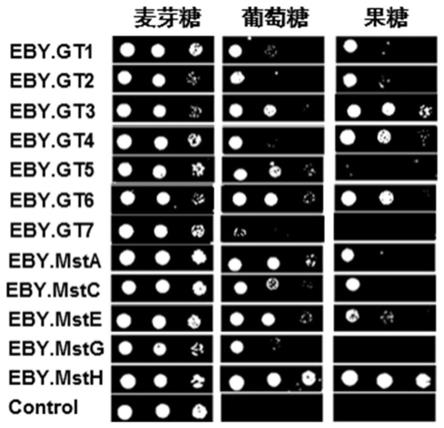
[0001]
本发明涉及生物工程和基因工程技术领域,尤其是涉及葡萄糖转运功能的蛋白、生产有机酸工程菌株的构建方法和应用。
背景技术:
[0002]
黑曲霉是有机酸与酶制剂产业极为重要的工业菌株。黑曲霉生产的柠檬酸全球年产量达200万吨,产值超过20亿美元,并以每年5%的速度递增。黑曲霉具有强大的水解酶系可快速将多聚葡萄糖分解为葡萄糖,由葡萄糖转运系统高效转运至胞内,供给细胞生长与发酵生产,因此,葡萄糖转运吸收直接影响黑曲霉发酵生产有机酸的性能。
[0003]
在已知的基因组数据库中,被注释为真菌来源的葡萄糖转运蛋白的数据极少,大部分均注释为糖转运蛋白。这是由于糖转运蛋白的转运底物种类复杂,涉及葡萄糖、果糖、甘露糖、半乳糖等己糖、木糖、阿拉伯糖、核糖等戊糖,或者蔗糖、乳糖等二糖,或者麦芽糖等三糖,甚至一些寡糖等,往往一种糖转运蛋白仅能转运特定的糖类物质,而不能转运其他糖类物质。仅通过序列同源性比对以及进化树分析不能确定糖转运蛋白对何种糖具有转运功能,需要进行大量的分子生物学实验。比如jiang等利用基因比对分析在里氏木霉的基因组中预测了三个潜在糖转运蛋白,但通过分子生物实验检测发现gatr1p虽为膜蛋白但无法转运葡萄糖、甘露糖、果糖与木糖等糖类物质,gltr1p则仅具有较微弱的葡萄糖转运能力,而xltr1p则具有较强的葡萄糖、甘露糖、果糖与木糖等糖类物质的能力(jiang et al.,identification and characterization of an efficient d-xylose transporter in saccharomyces cerevisiae.j agric food chem.2020mar4;68(9):2702-2710.)。再如虽然在clostridium phytofermentans基因组中注释到173个糖转运蛋白,但cerisy等通过基因敲除实验证实仅4个转运蛋白是糖类物质转运的关键,但转运底物存在显著差异,如cphy2241可转运葡萄糖与半乳糖,cphy2465可转运纤维二糖,cphy3589则参与半乳聚糖的转运与利用(tristan cerisy et al.,abc transporters required for hexose uptake by clostridium phytofermentans.j bacteriol.2019jul10;201(15):e00241-19.)。
[0004]
目前,已经被证实的来源于黑曲霉的葡糖糖转运蛋白较少。如2004年,vankuyk等通过基因文库的方式鉴定出了黑曲霉第一个高亲和力葡萄糖转运蛋白msta。但msta编码基因敲除后,黑曲霉仍可正常转运葡萄糖,这表明黑曲霉葡萄糖转运系统确实存在多基因协同作用的现象(vankuyk et al.,aspergillus niger msta encodes a high-affinity sugar/h+symporter which is regulated in response to extracellular ph.biochem j.2004apr15;379(pt 2):375-83.)。2007年,jorgensen等进一步在msta敲除菌株中,鉴定出了低亲和力葡萄糖转运蛋白mstc,并发现两者存在不同的表达模式(jorgensen et al.,glucose uptake and growth of glucose-limited chemostat cultures of aspergillus niger and a disruptant lacking msta,a high-affinity glucose transporter.microbiology(reading).2007jun;153(pt 6):1963-1973.)。sloothaak等结合隐马尔可夫模型与膜蛋白组,发现另两个高亲和力葡萄糖转运蛋白mstg与msth
(sloothaak et al.,aspergillus niger membrane-associated proteome analysis for the identification of glucose transporters.biotechnol biofuels.2015sep 17;8:150.)。
[0005]
同时,在现有技术中,对葡萄糖转运蛋白的研究多集中在机理的解析上,而整合有葡萄糖转运蛋白的黑曲霉工程菌株以及其在有机酸生产上的报道较少。如现有技术文献cn106635847a公开了过表达内源的葡萄糖转运蛋白lgt1可以提高黑曲霉柠檬酸的产量从134g/l提升至180g/l。
[0006]
因此,挖掘新的葡萄糖转运蛋白,构建高效的黑曲霉工程菌株提升有机酸而且是柠檬酸的产量,是本领域需要解决的问题。
技术实现要素:
[0007]
本发明在大量的前期实验研究中发现了新的具有葡萄糖转运功能的蛋白,其表达强化可以促进有机酸的生产,提高菌株的产酸水平,在此基础上完成本发明。
[0008]
第一方面,本发明提供了新的具有葡萄糖转运功能的蛋白,所述蛋白包括以下蛋白中的任一个:
[0009]
a)具有seq id no:1至seq id no:5任一项所示的氨基酸序列;或
[0010]
b)由序列seq id no:1至seq id no:5任一项所示的氨基酸序列经过一个或数个氨基酸残基的取代、缺失或添加而形成的且具有a)所述蛋白的功能的衍生蛋白。
[0011]
c)与序列seq id no:1至seq id no:5任一项所示的氨基酸序列高于90%、91%、92%、93%、94%、95%、96%、97%、98%、99%且来源于黑曲霉并具有葡萄糖转运功能的蛋白。
[0012]
在本发明中所用的“葡萄糖转运蛋白”,均是指能够将胞外葡萄糖转运至胞内的转运蛋白。
[0013]
此外,本发明还提供一种融合蛋白,其中,所述融合蛋白包括上所述的葡萄糖转运蛋白,以及与所述葡萄糖转运蛋白融合的外源多肽;可选地,所述外源多肽包括标签多肽;优选地,所述外源多肽包括标签多肽,以及连接所述标签多肽与所述具有葡萄糖转运蛋白活性的多肽的间隔多肽。
[0014]
第二方面,本发明提供了包含所述葡萄糖转运蛋白编码基因的表达盒、重组载体,以及重组宿主细胞。其中,所用到的载体并没有特别的限制,可为本领域中已知的任何载体,只要它能够在宿主中进行复制即可,包括质粒、病毒、噬菌体和转座子。用于本发明的可能载体包括但不限于染色体、非染色体和合成dna序列,例如细菌质粒、噬菌体dna、酵母质粒以及从质粒和噬菌体dna的组合中衍生的载体,来自如牛痘、腺病毒、鸡痘、杆状病毒、sv40和伪狂犬病等病毒的dna。即所述载体包括但不限于质粒,噬菌体。一旦转化入合适的宿主之后,所述载体可以复制并独立于宿主基因组发挥功能,或者在某些情况下整合入基因组本身。
[0015]
第三方面,本发明提供了一种有机酸生产工程菌株的构建方法,所述方法包括增强菌株中葡萄糖转运蛋白的活性,所述葡萄糖转运蛋白的氨基酸序列如seq id no:1至seq id no:5所示,或如序列seq id no:8、seq id no:9、seq id no:11、seq id no:12任一项所示。
[0016]
其中,上述提及的“增强菌株中葡萄糖转运蛋白的活性”指的是通过修饰使得蛋白在微生物中的细胞内葡萄糖转运蛋白的活性与自然状态的蛋白质活性相比有所提高。不仅包括由于蛋白质自身活性的增加而带来的比原始功能更高的效果,而且其可以通过选自如下的至少一种方法进行:增加编码蛋白质的多核苷酸的拷贝数、对编码蛋白质的基因的调控序列进行修饰、用具有强活性的序列置换染色体上编码蛋白质的基因的调控序列、用突变基因置换编码蛋白质的基因以增加蛋白质的活性、在染色体上编码蛋白质的基因中引入修饰以增强蛋白质的活性,也可以非限制性地包括任何抑制的方法,只要与内源性活性相比能够增强蛋白质的活性或增强引入蛋白质的活性。
[0017]
在一个具体实施方式中,所述增强菌株中葡萄糖转运蛋白的活性是通过向所述菌株转化导入含有所述葡萄糖转运蛋白的表达载体,以实现葡萄糖转运蛋白的过表达。此处“转化”具有本领域技术人员普遍理解的意思,即将外源性的dna导入宿主的过程。所述转化的方法包括任何将核酸导入细胞的方法,这些方法包括但不限于电穿孔法、磷酸钙(capo
4
)沉淀法、氯化钙(cacl
2
)沉淀法、微注射法、聚乙二醇(peg)法、deae-葡聚糖法、阳离子脂质体法以及乙酸锂-dmso法。
[0018]
更进一步地,所述重组宿主细胞中柠檬酸转运蛋白cexa活性增强,所述cexa的序列如seq id no:13所示。优选地通过导入含有所述cexa的编码基因的表达载体以实现过表达。其中,所述cexa能够将胞内柠檬酸转运至胞外的外排蛋白。
[0019]
本发明所用的术语“宿主细胞”意指易于用包含本发明的葡萄糖转运蛋白、编码蛋白的多核苷酸或重组表达载体转化、转染、转导等的任何细胞类型。所述宿主细胞选自黑曲霉(aspergilus niger),构巢曲霉(aspergillus nidulans),米曲霉(aspergillus oryzae),产黄青霉(penicillium chrysogenum),里氏木霉(trichoderma reesei),玉蜀黍黑粉菌(ustilago maydis),嗜热毁丝霉(myceliophthora thermophila),优选黑曲霉(aspergilus niger),构巢曲霉(aspergillus nidulans)。
[0020]
其中,所述有机酸选自柠檬酸,苹果酸,琥珀酸,衣康酸,富马酸,优选为柠檬酸。
[0021]
第四方面,本发明还提供上述的葡萄糖转运蛋白、或含有上述葡萄糖转运蛋白的编码核酸,或含有上述编码核酸的表达盒或重组载体、或上述含有所述编码核酸的重组宿主细胞在生产有机酸,优选为柠檬酸中的应用。相应地,本发明提供了一种生产有机酸的方法,所述方法包括培养上述方法构建获得的宿主细胞,并收集产生的目标产物。所述有机酸包括但不限于柠檬酸,苹果酸,琥珀酸,衣康酸,富马酸等。
[0022]
本发明人经过广泛而深入的研究,出乎意料地发现丝状真菌中存在一系列的葡萄糖转运蛋白。将有机酸生产菌株中的葡萄糖转运蛋白表达强化,可以促进有机酸的生产,提高菌株的产酸水平,从而为有机酸的生产菌株改造提供了全新的改造靶点。同时本发明转运蛋白可使酵母等微生物转运葡萄糖、果糖等己糖。通过研究实验,本发明通过培养所构建的工程菌株,其柠檬酸产量与出发菌株相比,可提高1-3倍,具有较好的工业应用潜能。
附图说明
[0023]
图1葡萄糖转运蛋白在酿酒酵母中的绿色荧光标记定位分析
[0024]
图2葡萄糖转运蛋白的酿酒酵母表达菌株在不同碳源培养基上的生长情况
具体实施方式
[0025]
术语定义:
[0026]
当在权利要求和/或说明书中与术语“包含”联用时,词语“一(a)”可以指“一个”,但也可以指“一个或多个”、“至少一个”以及“一个或多于一个”。
[0027]
本发明中所用的“包含”、“具有”、“包括”或“含有”是指包括在内的或开放式的,并不排除额外的、未引述的元件或方法步骤。
[0028]
本发明中所用的术语“约”表示:一个值包括测定该值所使用的装置或方法的误差的标准偏差。
[0029]
虽然所公开的内容支持术语“或”的定义仅为替代物以及“和/或”,但除非明确表示仅为替代物或替代物之间相互排斥外,权利要求中的术语“或”是指“和/或”。
[0030]
本发明中所用的术语可选/优选的“数值范围”既包括范围两端的数值端点,也包括相对于前述数值端点而言,所述数值端点中间所覆盖的所有自然数。
[0031]
本发明所用的术语“多肽”、“肽”和“蛋白质”在本文中互换地使用并且为任意长度的氨基酸聚合物。该聚合物可以是线形或分支的,它可以包含修饰的氨基酸,并且它可以由非氨基酸隔断。该术语也包括已经被修饰(例如,二硫键形成、糖基化、脂质化、乙酰化、磷酸化或任何其他操作,如以标记组分缀合)的氨基酸聚合物。
[0032]
本发明所用的术语“重组多肽”是指以采用基因工程的方法,使两种或两种以上的多肽融合表达。在一些实施方式中,重组多肽是将seq id no:1-5所示序列的多肽与外源多肽融合得到的重组多肽。在一些实施方式中,外源多肽包括标签多肽,此外,外源多肽包括标签多肽,以及连接突变体与标签多肽的间隔多肽,具体而言,间隔多肽可以具有10个以下的间隔氨基酸残基。
[0033]
本发明所用的术语“表达载体”是指线状或环状dna分子,该分子包含编码多肽的多核苷酸并且该多核苷酸有效地连接于供用于其表达的控制序列。
[0034]
本发明所用的术语“表达盒”包含与适合的调控序列可操作地连接的编码多肽的多核苷酸,该调控序列对于在所选细胞或者菌株进行多核苷酸的表达是必需的。在发明中,转录调控元件包含启动子,在此基础上,还可以包含增强子、沉默子、绝缘子等元件。对调控序列的修改包括但不限于,如:在多核苷酸序列中缺失、插入、保守突变或非保守突变、或其组合引入修改,也可以通过用具有增强活性的多核苷酸序列置换原始的多核苷酸序列。
[0035]
如发明所用的术语“可操作地连接”是指如下的构造:调控序列相对于多核苷酸的编码序列安置在适当位置,从而使得该调控序列指导该编码序列的表达。示例性的,所述调控序列可以选自启动子和/或增强子编码的序列。
[0036]
本发明的术语“序列同一性”或“同一性百分比”,是指当使用核苷酸或氨基酸残基序列比较算法或通过目视检查测量,以最大的对应性进行比较和比对时,它们是相同的或具有相同序列特定百分比数。也就是说,核苷酸或者氨基酸序列的同一性可以利用下述比例来定义,该比例是将两个或多个核苷酸或氨基酸序列按照一致的核苷酸或氨基酸数达到最大的方式,并根据需要加入空位来进行比对时一致的核苷酸数或氨基酸数,在比对部分的全部核苷酸或氨基酸数中的比例。本发明涉及的测定“序列同一性”或“同一性百分比”的方法包括但不限于:计算机分子生物学(computational molecular biology),lesk,a.m.编,牛津大学出版社,纽约,1988;生物计算:信息学和基因组项目(biocomputing:
informatics and genome projects),smith,d.w.编,学术出版社,纽约,1993;序列数据的计算机分析(computer analysis of sequence data),第一部分,griffin,a.m.和griffin,h.g.编,humana press,新泽西,1994;分子生物学中的序列分析(sequence analysis in molecular biology),von heinje,g.,学术出版社,1987和序列分析引物(sequence analysis primer),gribskov,m.与devereux,j.编m stockton press,纽约,1991和carillo,h.与lipman,d.,siam j.applied math.,48:1073(1988)。测定相同性的优选方法要在测试的序列之间得到最大的匹配。测定相同性的方法编译在公众可获得的计算机程序中。优选的测定两条序列之间相同性的计算机程序方法包括但不限于:gcg程序包(devereux,j.等,1984)、blastp、blastn和fasta(altschul,s,f.等,1990)。公众可从ncbi和其它来源得到blastx程序(blast手册,altschul,s.等,ncbi nlm nih bethesda,md.20894;altschul,s.等,1990)。熟知的smith waterman算法也可用于测定相同性。
[0037]
此外,本领域普通技术人员也不难知晓,在多肽的某些区域,例如非重要区域改变少数氨基酸残基基本上不会改变生物活性,例如,适当替换某些氨基酸得到的序列并不会影响其活性(可参见watson等,molecular biology of the gene,第四版,1987,the benjamin/cummings pub.co.p224)。这类保守突变的代表性例子为保守置换。
[0038]
本发明所用的术语“保守置换”涉及用具有类似侧链的氨基酸残基替换氨基酸残基。本领域已经定义了具有类似侧链的氨基酸残基家族,并且包括具有碱性侧链(例如赖氨酸、精氨酸和组氨酸)、酸性侧链(例如天冬氨酸和谷氨酸)、不带电极性侧链(例如甘氨酸、天冬酰胺、谷氨酰胺、丝氨酸、苏氨酸、酪氨酸、和半胱氨酸)、非极性侧链(例如丙氨酸、缬氨酸、亮氨酸、异亮氨酸、脯氨酸、苯丙氨酸、蛋氨酸和色氨酸)、β-支链(例如苏氨酸、缬氨酸和异亮氨酸)和芳香侧链(例如酪氨酸、苯丙氨酸、色氨酸和组氨酸)。“保守置换”通常在蛋白质的一个或多个位点上交换一种氨基酸。这种取代可以是保守的。作为被视作保守置换的置换,示例性的,可以举出ala向ser或thr的置换、arg向gln、his或lys的置换、asn向glu、gln、lys、his或asp的置换、asp向asn、glu或gln的置换、cys向ser或ala的置换、gln向asn、glu、lys、his、asp或arg的置换、glu向gly、asn、gln、lys或asp的置换、gly向pro的置换、his向asn、lys、gln、arg或tyr的置换、ile向leu、met、val或phe的置换、leu向ile、met、val或phe的置换、lys向asn、glu、gln、his或arg的置换、met向ile、leu、val或phe的置换、phe向trp、tyr、met、ile或leu的置换、ser向thr或ala的置换、thr向ser或ala的置换、trp向phe或tyr的置换、tyr向his、phe或trp的置换、及val向met、ile或leu的置换。此外,保守突变还包括起因于基因所来源的个体差异、株、种的差异等天然产生的突变。
[0039]
下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。本实施例中所用到的实验技术与实验方法,如无特殊说明均为常规技术方法,例如下列实施例中未注明具体条件的实验方法,通常按照常规条件如sambrook等人,分子克隆:实验室手册(new york:cold spring harbor laboratory press,1989)中所述的条件,或按照制造厂商所建议的条件。实施例中所使用的材料、试剂等,如无特殊说明,均可通过正规商业渠道获得。
[0040]
实施例1
[0041]
1.葡萄糖转运蛋白表达质粒的构建
[0042]
基于基因组数据挖掘结合转录组数据解析,预测了7个潜在葡萄糖转运蛋白gt1,
gt2,gt3,gt4,gt5,gt6,gt7,其氨基酸序列如seq id no:1-7所示。采用各葡萄糖转运蛋白的上游引物与下游引物,以柠檬酸产生菌株d菌株(购买于上海工微所科技有限公司(原上海工业微生物研究所)菌种资源库,公开保藏号m202)的cdna为模板,进行pcr扩增各葡萄糖转运蛋白的cdna片段。具体引物序列如表1所示。
[0043]
表1酿酒酵母中葡萄糖转运蛋白表达质粒构建的引物
[0044][0045]
[0046]
pcr反应体系为5
×
fastpfu buffer 10μl,10mm dntps 1μl,上游/下游引物各2.5μl,dna模板0.5μl,fastpfu(transgene)1.5μl,超纯水32μl。
[0047]
pcr反应条件为:95℃预变性5min;95℃变性30sec,55℃退火30sec,72℃延伸2min,35个循环;最后72℃延伸10min。pcr产物进行pcr产物纯化后,与质粒prs426-pgk1分别进行限制性内切酶spei与hindiii酶切。基因gt5的pcr产物与质粒prs426-pgk1(galazka et al.2010)采用限制性内切酶spei与ecori进行酶切。然后,将各基因与质粒prs426-pgk1的相应酶切产物进行连接,转化至大肠杆菌。然后,提取相应的重组质粒,采用酶切与测序验证,获得各葡萄糖转运蛋白的表达质粒prs-gt1,prs-gt2,prs-gt3,prs-gt4,prs-gt5,prs-gt6,prs-gt7,prs-msta,prs-mstc,prs-mste,prs-mstg,prs-msth。将验证正确的各重组质粒与空质粒prs426-pgk1转化酿酒酵母eby.vw4000(wieczorke et al.,1999)中,获得各葡萄糖转运蛋白的酿酒酵母表达菌株,分别命名为eby.gt1,eby.gt2,eby.gt3,eby.gt4,eby.gt5,eby.gt6,eby.gt7,eby.msta,eby.mstc,eby.mste,eby.mstg,eby.msth。各葡萄糖转运蛋白表达后,均可位于酿酒酵母的质膜,如图1所示。
[0048]
2.葡萄糖转运蛋白赋予微生物葡萄糖利用能力实验
[0049]
挑取各葡萄糖转运蛋白的酵母表达菌株与含有空质粒的对照菌株的单菌落,接种至含有2%麦芽糖的sc-ura液体培养基(无氨基酵母氮源6.7g/l,酵母合成缺失培养补充物1.4g/l,麦芽糖20g/l,亮氨酸20mg/l,组氨酸20mg/l,色氨酸20mg/l)中,30℃培养12-14小时左右。离心收集菌体后,用灭菌的超纯水洗涤菌体,并将菌浓调整至od
600
为0.3。将菌体分别稀释10倍,100倍,1000倍后,分别在含有麦芽糖的sc-ura固体培养基、以葡萄糖为唯一碳源的sc-ura固体培养基以及以果糖为唯一碳源的sc-ura上进行点板,30℃培养观察菌体的生长情况。酿酒酵母eby.vw4000中,敲除了17个己糖转运蛋白和3个麦芽糖/葡萄糖转运蛋白,失去了转运葡萄糖的能力。因此,含有空质粒的对照菌株可在含有麦芽糖的培养基上生长,但无法在以葡萄糖或果糖为唯一碳源的培养基上生长。如图2所示,与对照菌株相比,各转运蛋白的酵母表达菌株可利用葡萄糖进行生长,表明各转运蛋白的过表达可使酵母菌株获得葡萄糖利用能力。由此可见,本发明的7个新转运蛋白gt1,gt2,gt3,gt4,gt5,gt6与gt7都具有葡萄糖转运的功能。另外,gt1,gt2,gt3,gt4,gt6的酵母表达菌株还可在以果糖为唯一碳源的培养基上生长,表明gt1,gt2,gt3,gt4与gt6还具有转运果糖的功能,可使酵母能够重新利用果糖。
[0050]
实施例2
[0051]
1.葡萄糖转运蛋白黑曲霉表达质粒的构建
[0052]
采用各葡萄糖转运蛋白的上游引物与下游引物,以柠檬酸产生菌株d菌株的基因组为模板,进行pcr扩增各葡萄糖转运蛋白基因片段。具体引物序列如表2所示。虽然在黑曲霉中已报道的多个葡萄糖转运蛋白,但其过表达对柠檬酸发酵的影响并不明确。因此,本实施例中同时对5个已报道的葡萄糖转运蛋白(msta,mstc,mste,mstg,msth),其序列分别为seq id no:8、seq id no:9、seq id no:10、seq id no:11、seq id no:12进行过表达与柠檬酸发酵检测。
[0053]
表2葡萄糖转运蛋白黑曲霉表达质粒构建的引物
[0054][0055][0056]
pcr反应体系为5
×
fastpfu buffer 10μl,10mm dntps 1μl,上游/下游引物各2.5μl,dna模板0.5μl,fastpfu(transgene)1.5μl,超纯水32μl。
[0057]
pcr反应条件为:95℃预变性5min;95℃变性30sec,55℃退火30sec,72℃延伸2min,35个循环;最后72℃延伸10min。
[0058]
pcr产物进行pcr产物纯化后,与由限制性内切酶xholi酶切处理的质粒pgm-hyh(zheng et al.,2019),采用诺唯赞非连接酶依赖型单片段快速克隆试剂盒(货号:c112-01)进行重组反应,然后转化至大肠杆菌。提取相应的重组质粒后,采用酶切与测序验证,获得各葡萄糖转运蛋白的表达质粒pgm-gt1,pgm-gt2,pgm-gt3,pgm-gt4,pgm-gt5,pgm-gt6,
pgm-gt7,pgm-msta,pgm-mstc,pgm-mste,pgm-mstg,pgm-msth。
[0059]
2.通过peg-介导的原生质体转化将葡萄糖转运蛋白表达质粒转化至黑曲霉
[0060]
取黑曲霉野生型m202孢子悬浮于200ml cma液体培养基(葡萄糖20g/l,麦芽提取物20g/l,蛋白胨1g/l)中,孢子悬液的终浓度为10
5
/ml,在30℃、200r/min的条件培养12-16h。在无菌条件下用无菌的micro-cloth滤布收集菌体,并用溶液a(k
2
hpo
4 5mm,kh
2
po
4 5mm,mgso
4 96.312g/l,ph 5.8,过滤除菌)冲洗一次,用无菌棉签将其转移到20ml的裂解液(0.4g裂解酶于20ml溶液a)中,在37℃、75r/min条件下裂解约两个小时左右。用无菌的micro-cloth滤布过滤上述裂解液,并用两个50ml无菌离心管收集原生质体,用溶液b(tris-hcl 10mm,cacl
2 5.54g/l,d-sorbitol 218.64g/l,ph 7.5,过滤除菌)冲洗定容使每管大约25ml。在2000r/min条件下离心5min弃去上清,用20ml溶液b对沉淀再重悬沉淀两次。将沉淀重悬浮于10ml溶液b中,将两管合为一管并用血球计数板对原生质体计数。离心并根据计数结果加入适量溶液b重悬一次。在冰上向预先冷却的15ml离心管中加入100μl原生质体悬液,然后分别加入5μg葡萄糖转运蛋白的过表达质粒pgm-gt1,pgm-gt2,pgm-gt3,pgm-gt4,pgm-gt5,pgm-gt6,pgm-gt7,pgm-msta,pgm-mstc,pgm-mste,pgm-mstg,pgm-msth以及空质粒pgm,向其加入1ml溶液c(tris-hcl10mm,cacl
2 5.54g/l,peg6000 50%(w/v),ph 7.5,过滤除菌)冰浴10min,2ml溶液b并混匀。与预热的含有潮霉素的上层培养基mmsh混匀后,再平铺至下层培养基mmsh平板上。将平板在30℃培养箱中培养3-5天直到长出转化子为止。
[0061]
3.黑曲霉葡萄糖转运蛋白表达强化菌株的基因型验证
[0062]
采用天根新型植物基因组提取试剂盒dp350提取已进行二次传代分纯后转化子的基因组dna,然后以提取的基因组dna为模板,用引物pgm-f和pgm-r对转化子进行基因pcr验证。引物具体序列如表3所示。
[0063]
表3葡萄糖转运蛋白表达强化转化子的验证引物
[0064][0065]
pcr反应体系为:2
×
taq buffer 10μl,上游/下游引物各1μl,dna模板1μl,去离子水7μl。
[0066]
pcr反应条件为:94℃5min;94℃30sec,55℃30sec,72℃4min,30个循环;72℃10min。对pcr扩增产物进行1%琼脂糖凝胶电泳(150v电压,20分钟)。
[0067]
对pcr扩增产物进行1%琼脂糖凝胶电泳(150v电压,20分钟),在凝胶成像系统下观察基因扩增条带,结果表明各葡萄糖转运蛋白的表达质粒均已整合到了黑曲霉基因组中,获得各葡萄糖转运蛋白的黑曲霉表达强化菌株,分别命名为angt1,angt2,angt3,angt4,angt5,angt6,angt7,anmsta,anmstc,anmste,anmstg,anmsth。
[0068]
4.黑曲霉葡萄糖转运蛋白表达强化菌株的柠檬酸发酵
[0069]
将黑曲霉葡萄糖转运蛋白表达强化菌株angt1,angt2,angt3,angt4,angt5,angt6,angt7,anmsta,anmstc,anmste,anmstg,anmsth与整合pgm空质粒的对照菌株
ancontrol分别接种于pda培养基上30℃培养5天,然后用0.9%生理盐水收集孢子,并采用血球计数板进行孢子计数。以10
6
/ml的接种量接种于柠檬酸发酵培养基(玉米淀粉培养基,总糖含量12%),34℃,250r/min培养96h。
[0070]
通过快速抽滤收集发酵上清,稀释10倍后,加热煮沸10min,用滤膜过滤后用hplc检测柠檬酸含量。具体检测条件为采用色谱柱aminex hpx-87h(300mm x 7.8mm x 9μm,biorad),岛津uflc高效液相色谱仪(配有岛津lc-20ad输液泵、spd-20a uv检测器、cto-20a/ac柱温箱、sil-20acht uflc规格自动进样器,岛津lcsution工作站),流动相a为超纯水,流动相b为2.75mm h
2
so
4
,流速为0.6ml/min,进样量为10ul,柱温50℃,紫外检测波长为210nm。如表4所示,结果发现本发明中黑曲霉葡萄糖转运蛋白gt1-gt5与已报道的5个葡萄糖转运蛋白msta,mstc,mste,mstg,msth的表达强化时,与出发菌株相比,均能显著促进柠檬酸的生产。但葡萄糖转运蛋白gt6与gt7的表达强化确对柠檬酸的生产无影响。
[0071]
表4黑曲霉葡萄糖转运蛋白表达强化提高柠檬酸发酵
[0072][0073]
实施例3
[0074]
1.葡萄糖转运蛋白/柠檬酸外排蛋白黑曲霉表达质粒的构建
[0075]
首先采用柠檬酸外排蛋白cexa(其氨基酸序列为seq id no:13)的上游引物与下游引物,以柠檬酸产生菌株d菌株的基因组为模板,进行pcr扩增柠檬酸外排蛋白基因片段。具体引物序列如表5所示。
[0076]
表5葡萄糖转运蛋白黑曲霉表达质粒构建的引物
[0077][0078]
pcr反应体系为5
×
fastpfu buffer 10μl,10mm dntps 1μl,上游/下游引物各2.5μl,dna模板0.5μl,fastpfu(transgene)1.5μl,超纯水32μl。
[0079]
pcr反应条件为:95℃预变性5min;95℃变性30sec,55℃退火30sec,72℃延伸2min,35个循环;最后72℃延伸10min。
[0080]
pcr产物进行pcr产物纯化后,与由限制性内切酶xholi酶切处理的质粒pgm-hyh(zheng et al.,2019),采用诺唯赞非连接酶依赖型单片段快速克隆试剂盒(货号:c112-01)进行重组反应,然后转化至大肠杆菌。提取相应的重组质粒后,采用酶切与测序验证,获得柠檬酸外排蛋白的黑曲霉表达质粒pgm-cexa。
[0081]
采用pgm-f2与pgm-r2为引物,分别以实施例2中获得的各葡萄糖转运蛋白的表达质粒pgm-gt1,pgm-gt2,pgm-gt3,pgm-gt4,pgm-gt5,pgm-msta,pgm-mstc,pgm-mste,pgm-mstg,pgm-msth为模板,进行pcr扩增各葡萄糖转运蛋白的表达盒。pgm-f2与pgm-r2的具体序列如表5所示。
[0082]
pcr反应体系为5
×
fastpfu buffer 10μl,10mm dntps 1μl,上游/下游引物各2.5μl,dna模板0.5μl,fastpfu(transgene)1.5μl,超纯水32μl。
[0083]
pcr反应条件为:95℃预变性5min;95℃变性30sec,55℃退火30sec,72℃延伸4min,35个循环;最后72℃延伸10min。
[0084]
pcr产物进行pcr产物纯化后,与由限制性内切酶sphi酶切处理的质粒pgm-cexa,采用诺唯赞非连接酶依赖型单片段快速克隆试剂盒(货号:c112-01)进行重组反应,然后转化至大肠杆菌。提取相应的重组质粒后,采用酶切与测序验证,获得各葡萄糖转运蛋白与柠檬酸外排蛋白的黑曲霉共表达质粒,分别命名为pgm-cexa/gt1,pgm-cexa/gt2,pgm-cexa/gt3,pgm-cexa/gt4,pgm-cexa/gt5,pgm-cexa/msta,pgm-cexa/mstc,pgm-cexa/mste,pgm-cexa/mstg,pgm-cexa/msth。
[0085]
2.通过peg-介导的原生质体转化将葡萄糖转运蛋白表达质粒转化至黑曲霉
[0086]
取黑曲霉野生型m202孢子悬浮于200ml cma液体培养基(葡萄糖20g/l,麦芽提取物20g/l,蛋白胨1g/l)中,孢子悬液的终浓度为10
5
/ml,在30℃、200r/min的条件培养12-16h。在无菌条件下用无菌的micro-cloth滤布收集菌体,并用溶液a(k
2
hpo
4 5mm,kh
2
po
4 5mm,mgso
4 96.312g/l,ph 5.8,过滤除菌)冲洗一次,用无菌棉签将其转移到20ml的裂解液(0.4g裂解酶于20ml溶液a)中,在37℃、75r/min条件下裂解约两个小时左右。用无菌的micro-cloth滤布过滤上述裂解液,并用两个50ml无菌离心管收集原生质体,用溶液b(tris-hcl 10mm,cacl
2 5.54g/l,d-sorbitol 218.64g/l,ph 7.5,过滤除菌)冲洗定容使每管大约25ml。在2000r/min条件下离心5min弃去上清,用20ml溶液b对沉淀再重悬沉淀两次。将沉淀重悬浮于10ml溶液b中,将两管合为一管并用血球计数板对原生质体计数。离心并根据计数结果加入适量溶液b重悬一次。在冰上向预先冷却的15ml离心管中加入100μl原生质体悬液,然后分别加入5μg葡萄糖转运蛋白与柠檬酸外排蛋白的黑曲霉共表达质粒pgm-cexa/gt1,pgm-cexa/gt2,pgm-cexa/gt3,pgm-cexa/gt4,pgm-cexa/gt5,pgm-cexa/msta,pgm-cexa/mste,pgm-cexa/mstg,pgm-cexa/msth,向其加入1ml溶液c(tris-hcl 10mm,cacl
2 5.54g/l,peg6000 50%(w/v),ph 7.5,过滤除菌)冰浴10min,2ml溶液b并混匀。与预热的含有潮霉素的上层培养基mmsh混匀后,再平铺至下层培养基mmsh平板上。将平板在30℃培养箱中培养3-5天直到长出转化子为止。
[0087]
3.黑曲霉葡萄糖转运蛋白表达强化菌株的基因型验证
[0088]
采用天根新型植物基因组提取试剂盒dp350提取已进行二次传代分纯后转化子的基因组dna,然后以提取的基因组dna为模板,采用通用引物pgm-f和cexa-r对转化子进行pcr验证柠檬酸外排蛋白cexa的基因组整合情况,采用通用引物pgm-f2和各葡萄糖转运蛋白特异下游引物如gt-r2对转化子进行pcr验证各葡萄糖转运蛋白表达盒的基因组整合情况。引物具体序列如表2,表3与表5所示。
[0089]
pcr反应体系为:2
×
taq buffer 10μl,上游/下游引物各1μl,dna模板1μl,去离子水7μl。
[0090]
pcr反应条件为:94℃5min;94℃30sec,55℃30sec,72℃4min,30个循环;72℃10min。对pcr扩增产物进行1%琼脂糖凝胶电泳(150v电压,20分钟)。
[0091]
对pcr扩增产物进行1%琼脂糖凝胶电泳(150v电压,20分钟),在凝胶成像系统下观察基因扩增条带,结果表明各葡萄糖转运蛋白的表达盒与柠檬酸外排蛋白的表达盒均已整合到了黑曲霉基因组中,获得各葡萄糖转运蛋白与柠檬酸外排蛋白的共表达强化菌株,分别命名为ancgt1,ancgt2,ancgt3,ancgt4,ancgt5,ancmsta,ancmstc,ancmste,ancmstg,ancmsth。
[0092]
4.黑曲霉葡萄糖转运蛋白表达强化菌株的柠檬酸发酵
[0093]
将黑曲霉葡萄糖转运蛋白表达强化菌株ancgt1,ancgt2,ancgt3,ancgt4,ancgt5,ancmsta,ancmstc,ancmste,ancmstg,ancmsth与整合pgm空质粒的对照菌株ancontrol分别接种于pda培养基上30℃培养5天,然后用0.9%生理盐水收集孢子,并采用血球计数板进行孢子计数。以10
6
/ml的接种量接种于柠檬酸发酵培养基(玉米淀粉培养基,总糖含量12%),34℃,250r/min培养96h。
[0094]
通过快速抽滤收集发酵上清,稀释10倍后,加热煮沸10min,用滤膜过滤后用hplc检测柠檬酸含量。具体检测条件为采用色谱柱aminex hpx-87h(300mm x 7.8mm x 9μm,biorad),岛津uflc高效液相色谱仪(配有岛津lc-20ad输液泵、spd-20a uv检测器、cto-20a/ac柱温箱、sil-20acht uflc规格自动进样器,岛津lcsution工作站),流动相a为超纯水,流动相b为2.75mm h
2
so
4
,流速为0.6ml/min,进样量为10ul,柱温50℃,紫外检测波长为210nm。结果如表6所示。
[0095]
表6黑曲霉葡萄糖转运蛋白与柠檬酸转运蛋白共同表达强化提高柠檬酸发酵
[0096][0097]
上述结果表明,本发明中黑曲霉葡萄糖转运蛋白的表达强化时,与出发菌株相比,均能显著促进柠檬酸的生产,尤其有些促进效果达到原来的2-3倍。
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询

tips


 商标分类
商标分类  商标转让
商标转让 



