一种赖氨酸生产菌株的构建方法和应用与流程
 2021-02-02 13:02:42|
2021-02-02 13:02:42| 355|
355| 起点商标网
起点商标网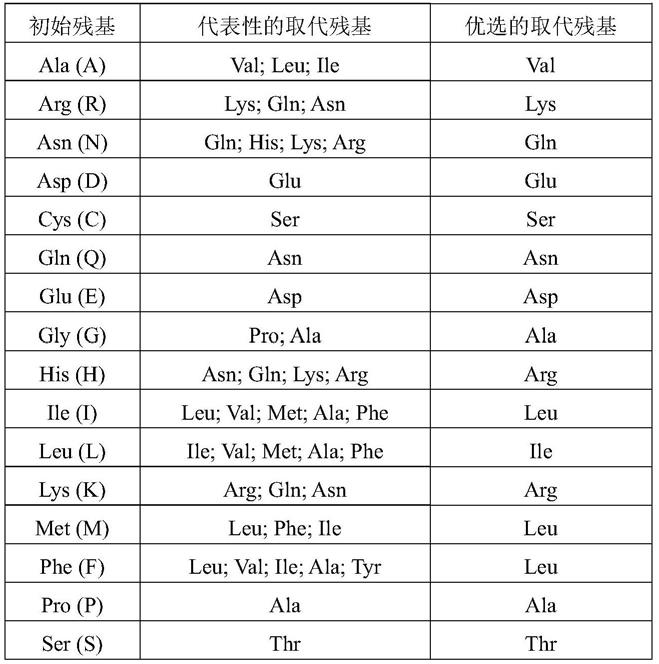
一种赖氨酸生产菌株的构建方法和应用
[0001]
本申请是申请号为201910393041.4、申请日为2019年5月13日、发明创造名称为“赖氨酸生产菌株的构建方法和应用”的分案申请。
技术领域
[0002]
本发明涉及基因工程领域,特别涉及赖氨酸生产菌株的构建方法和应用。
背景技术:
[0003]
赖氨酸是动物和人体必需氨基酸,能促进人体发育、增强免疫能力,并有提高中枢神经组织功能的作用。人体不能靠自身合成l-赖氨酸,只能从食物中摄取,而谷物食品中的赖氨酸含量甚低,故也被称为第一限制性氨基酸,在医药、健康、食品、动物饲料和化妆品等行业中有着十分重要的地位。当前,赖氨酸主要通过埃希氏菌属(escherichia),棒杆菌属(corynebavterium)、短杆菌属(brevibacterium)等微生物发酵来生产。近年来,在大肠杆菌工程菌株构建生产赖氨酸方面已经有了大量的报道,如wo1994011517报道了解除赖氨酸反馈抑制的突变天冬氨酸激酶lysc,wo1995016042报道了解除赖氨酸反馈抑制的突变体dapa,cn101243177a报道了赖氨酸运输蛋白的过表达等等。因此,在公众已知的赖氨酸代谢相关的各个方面都已经进行了大量的改造和研发,当前赖氨酸工业生产菌株的产酸能力已达到很高的水平。
[0004]
众所周知,细胞是一个复杂的代谢网络集合体,在某一化合物的合成过程中人们通常对其代谢直接相关途径(包括底物运输、产物运输等)进行改造,而不会去改造细胞中的其他不相关的途径,因为不相关途径的改变对菌株造成的影响是不可知的,且细胞中的代谢途径众多,想要从众多的途径中挖掘出与赖氨酸生产相关的可改造点难度巨大,尤其是在当前赖氨酸工业菌株已达到高水平的情况下,想要进一步提升,甚至是小幅提升都十分困难。
技术实现要素:
[0005]
speb蛋白,胍基丁酸酶,催化胍基丁胺生成尿素和腐胺。atpb蛋白,是atp合酶f0复合体的亚基。secy蛋白,sec转运子亚基。以上三种蛋白都不在赖氨酸合成的主要代谢途径上,也不在糖酵解途径中,因此,本领域技术人员通常不会想到这些蛋白的改造是否对赖氨酸生产有利。在申请前期大量的研究中,通过菌株的赖氨酸耐受性筛选获得了一株能够耐受高浓度赖氨酸的菌株,在对菌株的基因组测序和比较基因组分析后,发现该菌株中的speb蛋白、atpb蛋白、secy蛋白发生了点突变,并且这些突变体能够提高赖氨酸的产量,在此基础上完成了本发明。
[0006]
第一方面,本发明要求保护一种构建赖氨酸耐受能力和/或赖氨酸产量提高的工程菌的方法。
[0007]
本发明所要求保护的构建工程菌的方法,可包括如下步骤:在出发菌中,对speb蛋白、secy蛋白和/或atpb蛋白进行改造,获得与所述出发菌相比赖氨酸耐受能力和/或赖氨
酸产量提高的工程菌。
[0008]
其中,所述“在出发菌中,对speb蛋白、secy蛋白和/或atpb蛋白进行改造”可为对所述出发菌内源的speb蛋白、secy蛋白和/或atpb蛋白进行直接改造,也可为对外源的speb蛋白、secy蛋白和/或atpb蛋白进行改造后导入所述出发菌。
[0009]
在所述出发菌中,对所述speb蛋白进行的改造可为如下任一:
[0010]
(a1)过表达所述speb蛋白;
[0011]
(a2)过表达speb
a302v
蛋白;所述speb
a302v
蛋白为将所述speb蛋白的第302位的丙氨酸(a)突变为缬氨酸(v)后得到的蛋白质;
[0012]
(a3)将所述speb蛋白的第302位的丙氨酸突变为缬氨酸。
[0013]
在所述出发菌中,对所述secy蛋白进行的改造可为如下任一:
[0014]
(b1)抑制所述secy蛋白的表达;
[0015]
(b2)将所述secy蛋白的第145位的蛋氨酸(m)突变为缬氨酸;
[0016]
(b3)将所述secy蛋白的编码基因的起始密码子atg突变为gtg。
[0017]
在所述出发菌中,对所述atpb蛋白的改造可为如下任一:
[0018]
(c1)过表达atpb
s165n
蛋白;所述atpb
s165n
蛋白为将所述atpb蛋白的第165位的丝氨酸(s)突变为天冬酰胺(n)后得到的蛋白质;
[0019]
(c2)将所述atpb蛋白的第165位的丝氨酸突变为天冬酰胺。
[0020]
在本发明的具体实施方式中,所述方法具体为如下任一:
[0021]
方法a,包括如下步骤:在所述出发菌中过表达所述speb蛋白,得到所述工程菌。
[0022]
方法b,包括如下步骤:在所述出发菌中过表达所述speb
a302v
蛋白,得到所述工程菌。
[0023]
方法c,包括如下步骤:在所述出发菌中过表达所述atpb
s165n
蛋白,得到所述工程菌。
[0024]
方法d,包括如下步骤:抑制所述出发菌中所述secy蛋白的表达,得到所述工程菌。
[0025]
方法e,包括如下步骤:将所述出发菌中的所述secy蛋白的第145位的蛋氨酸突变为缬氨酸,得到所述工程菌。
[0026]
方法f,包括如下步骤:将所述出发菌中的所述secy蛋白的编码基因的起始密码子atg突变为gtg,得到所述工程菌。
[0027]
方法g,包括如下步骤:将所述出发菌中的所述speb蛋白的第302位的丙氨酸突变为缬氨酸,所述atpb蛋白的第165位的丝氨酸突变为天冬酰胺,所述secy蛋白的第145位的蛋氨酸突变为缬氨酸,得到所述工程菌。
[0028]
进一步地,在本发明的具体实施方式中,过表达所述speb蛋白是通过向所述出发中导入所述speb蛋白的编码基因来实现的。
[0029]
进一步地,在本发明的具体实施方式中,过表达所述speb
a302v
蛋白是通过向所述出发中导入所述speb
a302v
蛋白的编码基因来实现的。
[0030]
进一步地,在本发明的具体实施方式中,抑制所述出发菌中所述secy蛋白的表达是通过向所述出发菌中导入靶向所述secy蛋白的编码基因的第1-24位核苷酸的srna实现的。
[0031]
进一步地,在本发明的具体实施方式中,将所述出发菌中的所述secy蛋白的第145
位的蛋氨酸突变为缬氨酸是通过向出发菌中导入secy433片段实现的,所述secy433片段的核苷酸序列如seq id no.7所示。其中,seq id no.7的第1-442位和1435-2804位为第一次同源重组的两端同源臂,第443-482位和1395-1434位为第二次重组的同源序列,483-1394位为氯霉素抗性基因加n20pam片段。
[0032]
进一步地,在本发明的具体实施方式中,将所述出发菌中的所述secy蛋白的编码基因的起始密码子atg突变为gtg通过向出发菌中导入secygtg片段实现的,所述secygtg片段的核苷酸序列如seq id no.8所示。其中,seq id no.8的第1-78位和1071-1113位为第一次同源重组的两端同源臂,第79-118位和1031-1070位为第二次重组的同源序列,119-1030位为氯霉素抗性基因加n20pam片段。
[0033]
进一步地,在本发明的具体实施方式中,过表达所述atpb
s165n
蛋白通过向所述出发中导入所述atpb
s165n
蛋白的编码基因来实现的。
[0034]
在本发明中,所述出发菌具体可为赖氨酸生产菌株。
[0035]
进一步地,所述出发菌为大肠杆菌或谷氨酸棒杆菌。
[0036]
更进一步,所述大肠杆菌可为过表达lysc蛋白和dapa蛋白的大肠杆菌。
[0037]
其中,所述lysc蛋白的氨基酸序列为seq id no.9;所述dapa蛋白的氨基酸序列为seq id no.10。
[0038]
在本发明的具体实施方式中,所述大肠杆菌具体为大肠杆菌lys1;所述谷氨酸棒杆菌具体为谷氨酸棒杆菌b253。
[0039]
第二方面,本发明要求保护如下任一生物材料:
[0040]
(i)蛋白或成套蛋白;
[0041]
所述蛋白为speb
a302v
蛋白、atpb
s165n
蛋白或secy
m145v
蛋白;
[0042]
所述成套蛋白由如下蛋白中的至少两种组成:speb
a302v
蛋白、atpb
s165n
蛋白和secy
m145v
蛋白组成;
[0043]
所述speb
a302v
蛋白为将speb蛋白的第302位的丙氨酸突变为缬氨酸后得到的蛋白质;所述atpb
s165n
蛋白为将atpb蛋白的第165位的丝氨酸突变为天冬酰胺后得到的蛋白质;所述secy
m145v
蛋白为将secy蛋白的第145的蛋氨酸突变为缬氨酸后得到的蛋白质;
[0044]
(ii)基因或成套基因;
[0045]
所述基因为所述speb
a302v
蛋白的编码基因、所述atpb
s165n
蛋白的编码基因或所述secy
m145v
蛋白的编码基因;
[0046]
所述成套基因由所述speb
a302v
蛋白的编码基因、所述atpb
s165n
蛋白的编码基因和所述secy
m145v
蛋白的编码基因中的至少两种组成;
[0047]
(iii)dna片段,为secy433片段或者secygtg片段;
[0048]
所述secy433片段的核苷酸序列如seq id no.7所示(用于将所述出发菌中的所述secy蛋白的第145位的蛋氨酸突变为缬氨酸);所述secygtg片段的核苷酸序列如seq id no.8所示(用于将所述出发菌中的所述secy蛋白的编码基因的起始密码子atg突变为gtg);
[0049]
(iii)表达盒或成套表达盒;
[0050]
所述表达盒为含有所述speb
a302v
蛋白的编码基因的表达盒、含有所述atpb
s165n
蛋白的编码基因的表达盒、含有所述secy
m145v
蛋白的编码基因的表达盒或者含有所述dna片段的表达盒;
[0051]
所述成套表达盒由含有所述speb
a302v
蛋白的编码基因的表达盒、含有所述atpb
s165n
蛋白的编码基因的表达盒、含有所述secy
m145v
蛋白的编码基因的表达盒和含有所述dna片段的表达盒中的至少两种组成;
[0052]
(iv)重组载体或成套重组载体;
[0053]
所述重组载体为含有所述speb
a302v
蛋白的编码基因的重组载体、含有所述atpb
s165n
蛋白的编码基因的重组载体、含有所述secy
m145v
蛋白的编码基因的重组载体或含有所述dna片段的重组载体;
[0054]
所述成套重组载体由含有所述speb
a302v
蛋白的编码基因的重组载体、含有所述atpb
s165n
蛋白的编码基因的重组载体、含有所述secy
m145v
蛋白的编码基因的重组载体和含有所述dna片段的重组载体中的至少两种组成;
[0055]
(v)重组菌或成套重组菌;
[0056]
所述重组菌为含有所述speb
a302v
蛋白的编码基因的重组菌、含有所述atpb
s165n
蛋白的编码基因的重组菌、含有所述secy
m145v
蛋白的编码基因的重组菌或含有所述dna片段的重组菌;
[0057]
所述成套重组菌由含有所述speb
a302v
蛋白的编码基因的重组菌、含有所述atpb
s165n
蛋白的编码基因的重组菌、含有所述secy
m145v
蛋白的编码基因的重组菌和含有所述dna片段的重组菌中的至少两种组成;
[0058]
(vi)利用前文第一方面所述方法制备得到的工程菌。
[0059]
第三方面,本发明要求保护如下任一应用:
[0060]
(a)第二方面中所述的生物材料在提高出发菌赖氨酸耐受能力和/或赖氨酸产量中的应用;
[0061]
(b)第二方面中所述的生物材料在生产赖氨酸中的应用;
[0062]
(c)speb蛋白在提高出发菌耐受能力和/或赖氨酸产量中的应用;
[0063]
(d)speb蛋白在生产赖氨酸中的应用。
[0064]
在上述各方面中,所述speb蛋白具体可为如下任一所示蛋白质:
[0065]
(a1)氨基酸序列为seq id no.1的蛋白质(大肠杆菌speb蛋白);
[0066]
(a2)将seq id no.1所示的氨基酸序列经过一个或几个氨基酸残基的取代和/或缺失和/或添加且具有相同功能的蛋白质;
[0067]
(a3)与(a1)-(a2)中任一所限定的氨基酸序列具有99%以上、95%以上、90%以上、85%以上或者80%以上同源性且具有相同功能的蛋白质;
[0068]
(a4)在(a1)-(a3)中任一所限定的蛋白质的n端和/或c端连接标签后得到的融合蛋白。
[0069]
在上述各方面中,所述atpb蛋白具体可为如下任一所示蛋白质:
[0070]
(b1)氨基酸序列为seq id no.2的蛋白质(大肠杆菌atpb蛋白);
[0071]
(b2)将seq id no.2所示的氨基酸序列经过一个或几个氨基酸残基的取代和/或缺失和/或添加且具有相同功能的蛋白质;
[0072]
(b3)与(b1)-(b2)中任一所限定的氨基酸序列具有99%以上、95%以上、90%以上、85%以上或者80%以上同源性且具有相同功能的蛋白质;
[0073]
(b4)在(b1)-(b3)中任一所限定的蛋白质的n端和/或c端连接标签后得到的融合
蛋白。
[0074]
在上述各方面中,所述secy蛋白具体可为如下任一所示蛋白质:
[0075]
(c1)氨基酸序列为seq id no.3或seq id no.11的蛋白质(seq id no.3为大肠杆菌secy蛋白,seq id no.11为谷氨酸棒杆菌secy蛋白);
[0076]
(c2)将seq id no.3所示的氨基酸序列经过一个或几个氨基酸残基的取代和/或缺失和/或添加且具有相同功能的蛋白质;
[0077]
(c3)与(c1)-(c2)中任一所限定的氨基酸序列具有99%以上、95%以上、90%以上、85%以上或者80%以上同源性且具有相同功能的蛋白质;
[0078]
(c4)在(c1)-(c3)中任一所限定的蛋白质的n端和/或c端连接标签后得到的融合蛋白。
[0079]
对应于基因水平,所述speb蛋白的编码基因具体可为如下任一所述的dna分子:
[0080]
(d1)seq id no.4或seq id no.4的第101-1021位(cds)所示的dna分子(大肠杆菌speb基因);
[0081]
(d2)在严格条件下与(d1)限定的dna分子杂交且编码所述speb蛋白的dna分子;
[0082]
(d3)与(d1)或(d2)限定的dna序列具有99%以上、95%以上、90%以上、85%以上或者80%以上同源性且编码所述speb蛋白的dna分子。
[0083]
对应于基因水平,所述atpb蛋白的编码基因具体可为如下任一所述的dna分子:
[0084]
(e1)seq id no.5或seq id no.5的第101-916位(cds)所示的dna分子(大肠杆菌atpb基因);
[0085]
(e2)在严格条件下与(e1)限定的dna分子杂交且编码所述atpb蛋白的dna分子;
[0086]
(e3)与(e1)或(e2)限定的dna序列具有99%以上、95%以上、90%以上、85%以上或者80%以上同源性且编码所述atpb蛋白的dna分子。
[0087]
对应于基因水平,所述secy蛋白的编码基因具体可为如下任一所述的dna分子:
[0088]
(f1)seq id no.6或seq id no.6的第505-1836位(cds)所示的dna分子(大肠杆菌secy基因);
[0089]
(f2)seq id no.12或seq id no.12的第138-1460位(cds)所示的dna分子(谷氨酸棒杆菌secy基因);
[0090]
(f3)在严格条件下与(f1)或(f2)限定的dna分子杂交且编码所述secy蛋白的dna分子;
[0091]
(f4)与(f1)-(f3)中任一限定的dna序列具有99%以上、95%以上、90%以上、85%以上或者80%以上同源性且编码所述secy蛋白的dna分子。
[0092]
相应的,所述speb
a302v
蛋白的编码基因具体可为将所述speb蛋白的编码基因中编码所述speb蛋白的第302位丙氨酸的密码子(gcg)替换为缬氨酸的密码子(gtg),即c905t,该基因命名为speb
c905t
。
[0093]
相应的,所述atpb
s165n
蛋白的编码基因具体可为将所述atpb蛋白的编码基因中编码所述atpb蛋白的第165位丝氨酸的密码子(agc)替换为天冬酰胺的密码子(aac),即g494a,该基因命名为atpb
g494a
。
[0094]
相应的,所述secy
m145v
蛋白的编码基因具体可为将所述secy蛋白的编码基因中编码所述secy蛋白的第145位蛋氨酸的密码子(atg)替换为缬氨酸的密码子(gtg),即a433g,
该基因命名为secy
a433g
。
[0095]
上述蛋白质中,所述标签是指利用dna体外重组技术,与目的蛋白一起融合表达的一种多肽或者蛋白,以便于目的蛋白的表达、检测、示踪和/或纯化。所述蛋白标签可为flag标签、his标签、mbp标签、ha标签、myc标签、gst标签和/或sumo标签等。
[0096]
上述基因中,所述严格条件可为如下:50℃,在7%十二烷基硫酸钠(sds)、0.5m napo
4
和1mm edta的混合溶液中杂交,在50℃,2
×
ssc,0.1%sds中漂洗;还可为:50℃,在7%sds、0.5m napo
4
和1mm edta的混合溶液中杂交,在50℃,1
×
ssc,0.1%sds中漂洗;还可为:50℃,在7%sds、0.5m napo
4
和1mm edta的混合溶液中杂交,在50℃,0.5
×
ssc,0.1%sds中漂洗;还可为:50℃,在7%sds、0.5m napo
4
和1mm edta的混合溶液中杂交,在50℃,0.1
×
ssc,0.1%sds中漂洗;还可为:50℃,在7%sds、0.5m napo
4
和1mm edta的混合溶液中杂交,在65℃,0.1
×
ssc,0.1%sds中漂洗;也可为:在6
×
ssc,0.5%sds的溶液中,在65℃下杂交,然后用2
×
ssc,0.1%sds和1
×
ssc,0.1%sds各洗膜一次。
[0097]
在本发明中,所述生产赖氨酸具体为当菌株在培养中被培养时能够产生赖氨酸并且能够积累赖氨酸。
[0098]
本文所用的术语“本发明的蛋白”和“本发明的多肽”可互换使用,并具有本领域普通技术人员通常理解的含义。
[0099]
本发明的“speb蛋白突变体”是指通过对氨基酸序列如seq id no.1所示氨基酸序列进行突变获得。具体地说,本发明的speb蛋白突变体是氨基酸序列在对应于seq id no.1所示氨基酸序列的第302位丙氨酸被缬氨酸取代。关于本发明,还可以包括与seq id no.1同源性大于80%,优选90%,更优选95%,最优选99%以上来源于大肠杆且具有催化胍基丁胺生成尿素和腐胺活性的多肽,只要其在对应于seq id no.1所示氨基酸序列的第302位丙氨酸被缬氨酸取代,也在本发明的范围内。
[0100]
同样的,本发明的“atpb蛋白突变体”是指通过对氨基酸序列如seq id no.2所示氨基酸序列进行突变获得。具体地说,本发明的atpb蛋白突变体是氨基酸序列在对应于seq id no.2所示氨基酸序列的第165位s被n取代。关于本发明,还可以包括与seq id no.2同源性大于80%,优选90%,更优选95%,最优选99%以上来源于大肠杆且具有atp合酶f0复合体的亚基活性的多肽,只要其在对应于seq id no.2所示氨基酸序列的第165位丝氨酸被天冬酰胺取代,也在本发明的范围内。
[0101]
本发明的“secy蛋白突变体”是指通过对氨基酸序列如seq id no.3所示氨基酸序列进行突变获得。具体地说,本发明的secy蛋白突变体是氨基酸序列在对应于seq id no.3所示氨基酸序列的第145位蛋氨酸被缬氨酸取代。关于本发明,还可以包括与seq id no.3同源性大于80%,优选90%,更优选95%,最优选99%以上来源于大肠杆且具有sec转运子亚基活性的多肽,只要其在对应于seq id no.3所示氨基酸序列的第145位蛋氨酸被缬氨酸取代,也在本发明的范围内。
[0102]
本文所用的术语“自然状态”是指微生物中多肽处于未修饰状态的活性,即自然状态下的活性。
[0103]
本文所用的术语“与自然状态相比增强蛋白质的活性”指的是通过修饰蛋白增强在微生物中蛋白质的细胞内活性与以自然状态具备的蛋白质活性相比提高细胞内活性。本文所用的术语“外源性”是指某体系中包含了原来不存在的物质。例如,包括但不限于通过
转化等方式在某菌株中引入该菌株中原本不存在的酶的编码基因,从而在该菌株中表达该酶,则该酶对于该菌株是“外源性”的。
[0104]
本文所用的术语“增强”不仅包括由于蛋白质自身活性的增加而带来的比原始功能更高的效果,而且其可以通过选自如下的至少一种方法进行:增加编码蛋白质的多核苷酸的拷贝数、对编码蛋白质的基因的调控序列进行修饰、用具有强活性的序列置换染色体上编码蛋白质的基因的调控序列、用突变基因置换编码蛋白质的基因以增加蛋白质的活性、在染色体上编码蛋白质的基因中引入修饰以增强蛋白质的活性,也可以非限制性地包括任何已经的方法,只要与内源性活性相比能够增强蛋白质的活性或增强引入蛋白质的活性。
[0105]
本文所用的术语“引入蛋白质的活性”具有本领域技术人员常规理解的含义,并且可以通过本领域已知的方法实施,包括但不限于,如:将包含编码蛋白质的多核苷酸序列的多核苷酸插入到染色体上,和/或将多核苷酸克隆到载体上引入微生物,和/或在染色体上行直接增加该多核苷酸的拷贝数,和/或改造具有编码蛋白质的多核苷酸启动子以增强转录启动速度,和/或对编码蛋白质的多核苷酸的转录进行修饰以增强其活性,和/或修改携带有所述编码蛋白质的多核苷酸的信使rna的翻译调控序列以增强翻译强度,和/或修改编码蛋白质的多核苷酸本身以增强mrna稳定性、蛋白质稳定性、解除蛋白质的反馈抑制等方法来实现,也可以非限制性地包括任何已知的可以引入蛋白质活性的方法。
[0106]
如上面所述,调控序列包括能够起始转录的启动子,用于转录调控的任何操纵基因序列,编码合适的mrna核糖体结合结构域的序列,调控转录和翻译终止的序列。对调控序列的修改包括但不限于,如:在多核苷酸序列中缺失、插入、保守突变或非保守突变、或其组合引入修改,也可以通过用具有增强活性的多核苷酸序列置换原始的多核苷酸序列。载体是包括编码靶蛋白的多核苷酸序列的dna构建体,其被可操作地链接至合适的调控序列以使靶蛋白可在宿主细胞中表达。载体在被转入合适的宿主细胞后可独立于宿主细胞基因组复制或起作用,或可以被整合到宿主的基因组上。这些载体可以不特别地限制,只要该载体在宿主细胞中是可复制的,并且其可以使用本领域已知的热河载体构建。载体的实例包括天然或重组质粒、粘粒、病毒和噬菌体。例如,pwe15、pet、puc载体等。另外,通过将载体插入到宿主细胞的染色体上,可以将染色体上编码内源靶蛋白的多核苷酸替换成为修饰的多核苷酸。将多核苷酸插入染色体可以使用本领域已知的任何方法进行,包括但不限于,如:通过同源重组。多核苷酸包括编码的靶蛋白的dna和rna,其可以以任何形式插入到宿主细胞的染色体上,只要其能够在宿主细胞中表达。包括但不限于,如:多核苷酸可以以原始状态、和/或表达盒的形式引入宿主细胞。表达盒是包括自我表达所需的所有必需元件的基因构建体,也可以是能够自我复制的表达载体,可以包括可操作地结合至多核苷酸的启动子、转录终止信号、核糖体结合结构域和翻译终止信号。
[0107]
类似地,本文所用的术语“减弱”是指降低、削弱、减小或完全消除某种蛋白,例如酶的活性。在具体的实施方式中,减弱酶的活性可以通过部分或全部敲除酶的编码基因、基因突变失活或部分失活、基因启动子或翻译调控区改变令其转录或翻译弱化、改变基因序列使其mrna稳定性减弱或酶结构不稳定、通过srna对基因进行调控等方法或其组合来实现,包括但不限于以上方法。
[0108]
本文所用的术语“宿主细胞”是具有本领域普通技术人员通常理解的含义,即含有
speb蛋白、atpb蛋白、secy蛋白或其突变体的菌株。换言之,本发明可以利用任何宿主细胞,只要所述细胞中含有speb蛋白、atpb蛋白、secy蛋白或其突变体且能够生产赖氨酸的细胞。所述宿主细胞可以来自埃希氏菌属(escherichia)、泛菌属(pantoea)、短杆菌属(brevibacterium sp)、芽孢杆菌属(bacillus)、克雷伯氏菌属(klebsiella)、沙雷氏菌属(serratia)或弧菌属(vibrio)。优选大肠杆菌(e.coli)。具体地,本发明所述的宿主是指能够生产赖氨酸的菌株,即,当细菌在培养中被培养时能够产生赖氨酸并且能够积累赖氨酸,或者能够将赖氨酸分泌到培养基中,也就是能够得到胞外的游离赖氨酸,特别是指与野生型菌株或者亲本菌株相比,能够积累更多赖氨酸的能力。为了赋予菌株产赖氨酸的能力,可以采用传统的育种方法,比如培育营养缺陷型的突变株、抗类似物的菌株,或者能够产赖氨酸的代谢控制突变株,以及培育氨基酸生物合成相关酶活性提高的重组菌株的方法,或者以上方法的组合。
[0109]
本文所用的术语“含有本发明的speb蛋白、atpb蛋白、secy蛋白突变体”具有本领域技术人员常规理解的含义,并且可以通过本领域已知的方法实施,包括但不限于,如:将包含编码蛋白的多核苷酸序列的多核苷酸插入到染色体上,和/或将多核苷酸克隆到载体上引入微生物,和/或在染色体上行直接增加该多核苷酸的拷贝等方法来实现,也可以非限制性地包括任何已知的可以引入蛋白活性的方法。
[0110]
本领域技术人员知晓,为提升活性而对野生型多肽进行突变,找到能实现所需目的的位点更为重要。因此,基于本发明的教导,本领域技术人员会对seq id no.1所示氨基酸序列的第302位的氨基酸残基、seq id no.2所示氨基酸序列的第165位的氨基酸残基、seq id no.3所示氨基酸序列的第145位的氨基酸残基进行突变,并检测突变体的相关活性。在具体的实施方式中,本发明的speb蛋白突变体在对应于seq id no.1所示氨基酸序列的第302位是缬氨酸,atpb蛋白突变体在对应于seq id no.2所示氨基酸序列的第165位是天冬酰胺,secy蛋白突变体在对应于seq id no.3所示氨基酸序列的第145位是缬氨酸。
[0111]
此外,本领域普通技术人员也不难知晓,在多肽的某些区域,例如非重要区域改变少数氨基酸残基基本上不会改变生物活性,例如,适当替换某些氨基酸得到的序列并不会影响其活性(可参见watson等,molecular biology of the gene,第四版,1987,the benjamin/cummings pub.co.p224)。因此,本领域普通技术人员能够实施这种替换并且确保所得分子仍具有所需生物活性。
[0112]
因此,对本发明的speb蛋白、atpb蛋白、secy蛋白及其突变体作进一步突变而得到仍具备相应功能和活性的进一步突变体是显而易见的。例如,本领域技术人员公知在多肽的任一端增加或减少数个氨基酸残基,例如优选1-20个、更优选1-15个、更优选1-10个、更优选1-3个、最优选1个氨基酸残基不会影响得到的突变体的功能。例如,为便于纯化,技术人员往往在得到的蛋白的任一端带上6
×
his标签,而这种蛋白与不具备6
×
his标签的蛋白具有相同的功能。因此,本发明应包括在本发明基础上得到的保守性突变体。这些保守性突变体可以根据,例如表1所示进行氨基酸替换而产生。
[0113]
表1氨基酸保守替换
[0114][0115][0116]
本文所用的术语“对应于”具有本领域普通技术人员通常理解的意义。具体地说,“对应于”表示两条序列经同源性或序列相同性比对后,一条序列与另一条序列中的指定位置相对应的位置。因此,例如,就“对应于seq id no.1所示氨基酸序列的第40位的氨基酸残基”而言,如果在seq id no.1所示氨基酸序列的一端加上6
×
his标签,那么所得突变体中对应于seq id no.1所示氨基酸序列的第40位就可能是第46位。
[0117]
在具体的实施方式中,所述同源性或序列相同性可以是90%以上,优选95%以上,更优选96%、97%、98%、99%的同源性。
[0118]
本领域普通技术人员公知的测定序列同源性或相同性的方法包括但不限于:计算机分子生物学(computational molecular biology),lesk,a.m.编,牛津大学出版社,纽约,1988;生物计算:信息学和基因组项目(biocomputing:informatics and genome projects),smith,d.w.编,学术出版社,纽约,1993;序列数据的计算机分析(computer analysis of sequence data),第一部分,griffin,a.m.和griffin,h.g.编,humana press,新泽西,1994;分子生物学中的序列分析(sequence analysis in molecular biology),von heinje,g.,学术出版社,1987和序列分析引物(sequence analysis primer),gribskov,m.与devereux,j.编m stockton press,纽约,1991和carillo,h.与lipman,d.,siam j.applied math.,48:1073(1988)。测定相同性的优选方法要在测试的序
列之间得到最大的匹配。测定相同性的方法编译在公众可获得的计算机程序中。优选的测定两条序列之间相同性的计算机程序方法包括但不限于:gcg程序包(devereux,j.等,1984)、blastp、blastn和fasta(altschul,s,f.等,1990)。公众可从ncbi和其它来源得到blastx程序(blast手册,altschul,s.等,ncbi nlm nih bethesda,md.20894;altschul,s.等,1990)。熟知的smith waterman算法也可用于测定相同性。
[0119]
本发明的应用与优点:
[0120]
1、本发明提供了speb、atpb、secy蛋白的突变体,提高了赖氨酸的产量。
[0121]
2、本发明提供了过表达speb、弱化secy的赖氨酸高产菌株的构建方法。
[0122]
3、本发明为赖氨酸生产菌株构建提供了全新的思路。
具体实施方式
[0123]
下述实施例中所使用的实验方法如无特殊说明,均为常规方法。
[0124]
下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
[0125]
下列实施例中未注明具体条件的实验方法,通常按照常规条件如sambrook等人,分子克隆:实验室手册(new york:cold spring harbor laboratory press,1989)中所述的条件,或按照制造厂商所建议的条件。
[0126]
实施例1、筛选在赖氨酸发酵液中生长速度加快的耐受性菌株
[0127]
大肠杆菌dna聚合酶ε亚基突变体kr5-2能够加速dna复制过程中的错误率[luan g,cai z,li y,ma y.genome replication engineering assisted continuous evolution(greace)to improve microbial tolerance for biofuels production.biotechnol biofuels.2013;6:137.],从而使得菌株更容易发生自发突变,适应外界不利环境。利用pcr扩增大肠杆菌来源的kr5-2[luan g,cai z,li y,ma y.genome replication engineering assisted continuous evolution(greace)to improve microbial tolerance for biofuels production.biotechnol biofuels.2013;6:137.],pcr引物为表2中的kr-f和kr-r,所用模板为文献中报道的质粒pq-dnaq-kr5-2[luan g,cai z,li y,ma y.genome replication engineering assisted continuous evolution(greace)to improve microbial tolerance for biofuels production.biotechnol biofuels.2013;6:137.]。pcr产物用ecori和smai双酶切后,连接到同样双酶切的温度敏感型质粒pkd46(genbank accession no.:mf287367,30℃培养时质粒稳定,37℃以上培养时可将质粒丢失)上,构建出的质粒命名为pkar,其上含有阿拉伯糖诱导型启动子,调控kr5-2基因的表达。
[0128]
表2克隆dna聚合酶ε亚基突变体kr5-2所用的引物
[0129]
引物序列(5
’-
3
’
)kr-fcctgaattcgagctctaaggaggttataaaaaatgagcactgcaattacacgccagkr-rtatcccgggttattatgctcgccagaggcaacttccgcctttc
[0130]
通过连续传代的方式丢失产赖氨酸大肠杆菌mu-1[wang y,li q,zheng p,guo y,wang l,zhang t,sun j,ma y.evolving the l-lysine high-producing strain of escherichia coli using a newly developed high-throughput screening method.j ind microbiol biotechnol.2016;43:1227
–
1235.]中的质粒pag,获得菌株mu-11。将pkar
电转化到mu-11中获得菌株mu-11(pkar)。以此菌株为出发菌株,在含不同赖氨酸浓度的培养液中连续传代培养进化。
[0131]
不同赖氨酸浓度的培养液来源于菌株mu-1的发酵终点液,其中初始赖氨酸含量为136.5g/l,离心后上清经过0.22μm滤膜过滤。所获得的过滤液经过旋转蒸发仪浓缩后获得赖氨酸浓度更高的浓缩液,或加水稀释后获得赖氨酸浓度更低的稀释液,然后在原液、浓缩液、稀释液中加入10g/l的蛋白胨和5g/l的酵母粉,调节ph到7.0。将mu-11(pkar)在lb加阿拉伯糖培养基(10g/l的蛋白胨、5g/l的酵母粉、10g/l阿拉伯糖、10g/l氯化钠)中过夜培养后,在上述不同赖氨酸浓度的培养液中不断转接,从赖氨酸浓度低的培养液转接到浓度高的培养液,并且在第一次转接到含有125g/l赖氨酸的培养液中培养时,加入10g/l阿拉伯糖。转接时接种量为1%(体积分数),培养温度为30℃,培养时加入25mg/l的卡那霉素。以自lb培养基开始培养后始终不加入阿拉伯糖的mu-11(pkar)培养液为对照,检测每次培养结束后600nm的吸光度(od
600
),od
600
的检测方法为,取150μl到96孔浅孔板中,用酶标仪检测600nm吸光度(spectramax 190,购自molecular devices,中国)。结果如表3所示,可以看出,经过不断转接,当转接到赖氨酸浓度为140g/l和150g/l的培养液中时,不加阿拉伯糖的对照mu-11(pkar)培养液中菌株生长速度非常慢,加入阿拉伯糖的mu-11(pkar)培养液中菌株生长水平远远高于对照培养液。说明加入阿拉伯糖的培养液中产生能够在高浓度赖氨酸发酵液中生长速度加快的耐受性mu-11(pkar)突变株。
[0132]
表3 mu-11(pkar)在含赖氨酸的发酵培养液中连续传代培养生长情况
[0133][0134][0135]
注:a表示始终不加阿拉伯糖,b表示在种子液中及第一个转接至125g/l赖氨酸的培养基中加入10g/l阿拉伯糖。
[0136]
实施例2、耐受性突变株的分离和验证
[0137]
将上述能够在高浓度赖氨酸培养液中生长速度加快的菌株在lb培养基中培养,温度为42℃,以丢失质粒pkar,经过平板分纯,获得一株突变株,命名为rs3。对mu-11和rs3在不同赖氨酸浓度培养液中的生长情况进行分析,培养温度为37℃,结果如表4所示。可以看出,在125g/l和150g/l高浓度赖氨酸培养液中,rs3的生长水平明显高于mu-11。说明rs3为耐受性提高的突变株。
[0138]
表4 mu-11和rs3在含赖氨酸的发酵培养液中连续传代培养生长情况
[0139]
转接次数培养液中赖氨酸浓度(g/l)培养时间(小时)mu-11(od
600
)rs3(od
600
)175240.69260.585452100400.333850.35215
3125480.190450.26354150900.01650.09955
[0140]
碘化丙啶(pi)只能对细胞膜结构不完整的细胞染色,故pi染色能够反映细胞膜的完整性,从而反应细胞的耐受程度[li j,ahn j,liu d,chen s,ye x,ding t.evaluation of ultrasound-induced damage to escherichia coli and staphylococcus aureus by flow cytometry and transmission electron microscopy.appl environ microbiol.2016;82:1828
–
1837.],菌液中pi染色结果阳性的比率越高,说明菌株整体的环境耐受性越差。我们对表4中在125g/l赖氨酸浓度的培养液中培养后的细胞mu-11和rs3细胞液进行pi染色分析。首先,培养液离心后,菌体重新悬浮到pbs缓冲液中(nacl 8g/l,kcl 0.2g/l,na
2
hpo
4
·
12h
2
o 3.58g/l,kh
2
po
4 0.24g/l,ph 7.2),使od
600
为0.5左右。然后加入终浓度为2μg/ml的pi。室温下黑暗中反应10分钟,然后用pbs缓冲液洗涤一次。pi染色结果用moflo xdp流式细胞仪进行分析(beckman coulter inc.,usa)。激发波长和检测的发射波长分别为488nm和620nm,用summit 5.2软件的统计分析模块进行分析。结果如表5所示,mu-11的pi染色率为68.5,而rs3的pi染色率为20.1,说明rs3的耐受性远远高于mu-11。
[0141]
表5菌株mu-11和rs3的pi染色率
[0142]
菌株pi染色率(%)mu-1168.5rs320.1
[0143]
实施例3、突变株rs3发酵产赖氨酸和基因组测序分析
[0144]
利用赖氨酸发酵培养基对菌株mu-11和rs3发酵产赖氨酸情况进行测试,发酵培养基成份为:葡萄糖40g/l;kh
2
po
4 5g/l;mgso
4 1g/l;(nh
4
)
2
so
4 10g/l;feso
4 0.003g/l;mnso
4 0.003g/l;玉米浆50g/l;kcl 0.7g/l;3-(n-吗啉基)丙磺酸(mops)42g/l。首先,利用lb培养基过夜培养mu-11和rs3,培养物作为种子接种到含有20ml发酵培养基的500ml摇瓶中,220rpm,37℃培养,16h后,加入400μl浓度为25%的nh
3
·
h
2
o,继续培养到24h,取样利用sba-40d(生物传感器,山东,中国)测葡萄糖和赖氨酸含量,结果如表6所示。可以看出,rs3产赖氨酸水平远高于mu-11。
[0145]
表6菌株mu-11和rs3发酵产赖氨酸水平
[0146]
菌株赖氨酸产量(g/l)赖氨酸转化率(%,g/g葡萄糖)mu-117.124.8rs39.131.9
[0147]
提取mu-11和rs3基因组,对其进行全基因组测序,比较基因组分析发现,如表7所示,与mu-11相比,rs3基因组发生了3个重要基因上的点突变,并导致相应氨基酸突变。
[0148]
表7与大肠杆菌mu-11相比较rs3基因组上发生的点突变
[0149]
相关基因基因序列编码蛋白序列突变核酸位点突变氨基酸基因功能spebseq id no.4seq id no.1c905ta302v精氨酸酶家族相关酶atpbseq id no.5seq id no.2g494as165nfof1-类型的atp合成酶a亚基secyseq id no.6seq id no.3a433gm145v前体蛋白转位酶亚基
[0150]
注:表中突变核酸位点中的数字表示该突变位点在相应基因的cds(orf)序列中的位置。
[0151]
实施例4、speb、atpb、secy基因过表达或弱化质粒的构建
[0152]
以质粒psb4k5-i52002(带有卡那霉素抗性基因,genbank accession no.:eu496099)为模板,利用引物b4k5-f和b4k5-r进行pcr扩增,获得pcr产物。利用引物speb-f和speb-r,分别以mu-11和rs3基因组为模板,pcr扩增获得带有自身启动子的speb及其突变体speb
c905t
(两个扩增产物的序列差别仅在于一个中是speb基因序列,另一个中是speb
c905t
基因序列)。利用引物atpb-f和atpb-r,分别以mu-11和rs3基因组为模板,pcr扩增获得带有自身启动子的atpb及其突变体atpb
g494a
(两个扩增产物的序列差别仅在于一个中是atpb基因序列,另一个中是atpb
g494a
基因序列)。质粒psb4k5-i52002的pcr产物经过t4dna激酶和t4 dna连接酶处理后,获得自连质粒,命名为psb。利用一步法定向克隆无缝克隆试剂盒(the clonexpress ii one step cloning kit,南京诺唯赞生物科技有限公司,中国),分别将speb、speb
c905t
、atpb、atpb
g494a
的pcr产物与psb4k5-i52002的pcr产物相连,获得过表达speb、atpb、及其突变体的质粒psb-speb,psb-speb
c905t
,psb-atpb以及psb-atpb
g494a
。
[0153]
利用文献中报道的通过小rna(srna)的方法[sun d,chen j,wang y,li m,rao d,guo y,chen n,zheng p,sun j,ma y.metabolic engineering of corynebacterium glutamicum by synthetic small regulatory rnas.j ind microbiol biotechnol.2019;46:203
–
208.]测试secy弱化对赖氨酸生产的影响。利用引物secy-f和secy-r,以质粒pec-srna
gfp-hfq[sun d,chen j,wang y,li m,rao d,guo y,chen n,zheng p,sun j,ma y.metabolic engineering of corynebacterium glutamicum by synthetic small regulatory rnas.j ind microbiol biotechnol.2019;46:203
–
208.]为模板,扩增非编码小rna基因micc的骨架和终止子t1/te序列。引物secy-f上带有secy基因第1-24个碱基的对应序列以及组成型启动子j23109的序列(http://parts.igem.org/part:bba_j23100),从而可以表达用于弱化secy基因表达的小rna。利用一步法定向克隆无缝克隆试剂盒将扩增的pcr产物与质粒psb4k5-i52002的pcr产物连接,获得质粒psb-srna
secy-micc。将上述构建的质粒转化到大肠杆菌赖氨酸生产菌株lys1中,获得lys1(psb),lys1(psb-speb),lys1(psb-speb
c905t
),lys1(psb-atpb),lys1(psb-atpb
g494a
)以及lys1(psb-srna
secy-micc)。其中,大肠杆菌lys1是将解除反馈抑制的lysc蛋白(lysc蛋白的序列如seq id no.9所示)和dapa蛋白(dapa蛋白的序列如seq id no.10所示)用质粒ptrc99a(带有氨苄青霉素抗性基因,genbank accession no:.u13872)过表达后,导入大肠杆菌mg1655获得的赖氨酸生产菌株,其构建过程见参考文献(wang,y.,et al.ecolving the l-lysine high-producing strain of escherichia coli using a newly developed high-throughput screening method.(2016).j ind microbiol biotechnol 43(9):1227-1235.)以及参考文献(geng f,chen z,zheng p,sun j,zeng ap.exploring the allosteric mechanism of dihydrodipicolinate synthase by reverse engineering of the allosteric inhibitor binding sites and its application for lysine production.appl microbiol biot.2013;97:1963
–
1971.)。
[0154]
该实施例中所用到的各引物序列如表8所示。
[0155]
表8构建speb、atpb、secy基因过表达或弱化质粒所用引物
[0156][0157]
实施例5、基因组上secy基因的点突变
[0158]
采用crispr/cas9的大肠杆菌基因组快速操作技术[zhao,d.,et al.crispr/cas9-assisted grna-free one-step genome editing with no sequence limitations and improved targeting efficiency.(2017).sci rep 7(1):16624.]对基因组上secy基因进行点突变。利用表9中的引物secy-f1和secy-r1,以rs3基因组为模板pcr扩增,利用一步法定向克隆无缝克隆试剂盒将扩增的pcr产物与实施例4中质粒psb4k5-i52002的pcr产物连接,获得质粒psb-secy
a433g
。以表9中secy-f2和secy-r2为引物,以psb-secy
a433g
为模板,进行pcr扩增,以表9中cn20-f和cn20-r为引物,以氯霉素抗性基因加n20pam片段[zhao,d.,et al.crispr/cas9-assisted grna-free one-step genome editing with no sequence limitations and improved targeting efficiency.(2017).sci rep 7(1):16624.]为模板进行pcr扩增,两个扩增片段用一步法定向克隆无缝克隆试剂盒连接,获得质粒psb-secy
a433g-n20pam。在质粒psb-secy
a433g-n20pam上,带有突变的secy
a433g
基因以及上游的504个碱基,其中起始密码子上游的23-62bp为重复序列,并在重复序列的中间插入n20pam序列,以用于文献中所描述的重组。分别以ya433g-f和ya433g-r,以及yatg-f和yatg-r为引物,以psb-secy
a433g-n20pam为模板,进行pcr扩增,获得两个片段。其中一个片段命名为secy433,其核苷酸序列含有seq id no.7,用于对secy进行a433g突变;另一个片段命名为secygtg,其核苷酸序列含有seq id no.8,用于将起始密码子atg替换为gtg。seq id no.7的第1-442位和1435-2804位为第一次同源重组的两端同源臂,第443-482位和1395-1434位为第二次重组的同源序列,483-1394位为氯霉素抗性基因加n20pam片段。seq id no.8的第1-78位和1071-1113位为第一次同源重组的两端同源臂,第79-118位和1031-1070位为第二次重组的同源序列,119-1030位为氯霉素抗性基因加n20pam片段。将质粒pcago[zhao,d.,et al.crispr/cas9-assisted grna-free one-step genome editing with no sequence limitations and improved targeting efficiency.(2017).sci rep7(1):16624.]转化到大肠杆菌mg1655中,制备用于电转化的mg1655(pcago)感受态细胞,制备感受态所用的培养基为:10g/l蛋白胨,10g/l氯化钠,5g/l酵母粉,10g/l葡萄糖,终浓度为0.1mm的iptg。转化上述分别用于对secy进行a433g突变,以及起始密码子atg替换为gtg的pcr片段secy433和secygtg。30℃培养2小时后,挑选能够在含有100mg/l氨苄青霉素,30mg/l氯霉素,10g/l葡萄糖的lb平板上生长的菌落。获得的菌落进一步在含有100mg/l氨苄青霉
素,0.1mm的iptg,2g/l阿拉伯糖的lb液体培养基中,30℃培养6小时,然后涂布到含有100mg/l氨苄青霉素的lb培养基平板上,挑选单菌落,测序验证,获得secy基因发生a433g突变,以及secy起始密码子atg替换为gtg的突变株,然后在37℃培养,丢掉pcago质粒,获得菌株,分别命名为mg1655-secy
a433g
以及mg1655-secygtg。将yan wang等(wang,y.,et al.ecolving the l-lysine high-producing strain of escherichia coli using a newly developed high-throughput screening method.(2016).j ind microbiol biotechnol 43(9):1227-1235.)构建的菌株lys1中过表达解除反馈抑制的天冬氨酸激酶基因lysc和二氢吡啶二羧酸合成酶基因dapa的质粒ptrc99a导入到mg1655-secy
a433g
以及mg1655-secygtg中,获得赖氨酸生产菌株lys1-secy
a433g
以及lys1-secygtg。
[0159]
表9对基因组上secy基因进行点突变所用引物
[0160]
引物名称引物序列(5
’-
3
’
)secy-f1gaattccctaggatccgtcgctcctgctattcgcggtatgatcsecy-r1cagcggccgctactagttgacttctcgggcgaccaattatcgsecy-f2cggagaacgagatgacgttgtactaaaggcgctcgtgctgsecy-r2ctgatggagctgcacatgaaaccgccagcagcttcgatagcn20-fttcatgtgcagctccatcagcn20-rcaacgtcatctcgttctccgya433g-fctcctgctattcgcggtatgatcya433g-rcttctcgggcgaccaattatcgyatg-fcggtatccagatcgagttcgcgaaagtgyatg-rtaatcccggttgtttagccacctgctacttattcctcgatttt
[0161]
实施例6、产赖氨酸大肠杆菌的发酵测试
[0162]
利用赖氨酸发酵培养基对上述构建的赖氨酸生产菌株发酵产赖氨酸情况进行测试,包括lys1(psb),lys1(psb-speb),lys1(psb-speb
c905t
),lys1(psb-atpb),lys1(psb-atpb
g494a
),lys1(psb-srna
secy-micc),lys1,lys1-secy
a433g
,lys1-secygtg。发酵培养基成份为:葡萄糖40g/l;kh
2
po
4 5g/l;mgso
4 1g/l;(nh
4
)
2
so
4 10g/l;feso
4 0.003g/l;mnso
4 0.003g/l;酵母粉8g/l;kcl 0.7g/l;3-(n-吗啉基)丙磺酸(mops)42g/l。另外,在lys1(psb),lys1(psb-speb),lys1(psb-speb
c905t
),lys1(psb-atpb),lys1(psb-atpb
g494a
)以及lys1(psb-srna
secy-micc)种子及发酵培养基中加入终浓度为100mg/l的氨苄青霉素和25mg/l的卡那霉素,在lys1,lys1-secy
a433g
,lys1-secygtg种子及发酵培养基中加入终浓度为100mg/l的氨苄青霉素,利用lb种子培养基过夜培养上述菌株,培养物作为种子接种到每孔含有200μl发酵培养基的96孔深孔板中,接种量为5%(体积分数),37℃培养40小时,孔板摇床转速为800rpm,每个菌株3个平行,发酵结束后按照实施例2中提供的方法检测菌株的pi染色情况,按照实施例3中提供的方法检测赖氨酸浓度,葡萄糖消耗量。各菌株的检测结果如表10所示。由表10可见,与对照菌株lys1(psb)相比,过表达野生型speb基因的菌株lys1(psb-speb)赖氨酸产量提高,细胞膜损坏程度降低,过表达突变型speb
c905t
基因时,赖氨酸产量提高更多,菌株细胞膜损坏程度更低,说明speb基因的c905t点突变能够提高菌株性能,对产赖氨酸有利。与对照菌株lys1(psb)相比,过表达野生型atpb基因的菌株lys1(psb-atpb)产赖氨酸水平和细胞膜损伤程度变化不大,然而,过表达突变型atpb
g494a
基因的
菌株lys1(psb-atpb
g494a
)赖氨酸产量提高,细胞膜损坏程度降低,说明atpb基因的g494a点突变能够提高菌株性能,对产赖氨酸有利。利用srna弱化secy基因表达的菌株lys1(psb-srna
secy-micc)比对照菌株lys1(psb)的赖氨酸产量更高,菌株细胞膜损坏程度更低,说明secy基因弱化能够提高菌株性能,对产赖氨酸有利。与对照菌株lys1相比,基因组上的secy基因发生a433g点突变的菌株lys1-secy
a433g
和基因组上的secy基因起始密码子由atg突变为gtg的菌株lys1-secygtg的赖氨酸产量更高,菌株细胞膜损坏程度更低,说明secy基因a433g点突变,以及secy基因起始密码子由atg变为gtg引起的表达弱化(起始密码子由atg变为gtg是本领域公知的基因表达弱化方法)都能够提高菌株性能,对产赖氨酸有利。
[0163]
表10各工程菌株的赖氨酸生产情况
[0164][0165]
结果的显著性通过p值分析来表示,所用方法为:student
’
s two-tailed t-test.*代表p<0.05(有差异),**代表p<0.01(有显著差异),没有*代表无差异。菌株lys1(psb-speb),lys1(psb-speb
c905t
),lys1(psb-atpb),lys1(psb-atpb
g494a
)以及lys1(psb-srna
secy-micc)结果的显著性是通过与lys1(psb)比较分析。菌株lys1-secy
a433g
以及lys1-secygtg结果的显著性是通过与lys1比较分析。
[0166]
实施例7、谷氨酸棒杆菌secy基因的弱化表达
[0167]
为了验证谷氨酸棒杆菌中secy基因表达弱化对赖氨酸产量的影响,本申请首先利用基于srna的基因表达调控技术构建secy的弱化载体。根据ncbi公布的谷氨酸棒杆菌赖氨酸生产菌株b253(genebank accession number cp010451)的secy基因序列(seq id no.12,其对应的编码蛋白序列如seq id no.11所示)设计表11中引物rsecy-f1和rsecy-r1,以携带srna元件的载体pec-srna
gfp-hfq(构建过程参考文献:sun,et al.,(2019).metabolic engineering of corynebacterium glutamicum by synthetic small regulatory rnas.journal of industrial microbiology&biotechnology,46:203-208)为模板,进行pcr扩增,pcr产物经过t4 dna激酶和t4 dna连接酶处理后,获得自连质粒,命名为pecsrna-secy,能够组成型表达srna,表达的srna含有对应于secy基因(seq id no.12)第1-24bp的序列,从而能够弱化secy基因的表达。将pecsrna-secy转化到菌株b253中,获得菌株b253(pecsrna-secy)。
[0168]
利用表11中引物rsecy-f2和rsecy-r2,同样以载体pec-srna
gfp-hfq为模板pcr扩
增,同样对产物自连后,获得质粒pec-hfq,与pecsrna-secy相比,pec-hfq缺少对应于secy基因第1-24bp的序列,从而无法弱化secy基因的表达。将pec-hfq转化到菌株b253中,获得菌株b253(pec-hfq)。
[0169]
表11构建用于谷氨酸棒杆菌secy基因弱化表达的质粒所用引物
[0170]
引物名称引物序列(5
’-
3
’
)rsecy-f1aatggcggacactttctgttgggccattgcattgcrsecy-r1attcaggcattctgaattacactgtacctgttgrsecy-f2tttctgttgggccattgcattgcrsecy-r2tgaattacactgtacctgttg
[0171]
实施例8、产赖氨酸谷氨酸棒杆菌的发酵测试
[0172]
为了测试谷氨酸棒杆菌中secy基因表达弱化对菌株产赖氨酸的影响,分别对b253(pec-hfq)和b253(pecsrna-secy)进行发酵测试,发酵培养基成份为:葡萄糖80g/l;酵母粉8g/l;尿素9g/l;k
2
hpo
4 1.5g/l;mnso
4 0.01g/l;mgso
4 0.6g/l;feso
4 0.01g/l;mops 42g/l。首先将菌株接种到含有10g/l葡萄糖的lb培养基中过夜培养,培养物作为种子接种到每孔含有200μl发酵培养基的96孔深孔板中,接种量为5%,30℃培养48小时,孔板摇床转速为800rpm,每个菌株3个平行,发酵结束后按照实施例3中提供的方法检测赖氨酸产量和葡萄糖消耗量。结果如表12所示。由表可见,谷氨酸棒杆菌的secy基因弱化能够大幅提高赖氨酸产量。
[0173]
表12谷氨酸棒杆菌b253中secy基因弱化后对赖氨酸生产的影响
[0174][0175]
结果的显著性通过p值分析来表示,所用方法为:student
’
s two-tailed t-test.**代表p<0.01(有显著差异)。菌株b253(pecsrna-secy)结果的显著性是通过与b253(pec-hfq)比较分析。
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询

tips


 商标分类
商标分类  商标转让
商标转让 



