一种体外高效诱导扩增NK细胞的方法与流程
 2021-02-02 13:02:25|
2021-02-02 13:02:25| 322|
322| 起点商标网
起点商标网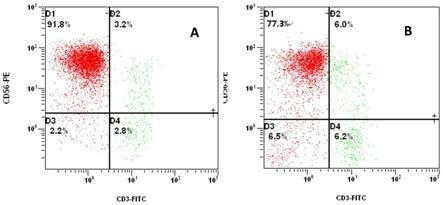
一种体外高效诱导扩增nk细胞的方法
技术领域
[0001]
本发明旨在提供一种体外细胞培养的方法,具体涉及一种体外高效诱导扩增nk细胞的方法。
背景技术:
[0002]
自然杀伤细胞(natural killer cell,nk),是一群大颗粒淋巴细胞,作为机体防御体系的第一道防线,在对抗病毒、细菌入侵及肿瘤防御方面发挥着重要的作用。nk细胞通过其表面的活化性及抑制性受体识别靶细胞,活化性及抑制性信号的平衡决定了nk细胞介导的细胞毒作用。nk细胞对表达下调或缺失主要组织相容复合体-i(major histocompatibility complex class i,mhc-i)的靶细胞发挥快速的自然杀伤,而不需要预先致敏。随着对nk细胞生物活性的进一步了解,以nk细胞输注为代表的过继性免疫疗法在临床应用中得到快速的发展,并且己经在肺癌、胃癌及结直肠癌等多种肿瘤的治疗中取得了一定的疗效。
[0003]
但是nk细胞的临床应用同时受到其数量的限制,nk细胞在外周血中仅占淋巴细胞的10%-15%,远远不能满足临床治疗的需要。所以体外高效扩増nk细胞是目前研究者们极其关注的问题。
[0004]
目前体外扩增nk细胞的方法有多种,如利用细胞因子,磁珠分选或基因改造的饲养细胞等,但都存在着不足:如扩増效率低,生产成本高或安全性等问题,难以大规模应用于临床。本研究旨在开发一种相对简单,但可有效诱导和扩增nk细胞的方法。
技术实现要素:
[0005]
本发明提供了一种由外周血体外高效诱导扩增nk细胞的方法。
[0006]
本发明采用以下技术方案解决上述技术问题:
[0007]
本发明提供了一种可体外高效诱导扩增nk细胞的方法,包括:用herceptin和pha包被培养瓶、外周血单个核细胞的分离、细胞因子的添加,用无血清培养基培养扩增细胞以及细胞杀伤活性检测等步骤。
[0008]
具体包括如下步骤:
[0009]
(1)培养瓶预处理
[0010]
使用包含10-30μg/ml herceptin及10-50μg/ml pha的缓冲液包被t175细胞培养瓶,4℃温育10-16小时。
[0011]
(2)外周血单个核细胞(pbmc)的分离
[0012]
取30-50ml外周血,采用密度梯度离心法分离获得单个核细胞,重悬于无血清培养基中,调整单个核细胞浓度至(1-4)x10
6
个/ml。
[0013]
(3)nk细胞的诱导活化
[0014]
将所分离的单个核细胞转移至上述包被好的t175细胞培养瓶中,添加500-1000u/ml的il-2及1-10%的自体灭活血浆,于体积含量5%co
2
的空气且饱和湿度的培养箱中静置
培养。
[0015]
(4)nk细胞的继续培养
[0016]
第3-12天,适时补加包含500-1000u/ml的il-2及1-10%的自体灭活血浆的无血清培养基,保持细胞密度(1-4)x10
6
个/ml。
[0017]
(5)离心收集nk细胞
[0018]
第13-15天,离心收集nk细胞,流式细胞仪检测nk细胞表型,cck-8法检测nk细胞杀伤活性。
[0019]
本发明不使用磁珠分选,也不使用滋养层细胞,操作简单、安全性高、可高效扩增nk细胞,临床应用价值高。
附图说明
[0020]
图1:a和b分别为实施例及对比例中培养第15天的nk细胞流式检测结果。
[0021]
图2:实施例及对比例中培养的nk细胞扩增倍数比较。
[0022]
图3:实施例及对比例中培养的nk细胞对k562靶细胞株杀伤活性的比较。
具体实施方式
[0023]
下面通过具体的实施例和附图对本发明实施例中的技术方案做进一步详细地描述。应理解,所描述的实施例仅是本发明较佳的实施例,并非是对本发明做其他形式的限定,任何本专业的技术人员可能利用上述揭示的技术内容加以变更为同等变化的等效实施例。这些等价形式同样落于本申请所附权利要求书所限定的范围。
[0024]
实施例1
[0025]
本发明分离培养方法,所述方法包括如下步骤:
[0026]
(1)抗体包被(培养瓶预处理):
[0027]
使用包含20μg/ml herceptin(赫赛汀(注射用曲妥珠单抗))及20μg/ml pha(植物凝集素,phytohemagglutinin)的pbs缓冲液(磷酸盐缓冲溶液)20ml平铺到t175细胞培养瓶(美国巴罗克)底部,4℃温育12小时(过夜)。
[0028]
(2)外周血单个核细胞(pbmc)的分离
[0029]
取50ml人外周血,将外周血转移至50ml离心管中,经800g,10min离心后,吸取上层淡黄色液体即为人的自体血浆。取上层血浆置于56℃温度下灭活30min,灭活后经1000g,10min离心,置于4度冰箱备用。
[0030]
用生理盐水1:1(v/v)稀释下层血液,缓慢加至预先装有20ml淋巴细胞分离液(天津灏洋华科生物科技有限公司,货号hy2015)的液面上,900g离心20min,吸取单个核细胞层于50ml离心管中,加入生理盐水40~50ml(在此为45ml),洗涤2~3次(在此为3次);
[0031]
(3)nk细胞的诱导活化:
[0032]
将所分离的单个核细胞,重悬于无血清初始培养基(在此采用x-vivo 15培养基,或也可用其它适合淋巴细胞培养的培养基来代替,例如,aim-v培养基,gt-t551h3培养基或alys-505n培养基)中,调整单个核细胞浓度至1x10
6
个/ml。转移至上述包被好的t175细胞培养瓶中,添加终浓度500u/ml的il-2(白细胞介素-2)及终体积浓度5%的人的自体血浆,于体积含量5%co
2
的空气且饱和湿度的培养箱中静置培养。
[0033]
(4)nk细胞的继续培养:
[0034]
培养第3天观察细胞并计数,补加无血清初始培养基,保持细胞密度1x10
6
个/ml。所述无血清初始培养基包含il-2及自体灭活血浆,其中il-2的终浓度为500u/ml,自体灭活血浆的终体积浓度为1%。
[0035]
每三天(分别为第6天、第9天、第12天)观察细胞状态并进行细胞计数,补充新鲜的无血清初始培养基调整细胞密度为1x10
6
个/ml,该新鲜培养基包含il-2及自体灭活血浆,其中il-2的终浓度为500u/ml,自体灭活血浆的终体积浓度为1%。
[0036]
(5)离心收集nk细胞
[0037]
第15天,离心收集nk细胞,流式细胞仪检测nk细胞表型。
[0038]
流式检测:取培养15天的细胞悬液计数,离心收集细胞,用pbs缓冲液稀释制备成1
×
10
6
/ml的细胞悬液,取500μl细胞悬液放于1.5mlep管内,离心后弃上清,沉淀用100μl dpbs重悬,分别加入cd3-fitc抗体(美国bd)和cd56-pe抗体(美国bd)各10μl,室温避光孵育30min。加入500μl dpbs重悬细胞,1500rpm/min离心7min,沉淀用200μl pbs重悬,流式细胞仪上机检测,检测结果如图1a所示;由图1a可以看出,nk细胞(cd3-cd56+)比例为91.8%,cik细胞(cd3+cd56+)比例为3.2%,其余细胞(cd56-)比例为5.0%。(
“-”
为表达阴性,“+”为表达阳性)。
[0039]
(6)绘制nk细胞生长曲线
[0040]
分别在培养的第3、6、9、12、15天对培养的细胞用台盼蓝染色后计数,计数当天的细胞总数除以培养前的细胞数(即第0天),数值即为细胞的扩增倍数,经过本发明方法培养的nk细胞扩增了425倍(图2),细胞总数达到9.1
×
10
9
,可满足临床使用的需要。
[0041]
(7)nk细胞杀伤活性检测
[0042]
取对数生长期的k562细胞作为靶细胞,按不同的效靶比(5:1,10:1,20:1,40:1)分别把nk细胞和靶细胞(1*10
5
/ml)加入96孔板中。每组设3个复孔,置于37℃、体积含量5%co
2
空气的细胞培养箱中培养24h。接着每孔加入10μl的cck-8试剂(碧云天,上海),于培养箱中孵育4h后,采用酶标仪(bio-rad 680,usa)于450nm处检测各孔光密度值(optical density,od)。
[0043]
实验组:k562细胞+nk细胞
[0044]
效应细胞组:单独的nk细胞
[0045]
靶细胞组:单独的k562细胞
[0046]
效靶比:效应细胞数量与靶细胞数量的比值
[0047]
杀伤活性(%)=[1-(实验组od值-效应细胞组od值)/靶细胞组od值
×
100%。
[0048]
结果如图3所示。
[0049]
对比例1
[0050]
不使用pha体外诱导扩增nk细胞的方法,所述方法包括如下步骤:
[0051]
(1)抗体包被(培养瓶预处理):
[0052]
使用包含20μg/ml herceptin的pbs缓冲液20ml平铺到t175细胞培养瓶底部,4℃温育过夜。
[0053]
(2)外周血单个核细胞(pbmc)的分离
[0054]
取50ml人外周血,将外周血转移至50ml离心管中,经800g,10min离心后,吸取上层
淡黄色液体即为人的自体血浆。取上层血浆置于56℃温度下灭活30min,灭活后经1000g,10min离心,置于4度冰箱备用。
[0055]
用生理盐水1:1(v/v)稀释下层血液,缓慢加至预先装有20ml淋巴细胞分离液的液面上,900g离心20min,吸取单个核细胞层于50ml离心管中,加入生理盐水40~50ml(在此为45ml),洗涤2~3次(在此为3次);
[0056]
(3)nk细胞的诱导活化:
[0057]
将所分离的单个核细胞,重悬于无血清初始培养基(在此采用x-vivo15培养基,或也可用其它适合淋巴细胞培养的培养基来代替,例如,aim-v培养基,gt-t551h3培养基或alys-505n培养基)中,调整单个核细胞浓度至1x10
6
个/ml。转移至上述包被好的t175细胞培养瓶中,添加终浓度500u/ml的il-2及终体积浓度5%的人的自体血浆,于体积含量5%co
2
的空气且饱和湿度的培养箱中静置培养。
[0058]
(4)nk细胞的继续培养:
[0059]
培养第3天观察细胞并计数,补加无血清初始培养基,保持细胞密度(1-4)x10
6
个/ml。所述无血清初始培养基包含il-2及自体灭活血浆,其中il-2的终浓度为500u/ml,自体灭活血浆的终体积浓度为1%。
[0060]
每三天(分别为第6天、第9天、第12天)观察细胞状态并进行细胞计数,补充新鲜的无血清初始培养基调整细胞密度为1x10
6
个/ml,该新鲜培养基包含il-2及自体灭活血浆,其中il-2的终浓度为500u/ml,自体灭活血浆的终体积浓度为1%。
[0061]
(5)离心收集nk细胞
[0062]
第15天,离心收集nk细胞,流式细胞仪检测nk细胞表型。
[0063]
流式检测:取培养15天的细胞悬液计数,离心收集细胞,用pbs缓冲液稀释制备成1
×
10
6
/ml的细胞悬液,取500μl细胞悬液放于1.5mlep管内,离心后弃上清,沉淀用100μl dpbs重悬,分别加入cd3-fitc抗体和cd56-pe抗体各10μl,室温避光孵育30min。加入500μl dpbs重悬细胞,1500rpm/min离心7min,沉淀用200μl pbs重悬,流式细胞仪上机检测,检测结果如图1b所示;由图1b可以看出,nk细胞(cd3-cd56+)比例为77.3%,cik细胞(cd3+cd56+)比例为6.0%,其余细胞(cd56-)比例为16.7%。
[0064]
(6)绘制nk细胞生长曲线
[0065]
分别在培养的第3、6、9、12、15天对培养的细胞用台盼蓝染色后计数,计数当天的细胞总数除以培养前的细胞数(即第0天),数值即为细胞的扩增倍数,经过本发明方法培养的nk细胞扩增了314倍(图2)。
[0066]
(7)nk细胞杀伤活性检测
[0067]
取对数生长期的k562细胞作为靶细胞,按不同的效靶比(5:1,10:1,20:1,40:1)分别把nk细胞和靶细胞(1*10
5
/ml)加入96孔板中。每组设3个复孔,置于37℃、体积含量5%co
2
空气的细胞培养箱中培养24h。接着每孔加入10μl的cck-8试剂,于培养箱中孵育4h后,采用酶标仪于450nm处检测各孔光密度值。
[0068]
实验组:k562细胞+nk细胞
[0069]
效应细胞组:单独的nk细胞
[0070]
靶细胞组:单独的k562细胞
[0071]
效靶比:效应细胞数量与靶细胞数量的比值
[0072]
杀伤活性(%)=[1-(实验组od值-效应细胞组od值)/靶细胞组od值
×
100%。
[0073]
结果如图3所示。
[0074]
结论:
[0075]
从上述实施例及对比例各实验检测结果来看,实施例所培养的nk细胞纯度扩增倍数及杀伤活性均优于对比例,说明本发明的培养方法优于常规的不使用pha的培养方法。
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询

tips


 商标分类
商标分类  商标转让
商标转让 



