一种栀子蓝色素的提取方法与流程
 2021-02-02 12:02:25|
2021-02-02 12:02:25| 417|
417| 起点商标网
起点商标网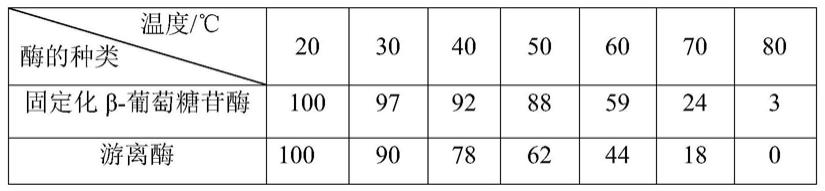
[0001]
本发明涉及食品领域,具体涉及一种栀子蓝色素的提取方法。
背景技术:
[0002]
栀子,别名:黄栀子、山栀、白蟾,是茜草科植物栀子的果实。栀子的果实是传统中药,属卫生部颁布的第1批药食两用资源,具有护肝、利胆、降压、镇静、止血、消肿等作用。在中医临床常用于治疗黄疸型肝炎、扭挫伤、高血压、糖尿病等症。含番红花色素苷基,可作黄色染料。栀子苷是从茜草科植物栀子的干燥成熟果实中运用高科技生产工艺提取精制而成的产品。栀子苷为环烯醚萜苷类化合物,异名京尼平苷。栀子苷有多种用途,不同条件的发酵,可以制成天然食用着色剂栀子蓝和栀子红,也是用于治疗心脑血管、肝胆等疾病及糖尿病的原料药物。
[0003]
固定化酶技术不仅可以保证酶的回收利用,还能改善酶在催化过程中的稳定性,从而使酶的工业化应用更加经济。目前在提取栀子蓝色素固定化过程中,普遍使用戊二醛作为交联剂,然而,有研究表明:戊二醛的使用量控制较严格,固定化酶活力与戊二醛用量成反比,过量的戊二醛会引起不必要的酶分子间交联,而过度的交联会扭曲酶的结构,使酶活力降低。此外,戊二醛的生物毒性限制了其应用范围,因此,亟需寻找一种简单的、无毒的、温和的方法进行酶的高效绿色固定化。利用磁性二氧化硅为载体,通过多巴胺自聚合反应将β-葡萄糖苷酶固定在载体上制备新型固定化酶是绿色固定化方法。
[0004]
β-葡萄糖苷酶(ec 3.2.1.21)又称β-d-葡萄糖苷葡萄糖水解酶,能够水解结合于非还原性末端的β-d-葡萄糖苷键,同时释放出β-d-葡萄糖和相应的配基;亦能够在微水环境下催化逆水解反应合成糖苷类化合物。催化特性决定了β-葡萄糖苷酶在改良果汁风味,果酒增香,茶叶增香,生产大豆异黄酮活性苷元和纤维素降解等多方面具有重要的应用前景。
技术实现要素:
[0005]
为解决栀子蓝色素在固定过程中存在的问题,本发明提出了一种栀子蓝色素的提取方法,制备的栀蓝色素不仅具有人体相容性好、安全性高的特点,而且固定化β-葡萄糖苷酶具有良好的特性。
[0006]
本发明是通过以下技术方案实现的:一种栀子蓝色素的提取方法为以下步骤:
[0007]
(1)固定化β-葡萄糖苷酶的制备;固定化β-葡萄糖苷酶的制备方法为以下步骤:
[0008]
(1.1)fe
3
o
4
纳米粒子的制备;
[0009]
采用溶剂热法制备fe
3
o
4
纳米粒子:首先,将三氯化铁、柠檬酸钠、醋酸钠,在搅拌下依次溶解在乙二醇中,持续搅拌直至形成黄色均向溶液,然后,转移至高压反应釜中,180-220℃下反应8-12h。冷却后,黑色固体依次用水和乙醇洗涤数次,真空下干燥。
[0010]
其中,三氯化铁、柠檬酸钠、醋酸钠的质量比为1∶0.25-0.3∶1.5-2.3,作为优选,乙二醇的使用量为:三氯化铁、柠檬酸钠、醋酸钠的质量和与乙二醇的质量体积比为8-12g∶
100ml。
[0011]
(1.2)fe
3
o
4
@sio
2
纳米粒子的制备;
[0012]
使用改进的水解法制备fe
3
o
4
@sio
2
纳米粒子:在超声作用下,将fe
3
o
4
纳米粒子均匀分散在水、乙醇、氨水的混合体系中,然后,逐滴滴加正硅酸乙酯(teos,ar),室温下搅拌6-7h,磁性分离产物,用水洗去未反应的原料,然后干燥得到fe
3
o
4
@sio
2
纳米粒子。
[0013]
fe
3
o
4
纳米粒子与正硅酸乙酯的质量体积比为:0.1-0.2g∶1ml。
[0014]
混合体系中水、乙醇、氨水体积比为5∶1∶1。
[0015]
作为优选,超声分散的频率80-120hz,时间0.5-1h。
[0016]
(1.3)β-葡萄糖苷酶的固定化。
[0017]
取fe
3
o
4
@sio
2
纳米粒子,在超声作用下,均匀分散在三羟甲基氨基甲烷(tris,纯度≥99.5%)缓冲液中,添加盐酸多巴胺,在室温下搅拌22-26h,磁性分离产物,再用水洗去未反应的多巴胺,得到fe
3
o
4
@sio
2
@pda纳米粒子。再将fe
3
o
4
@sio
2
@pda纳米粒子均匀分散在柠檬酸钠(纯度≥99%)缓冲溶液中,加入β-葡萄糖苷酶,室温下固定化24h。磁性分离产物,再用水洗去未固定上的β-葡萄糖苷酶,得到固定化β-葡萄糖苷酶。
[0018]
fe
3
o
4
@sio
2
纳米粒子与盐酸多巴胺的物质的量之比为1∶8-9。作为优选,fe
3
o
4
@sio
2
纳米粒子与三羟甲基氨基甲烷缓冲液的质量体积比为1.5-2.5mg∶1ml。
[0019]
β-葡萄糖苷酶添加量为50u/g的fe
3
o
4
@sio
2
@pda纳米粒子,作为优选,fe
3
o
4
@sio
2
@pda纳米粒子与柠檬酸钠缓冲溶液的质量体积比为8-12mg∶1ml。
[0020]
本申请使用磁性载体材料作为固定化材料,具有无毒、独特的磁响应性、易与底物固体分离的优点。
[0021]
多巴胺是一种生物神经递质,可在碱性有氧溶液中发生自聚合反应,从而形成一层强力黏附在固体材料表面的聚多巴胺层,具有优良分散性、生物相容性和温和反应条件。
[0022]
(2)从栀子提取京尼苷:从栀子提取京尼苷的提取方法为:
[0023]
(2.1)取干燥的栀子原料粉碎,过20-60目筛,收集粗粉备用;
[0024]
(2.2)酶解:称取粗粉,加入乙醇浸泡,并加入生物酶,在ph值为4-6,温度为40-50℃的条件下浸泡酶解1-2h,得到酶解液;
[0025]
所述的生物酶选自果胶酶、纤维素酶、半纤维素酶中的一种或几种。生物酶的添加量为粗粉重量的0.1%-0.3%。
[0026]
作为优选,粗粉与乙醇的料液比为1g∶3-5ml,其中乙醇的质量浓度为50%-70%。
[0027]
(2.3)将酶解液脱洗,收集脱洗液,干燥后即得京尼苷;
[0028]
具体步骤为:将所得酶解液通过大孔吸附树脂柱,先用2-5倍柱体积的蒸馏水洗脱,再用2-5倍柱体积的质量浓度为60~80%的乙醇洗脱,收集乙醇洗脱液;
[0029]
所述大孔吸附树脂为x-5、lsa-21、wld中的一种;用后试剂可以回收。
[0030]
(3)京尼苷通过β-葡萄糖苷固定化酶提取京尼平;
[0031]
提取方法为以下步骤:称取京尼平苷,添加固定化β-葡萄糖苷酶水溶液,在温度50-60℃,ph为4-5的条件下水解反应,反应的时间为6-8h,得到京尼平。
[0032]
固定化β-葡萄糖苷酶水溶液的添加量为京尼平苷质量的0.1%-0.3%,固定化β-葡萄糖苷酶水溶液的质量浓度为7%-9%。
[0033]
(4)从京尼平提取栀子蓝色素。
[0034]
提取方法为:在京尼平中加入氨基酸,在ph为中性环境下,温度为70-90℃,反应8-12,得到栀子蓝色素。
[0035]
所述的氨基酸包括甲硫氨酸、甘氨酸、赖氨酸、丙氨酸。氨基酸与京尼平的摩尔比为5-7∶1。
[0036]
本发明选用了栀子为基础材料,以核壳式结构的磁性二氧化硅为固定化载体,通过多巴胺自聚合将β-葡萄糖苷酶固定在载体上,优化各种固定化条件。再用所得固定化β-葡萄糖苷酶催化栀子苷。在β-葡萄糖苷酶催化条件下,桅子苷会被水解生成葡萄糖和桅子苷元,继而桅子苷元与氨基酸反应生成桅子蓝色素。
[0037]
所述的一种栀子蓝色素的提取方式得到的栀子蓝色素在食品着色方面具有很好的作用。本发明采用了生物工程技术,提取得到的物质具有食品着色的功能,具有人体相容性好、安全性高的优点。与已有的栀子蓝色素制备方法相比,本工艺运用的磁性纳米粒子材料,能够有效提高栀子蓝色素生产效率,所制备的固定化β-葡萄糖苷酶活力明显优于传统戊二醛交联固定的β-葡萄糖苷酶活力。其反应选择性高,且稳定性好,可回收重复使用。
[0038]
与现有技术相比,本发明的有益效果是:
[0039]
(1)生产过程不会对环境造成污染;
[0040]
(2)所需材料简单易得,生产成本低;
[0041]
(3)所得产物人体相容性好、安全性高;
[0042]
(4)采用的固定化酶的催化活性比游离酶更高;
[0043]
(5)固定化酶的回收率和重复使用率很高。
附图说明
[0044]
图1为栀子蓝色素的hplc图;
[0045]
图2为固定化β-葡萄糖苷酶和游离酶的热力学稳定性;
[0046]
图3为固定化β-葡萄糖苷酶和游离酶的耐酸碱性。
具体实施方式
[0047]
下面通过实施例和附图对本发明作进一步详细说明,实施例中所用原料均可市购或采用常规方法制备。
[0048]
实施例中,超声分散的频率100hz,时间为1h。
[0049]
实施例1
[0050]
(1)固定化β-葡萄糖苷酶的制备:
[0051]
(1.1)fe
3
o
4
纳米粒子的制备:采用溶剂热法制备fe
3
o
4
纳米粒子。首先,称取3g三氯化铁、0.87g柠檬酸钠和6g醋酸钠,在搅拌下依次溶解在100ml乙二醇中,持续搅拌直至形成黄色均相溶液。然后,转移至高压反应釜中,220℃下反应8h,冷却后,黑色固体依次用水和乙醇洗涤数次,真空下干燥24h。
[0052]
(1.2)fe
3
o
4
@sio
2
纳米粒子的制备:使用改进的水解法制备fe
3
o
4
@sio
2
纳米粒子。在超声作用下,将0.2g fe
3
o
4
纳米粒子均匀分散在水、乙醇和氨水的混合体系中。然后,逐滴滴加1.8ml teos,室温下搅拌7h,磁性分离产物,用水洗去未反应的原料,真空下干燥24h.
[0053]
(1.3)β-葡萄糖苷酶的固定化:采用多巴胺自聚合:取300mg fe
3
o
4
@sio
2
纳米粒子,在超声作用下,均匀分散在150ml tris缓冲液中,添加盐酸多巴胺(fe
3
o
4
@sio
2
纳米粒子与盐酸多巴胺的物质的量之比为1∶8),在室温下搅拌24h。磁性分离产物,再用水洗去未反应的多巴胺。将50mg fe
3
o
4
@sio
2
@pda纳米粒子均匀分散在5ml柠檬酸钠缓冲溶液中,按照50u/g载体加入β-葡萄糖苷酶,室温下固定化24h。磁性分离,再用水洗去未固定上的β-葡萄糖苷酶,得到固定化β-葡萄糖苷酶1。
[0054]
(2)栀子提取京尼苷:
[0055]
(2.1)取8g干燥的栀子原料粉碎,过60目筛,收集粗粉备用;
[0056]
(2.2)酶解:称取3g粗粉,加入12ml、60wt%的乙醇浸泡,并加入粗粉重量0.2%的半纤维素酶在ph值为4温度为40℃的条件下浸泡酶解2h;
[0057]
(2.3)将所得酶解液上大孔吸附树脂柱x-5,先用3倍柱体积的蒸馏水洗脱,再用3倍体积、60wt%的乙醇洗脱,收集乙醇洗脱液;回收试剂,真空干燥洗脱液,即得栀子苷,也是京尼平苷;
[0058]
(3)京尼平苷提取京尼平:取1g京尼平苷,添加京尼平苷用量0.1wt%,质量浓度为8%的固定化β-葡萄糖苷酶,在温度50℃ph为4的条件下,进行充分水解反应,反应的时间为6h,得到京尼平;
[0059]
(4)京尼平提取栀子蓝色素:在京尼平中,加入甘氨酸,甘氨酸与京尼平的摩尔比为5∶1,在ph=7.0、温度70℃下反应时间12h;充分反应后,真空干燥得到栀子蓝色素1。
[0060]
实施例2:
[0061]
(1)固定化β-葡萄糖苷酶的制备:
[0062]
(1.1)fe
3
o
4
纳米粒子的制备:采用溶剂热法制备fe
3
o
4
纳米粒子。首先,称取3.25g三氯化铁、0.87g柠檬酸钠和6g醋酸钠,在搅拌下依次溶解在100ml乙二醇中,持续搅拌直至形成黄色均相溶液。然后,转移至高压反应釜中,200℃下反应10h。冷却后,黑色固体依次用水和乙醇洗涤数次,真空下干燥24h。
[0063]
(1.2)fe
3
o
4
@sio
2
纳米粒子的制备:使用改进的水解法制备fe
3
o
4
@sio
2
纳米粒子。在超声作用下,将0.3g fe
3
o
4
纳米粒子均匀分散在水、乙醇和氨水的混合体系中。然后,逐滴滴加1.8ml teos,室温下搅拌6h,磁性分离产物,用水洗去未反应的原料,真空下干燥24h。
[0064]
(1.3)β-葡萄糖苷酶的固定化:采用多巴胺自聚合:取300mg fe
3
o
4
@sio
2
纳米粒子,在超声作用下,均匀分散在150ml tris缓冲液中,添加盐酸多巴胺(fe
3
o
4
@sio
2
纳米粒子与盐酸多巴胺的物质的量之比为1∶8),在室温下搅拌24h。磁性分离产物,再用水洗去未反应的多巴胺。将50mg fe
3
o
4
@sio
2
@pda纳米粒子均匀分散在5ml柠檬酸钠缓冲溶液中,按照50u/g载体加入β-葡萄糖苷酶,室温下固定化24h。磁性分离,再用水洗去未固定上的β-葡萄糖苷酶。得到所需的固定化β-葡萄糖苷酶2。
[0065]
(2)栀子提取京尼苷:
[0066]
(2.1)取8g干燥的栀子原料粉碎,过40目筛,收集粗粉备用;
[0067]
(2.2)酶解:称取3g粗粉,加入9ml、50wt%的乙醇浸泡,并加入粗粉重量0.1%的纤维素酶在ph值为5温度为45℃的条件下浸泡酶解1.5h;
[0068]
(2.3)将酶解液上大孔吸附树脂柱lsa-21,先用3倍柱体积的蒸馏水洗脱,再用3
倍、70wt%的乙醇洗脱,收集乙醇洗脱液;回收试剂,真空干燥即得京尼平苷;
[0069]
(3)京尼平苷提取京尼平:取1g京尼平苷,添加京尼平苷用量的0.2wt%、质量浓度为8%的固定化β-葡萄糖苷酶,在温度55℃ph为4的条件下,进行充分水解反应,反应的时间为7h,得到京尼平;
[0070]
(4)京尼平提取栀子蓝色素:在产物2中,加甲硫氨酸,甲硫氨酸与京尼平苷的摩尔比为6∶1,在ph 7.0,在温度80℃下反应时间10h,充分反应后,真空干燥即可得到栀子蓝色素2。
[0071]
实施例3:
[0072]
(1)固定化β-葡萄糖苷酶的制备:
[0073]
(1.1)fe
3
o
4
纳米粒子的制备:采用溶剂热法制备fe
3
o
4
纳米粒子。首先,称取3.4g三氯化铁、0.87g柠檬酸钠和6g醋酸钠,在搅拌下依次溶解在100ml乙二醇中,持续搅拌直至形成黄色均相溶液。然后,转移至高压反应釜中,180℃下反应12h。冷却后,黑色固体依次用水和乙醇洗涤数次,真空下干燥24h。
[0074]
(1.2)fe
3
o
4
@sio
2
纳米粒子的制备:使用改进的水解法制备fe
3
o
4
@sio
2
纳米粒子。在超声作用下,将0.35g fe
3
o
4
纳米粒子均匀分散在水、乙醇和氨水的混合体系中。然后,逐滴滴加1.8ml teos,室温下搅拌6h,磁性分离产物,用水洗去未反应的原料,真空下干燥24h。
[0075]
(1.3)β-葡萄糖苷酶的固定化:采用多巴胺自聚合:取300mg fe
3
o
4
@sio
2
纳米粒子,在超声作用下,均匀分散在150ml tris缓冲液中,添加盐酸多巴胺(fe
3
o
4
@sio
2
纳米粒子与盐酸多巴胺的物质的量之比为1∶8),在室温下搅拌24h。磁性分离产物,再用水洗去未反应的多巴胺。将50mg fe
3
o
4
@sio
2
@pda纳米粒子均匀分散在5ml柠檬酸钠缓冲溶液中,按照50u/g载体加入β-葡萄糖苷酶,室温下固定化24h。磁性分离,再用水洗去未固定上的β-葡萄糖苷酶。得到所需的固定化β-葡萄糖苷酶3。
[0076]
(2)栀子提取京尼苷:
[0077]
(2.1)取8g干燥的栀子原料粉碎,过20目筛,收集粗粉备用;
[0078]
(2.2)酶解:称取3g粗粉,加入15ml、70wt%的乙醇浸泡,并加入粗粉重量0.3%的果胶酶在ph值为6温度为50℃的条件下浸泡酶解1h;
[0079]
(2.3)将所得酶解液上大孔吸附树脂柱wld,先用3倍柱体积的蒸馏水洗脱,再用3倍、80wt%的乙醇洗脱,收集乙醇洗脱液;回收试剂,真空干燥即得京尼平苷;
[0080]
(3)京尼平苷提取京尼平:取1g京尼平苷,添加京尼平苷用量的0.3wt%、质量浓度为9%的固定化β-葡萄糖苷酶,在温度60℃,ph为5的条件下,进行充分水解反应,反应的时间为6h,得到京尼平;
[0081]
(4)京尼平提取栀子蓝色素:在京尼平中,加入甲硫氨酸,甲硫氨酸与京尼平苷的摩尔比为7∶1,在ph 7.0,温度80℃下反应时间为10h;充分反应后,真空干燥即可得到栀子蓝色素3。
[0082]
对比例1
[0083]
(1)栀子提取京尼苷:
[0084]
(1.1)取8g干燥的栀子原料粉碎,过20-60目筛,收集粗粉备用;
[0085]
(1.2)酶解:称取3g粗粉,加入9ml、50%的乙醇浸泡,并加入粗粉重量0.1%的果胶
酶在ph值为5,温度为45℃的条件下浸泡酶解1.5h;
[0086]
(1.3)将所得浓缩液上大孔吸附树脂柱,先用3倍柱体积的蒸馏水洗脱,再用3倍、70%的乙醇洗脱,收集乙醇洗脱液;回收试剂,真空干燥即得京尼平苷;
[0087]
(2)京尼平苷提取京尼平:取1g京尼平苷,添加京尼平苷用量的0.2wt%,质量浓度为8%的游离β-葡萄糖苷酶,在温度55℃ph为4的条件下,进行充分水解反应,反应的时间为7h,得到京尼平;
[0088]
(3)京尼平提取栀子蓝色素:在京尼平,加入甲硫氨酸,甲硫氨酸与京尼平苷的摩尔比为6∶1,在ph 7.0,温度80℃下反应时间10h;充分反应后,真空干燥即可得到栀子蓝色素。
[0089]
测试例1:
[0090]
以hplc为检测手段,旨在提供一种经济、简单和高效的栀子蓝色素生产工艺。最终得到的物质具有人体相容性好、安全性高的特点。在处理过程中具有节约成本、对环境无害等意义
[0091]
实施例1-3所得到的栀子蓝色素的hplc图如图1所示,由hplc图可知,通过本实验方法,能制得栀子蓝色素。
[0092]
测试例2:
[0093]
(1)实施例1-3所制备的β-葡萄糖苷酶的固载率如表1所示:
[0094]
表1:β-葡萄糖苷酶的固载率
[0095]
实施例123酶的固载率67%72%69%
[0096]
(2)实施例1-3的固定化β-葡萄糖苷酶和对比例的β-葡萄糖苷酶的酶活检测如表2所示。
[0097]
表2:β-葡萄糖苷酶的酶活
[0098]
实施例实施例1实施例2实施例3实施例4酶活/(u
·
g-1
)24.0924.4324.2410.08
[0099]
可见,本发明的固定化β-葡萄糖苷酶的酶活高于普通β-葡萄糖苷酶的酶活。
[0100]
(3)实施例2制备的β-葡萄糖苷酶2和实施例4在不同温度下的热力学稳性曲线如图2所示,说明随着温度的升高,β-葡萄糖苷酶和游离酶的相对酶活力不断下降,固载酶的相对酶活力总是高于游离酶的相对酶活力。不同温度的固载酶和游离酶活力如表3所示。
[0101]
表3:不同温度的固载酶和游离酶活力
[0102][0103]
(4)将固定化β-葡萄糖苷酶和游离β-葡萄糖苷酶分别在ph 2.0~8.0的缓冲液中于30℃条件下处理8h后测定残余酶活力,以各自最高酶活力为100%,计算相对酶活力,结果如图3所示,由图3耐酸碱性可知,固定化β-葡萄糖苷酶ph稳定性明显高于游离酶,且经固
定化后其ph稳定范围变宽,有利于扩大其应用范围。相同温度,不同ph条件下的固定化β-葡萄糖苷酶和游离酶的相对酶活力如表4所示。
[0104]
表4不同ph条件下的固定化酶和游离酶的相对酶活力
[0105][0106]
(5)实施例1-3与对比例所得到的栀子蓝色素的产率如表5所示。
[0107]
表5:(产率/%)
[0108]
实施例实施例1实施例2实施例3对比例产率/%63716943
[0109]
可知,运用固定化酶催化反应的栀子蓝色素的产率高于运用游离酶催化反应的栀子蓝色素的产率。
[0110]
(6)将实施例2所得的栀子蓝色素进行食品安全国家标准检测。
[0111]
①
感官检测:取0.1g实施例2所得栀子蓝色素置于清洁、干燥的白瓷盘中,在自然光线下,观察其色泽和状态,并嗅其气味。经检验,产物为略有特殊的芳香性气味、呈浅紫蓝色的粉末状固体,符合感官要求。
[0112]
②
理化指标检测:将实施例2所得的栀子蓝色素进行理化指标检测,检测结果如表6所示。可知,本工艺所制备的栀子蓝色素是符合食品安全国家标准的优良产品。
[0113]
表6:食品国家安全标准对比
[0114][0115]
以上的实施例是为了说明本发明公开的实施方案,并不能理解为对本发明的限制。此外,本文所列出的各种修改以及发明中方法、组合物的变化,在不脱离本发明的范围和精神的前提下对本领域内的技术人员来说是显而易见的。虽然已结合本发明的多种具体优选实施例对本发明进行了具体的描述,但应当理解,本发明不应仅限于这些具体实施例。事实上,各种如上所述的对本领域内的技术人员来说显而易见的修改来获取发明都应包括在本发明的范围内。
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询

tips


 商标分类
商标分类  商标转让
商标转让 



