一种采用本氏烟作为生物反应器制备的轮状病毒疫苗及其制备方法和应用与流程
 2021-02-02 12:02:49|
2021-02-02 12:02:49| 367|
367| 起点商标网
起点商标网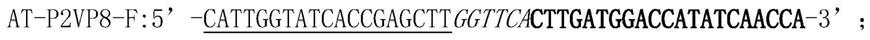
[0001]
本发明属于生物技术领域,具体涉及一种采用本氏烟作为生物反应器制备的轮状病毒疫苗及其制备方法和应用。
背景技术:
[0002]
以植物为生物反应器生产人和动物疫苗,是一种正在极速发展的新型生物技术体系。与鸡胚、动物细胞、昆虫细胞体系相比,因其不被动物病原感染的特征,具备很高的生物安全性。植物易于培养和不需无菌操作等特征,使植物产品具备成本低、周期短、易于扩大规模等优势。
[0003]
轮状病毒(rotavirus)是引起婴幼儿重症腹泻的主要病因,每年造成约几十万病例婴幼儿死亡,接种疫苗是唯一有效的防控手段。通过两剂以上的免疫程序可获得持久性保护,避免重症腹泻的发生。目前上市的rv疫苗均为口服减毒活疫苗,因其潜在的肠套叠风险,被who列为“工艺需要改进的疫苗”。亚单位疫苗由病毒的主要抗原组成并通过注射接种,能有效避免肠套叠的发生。同时亚单位疫苗能实现对流行毒株的精准免疫,应对轮状病毒的变异。
[0004]
轮状病毒主要的中和抗原为vp7(g蛋白)和vp4(p蛋白),vp4在消化道被胰蛋白酶裂解为vp5*和vp8*两个片段,其中vp8*亚单位是病毒粒子识别宿主细胞的位点,在不同毒株之间变化很大,是实现精准免疫的主要抗原之一。
技术实现要素:
[0005]
本发明的目的是提供一种采用本氏烟作为生物反应器制备的轮状病毒疫苗及其制备方法和应用。
[0006]
本发明提供了一种制备p2
-△
vp8*蛋白的方法,包括如下步骤:
[0007]
(1)将重组农杆菌甲侵染本生烟植株,培养植株;
[0008]
(2)取植株被侵染的组织,提取总蛋白;
[0009]
(3)从总蛋白中纯化得到p2
-△
vp8*蛋白。
[0010]
本发明还提供了一种制备p2
-△
vp8*蛋白的方法,包括如下步骤:
[0011]
(1)将重组农杆菌甲和重组农杆菌乙共侵染本生烟植株,培养植株;
[0012]
(2)取植株被侵染的组织,提取总蛋白;
[0013]
(3)从总蛋白中纯化得到p2
-△
vp8*蛋白。
[0014]
本发明还提供了一种制备p2
-△
vp8*蛋白的方法,包括如下步骤:
[0015]
采用本生烟植株作为生物反应器,植株叶片被注射重组农杆菌甲,然后培养4-7天,然后取所述叶片提取总蛋白,然后从总蛋白中纯化得到p2
-△
vp8*蛋白。
[0016]
本发明还提供了一种制备p2
-△
vp8*蛋白的方法,包括如下步骤:
[0017]
采用本生烟植株作为生物反应器,植株叶片被注射重组农杆菌甲和重组农杆菌
乙,然后培养4-7天,然后取所述叶片提取总蛋白,然后从总蛋白中纯化得到p2
-△
vp8*蛋白。
[0018]
以上任一所述p2
-△
vp8*蛋白为如下(a1)或(a2):
[0019]
(a1)序列表的序列1所示的蛋白质;
[0020]
(a2)序列表的序列3所示的蛋白质。
[0021]
重组农杆菌甲是将表达p2
-△
vp8*基因的质粒导入农杆菌得到的;p2
-△
vp8*基因编码p2
-△
vp8*蛋白。
[0022]
重组农杆菌乙是将表达p19基因的质粒导入农杆菌得到的;p19基因编码p19蛋白;p19蛋白为序列表的序列7所示的蛋白质。
[0023]
p19基因来源于番茄丛矮病毒(tomato bushy stunt virus,tbsv)。
[0024]
以上任一所述p2
-△
vp8*基因为如下(b1)或(b2):
[0025]
(b1)编码区如序列表的序列2所示的dna分子;
[0026]
(b2)编码区如序列表的序列4所示的dna分子。
[0027]
以上任一所述p19基因为编码区如序列表的序列6所示的dna分子。
[0028]
以上任一所述农杆菌为农杆菌eha105。
[0029]
以上任一所述培养植株为培养植株4-7天(例如,5天)。
[0030]
以上任一所述总蛋白为可溶性总蛋白。
[0031]
表达p2
-△
vp8*基因的质粒具体可为实施例1构建的重组质粒pat-p2
-△
vp8*。
[0032]
表达p19基因的质粒具体可为质粒pbin61-p19。
[0033]
将重组农杆菌甲和重组农杆菌乙共侵染本生烟植株具体可为:30天苗龄的本生烟植株,在自下至上计的第5个叶片、第6个叶片和第7个叶片的背面注射侵染液。
[0034]
植株叶片被注射重组农杆菌甲和重组农杆菌乙具体可为:30天苗龄的本生烟植株,在自下至上计的第5个叶片、第6个叶片和第7个叶片的背面注射侵染液。
[0035]
侵染液的制备方法:
①
将重组质粒pat-p2
-△
vp8*导入农杆菌eha105,得到重组农杆菌甲;用mma溶液重悬重组农杆菌甲,使体系od
600nm
=1.0,室温静置2-4小时;
②
将质粒pbin61-p19导入农杆菌eha105,得到重组农杆菌乙;用mma溶液重悬重组农杆菌乙,使体系od
600nm
=1.0,室温静置2-4小时;
③
将4体积份步骤
①
得到的农杆菌菌液和1体积份步骤
②
得到的农杆菌菌液混合,然后用mma溶液稀释至体系od
600nm
=0.1,即为侵染液。
[0036]
所述取植株被侵染的组织,具体可为取被注射过的本叶片。
[0037]
提取总蛋白的方法包括如下步骤:取被注射过的本叶片,在预冷的研钵中研磨成粉末,然后按照1g叶片(鲜重)配比2ml蛋白提取缓冲液的比例加入蛋白提取缓冲液,4℃振荡30分钟;然后4℃、15000g离心15分钟,收集上清液;取所述上清液,4℃、15000g离心15分钟,收集上清液。
[0038]
从总蛋白中纯化得到p2
-△
vp8*蛋白包括如下步骤:取提取总蛋白得到的上清液,采用ni-nta agarose进行纯化,然后采用孔径为3kda超滤管进行浓缩,收集浓缩液,然后将缓冲体系更换为蛋白缓冲液,得到的溶液即为p2
-△
vp8
*
蛋白溶液。
[0039]
采用ni-nta agarose(qiagen)进行纯化的具体参数可为:每5ml上清液配比1ml ni-nta agarose,4℃结合2小时;然后用3倍柱体积的wash缓冲液洗涤;然后用3倍柱体积洗脱缓冲液洗脱,以收集目标蛋白。
[0040]
将缓冲体系更换为蛋白缓冲液采用zeba
tm spin desalting columns。
[0041]
以上任一所述方法制备得到的p2
-△
vp8*蛋白或p2
-△
vp8
*
蛋白溶液均属于本发明的保护范围。
[0042]
本发明还保护p2
-△
vp8*蛋白,为如下(a1)或(a2):
[0043]
(a1)序列表的序列1所示的蛋白质;
[0044]
(a2)序列表的序列3所示的蛋白质。
[0045]
本发明还保护p2
-△
vp8*基因,为如下(b1)或(b2):
[0046]
(b1)编码区如序列表的序列2所示的dna分子;
[0047]
(b2)编码区如序列表的序列4所示的dna分子。
[0048]
本发明还保护用于制备p2
-△
vp8*蛋白的试剂盒,包括如下(c1)或(c2)或(c3)或(c4)或(c5)或(c6):
[0049]
(c1)p2
-△
vp8*基因;
[0050]
(c2)质粒甲;所述质粒甲为表达p2
-△
vp8*基因的质粒;
[0051]
(c3)重组农杆菌甲;重组农杆菌甲是将质粒甲导入农杆菌得到的重组农杆菌;
[0052]
(c4)p2
-△
vp8*基因和p19基因;
[0053]
(c5)质粒甲和质粒乙;所述质粒甲为表达p2
-△
vp8*基因的质粒;所述质粒乙为表达p19基因的质粒;
[0054]
(c6)重组农杆菌甲和重组农杆菌乙;重组农杆菌甲是将质粒甲导入农杆菌得到的重组农杆菌;重组农杆菌乙是将质粒乙导入农杆菌得到的重组农杆菌。
[0055]
p2
-△
vp8*基因编码p2
-△
vp8*蛋白。
[0056]
p2
-△
vp8*蛋白为如下(a1)或(a2):
[0057]
(a1)序列表的序列1所示的蛋白质;
[0058]
(a2)序列表的序列3所示的蛋白质。
[0059]
p2
-△
vp8*基因为如下(b1)或(b2):
[0060]
(b1)编码区如序列表的序列2所示的dna分子;
[0061]
(b2)编码区如序列表的序列4所示的dna分子。
[0062]
p19基因编码p19蛋白;p19蛋白为序列表的序列7所示的蛋白质。
[0063]
p19基因为编码区如序列表的序列6所示的dna分子。
[0064]
所述农杆菌为农杆菌eha105。
[0065]
所述试剂盒还包括本生烟。
[0066]
(c1)或(c4)所述试剂盒,还包括植物病毒表达载体pat-p2或质粒p35s-30b。
[0067]
(c1)或(c4)所述试剂盒,还包括农杆菌。
[0068]
(c2)或(c5)所述试剂盒,还包括农杆菌。
[0069]
以上任一所述表达p2
-△
vp8*基因的质粒中具有如下元件:35s启动子、tmv的复制酶和运动蛋白、所述p2
-△
vp8*基因、tmv的3
’
末端非翻译区、35s终止子。
[0070]
tmv即烟草花叶病毒。
[0071]
以上任一所述表达p2
-△
vp8*基因的质粒是以植物病毒表达载体pat-p2为出发载体,借助sali和xhoi酶切位点插入外源dna分子得到的。
[0072]
植物病毒表达载体pat-p2:将质粒p35s-30b用paci和kpni酶切,然后引入序列表
rotavirus ssrnas are neither infectious nor translated in permissive cells.plos one.8(9):e74328,2013.。
[0091]
质粒p35s-30b(即文献中的plasmid p35s-30b),记载于如下文献:hongge jia,yongqi pang,rongxiang fang*.agroinoculation as a simple way to deliver a tobacco mosaic virus-based expression vector.acta botanica sinica 45:770-773,2003。
[0092]
质粒pbin61-p19表达序列表的序列6所示的p19基因,p19基因编码的蛋白质具有抑制外源基因沉默的作用。质粒pbin61-p19,记载于如下文献:frank sainsbury,eva c.thuenemann,george p.lomonossoff*.peaq:versatile expression vectors for easy and quick transient expression of heterologous proteins in plants.plant biotechnology journal 7(7):682-693,2009.。
[0093]
本生烟(nicotiana benthamiana),记载于如下文献:michael m.goodin*,david zaitlin,rayapati a.naidu,and steven a.lommel.nicotiana benthamiana:its history and future as a model for plant
–
pathogen interactions.molecular plant-microbe interactions 21(8):1015
–
1026,2008。
[0094]
实施例1、重组质粒pat-p2
-△
vp8*的构建
[0095]
1、取轮状病毒rf毒株,提取总rna,反转录得到cdna。
[0096]
2、以步骤1得到的cdna为模板,采用at-p2vp8-f和at-p2vp8-r组成的引物对进行pcr扩增,回收pcr扩增产物。
[0097][0098][0099]
引物中,下划线区域用于与载体进行同源重组,粗体为靶序列特异性序列,斜体为linker序列(编码gly-ser)。
[0100]
3、将质粒p35s-30b用paci和kpni酶切,然后引入序列表的序列5所示的dna分子,得到植物病毒表达载体pat-p2。植物病毒表达载体pat-p2中依次具有:35s启动子;tmv的复制酶和运动蛋白;his
6
标签编码序列、tev蛋白酶识别位点编码序列、破伤风毒素的t细胞表位p2编码序列、sali酶切识别序列(gtcgac)、xhoi酶切识别序列(ctcgag);tmv的3
’
末端非翻译区;35s终止子。tmv即烟草花叶病毒。
[0101]
4、取植物病毒表达载体pat-p2,用限制性内切酶sali和xhoi酶进行双酶切,回收载体骨架。
[0102]
5、将步骤2得到的pcr扩增产物和步骤4得到的载体骨架进行同源重组,得到重组质粒pat-p2
-△
vp8*。
[0103]
重组质粒pat-p2
-△
vp8*已进行测序验证。
[0104]
重组质粒pat-p2
-△
vp8*中,具有序列表的序列4所示的dna分子,编码序列表的序列3所示的蛋白质(命名为p2
-△
vp8
*
蛋白)。
[0105]
重组质粒pat-p2
-△
vp8*的酶切鉴定结果见图1。图1中,m对应dna marker,泳道1对应重组质粒pat-p2
-△
vp8*,泳道2对应重组质粒pat-p2
-△
vp8*的ncoi和kpni酶切产物。
[0106]
实施例2、利用本氏烟作为生物反应器制备p2
-△
vp8
*
蛋白
[0107]
mma溶液(ph5.6):含10mm mgcl
2
、10mm mes、100μm as,溶剂为水。
[0108]
蛋白提取缓冲液(ph7.5):含50mm tris、150mm nacl、10%(体积百分含量)glycerol、20mm imidazole、1
×
complete protease inhibitor cocktail,溶剂为水。
[0109]
一、制备侵染液
[0110]
1、将重组质粒pat-p2
-△
vp8*导入农杆菌eha105,得到重组农杆菌;用mma溶液重悬重组农杆菌,使体系od
600nm
=1.0,室温静置2-4小时。
[0111]
2、将质粒pbin61-p19导入农杆菌eha105,得到重组农杆菌;用mma溶液重悬重组农杆菌,使体系od
600nm
=1.0,室温静置2-4小时。
[0112]
3、将4体积份步骤1得到的农杆菌菌液和1体积份步骤2得到的农杆菌菌液混合,然后用mma溶液稀释至体系od
600nm
=0.1,即为侵染液。
[0113]
二、制备p2
-△
vp8
*
重组蛋白
[0114]
在温室培养本生烟植株。
[0115]
1、30天苗龄的本生烟植株,在自下至上计的第5个叶片、第6个叶片和第7个叶片的背面注射步骤一制备的侵染液(使整个叶片注满,每个叶片约注射500μl),然后继续培养5天(实际应用中,培养4-7天均可),然后收获被注射过的本叶片。
[0116]
2、取步骤1得到的叶片,在预冷的研钵中研磨成粉末,然后按照1g叶片(鲜重)配比2ml蛋白提取缓冲液的比例加入蛋白提取缓冲液,4℃振荡30分钟;然后4℃、15000g离心15分钟,收集上清液;取所述上清液,4℃、15000g离心15分钟,收集上清液。上清液中,总蛋白浓度约为5μg/μl。
[0117]
3、30天苗龄的本生烟植株,在自下至上计的第5个叶片、第6个叶片和第7个叶片的背面注射mma溶液(使整个叶片注满,每个叶片约注射500μl),然后继续培养5天,然后收获被注射过的本叶片。
[0118]
4、取步骤3得到的叶片,在预冷的研钵中研磨成粉末,然后按照1g叶片(鲜重)配比2ml蛋白提取缓冲液的比例加入蛋白提取缓冲液,4℃振荡30分钟;然后4℃、15000g离心15分钟,收集上清液;取所述上清液,4℃、15000g离心15分钟,收集上清液。
[0119]
5、取步骤2得到的上清液(含有总可溶性蛋白)或步骤4得到的上清液(含有总可溶性蛋白),进行western blot。western blot采用his-tag抗体(sigma-aldrich公司,货号为sab2702220)。结果见图2。图2中,泳道m对应蛋白marker,泳道1对应步骤4得到的上清液(蛋白上样量为40μg),泳道2对应步骤2得到的上清液(蛋白上样量为40μg)。箭头表示p2
-△
vp8*蛋白,分子量为22kda。
[0120]
6、取步骤2得到的上清液,采用ni-nta agarose(qiagen)进行纯化。具体参数:每5ml上清液配比1ml ni-nta agarose,4℃结合2小时;然后用3倍柱体积的wash缓冲液洗涤;然后用3倍柱体积的洗脱缓冲液洗脱,以收集目标蛋白。
[0121]
wash缓冲液(ph7.4):含50mm tris、150mm nacl、10%(体积百分含量)glycerol,40mm imidazole,溶剂为水。
[0122]
洗脱缓冲液(ph7.4):含50mm tris、150mm nacl、10%(体积百分含量)glycerol,200mm imidazole,溶剂为水。
[0123]
7、取步骤6得到的过柱后溶液,采用孔径为3kda超滤管(millipore)进行浓缩,收集浓缩液。
[0124]
8、取步骤7得到的浓缩液,采用zeba
tm spin desalting columns将缓冲体系更换为蛋白缓冲液,得到的溶液即为p2
-△
vp8
*
蛋白溶液。
[0125]
蛋白缓冲液(ph7.4):含50mm tris、150mm nacl、10%(体积百分含量)glycerol,溶剂为水。
[0126]
9、取p2
-△
vp8
*
蛋白溶液,进行聚丙烯酰胺凝胶电泳,电泳图见图3。图3中,m对应蛋白marker,泳道1对应p2
-△
vp8
*
蛋白溶液。经过灰度扫描,p2
-△
vp8
*
蛋白溶液中p2
-△
vp8
*
蛋白的纯度为80%。
[0127]
检测p2
-△
vp8
*
蛋白溶液的总蛋白浓度,按照80%纯度换算p2
-△
vp8
*
蛋白的浓度,再与步骤2的总蛋白浓度进行参比,p2
-△
vp8*重组蛋白占本氏烟总可溶蛋白的比例高达10%。
[0128]
实施例3、p2
-△
vp8
*
蛋白作为疫苗的应用
[0129]
试验动物:5-6周龄balb/c雌性小鼠。
[0130]
佐剂为alum佐剂,thermo fisher scientific,货号为77161。
[0131]
蛋白缓冲液(ph7.4):含50mm tris、150mm nacl、10%(体积百分含量)glycerol,溶剂为水。
[0132]
免疫过程:试验第1天,进行第1次免疫;试验第15天进行第2次免疫;试验第29天进行第3次免疫。
[0133]
疫苗组:将实施例2制备的p2
-△
vp8
*
蛋白溶液用蛋白缓冲液稀释,然后和佐剂等体积混匀并乳化,然后免疫试验动物;单只试验动物的单次免疫体积为100μl;单只试验动物的p2
-△
vp8
*
蛋白的单次免疫剂量为2μg。p2
-△
vp8
*
蛋白的量=p2
-△
vp8
*
蛋白溶液的总蛋白量
×
80%。
[0134]
无疫苗组:将蛋白缓冲液和佐剂等体积混匀并乳化,然后免疫试验动物;单只试验动物的单次免疫体积为100μl。
[0135]
一、检测中和抗体效价
[0136]
疫苗组的10只试验动物,试验第43天和试验第57天取眼眶血,分离血清,即为供试血清。检测供试血清的中和抗体滴度。
[0137]
1、将ma104细胞传代至96孔板中,培养16-20小时。
[0138]
2、取供试血清,60℃水浴30min以灭活补体,然后采用含2μg/ml胰酶的mem培养基进行4倍梯度稀释,得到各个血清稀释液。
[0139]
3、取轮状病毒rf毒株,加入无edta胰酶并使其浓度为10μg/ml,然后37℃孵育1小时,然后用含2μg/ml胰酶的mem培养基稀释至200tcid
50
。
[0140]
4、将步骤2得到的血清稀释液和步骤3得到的病毒液等体积混合,37℃孵育1小时。
[0141]
5、完成步骤1后,用mem培养基清洗细胞3遍,然后每孔加入20μl步骤4得到的混合液,37℃孵育1h。
[0142]
6、完成步骤5后,吸弃上清,加入含2μg/ml胰酶的mem培养基,37℃培养3天。
[0143]
7、完成步骤6后,观察细胞病变情况,计算血清中和抗体效价。
[0144][0145]
lg(tcid
50
)=高于50%血清稀释度的对数-距离比
×
稀释系数的对数=n
[0146]
tcid
50
=10
n
,20μl
[0147]
10
n
=1:m,即1:m的血清可保护细胞不病变,即为该份血清的中和抗体效价。
[0148]
试验第43天中和抗体滴度达到1:301,试验第57天中和抗体滴度达到1:500。
[0149]
二、动物保护试验
[0150]
试验第50天的试验动物和balb/c雄性小鼠合笼,雌鼠自然受孕,分娩后获得乳鼠。
[0151]
疫苗组试验动物获得的8天龄乳鼠分为两组,一组作为疫苗-攻毒组(30只),另一组作为疫苗-对照组(30只)。无疫苗组试验动物获得的8天龄乳鼠,作为无疫苗-攻毒组(30只)。
[0152]
攻毒组:攻毒当天,将母鼠与乳鼠分离,乳鼠饥饿处理1h,并称重记录;采用轮状病毒rf毒株病毒液进行灌胃攻毒,病毒液的tcid
50
为10-6.5
/ml,每只乳鼠灌胃100μl病毒液。对照组:用等体积ph7.4的pbs缓冲液代替病毒液,其他同攻毒组。
[0153]
攻毒后0-7天,每天观察乳鼠精神状态、腹泻情况根据粪便的颜色、软硬、数量等对乳鼠腹泻进行评分(0-4)。具体评分标准:无0,棕色成形1,棕色软2,黄色软3,黄色稀水样4,肛周粪便污染4。大于2认为腹泻。3为轻度腹泻,4为重度腹泻。将乳鼠的腹泻情况进行记录。
[0154]
无疫苗保护时,腹泻从攻毒后一天开始,持续4-6天;疫苗保护后,腹泻从攻毒第3天开始,持续1-2天。见图4(**,p<0.01;***,p<0.001;****,p<0.0001)。结果表明,p2
-△
vp8*免疫使乳鼠不腹泻或腹泻时长大大缩短。
[0155]
在1-6天收集的所有粪便样本中,88.5%的样本表现为不腹泻。见图5。乳鼠攻毒后,64%的乳鼠表现为不发生腹泻,其余36%的乳鼠轻度腹泻持续1-2天,基本不产生重度腹泻。
[0156]
以上对本发明进行了详述。对于本领域技术人员来说,在不脱离本发明的宗旨和范围,以及无需进行不必要的实验情况下,可在等同参数、浓度和条件下,在较宽范围内实施本发明。虽然本发明给出了特殊的实施例,应该理解为,可以对本发明作进一步的改进。总之,按本发明的原理,本申请欲包括任何变更、用途或对本发明的改进,包括脱离了本申请中已公开范围,而用本领域已知的常规技术进行的改变。按以下附带的权利要求的范围,可以进行一些基本特征的应用。
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询

tips


 商标分类
商标分类  商标转让
商标转让 



