一种通过林可链霉菌调控基因组合改造提高林可霉素产量的方法与流程
 2021-02-02 12:02:45|
2021-02-02 12:02:45| 402|
402| 起点商标网
起点商标网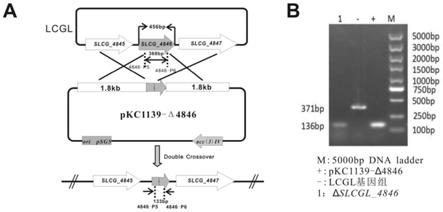
[0001]
本发明涉及基因工程技术领域,尤其涉及一种通过林可链霉菌调控基因组合改造提高林可霉素产量的方法。
背景技术:
[0002]
抗生素是一类可抑制致病菌生长的次级代谢产物,其半数以上的产生菌是链霉菌。本发明所涉及的林可链霉菌属于链霉菌的一种,所产抗生素为林可霉素,在临床上主要用于治疗革兰氏阳性菌引起的感染,其衍生物克林霉素在治疗细菌感染尤其是厌氧菌感染方面效果更佳。
[0003]
林可链霉菌的遗传改造从未间断,传统的诱变方法不但耗时,随机性也较大,并不适合进一步进行遗传改造。二十一世纪以来,新颖高效的基因工程技术,如大片段同源重组、cre/loxp以及cripsr/cas 9,为遗传改良林可链霉菌提高林可霉素生物合成的产量带来了机遇。
[0004]
林可霉素是由丙基脯氨酸(ppl)和林可酰胺(lsm)缩合后修饰形成的,在此过程中受多种调控因子作用。近年来,已发现多种调控因子,如lrp、tetr、bldd、lmbu、blda和adpa,调控林可霉素的生物合成。然而,较其它抗生素而言,林可霉素的生物合成调控研究还比较有限,不利于定向改造林可链霉菌获得高产菌株。本发明目的就是通过基因工程途径组合敲除两个调控基因来获得林可霉素高产菌株,用于林可霉素或中间产物生产,并为改造多个调控基因奠定基础。
[0005]
lrp(leucine-responsive regulatory protein)家族是一类广泛存在于细菌和古细菌中的转录调控因子,参与控制微生物菌毛生成、重金属转运、多肽运输、能量代谢等多种重要的生理过程。近年来报道了放线菌多种lrp/asnc家族转录调控子参与抗生素产量和形态分化,比如bkdr、sco2140、sace_lrp、sco3361、sace_5717、slcg_lrp等,暗示着lrp家族调控基因在放线菌抗生素生物合成中的重要性。
[0006]
tetr家族转录调控因子(tetr family transcriptional regulators,tfrs)在调控抗生素的生物合成、菌体的形态分化、药物外排、初级代谢、群体感应和应对渗透胁迫等生理过程中发挥着重要作用。近年来报道了多种参与抗生素产量和链霉菌形态分化有关的tfrs,如sav_576、sav_3619、sco_1712、atra、slcg_2919等,暗示着tetr家族调控基因在链霉菌次级代谢及抗生素生物合成中的重要性。
技术实现要素:
[0007]
本发明目的就是为了弥补已有技术的缺陷,提供一种通过林可链霉菌调控基因组合改造提高林可霉素产量的方法,进一步提高林可霉素的产量,获得林可霉素高产菌株。在林可链霉菌的基因组中含多个编码lrp家族转录调控因子的基因,同时对这些基因进行敲除实验后发现:缺失slcg_4846基因后,菌株的林可霉素产量较出发菌株提高了23%。在缺
失突变株中回补slcg_4846基因,林可霉素产量恢复至出发菌株水平,表明slcg_4846负向调控林可霉素的生物合成。之后在工业菌株la219x中敲除slcg_4846,突变株产量显著提高,增幅达11.5%。
[0008]
本实验室前期发现tetr家族转录调控因子slcg_2919对林可霉素的生物合成具有负调控效应。
[0009]
为进一步提高林可霉素产量,本发明对slcg_4846和slcg_2919这两个调控因子进行了组合改造,获得了双敲菌株la219xδ4846-2919。
[0010]
本发明是通过以下技术方案实现的:
[0011]
一种通过林可链霉菌调控基因组合改造提高林可霉素产量的方法,将林可链霉菌中编码lrp家族转录调控因子和tetr家族转录调控因子的基因组合利用同源重组进行无痕敲除,敲除后获得菌株,利用获得的菌株发酵生产林可霉素。
[0012]
在所述的同源重组无痕敲除过程中不引入抗性基因,且在同一菌株中连续进行多次敲除实验。
[0013]
所述编码lrp家族转录调控因子的基因为slcg_4846基因,tetr家族转录调控因子的基因为slcg_2919基因,且slcg_4846和slcg_2919基因产物均可负向调控林可霉素生物合成。
[0014]
构建方法具体如下:
[0015]
(1)以林可链霉菌高产菌株lcgl基因组为模板,以4846-p1和4846-p2为引物扩增出slcg_4846上游片段;以4846-p3和4846-p4为引物扩增出slcg_4846下游片段;
[0016]
(2)将slcg_4846上下游片段以酶切、连接的方式,连接到pkc1139载体上,构建pkc1139-δ4846载体;
[0017]
(3)将pkc1139-δ4846载体转化至林可链霉菌lcgl中,筛选后获得slcg_4846缺失突变株δslcgl_4846。
[0018]
上述缺失突变株在发酵水平提高林可霉素产量的应用。
[0019]
在工业菌株la219x中对slcg_4846进行改造,改造方法如下:
[0020]
(1)以林可链霉菌高产菌株la219x基因组为模板,以4846-p1和4846-p2为引物扩增出slcg_4846上游片段;以4846-p3和4846-p4为引物扩增出slcg_4846下游片段;
[0021]
(2)将slcg_4846上下游片段以酶切、连接的方式,连接到pkc1139载体上,构建pkc1139-δ4846载体;
[0022]
(3)将pkc1139-δ4846载体转化至林可链霉菌la219x中,筛选后获得slcg_4846缺失突变株la219xδ4846。
[0023]
上述工业突变株在发酵水平提高林可霉素产量的应用。
[0024]
在缺失突变株la219xδ4846基础上构建组合缺失突变株,构建方法如下:
[0025]
(1)以林可链霉菌高产菌株la219x基因组为模板,以2919-p1和2919-p2为引物扩增出slcg_2919上游片段;以2919-p3和2919-p4为引物扩增出slcg_2919下游片段;
[0026]
(2)将slcg_2919上下游片段以酶切、连接的方式,连接到pkc1139载体上,构建pkc1139-δ2919载体;
[0027]
(3)将pkc1139-δ2919载体转化至工业缺失突变株la219xδ4846中,筛选后获得组合缺失突变株la219xδ4846-2919。
[0028]
组合缺失突变株在发酵水平提高林可霉素产量的应用。
[0029]
本发明的优点是:
[0030]
本发明研究中筛选到了林可霉素生物合成负调控子slcg_4846,通过基因工程途径缺失林可链霉菌染色体上slcg_4846基因,能够获得林可霉素高产菌株。
[0031]
slcg_2919负向调控林可霉素的生物合成。在林可链霉菌中敲除slcg_2919,林可霉素产量显著提高。为寻求更加高产的林可链霉菌,本发明对slcg_4846和slcg_2919这两种调控基因进行了组合改造,获得了林可链霉菌la219xδ4846-2919,林可霉素产量进一步提高,为工业生产提高林可霉素发酵产量提供技术支持。此外,在林可链霉菌中组合敲除两种调控基因尚属首例。
[0032]
上述组合改造菌株构建方法简单,敲除过程中不引入抗性基因,这既降低了发酵成本,也保证了遗传的稳定性。同时,敲除并不影响菌体生长。最重要的是,可在同一菌株中连续进行多次敲除实验,为高产菌株的进一步改造奠定了基础。
附图说明
[0033]
图1为slcg_4846基因及周边邻近基因在染色体上的位置信息。
[0034]
图2为δslcgl_4846突变体构建示意图及缺失突变株的pcr鉴定,其中:
[0035]
(a)δslcgl_4846突变体构建示意图;
[0036]
(b)δslcgl_4846突变体的pcr鉴定。
[0037]
图3为slcg_4846基因回补菌株的构建,δslcgl_4846/pib139-4846回补菌株与δslcgl_4846/pib139回补空载菌株的pcr鉴定:pcr产物为apr抗性基因(776bp)。
[0038]
图4为slcg_4846基因对菌株形态分化的影响及δslcgl_4846突变株生物量的测定,其中:
[0039]
(a)δslcgl_4846突变株和出发菌株lcgl菌株菌丝体的生物量测定;
[0040]
(b)δslcgl_4846突变株和出发菌株lcgl菌株的孢子生长情况。
[0041]
图5为出发菌株lcgl、缺失突变株δslcgl_4846以及缺失回补菌株及回补空载对照菌株林可霉素的hplc分析。
[0042]
图6为la219xδ4846-2919突变体构建示意图及缺失突变株的pcr鉴定:
[0043]
(a)la219xδ4846-2919突变体构建示意图;
[0044]
(b)la219xδ4846-2919突变体的pcr鉴定。
[0045]
图7为slcg_4846和slcg_2919基因对菌株形态分化的影响及la219xδ4846突变株生物量的测定,其中:
[0046]
(a)la219xδ4846-2919突变株和出发菌株la219x菌株菌丝体的生物量测定;
[0047]
(b)la219xδ4846-2919突变株和出发菌株la219x菌株的孢子生长情况。
[0048]
图8为出发菌株la219x、单敲突变株la219xδ4846和双敲突变株la219xδ4846-2919的林可霉素产量分析。
具体实施方式
[0049]
以下结合具体的实例对本发明的技术方案做进一步说明:
[0050]
实施例中使用到的菌株和质粒见表1,合成的引物序列见表2。大肠杆菌在37℃的
液体lb培养基或在添加1.25%琼脂的固体lb平板上培养。林可霉素产生菌林可链霉菌及其工程菌株在30℃胰蛋白胨大豆肉汤(tsby)培养基或在含有2.2%琼脂的mgm平板上培养。
[0051]
实施例中使用的材料中peg3350、溶菌酶、tes、酪蛋白氨基酸、硫链丝菌肽、安普霉素从sigma公司购买。tsb、酵母提取物、蛋白胨购买于oxoid公司。甘氨酸、琼脂粉、氯化钠和其它生物学试剂都购于试剂公司。大肠杆菌和林可链霉菌的一般操作技术按照标准操作。引物的合成和dna测序由生工生物工程(上海)股份有限公司完成。
[0052]
表1研究中所用的菌种和质粒
[0053][0054][0055]
表2本研究所用引物
[0056][0057]
实施例1
[0058]
slcg_4846基因缺失突变体的构建:
[0059]
如图1、2所示,为了敲除林可链霉菌中的slcg_4846基因,分别用4846-p1/4846-p2和4846-p3/4846-p4为引物、林可链霉菌lcgl基因组为模板,pcr扩增slcg_4846基因的上、下游各约1.8kb的同源片段。同时将上述两个4846-u和4846-d上下游片段连接到pkc1139载体上,完成构建质粒pkc1139δ4846,如图2中a所示。利用原生质体转化技术,将pkc1139δ4846质粒转化到林可链霉菌原生质体中,根据安普霉素抗性筛选阳性突变株,获得slcg_4846基因敲除的基因工程菌株。以4846-p5和4846-p6作为鉴定引物,以质粒pkc1139δ4846为阳性模板,lcgl基因组为阴性模板进行pcr鉴定,阳性缺失突变体命名为δslcgl_4846(如图2中b所示)。
[0060]
实施例2
[0061]
slcg_4846基因回复菌株的构建:
[0062]
利用设计的引物4846-p7和4846-p8扩增出slcg_4846基因,并电泳回收,使用ndei和xbai内切酶分别对回收到的slcg_4846基因片段与pib139进行双酶切并回收,通过t4 dna连接酶将slcg_4846基因片段连接到pib139上,成功获得质粒pib139-4846。然后通过peg介导的原生质体转化方法将pib139-4846和pib139导入δslcgl_4846原生质体中。通过安普霉素初步筛选,以安普霉素抗性基因(apr,776bp)为对象进行pcr鉴定,获得的回复菌
株命名为δslcgl_4846/pib139-4846和回补空载菌株δslcgl_4846/pib139(见图3)。
[0063]
实施例3
[0064]
林可链霉菌菌丝体生物量检测:
[0065]
以相同的接种量分别将δslcgl_4846突变株与lcgl接种于的液体tsby中,30℃摇床培养48小时后,转接到50mlymg培养基中30℃转速240rpm摇床培养7d,期间设置不同时间段取样,用无水乙醇清洗后烘干称量菌体干重,每次重复取样两次,并取得平均值,测量结束后根据实验数据绘制菌体生物量曲线,如图4中b所示,缺失slcg_4846基因不会对菌体的生物量产生明显影响。
[0066]
实施例4
[0067]
林可链霉菌孢子形态观察:
[0068]
在工业培养基上做好标记,以相同的接种量分别将lcgl和δslcgl_4846的孢子甘油菌液,涂布在工业培养基上,超净台中晾干后置于30℃恒温培养箱中倒置生长。每隔24h观察并记录孢子生长情况,如图4中a所示,slcg_4846的缺失不影响菌体的孢子形态。
[0069]
实施例5
[0070]
林可链霉菌发酵产物hplc检测:
[0071]
将lcgl、δslcgl_4846、δslcgl_4846/pib139和δslcgl_4846/pib139-4846孢子甘油菌液涂布在斜面培养基上培养7d后,挖1cm
2
接种于种子培养基,在30℃振荡培养48小时后,转接至发酵培养基,30℃振荡培养7d,然后取2ml菌液12000rpm离心10min;再取200ul上清加800ul无水乙醇混匀,12000rpm离心10分钟;最后将上清通过有机滤膜注入检测瓶中进行产量检测,如图5所示,相比于出发菌株lcgl,δslcgl_4846突变株林可霉素a产量提高了23%,当在δslcgl_4846中回补了slcg_4846后,突变株林可霉素a产量回复到出发菌株的水平,说明slcg_4846对林可霉素生物合成起负向调控作用。之后对工业菌株la219x、单敲菌株la219xδ4846和双敲菌株la219xδ4846-2919也进行了发酵实验,对其发酵产物hplc检测后发现:如图8所示,单敲菌株la219xδ4846的产量达2.80g/l,较出发菌株提高了11.5%,双敲突变株la219xδ4846-2919的产量较单敲菌株提高12.1%,较出发菌株提高了25.1%。双敲突变株构建过程参考上述实施例1,生物量检测及孢子形态观察参照实施例3、4,具体如图6、图7所示。
[0072]
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询

tips


 商标分类
商标分类  商标转让
商标转让 



