一种倍半萜合酶IlTPS1,编码核苷酸序列及其应用的制作方法
 2021-02-02 12:02:21|
2021-02-02 12:02:21| 491|
491| 起点商标网
起点商标网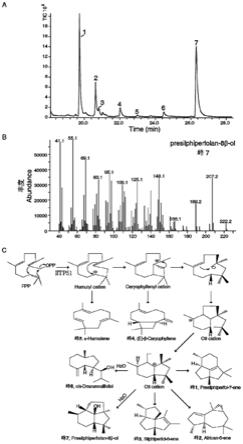
一种倍半萜合酶iltps1,编码核苷酸序列及其应用
技术领域
[0001]
本发明属于合成生物学领域,涉及一种倍半萜合酶iltps1,编码核苷酸序列及其应用。
背景技术:
[0002]
倍半萜类化合物是菊科植物的特征化合物和主要活性成分,具有显著的生物学和药理学活性,如抗菌、抗炎、抗肿瘤等,是非常重要的植物活性天然产物。其中,presilphiperfolan-8β-ol是一种结构极其新颖的桥连三环presilphiperfolane型倍半萜化合物,同时也是很多活性显著的聚环倍半萜化合物的生物合成前体,具有极高的产业应用潜力,引起了植物化学、化学合成和药理学等领域研究者们的广泛关注,被《natural product reports》立为重点研究对象。
[0003]
然而,该类倍半萜化合物在自然界中分布稀少且天然含量极低,仅在少数几种植物(如旋复花属植物inula lineariifolia)和真菌(灰霉病菌botrytis cinerea)中被发现。原料的匮乏限制了对该类物质的开发和利用,尽管presilphiperfolan-8β-ol的化学合成已取得成功,但因其合成步骤冗长,产率较低,合成成本高,且引起环境污染等问题,仍达不到工业化生产需求。
[0004]
因此,为实现presilphiperfolan-8β-ol的工业化生产及应用,挖掘合成presilphiperfolan-8β-ol的倍半萜合酶基因,继而利用合成生物学策略大量合成presilphiperfolan-8β-ol十分必要。
技术实现要素:
[0005]
为了有效解决presilphiperfolane-8β-ol资源稀缺及其产业应用有限的现状,本发明提供一种倍半萜合酶iltps1、编码核苷酸序列及其应用。本发明还具体提供了一种高产presilphiperfolane-8β-ol的酵母工程菌株。
[0006]
本发明第一方面提供了一种倍半萜合酶iltps1,所述iltps1的氨基酸序列包含或由如下序列组成:
[0007]
a)seq id no.1所示的氨基酸序列;或,
[0008]
b)与seq id no.1所示的氨基酸序列具有至少75%序列相似性的功能性同源序列;或
[0009]
c)在seq id no.1所示的氨基酸序列中添加、缺失、替换一个或多个氨基酸且具有倍半萜合酶iltps1活性的氨基酸序列。
[0010]
本申请的发明人通过大规模的资源筛选,从菊科药用植物线叶旋复花inula lineariifolia中筛选分离得到了一个倍半萜合酶基因iltps1,并成功获得该基因的编码蛋白(本发明中也命名为iltps1)。功能分析发现iltps1催化底物fpp(farnesyl diphosphate,法尼基二磷酸)生成7个倍半萜类化合物,其中presilphiperfolane-8β-ol为主要产物,约占41.19%,倍半萜合酶基因iltps1为生产presilphiperfolane-8β-ol提供了
no.2的核苷酸序列杂交,且能够编码倍半萜合酶iltps1的核苷酸序列。
[0025]
示例性地,所述“严格条件”是指探针将与其靶序列杂交至可探测程度超过与其它序列杂交(如至少2倍于背景)的条件。严格条件具有序列依赖性,且因环境的不同而不同。通过控制杂交和/或洗涤条件的严格性,可以鉴定与探针100%互补的靶序列。可选择地,可以调节严格条件以允许一些序列错配,使得探测到较低程度的相似性。
[0026]
本发明第三方面提供了所述倍半萜合酶iltps1,或,所述的编码倍半萜合酶iltps1的核苷酸序列在合成倍半萜,尤其是合成presilphiperfolane-8β-ol中的应用。
[0027]
其中,所述倍半萜合酶iltps1在合成presilphiperfolane-8β-ol(倍半萜)中的应用包括以下几个方面:(1)本发明所提供的iltps1氨基酸序列或至少部分序列的多肽可能在去除或替代某些氨基酸之后仍有生物活性甚至有新的生物学活性,或者提高了产量或优化了蛋白动力学特征或其他致力于得到的性质;(2)涉及presilphiperfolane-8β-ol的生物合成;(3)涉及presilphiperfolane-8β-ol抑制真菌活性。
[0028]
所述的编码倍半萜合酶iltps1的核苷酸序列在合成presilphiperfolane-8β-ol(倍半萜)中的应用包括以下几个方面:(1)本发明所提供的核苷酸序列或至少部分核苷酸序列被修饰或突变,修饰或突变的途径包括插入、缺失,聚合酶链式反应(pcr),易错pcr,不同序列的重新连接,序列的不同部分或与其他来源的同源序列进行定向进化,或通过化学试剂诱变等。(2)本发明所提供的核苷酸序列或至少部分核苷酸序列的克隆基因通过合适的表达体系在外源宿主中表达以得到相应的酶或其他更高的生物活性或产量。(3)本发明所提供的核苷酸序列或至少部分核苷酸序列的基因或基因簇可以通过遗传重组来构建重组质粒以获得新型生物合成途径,也可以通过插入、置换、缺失或失活进而获得新型生物合成途径。
[0029]
本发明第四方面提供了载体,所述载体导入了所述的核苷酸序列。
[0030]
对于载体的种类不作具体限定,可以根据需要选择适合的载体。例如载体包括但不限于pesc-ura、pesc-trp、pesc-leu、pesc-his、pgex2t、ptaex3、pusa、pymb03或pht43,优选pesc-ura。
[0031]
本发明第五方面提供了遗传工程化的宿主细胞,其包含所述的氨基酸序列,或包含所述的核苷酸序列,或导入了所述的载体。
[0032]
进一步,所述的宿主细胞包括植物细胞和/或微生物细胞;
[0033]
进一步,所述植物体也包括如外植体的植物部分,包括但不限于:插条、组织培养物、细胞悬浮液和愈伤组织。
[0034]
进一步,所述植物更优选为旋复花、线叶旋复花细胞和发根、烟草细胞、青蒿细胞。
[0035]
进一步,所述微生物细胞包括但不限于链霉菌、假单孢菌、芽孢杆菌、酵母细胞、大肠杆菌。
[0036]
进一步,在体内和体外将编码倍半萜合酶iltps1的核苷酸序列,或所述的重组质粒,或所述的表达载体引入宿主细胞的方法包括但不限于电穿孔、聚乙二醇(peg)转化、脂质转染、热休克、磷酸钙沉淀、病毒介导和显微注射。
[0037]
本发明第六方面提供一种生产倍半萜的酵母工程菌株,该菌株包含有甲羟戊酸途径相关基因和倍半萜合成的相关基因。
[0038]
进一步,所述甲羟戊酸途径的相关基因包括羟甲基戊二酰辅酶a还原酶基因hmgr,
麦角甾醇通路调控基因upc2-1和法尼基焦磷酸合酶基因fps;所述倍半萜合成的基因包括所述iltps1核苷酸序列。
[0039]
采用下述制备方法获得:将n末端截断的hmgr基因,upc2-1基因分别整合到酵母基因组中,替换启动子弱化分路代谢流,再将fps基因整合到酵母基因组中,最后导入含有所述iltps1核苷酸序列的载体。
[0040]
进一步,所述的生产倍半萜的酵母工程菌株,将2个拷贝数的n末端截断的hmgr基因构建在半乳糖启动子gal1下整合到酵母基因组中,整合位点为酵母逆转录转座子的长重复序列位点。
[0041]
进一步,所述的生产倍半萜的酵母工程菌株,将upc2-1构建在半乳糖启动子gal1下整合到酵母基因组中,整合位点为酵母逆转录转座子的长重复序列位点。
[0042]
进一步,所述的生产倍半萜的酵母工程菌株,用甲硫氨酸抑制型启动子p
met3
替代鲨烯合酶erg9自身启动子,弱化分路代谢流。
[0043]
进一步,所述的生产倍半萜的酵母工程菌株,将fps基因构建在半乳糖启动子gal1下整合到酵母基因组中,整合位点为酵母逆转录转座子的长重复序列位点。
[0044]
进一步,所述的生产倍半萜的酵母工程菌株为含有pesc-ura::iltps1质粒的酿酒酵母菌。
[0045]
本发明第七方面提供了一种生产倍半萜的方法,所述方法包括在所述的倍半萜合酶iltps1存在下将法尼基二磷酸转化成倍半萜化合物,优选生产presilphiperfolane-8β-ol;或,
[0046]
使用所述的遗传工程化的宿主细胞,或所述的酵母工程菌生产倍半萜,优选生产presilphiperfolane-8β-ol。
[0047]
本发明第八方面提供了生产presilphiperfolane-8β-ol倍半萜的宿主细胞在抑制真菌中的应用,所述宿主细胞包含所述的iltps1氨基酸序列和/或核苷酸序列。
[0048]
进一步地,所述真菌包括稻黑孢n.oryzae。
[0049]
进一步地,所述宿主细胞优选所述生产倍半萜(presilphiperfolane-8β-ol)的酵母工程菌株。
[0050]
进一步地,本发明提供了所述酵母工程菌株粗提物和/或发酵液在抑制稻黑孢n.oryzae中的应用。
[0051]
本发明采用上述技术方案具有以下有益效果:
[0052]
(1)本发明提供了一种倍半萜合酶iltps1,催化fpp生成7个倍半萜类化合物,presilphiperfolane-8β-ol为主要产物,为生产presilphiperfolane-8β-ol提供了新的基因资源,有效缓解了presilphiperfolane-8β-ol资源稀缺及其产业应用有限的现状。
[0053]
(2)本发明进一步提供了一种高产presilphiperfolane-8β-ol的工程酵母菌株,可以用于工业化生产presilphiperfolane-8β-ol,具有显著产业应用价值及经济价值。
[0054]
(3)本发明提供了生产presilphiperfolane-8β-ol倍半萜的宿主细胞在抑制真菌中的应用,相应粗提物和/或发酵液可开发为新型环保型生物农药,具有显著经济和生态价值。
附图说明
[0055]
图1所示为iltps1体外生化活性分析结果。其中,a:gc-ms检测iltps1酶促产物的总离子色谱图(tic);b:iltps1主要酶促产物presilphiperfolane-8β-ol(峰7)的质谱图,母离子和特征离子分别为m/z 222和m/z 207;c:iltps1催化底物fpp生成7个倍半萜产物的反应机理示意图。
[0056]
图2所示为工程酵母菌株eyp300/iltps1的生长势及主要产物含量变化图。其中,a:gc-ms检测工程酵母菌eyp300/iltps1合成presilphiperfolane型倍半萜化合物的色谱图(提取离子m/z 204和m/z 207);b:工程酵母菌eyp300/iltps1主要合成产物presilphiperfolane-8β-ol(峰7)的质谱图,母离子和特征离子分别为m/z 222和m/z 207;c:不同诱导时间下,eyp300/iltps1生长势(od600)和3个主要产物(presilphiperfolane-8β-ol,presilphiperfol-7-ene和silphiperfol-6-ene)含量变化趋势图。
[0057]
图3所示为工程酵母菌epy300/iltps1发酵粗提物抑菌活性结果。其中,a为稻黑菌n.oryzae在空载体工程酵母菌epy300/pesc-ura粗提物的pda平板上生长情况;b,c,d分别为n.oryzae在涂有5mg
·
l-1
,25mg
·
l-1
和50mg
·
l-1
工程酵母菌epy300/iltps1发酵粗提物的pda平板上生长情况。
具体实施方式
[0058]
本发明中,术语“iltps1”可以表示倍半萜合酶,或presilphiperfolane-8β-ol合酶,或presilphiperfolane-8β-ol合酶基因,或编码presilphiperfolane-8β-ol合酶的核苷酸序列,具体所指的含义可以结合上下文判断。
[0059]
本发明中,术语“基因”被定义为在染色体中占据特定位置并包含对植株潜在的表型特征或性状作出贡献的遗传指令的遗传单位(通常用dna序列表示)。
[0060]
本发明中,术语“核苷酸”以本领域技术人员理解的一般含义。
[0061]
本发明中,术语“氨基酸”是指任何氨基酸(标准和非标准氨基酸二者),包括但不限于α-氨基酸、β-氨基酸、γ-氨基酸和δ-氨基酸。适合的氨基酸的实例包括但不限于丙氨酸、天冬酰胺、天冬氨酸、半胱氨酸、谷氨酸、谷氨酰胺、甘氨酸、脯氨酸、丝氨酸、酪氨酸、精氨酸、组氨酸、异亮氨酸、亮氨酸、赖氨酸、蛋氨酸、苯基丙氨酸、苏氨酸、色氨酸和缬氨酸。
[0062]
本发明中,所述的“严格条件”可为低严格条件、中严格条件、高严格条件中的任一种。“低严格条件”,例如,为5
×
ssc、5
×
denhardt溶液、0.5%sds、50%甲酰胺、32℃的条件。“中严格条件”,例如,为5
×
ssc、5
×
denhardt溶液、0.5%sds、50%甲酰胺、42℃的条件。“高严格条件”,例如,为5
×
ssc、5
×
denhardt溶液、0.5%sds、50%甲酰胺、50℃的条件。在上述条件中,越提高温度,越能期待高效地获得具有高同源性的dna。影响杂交严格性的因素可为温度、探针浓度、探针长度、离子强度、时间、盐浓度等多种因素,本领域技术人员通过适宜选择这些因素,可实现同样的严格条件。
[0063]
除非另有定义,本发明中所使用的所有科学和技术术语具有与本发明涉及技术领域的技术人员通常理解的相同的含义。
[0064]
下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实
施例,都属于本发明保护的范围。
[0065]
下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
[0066]
下面结合具体实施例详细描述本发明,这些实施例用于理解而不是限制本发明。
[0067]
实施例1 iltps1基因的克隆及表达纯化
[0068]
1.iltps1基因的克隆和序列分析
[0069]
以功能已知的向日葵吉玛烯a合酶(hagas;genbank accession no.q4u3f7.2)和青蒿紫穗槐二烯合酶(aaads;genbank accession no.cab94691.1)为靶基因序列在线叶旋覆花i.lineariifolia花的转录组数据库中搜索(evalue<0.00001),找到1条有完整开放阅读框的倍半萜烯合酶基因,命名为iltps1(i.lineariifolia terpene synthase 1)。其中,经过序列比对分析发现:iltps1读码框氨基酸序列与洋甘菊matricaria recutita三环倍半萜烯合酶(mrtps2;genbank accession no.jq255376.1)最近似,同源性为70.73%,核苷酸相似性为75.98%;iltps1读码框氨基酸序列和核苷酸序列分别为seq id no.1和seq id no.2所示。
[0070]
以iltps1基因的核苷酸序列为依据,设计iltps1基因与载体上谷胱甘肽-s转移酶(gst)融合表达的引物p1和p2,引物包含bamh i和ecor i酶切位点序列。以线叶旋覆花i.lineariifolia花的cdna为模板,采用pcr方法扩增iltps1基因,与经bamh i和ecor i双酶切的线性pgex2t载体重组,采用hieff clone
tm
一步克隆试剂盒(yeasen,china)克隆并测序,阳性重组质粒命名为pgex2t-iltps1。
[0071]
其中iltps1的扩增引物p1和p2序列如下:
[0072]
p1:5
’-
ctggttccgcgtggatccatgcccatggatgttaagcg-3
’
(seq id no.3下划线为载体序列)
[0073]
p2:5
’-
tcagtcacgatgaattctcatatagtgatagcagcaac-3
’
(seq id no.4下划线为载体序列)
[0074]
2.iltps1的表达纯化
[0075]
(1)iltps1-gst融合蛋白诱导表达:将构建好的融合表达载体pgex2t-iltps1转入大肠杆菌bl21中,获得bl21/pgex2t-iltps1转基因菌株;挑取阳性单克隆接种于lb培养基中(含100μg
·
ml-1
的ampicillin),37℃过夜培养;取过夜培养物按1:100的比例于300ml新鲜lb培养基中(含100μg
·
ml-1
的ampicillin),37℃扩大培养至od600值为0.4-0.6;加入iptg(异丙基硫代半乳糖苷)至终浓度为1.0mmol
·
l-1
,置于16℃恒温摇床160rpm诱导表达12小时;4,000g,4℃条件下离心2分钟收集菌体,用于纯化。
[0076]
(2)iltps1-gst融合蛋白纯化:将收集的菌体重悬于gst提取缓冲液(100mm磷酸钾,ph8.0,500mm nacl)中,于4℃条件下超声波降解法破壁,裂解后重组蛋白于4,000g,4℃条件下离心20分钟,将上清加载到1.5ml gst标签纯化树脂填料柱中(ge healthcare,http://www3.gehealthcare.com/),经除杂后使用谷胱甘肽洗脱缓冲液[50mm2-amino-2-(hydroxymethyl)-1,3-propanediol(tris)-hcl,ph8.0,10mm还原型谷胱甘肽]洗脱。纯化后的重组iltps1-gst使用30kda超滤管(millipore,http://www.merckmillipore.com/cn/zh)浓缩,并保存于酶反应缓冲液(25mm tris-cl,ph 7.5,10%甘油,1mm二硫苏糖醇dtt,1mg
·
ml-1
牛血清白蛋白bsa,10mm mgcl
2
,1mm mncl
2
)中,重组蛋白iltps1-gst的含量和纯度分别用bca蛋白检测试剂盒(beyotime,china)、bsa标准品和sds-page凝胶电泳检查。结
果表明iltps1-gst为可溶性表达蛋白,纯化的蛋白纯度高达98%以上,以bsa标准蛋白估算浓度为2.5μg
·
μl-1
。
[0077]
实施例2 iltps1的生化功能分析
[0078]
iltps1-gst体外活性:500μl体外酶促反应体系中包含100μg纯化蛋白,100μm法尼基焦磷酸fpp(sigma-aldrich)和酶反应缓冲液(25mm tris-cl,ph 7.5,10%甘油,1mm二硫苏糖醇dtt,1mg
·
ml-1
牛血清白蛋白bsa,10mm mgcl
2
,1mm mncl
2
),反应混合物覆盖500μl正戊烷(macklin,gc-ms级),于30℃水浴锅中反应2小时,轻微漩涡混匀后,12,000rpm离心1分钟,收集上层正戊烷放入一个新的2ml进样品中,氮吹仪上浓缩至50μl,转移到内插管中,用气相色谱质谱(gc-ms)仪器进行酶促产物的定性和定量分析。对照组为重组蛋白iltps1-gst于100℃灭活10min的反应产物。gc-ms仪器为安捷伦7890b/7000c(美国waldbronn安捷伦科技),质谱检测器参数:70ev,氦气流速1.2ml
·
min-1
,色谱柱安捷伦hp-5ms(5%苯基甲基氧化硅,30m
×
250μm内径,0.25μm膜厚度),进样体积2μl;柱温箱温度程序如下:45℃持续1分钟,然后5℃
·
min-1
梯度上升到250℃,250℃保持5分钟。进样口温度为250℃;扫描质荷比(m/z)为40-350,以混合烷烃(c
8-c
20
)对照品的保留时间来计算酶促产物的相对保留时间,并通过比对mass finder 4.0萜类化合物数据库进行产物的定性分析。
[0079]
体外生化功能分析如图1所示,图1中a的结果表明iltps1-gst能催化底物fpp生成多种桥连三环倍半萜烯化合物,其中峰1,2和7为其主要酶促产物,峰3、4、5和6为微量副产物;通过检索mass finder 4.0萜类化合物数据库,比对相对保留时间和离子碎片模式,峰1暂定性为presilphiperfol-7-ene(占总产物的35.21%),峰2为african-5-ene(13.29%),峰7暂定性为presilphiperfolane-8β-ol(41.19%),峰3为silphiperfol-6-ene(3.10%),峰4为(e)-β-caryophyllene(4.27%),峰5为α-humulene(0.70%)和峰6为cis-dracunculifoliol(2.24%)。因presilphiperfolane-8β-ol是iltps1-gst体外酶促反应的最高产物,暂将iltps1命名为presilphiperfolane-8β-ol(倍半萜)合酶。
[0080]
实施例3酶促产物峰7的制备和结构解析
[0081]
为了大量制备主要酶促产物峰7用于结构解析,5ml体外酶促反应体系中包含2mg纯化蛋白,终浓度200μm法尼基焦磷酸fpp(sigma-aldrich)和酶反应缓冲液(25mm tris-cl,ph 7.5,10%甘油,1mm二硫苏糖醇dtt,1mg
·
ml-1
牛血清白蛋白bsa,10mm mgcl
2
,1mm mncl
2
),反应混合物覆盖3ml正戊烷(macklin,gc-ms级),于30℃水浴锅中反应12小时,轻微漩涡混匀后,5,000rpm离心1分钟,收集上层正戊烷;3ml正戊烷重复萃取两次,合并3次提取液后,于氮吹仪上浓缩,gc-ms定性分析后进一步浓缩挥发干,溶于氘代苯c
6
d
6
中,样品直接用于nmr(nuclear magnetic resonance)分析。
[0082]
bruker avance iii 700mhz核磁共振波谱仪(bruker biospin,germany)被用于nmr试验,温度298k,5mm外径nmr管,采集数据包括一维
1
h和6个二维nmr谱图(tocsy,cosy,j-res,noesy,hsqc,hmbc)。化学位移参照氘代-(d6)苯,
1
h为7.21ppm,
13
c为128.4ppm。核磁数据归属表(700mhz,c
6
d
6
)见表1,根据1维和2维nmr试验结果,进一步证实iltps1催化fpp的主要酶促产物峰7为presilphiperfolane-8β-ol,因此,将iltps1命名为presilphiperfolane-8β-ol合酶。
[0083]
表1核磁数据归属表(700mhz,c
6
d
6
)
[0084][0085]
a:高磁场位移;b:低磁场位移;d:双峰;m:多峰;s:单峰
[0086]
实施例4工程菌株的构建及生产presilphiperfolane-8β-ol的方法
[0087]
1.酵母工程菌株的构建
[0088]
高产倍半萜类前体法尼基焦磷酸fpp的底盘工程酵母菌株为epy300(s288c,mata his3δ1leu2δ0p
gal1
–
thmg1::δ1p
gal1
–
upc2-1::δ2erg9::p
met3
–
erg9::his3 p
gal1
–
erg20::δ3p
gal1
–
thmg1::δ4)(ro et al.,2006),代谢改造甲羟戊酸途径相关基因,如hmgr,upc2-1和fps,以及替换erg9的启动子,具体改造过程如下:
[0089]
i.将2个拷贝数的n末端截断的hmgr基因构建在半乳糖启动子gal1下整合到酵母基因组中(donald,hampton,&fritz,1997);
[0090]
ii.将调控酵母麦角甾醇合成途径基因的upc2-1构建在半乳糖启动子gal1下整合到酵母基因组中(davies,wang,&rine,2005);
[0091]
iii.用甲硫氨酸抑制型启动子p
met3
替代erg9自身启动子,弱化分路代谢流;
[0092]
iv.将fps基因构建在半乳糖启动子gal1下整合到酵母基因组中。
[0093]
上述整合位点均为酵母逆转录转座子的长重复序列位点。
[0094]
最后,设计引物p3和p4,以重组质粒pgex2t-iltps1为模板,高保真酶pcr扩增iltps1基因,并通过hieff clone
tm
一步克隆试剂盒(yeasen,china)将其构建在半乳糖诱导型酵母表达载体pesc-ura的gal1启动子下,得到重组质粒pesc-ura::iltps1,进一步通过peg/liac的方法导入底盘菌株epy300中,获得产presilphiperfolane-8β-ol的工程菌株epy300/iltps1,同时通过导入空载体pesc-ura获得对照工程菌株epy300/pesc-ura。
[0095]
pcr基因特异引物如下:
[0096]
p3:5
’-
cgggatccatgcccatggatgttaagcg-3
’
(seq id no.5,下划线为载体序列)
[0097]
p4:5
’-
ggggtacctcatatagtgatagcagcaac-3
’
(seq id no.6,下划线为载体序列)
[0098]
2.工程菌发酵生产presilphiperfolane-8β-ol的方法
[0099]
工程菌生长势及合成presilphiperfolane-8β-ol能力的检测:随机挑取5个单克隆酿酒酵母工程菌epy300/iltps1接种于4ml含有2%葡萄糖的sd-ura-液体培养基中,于30℃,250rpm摇床中培养24小时,700g离心6分钟收集菌体,用无菌去离子水洗涤菌体三次后重悬于25ml诱导培养基(含0.2%葡萄糖,1.8%半乳糖,终浓度1mm的蛋氨酸met和100μm mops,省却尿嘧啶ura,覆盖2ml十二烷)中诱导培养,分别取诱导12,24,36,48,60,72,84,96,120和144小时的下层液体菌100μl和上层十二烷10μl,下层菌体样品稀释10倍后紫外分光光度计检测吸光值od600,上层十二烷有机层12,000rpm离心5分钟后,置于内插管中gc-ms检测代谢物;gc-ms检测方法中除了将5℃
·
min-1
升温梯度改为10℃
·
min-1
以外,分析仪器和其余方法同实施例2,三次独立生物学重复。
[0100]
25ml酵母菌置于50ml三角瓶,覆盖2ml十二烷,于4℃,250rpm条件下培养;生长势od600为波长600nm下,不同诱导培养时间酵母菌的吸光值,presilphiperfolane型倍半萜化合物含量为gc-ms定量分析不同诱导培养时间下覆盖的1μl十二烷中产物含量,以乙酸壬酯为对照品,外标法定量。
[0101]
吸光值od600结果表明(图2c):从12小时的0.82到24小时的1.40为工程菌快速生长期,随后进入缓慢生长期,144小时达到最大1.72;gc-ms检测结果表明(图2a和2b):工程菌发酵产生了与体外酶促反应类似的倍半萜类化合物,检索mass finder 4.0数据库和比对相对保留指数及离子碎片裂解规律,9个产物分别被鉴定为:7αh-presilphiperfol-5-ene,presilphiperfol-7-ene,7βh-presilphiperfol-5-ene,african-5-ene,silphiperfol-6-ene,(e)-β-caryophyllene,α-humulene,cis-dracunculifoliol和presilphiperfolan-8β-ol;其中产量排名前三的产物为presilphiperfolan-8β-ol,presilphiperfol-7-ene和silphiperfol-6-ene;诱导12-48小时三个产物均呈现对数增长趋势,48-96小时进入缓慢增长期,96-144小时倍半萜烯醇产物presilphiperfolan-8β-ol的产量一直缓慢上升,144小时产量达到最高,为111.19mg
·
l-1
;而两个倍半萜烯产物presilphiperfol-7-ene和silphiperfol-6-ene则呈现下降趋势,均在72小时产量最高,分别为48.58和13.97(图2c)。
[0102]
实施例5生产presilphiperfolane-8β-ol工程菌发酵液的抑菌活性检测
[0103]
工程菌发酵液制备:参照实施例4中生产presilphiperfolane-8β-ol的方法,并将工程菌epy300/iltps1的诱导培养体积扩大为100ml,十二烷覆盖收集体积放大为5ml;阴性对照为转空载体对照的工程菌株epy300/pesc-ura,相同诱导和十二烷覆盖体积;诱导48小时后收集十二烷层发酵液,以乙酸壬酯为对照品,外标法定量presilphiperfolane-8β-ol
浓度约为50.45mg
·
l-1
。
[0104]
抑菌活性:真菌稻黑孢n.oryzae分离自猕猴桃,于马铃薯葡萄糖琼脂potato dextrose agar(pda)培养基中30℃活化两次后用于抑制试验。50.45mg
·
l-1
的发酵液用十二烷依次稀释至终浓度为5mg
·
l-1
,25mg
·
l-1
和50mg
·
l-1
,150μl各稀释液与100μl初始菌体(od600为0.04)均匀混合后涂于pda平板,阴性对照为150μl工程菌epy300/pesc-ura发酵液与100μl相同初始菌体混合涂于pda平板,平板于30℃黑暗培养48小时后拍照,三次生物学重复。
[0105]
结果表明稻黑孢菌n.oryzae在阴性pda平板上生长旺盛,然而在涂有5mg
·
l-1
,25mg
·
l-1
和50mg
·
l-1
工程菌epy300/iltps1发酵液的pda平板上生长由旺盛逐步变弱,展现抑制稻黑孢n.oryzae的活性(图3)。
[0106]
综上所述,本发明提供一种产presilphiperfolane-8β-ol的倍半萜合酶iltps1,酵母工程菌株epy300/iltps1,及其抑制真菌的应用,可被用于工业化生产presilphiperfolane-8β-ol和开发成为新型生物农药,具有显著经济和生态价值。
[0107]
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换等,均应包含在本发明的保护范围之内。
[0108]
本发明提供的生产倍半萜的酵母工程菌株,其实施过程中使用的底盘工程酵母菌株及模板重组质粒等生物材料在申请日前已被公开,可被公众获得;本发明也公开了制备所述酵母工程菌株的具体实施方法及过程,本领域技术人员可以在本发明公开内容基础上重复实施,因此按照专利法实施细则的规定,无需提供保藏证明,特此说明。
[0109]
参考文献
[0110]
ro,d.-k.,paradise,e.m.,ouellet,m.,fisher,k.j.,newman,k.l.,ndungu,j.m.,et al.(2006).production of the anti-malarial drug precursor artemisinic acid in engineered yeast.nature,440,940
–
943.
[0111]
donald,k.a.g.,hampton,r.y.,&fritz,i.b.(1997).effects of overproduction of the catalytic domain of 3-hydroxy-3-methylglutaryl coenzyme a reductase on squalene synthesis in saccharomyces cerevisiae.applied and environmental microbiology,63,3341
–
3344.
[0112]
davies,b.s.j.,wang,h.s.,&rine,j.(2005).dual activators of the sterol biosynthetic pathway of saccharomyces cerevisiae:similar activation/regulatory domains but different response mechanisms.molecular and cellular biology,25,7375
–
7385.
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询

tips


 商标分类
商标分类  商标转让
商标转让 



