一种线粒体靶向的基因编辑复合体、制备方法、应用及线粒体基因组编辑方法与流程
 2021-02-02 12:02:19|
2021-02-02 12:02:19| 475|
475| 起点商标网
起点商标网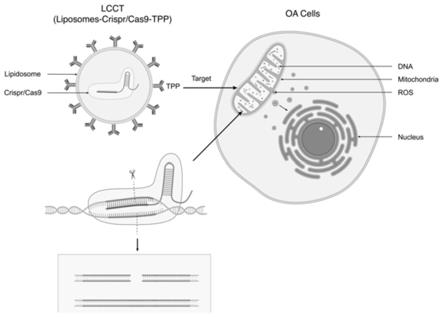
[0001]
本发明涉及生物技术领域,尤其是涉及一种线粒体靶向的基因编辑复合体、制备方法、应用及线粒体基因组编辑方法。
背景技术:
[0002]
骨关节炎(osteoarthritis,oa)是骨科常见的关节疾病,随着人口老龄化加重其患病率也在增加。近年来越来越多的证据表明,氧化应激是骨关节炎发病的一个重要机制。氧化应激不仅导致软骨破坏,同时参与炎症介质的分泌和降解过程,促进从临床无症状的软骨破坏到明显骨关节炎的过渡。氧化应激是氧化和抗氧化系统平衡失调,导致活性氧(reactive oxygenspecies,ros)在机体中大量积聚,对人体内细胞组分的过度氧化,因此氧化应激被认为是导致衰老和疾病的一个重要因素。
[0003]
研究表明,抗氧化基因的突变和下调是导致氧化应激的重要原因,而氧化应激过程中ros聚集也会导致基因的进一步损伤,所以在氧化应激的发生和进展中,基因改变既是原因又是结果。因此维持ros的平衡(主要限制ros的过量产生)是治疗氧化应激相关疾病例如氧化应激的潜在手段。
[0004]
目前氧化应激的治疗策略多采用抗氧化剂去改善氧化与抗氧化系统平衡,这是一种通过减弱或者抵消多余ros的治疗策略,没有从根本上治疗 ros增加的原因。这是一种治标不治本的方式,只能通过外源性的抗氧化剂维持细胞内氧化与抗氧化的平衡,没有从源头上探究ros过度产生的原因,不能从根本上减少ros的过度释放,因此它需要长期的维持治疗甚至终生用药,它可能给机体带来不可预计的严重后果,同时这种方式也给社会带来了沉重的经济负担。因此,急需开发一种新的氧化应激治疗策略。
[0005]
线粒体呼吸链在氧化应激中扮演重要角色,当线粒体呼吸链的结构受损,抑制线粒体的复合体i,会增加ros。然而,目前对氧化应激的治疗策略没有正视或者强调线粒体结构和功能变化所起的作用,而是一味单纯地施加抗氧化剂,这样常规抗氧化剂进入细胞后,会没有选择性的与细胞内的细胞器结合,不可避免的与一些不需要结合的靶点形成稳定的结合,这样可能会对正常的生理功能产生影响,不仅不能治疗氧化应激,还可能对细胞有害。
[0006]
目前的线粒体基因治疗的主要思路是编辑更正突变的基因,或促使异质性的转变,以降低突变型与野生型基因组的比例,从而达到治疗作用,代表性方式是线粒体dna碱基编辑,这种方式最大的劣势标记效率很低,难以恢复靶标基因功能。
[0007]
鉴于此,特提出本发明。
技术实现要素:
[0008]
本发明的目的在于提供一种线粒体靶向的基因编辑复合体(lcct, liposomes-crispr/cas9-tpp)、制备方法、应用及线粒体基因组编辑方法,通过将线粒体靶向手段和
crispr/cas9技术结合构建一种线粒体靶向的基因编辑复合体,导入正常的线粒体tert基因功能片段代替错配的基因,实现对线粒体基因组的编辑,通过上调线粒体tert基因来改善氧化应激水平。
[0009]
在一个方面,本发明提供了一种线粒体靶向的基因编辑复合体,所述复合体包括:
[0010]
线粒体靶向的阳离子脂质体;和
[0011]
mtcrispr/cas9系统:线粒体tert基因双链同源模板、特异性靶向 tert基因的crrna、rna同源重组修复模板以及cas9蛋白。
[0012]
细胞线粒体端粒酶逆转录酶(telomerase reverse transcriptase,tert)被抑制与氧化应激的发生具有显著的相关性,正常细胞线粒体的tert基因表达是显著高于氧化应激环境下的细胞线粒体。靶向上调线粒体基因tert 基因是改善氧化应激的重要途径。
[0013]
crispr/cas9系统通过crrna-cas9体系使间区序列邻近基序 (protospacer adjacentmotif,pam)3
’
端前与crrna互补的目标dna产生双链断裂(double-strand breaks,dsb),之后可以选择通过同源介导的双链 dna修复(homology-directed repair,hdr)对dna进行修复,以实现对基因组的编辑。本发明通过线粒体靶向的基因编辑复合体,将修饰有的线粒体靶向剂的阳离子脂质体包裹着crispr/cas9系统和同源修复模板,合成了一种线粒体靶向性的基因编辑复合体,用于靶向调控tert基因的表达。
[0014]
在一个实施方案中,本发明采用的所述crrna的对应的核苷酸序列如 seq id no.1所示。
[0015]
在一个实施方案中,所述线粒体靶向的阳离子脂质体包括阳离子脂质体、线粒体靶向剂以及脂质体修饰剂;
[0016]
优选地,所述线粒体靶向剂选自三苯基膦或线粒体定位肽;
[0017]
优选地,所述脂质体修饰剂为马来酰亚胺聚乙二醇-fitc胶束溶液。
[0018]
在一个实施方案中,所述cas9为蛋白为具有线粒体选择性的 mito-cas9,所述cas9蛋白的n端融合有线粒体定位信号 (mitochondrial-targeting sequence,mts)。
[0019]
在一个实施方案中,所述线粒体tert基因双链同源模板为报告基因标记的;所述报告基因可选自mcherry、gfp、5-moutp、t-sapphire和 mtagbfp等,优选为mcherry。
[0020]
选择恰当的载体,使目的基因靶向、可控并有效地表达,是基因治疗成功的关键。本发明采用的是一种阳离子脂质体载体,它具有转染效率高、表面易修饰的优势,更重要的是相对于常规的腺病毒基因载体显著的降低了免疫排次反应。
[0021]
在一个具体的实施方案中,为了实现线粒体靶向功能,本发明在阳离子脂质体上面修饰了一个经典的线粒体靶向剂三苯基膦。
[0022]
本发明还提供了一种药物,所述药物包含所述基因编辑复合体。
[0023]
另一方面,本发明提供了所述基因编辑复合体的制备方法,所述方法包括以下步骤:
[0024]
a)合成线粒体靶向的阳离子脂质体;
[0025]
b)将所述线粒体tert基因双链同源模板、特异性靶向tert的crrna、 rna同源重组修复模板以及cas9蛋白装载于步骤a)的线粒体靶向的阳离子脂质体中,合成线粒体靶向的基因编辑复合体。
[0026]
在一个实施方案中,所述步骤a)包括:用磷脂与胆固醇合成普通脂质体,用线粒体
靶向剂修饰脂质体赋予脂质体线粒体靶向性能;然后以脂质体修饰剂共价修饰脂质体;优选地,所述脂质体修饰剂为马来酰亚胺聚乙二醇-fitc胶束溶液。
[0027]
在一个具体实施方案中,用阳离子脂质体用磷脂(dotap)与胆固醇 (chol)合成普通脂质体(liposomes);以经典的线粒体靶向剂三苯基膦修饰脂质体,赋予脂质体线粒体靶向性能;在此基础上,以马来酰亚胺聚乙二醇
ꢀ-
fitc胶束溶液(mal-peg-fitc)共价键修饰脂质体,以增加其的水溶性和稳定性,降低免疫原性,同时赋予其fitc荧光标记。
[0028]
在一个实施方案中,所述步骤b)中,所述线粒体tert基因双链同源模板、特异性靶向tert的crrna、rna同源重组修复模板以及cas9蛋白的各组分按照1:1:1:3的质量比装载于所述线粒体靶向的阳离子脂质体中。
[0029]
在一个具体实施方案中,步骤b)中,以15953与15956两位点之间的区域做为酶切位点,以u6为启动子,合成与之相对应的crrna;构建报告基因mcherry标记的、tert的双链同源模板(dsdna donor-tert-mcherry);在cas9蛋白的n端融合线粒体定位信号(mls),合成具有线粒体选择性的cas9(mitocas9)。将该双链同源插入模板、crrna、rna同源重组修复模板(rna-donor homology directed repair,rna-donor hdr)和mitocas9 按照1:1:1:3的比例一起装载于具有线粒体靶向性的脂质体中,合成lcct 复合体。
[0030]
在一个实施方案中,所述方法还包括在合成lcct复合体后,对lcct 复合体的形貌特征进行电镜表征。
[0031]
本发明还提供了所述基因编辑复合体在制备治疗氧化应激疾病特别是骨关节炎的药物中的应用。
[0032]
本发明还提供了一种线粒体基因组编辑方法,所述方法利用所述基因编辑复合体导入正常的线粒体tert基因功能片段。
[0033]
有益效果:
[0034]
(1)本发明考虑到线粒体可以容受较高的基因异质性,从线粒体的这个特点出发,用crispr/cas9技术导入正常的线粒体基因片段功能代替错配的基因,而不是修复它。
[0035]
(2)本发明的线粒体基因编辑复合体(lcct)在骨关节炎(oa)细胞中的线粒体靶向性比正常细胞的更好。且本发明的线粒体基因编辑复合体具有显著的抗氧化能力,对氧化应激相关疾病(特别是骨关节炎)具有治疗作用。
[0036]
(3)本发明线粒体靶向的基因编辑复合体和线粒体基因组编辑方法能够导入正常的线粒体tert基因功能片段,清除线粒体内突变的基因,通过上调线粒体tert基因来改善氧化应激水平。本发明实现了对线粒体基因组上的特异基因或位点进行打靶,实现对线粒体特定基因的敲除及修饰。
[0037]
(4)本发明不同于传统的氧化应激的治疗方式,着眼于氧化应激的源头线粒体对线粒体氧化基因进行编辑,本发明的基因组编辑方法可以从根本减少ros的产生,具有针对性强和一劳永逸的优势。
附图说明
[0038]
为了更清楚地说明本发明具体实施方式或现有技术中的技术方案,下面将对具体实施方式或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图是本发明的一些实施方式,对于本领域普通技术人员来讲,在不付出创造性劳动的前
提下,还可以根据这些附图获得其他的附图。
[0039]
图1为本发明提供的lcct(liposomes-crispr/cas9-tpp)复合体靶向线粒体dna的示意图;
[0040]
图2为本发明构建线粒体靶向的基因编辑复合体的过程的示意图;
[0041]
图3为线粒体靶向的基因编辑复合体lcct (liposomes-crispr/cas9-tpp)和非线粒体靶向的基因编辑复合体lcc (liposomes-crispr/cas9)的表征;图3中a图为采用透射电镜检测lcc 和lcct复合体的形貌特征,其中a图的上图为lcc复合体的形貌,下图为lcct复合体的形貌;b图为利用动态光散射分析(dls)检测线粒体基因组编辑复合体(lcct复合体)的粒径;c图为zeta电位分析检测lcct 复合体所带电位;d图为得到的粒径和电位信息;
[0042]
图4为荧光显微镜检测线粒体靶向性结果图,其中左列为lcct荧光信号,中间列为线粒体荧光探针(mito-tracker red)信号,右列为lcct荧光信号和线粒体荧光探针信号的叠加图;
[0043]
图5为荧光显微镜检测lcct复合体荧光信号与dapi染色标记荧光信号的重合情况的结果图;其中左列为dapi染色信号,中间列为lcct 荧光信号,右列为lcct荧光信号和dapi染色信号的叠加图;
[0044]
图6为lcct复合体对线粒体tert基因的表达和ros含量影响的结果图;
[0045]
图7为线粒体基因编辑复合体对氧化应激相关疾病的治疗作用的实验结果图。
具体实施方式
[0046]
下面将结合实施例对本发明的技术方案进行清楚、完整地描述,显然,所描述的实施例是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
[0047]
实施例
[0048]
1.线粒体靶向的阳离子脂质体的合成:
[0049]
用阳离子脂质体用磷脂(dotap)与胆固醇(chol)合成普通脂质体 (liposomes);以经典的线粒体靶向剂三苯基膦修饰脂质体,赋予脂质体线粒体靶向性能;在此基础上,以马来酰亚胺聚乙二醇-fitc (mal-peg-fitc)胶束溶液共价键修饰脂质体,以增加其的水溶性和稳定性,降低免疫原性,同时赋予其fitc荧光标记。
[0050]
2.构建并组装线粒体靶向的基因编辑复合体(lcct复合体)
[0051]
以15953与15956两位点之间的区域做为酶切位点,以u6为启动子,合成与之相对应的crrna;
[0052]
[0053]
构建报告基因mcherry标记的、tert的双链同源模板(dsdnadonor-tert-mcherry);在cas9蛋白的n端融合线粒体定位信号(mls),合成具有线粒体选择性的cas9(mitocas9)。
[0054]
tert的双链同源模板序列为seq id no.2所示序列。
[0055]
线粒体定位信号的序列如下:
[0056][0057]
将该双链同源模板、crrna、rna同源重组修复模板(rna-donorhomology directed repair,rna-donor hdr)和mito-cas9按照1:1:1:3的质量比一起装载于步骤(1)具有线粒体靶向性的脂质体中,合成lcct复合体。
[0058]
图1为本发明提供的lcct(liposomes-crispr/cas9-tpp)复合体靶向线粒体dna的示意图。图2示出了构建线粒体靶向的基因编辑复合体过程的示意图。
[0059]
3.lcct复合体的表征
[0060]
采用透射电镜检测lcct复合体的形貌特征,利用动态光散射分析 (dls)检测线粒体基因组编辑复合体(lcct复合体)的粒径;zeta电位分析检测lcct复合体所带电位。
[0061]
图3为lcct和lcc复合体的表征,示出了所合成的大小较均匀,结构较完整的阳离子脂质体。并且线粒体靶向剂三苯基膦对其表面修饰后,阳离子脂质体任然保持完整的形态,说明本发明对阳离子脂质体的修饰是成功的。图中b-d示出,阳离子脂质体被三苯基膦修饰后表现出更高的电位,这有利于阳离子脂质体通过线粒体的双层膜结构。
[0062]
4.线粒体基因组编辑复合体的线粒体靶向性验证。
[0063]
4.1体外细胞实验和体内验证
[0064]
体外实验:
[0065]
使用oa患者的软骨细胞和正常人软骨细胞,实验分为两组:
[0066]
①
lcct复合体干预的正常软骨细胞(normal+lcct);
[0067]
②
lcct复合体干预的oa软骨细胞(oa+lcct)。
[0068]
具体方法如下:
[0069]
获取oa患者软骨细胞:无菌条件下,收集行关节置换的骨关节炎患者的软骨组织,把软骨组织剪碎成约1mm
3
的组织块;用含青霉素和链霉素混合液冲洗软骨3次。加入软骨体积10-15倍的0.25%胰蛋白酶,37℃消化半小时后终止消化。然后加0.02%的ii型胶原酶消化三小时。液体充分吹打混合、离心1000r/分钟5分钟,去上清液,重悬后将上清液移至10cm 的培养皿中,加入10ml完全dmem培养基,置于37℃、5%co
2
及饱和湿度条件下培养,24h可见细胞贴壁,此时首次换液,然后每3d换液1次。约7d细胞长满瓶底,此时进行传代培养。传代用0.25%胰蛋白酶消化5min,胎牛血清终止消化,按此法反复传代培养增殖。
[0070]
同样的方法获取正常人的软骨细胞。
[0071]
oa软骨细胞和正常软骨细胞被培养至第三代,分别接种到六孔板中 (5
×
10
4
cell/孔),加入lcct复合体(60μg/孔)作用8小时,然后更换培养基,加入红色线粒体荧光探针(mito-tracker red)孵育半小时,用没有血清的培养基反复冲洗3-5次,通过荧光显
微镜分别检测绿色荧光和红色荧光的荧光信号,考察线粒体荧光信号与lcct荧光信号的重合率,反映其线粒体靶向性。
[0072]
如图4所示,lcct复合体作用于oa细胞中,lcct复合体的绿色荧光与线粒体的红色荧光有相当高的重合度,表明lcct复合体可以很好的靶向到线粒体;而lcct复合体作用正常软骨细胞,lcct复合体的绿色荧光与线粒体的红色荧光能够部分重合,而有一部分绿色荧光分布在非线粒体部位。以上结果表明lcct复合体具有很好的线粒体靶向性;lcct复合体在oa细胞中的线粒体靶向性比正常细胞的更好。
[0073]
体内实验:
[0074]
通过交叉韧带横断和内侧半月板切除术构建oa动物模型,将oa大鼠分为两组:
①
注射生理盐水组(normal saline,ns组);
②
关节腔注射lcct 复合体的sd大鼠(lcct组)。
[0075]
具体方法如下:购买12只7周龄的sd大鼠,饲养一周后,将所有大鼠通过交叉韧带横断和内侧半月板切除术构建oa动物模型。普通喂养4 周后oa大鼠被分为2组,分别是oa+ns组和oa+lcct组。按照分组分别对大鼠关节腔注射药物(生理盐水0.1ml,lcct 100μg/0.1ml水溶液),每天一次。连续治疗1周后,安乐死所有的大鼠,截取关节组织,行组织切片,用dapi染液五分钟,pbs清洗3-5次后通过荧光显微镜分别检测绿色荧光和蓝色荧光的荧光信号,考察细胞核荧光信号与lcct荧光信号的重合率,验证反映其定位于细胞质中而非细胞核,从侧面反映线粒体靶向性。
[0076]
如图5所示,没有被lcct复合体处理的大鼠软骨细胞中没有绿色荧光的表达。lcct复合体处理的oa大鼠软骨细胞质中出现了绿色荧光信号,而细胞核中则没有绿色荧光信号。以上结果说明lcct复合体主要分布在细胞质中,而没有进入细胞核,从侧面反映了lcct复合体的线粒体靶向性。
[0077]
5.lcct复合体对线粒体tert基因的表达和ros含量的影响。
[0078]
将lcct复合体分别作用于正常的软骨细胞、oa的软骨细胞,提取不同分组细胞中的线粒体,分别检测线粒体基因组中tert基因的表达和ros 的含量。
[0079]
实验方法:
[0080]
(1)qpcr检测:实验分为三组,normal组、oa组和oa+lcct组。将三代的正常软骨细胞(normal组)或oa患者的软骨细胞以50000个/孔的数量接种于6孔板中,培养24小时后加入正常dmem培养基(oa组) 或者含lcct复合体的dmem培养基(oa+lcct组),孵育24小时,用线粒体分离试剂盒,分离线粒体,而后用mrna提取试剂盒提取样品中的mrna,在按照标准的qpcr操作流程检测tert基因的表达。
[0081]
(2)ros的流式细胞学分析:按照上述分组和治疗,培养24小时后, pbs清洗细胞三次,用无edta的胰酶消化细胞使之悬浮,使用ros试剂盒按照说明书,加入dcfh-da探针(活性氧ros探针)在37℃避光孵育半小时后进行流式细胞学分析。
[0082]
实验结果:
[0083]
在图6中,a图示出在oa软骨细胞中线粒体tert基因显著低于正常细胞,而接受lcct复合体治疗的oa细胞线粒体中tert基因相对于oa 组显著上升(提升了122.22%)。作为结果lcct复合体显著降低了oa细胞中ros的含量(如图6中b图所示)。
[0084]
6.线粒体基因组编辑复合体的对氧化应激相关疾病的治疗作用。
[0085]
实验方法
[0086]
(1)抗氧化物酶:实验分为三组,normal组、oa组和oa+lcct组。将三代的oa患者的软骨细胞或正常软骨细胞(normal组)以50000个/孔的数量接种于6孔板中,培养24小时后加入正常培养基(oa组)或者含 lcct复合体的培养基(oa+lcct组),孵育24小时,收集培养基,使用cat、mad和gsh-px检测试剂盒,通过应该酶标仪检测od值分析抗氧化物酶的含量。
[0087]
(2)透射电镜:按照上述方式分组和治疗,24小时后,用胰蛋白酶消化离心至1.5毫升的pe管中,使用3%的戊二醛固定软骨细胞24小时,pbs 清洗三遍,用四氧化锇固定细胞和细胞器的生物膜15分钟,接着用浓度为 50%、70%、80%、90%、100%的梯度酒精脱水(各脱15分钟),接着将细胞样本包埋在树脂中进行切片,最后在透射电镜下观察拍照。
[0088]
(3)qpcr检测:按照上述方式分组和治疗,干预24小时,后用mrna 提取试剂盒提取oa软骨细胞的mrna,在按照标准的qpcr操作流程检测软骨细胞内的炎症(il-6,tnf-α和mmp-13)的表达。
[0089]
(4)免疫组化:按照上述方式分组和治疗,24小时后,用4%多聚甲醛固定半小时,用免疫组化试剂盒对软骨细胞进行mmp-13的免疫组化染色,拍摄照片。并用image j半定量检测阳性表达。
[0090]
(5)体内实验:购买18只7周龄的sd大鼠,饲养一周后将所有大鼠分为3组(n=6),分别是normal组,oa+pbs组和oa+lcct组,将其中12只大鼠(后两组)通过交叉韧带横断和内侧半月板切除术构建oa动物模型,四周后,通过关节腔给药注射对应的药物(0.1ml)。连续注射四周。
[0091]
关节液的elisa检测:动物接收连续治疗四周后,注射0.1毫升生理盐水进入关节腔,1分钟后抽出关节液,通过标准的elisa操作流程,检测关节液中il-6和tnf-α的分泌。
[0092]
大体观测:动物接收连续治疗四周后,安乐死所有的大鼠,截取关节组织,分离股骨髁进行拍照,分析关节面的损伤情况。
[0093]
he染色:将分离出来的关节组织,edta脱钙1个月,脱水和进行石蜡包埋切片。使用he试剂盒行he染色。
[0094]
免疫组化染色:将分离出来的关节组织,edta脱钙1个月,脱水和进行石蜡包埋切片。脱蜡后通过高分进行抗原修复,行mmp-13的免疫组化染色,最后通过倒置显微镜拍照。
[0095]
实验结果:cat和gsh-px是体内最重要的抗氧化酶之一,mda是有一个反映氧化水平的指标。
[0096]
图7为线粒体基因编辑复合体对氧化应激相关疾病的治疗作用的实验结果图。其中,a图示出oa细胞分泌的cat和gsh-px显著低于正常的软骨细胞,而mda却高于正常组;而lcct复合体治疗组cat和gsh-px 的含量得到了极大的提高,大大降低了mda的水平,以上结果表明lcct 复合体具有显著的抗氧化能力。
[0097]
另外在透射电镜结果显示oa软骨细胞的线粒体轮廓模糊,纹理不清,这是线粒体膜电位失常和功能障碍的表现。而lcct的治疗使oa细胞的轮廓相对清晰,纹理可辨,这表明lcct复合体可以维持线粒体的稳定(b 图)。
[0098]
图7中c图是体外实验的免疫组化实验,d图为体外细胞层面的炎症介质的表达结果,e图为体内实验中关节腔中炎症介质的表达水平;c-e图示出,相对于正常软骨细胞,oa软骨细胞中炎症介质(il-6,tnf-α和 mmp-13)具有较高的表达,lcct复合体显著降低了oa细胞中炎症介质的表达。图7中,f图为he染色结果,g图为免疫组化染色结果;f-g图示出,oa
大鼠的关节面粗糙,软骨面变薄,有一定的纤维化,而lcct复合体处理的大鼠关节面相对光滑,软骨面更厚,免疫组化(mmp-13)中阳性信号显著降低。关节液的elisa检测结果也证实,oa大鼠的关节液炎症介质分泌相对正常大鼠显著升高,而lcct复合体的治疗显著改善了大鼠关节的炎症环境,降低关节液中炎症介质的分泌(图7中e图)。
[0099]
最后应说明的是:以上各实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述各实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分或者全部技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的范围。
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询

tips


 商标分类
商标分类  商标转让
商标转让 


