受阻胺光稳定剂中间体及受阻胺光稳定剂的制备方法与流程
 2021-02-02 12:02:27|
2021-02-02 12:02:27| 375|
375| 起点商标网
起点商标网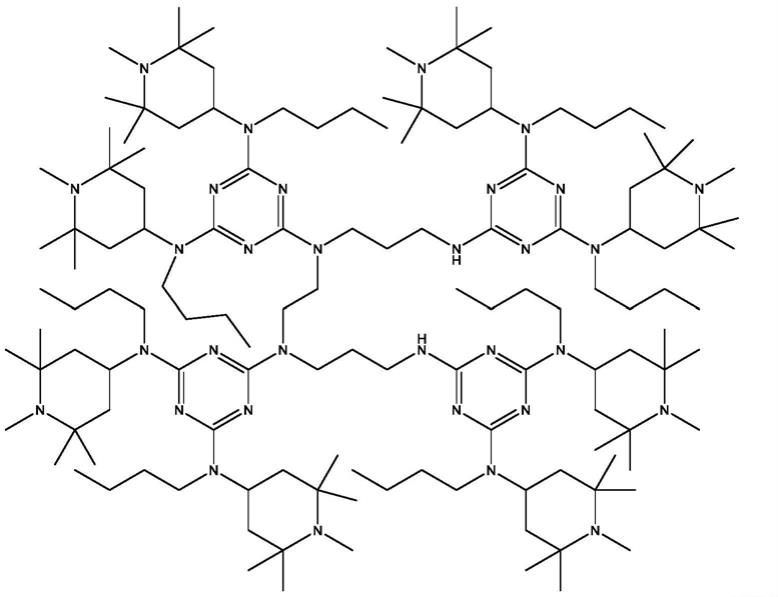
[0001]
本发明涉及高分子材料功能助剂技术领域,具体而言,涉及一种受阻胺光稳定剂中间体及受阻胺光稳定剂的制备方法。
背景技术:
[0002]
受阻胺光稳定剂(hindered amine light stabilizer,简称hals)分子中含有受阻哌啶基,其可以捕获高分子材料因光照老化而产生的自由基,阻止高分子材料的老化连锁反应;其光稳定效果是传统光稳定剂的数倍,与紫外线吸收剂和抗氧剂有良好的协同效应,正是凭借其优异的光稳定性以及与聚合物材料的相容性,其成为目前使用范围最广,市场占有率最高的一类新型高效光稳定剂。
[0003]
低相对分子质量的hals产品具有耐抽提性差和耐迁移性差等缺点,hals产品的高相对分子质量化是未来的发展方向,但是过高的相对分子质量又会影响其光稳定效果,目前普遍认为hals产品相对分子质量的合适分布范围为2000-3000。由于聚合型hals的分子量较难控制,而高分子量的单体型hals具有合成工艺简单以及分子量适宜的优点,成为新的发展方向之一。光稳定剂119,即1,5,8,12-四[2,4-双(n-丁基-n-1,2,2,6,6-五甲基-4-哌啶基氨基)-1,3,5-三嗪-6-基]-1,5,8,12-四氮杂十二烷,是一种非聚合型高分子量的受阻胺类光稳定剂,其结构如下:
[0004][0005]
其相对分子质量为2286,具有优异的耐抽提性以及耐迁移性等性能,尤其适用于农膜、涂料、粘合剂、热熔胶、聚氨酯和聚酰胺等材料中;其与聚合物相容性好且容易分散,与uv-622等光稳定剂复配使用时有良好的协同效果。
1,3,5-三嗪的结构式为上述制备方法包括以下步骤:在氢气的存在下,将1,2,2,6,6-五甲基-4-哌啶酮和正丁胺进行加氢取代反应,得到中间体1,中间体1具有以下结构:
[0014][0015]
将中间体1与三聚氯氰进行取代反应,得到2-氯-4,6-二(n-丁基-n-1,2,2,6,6-五甲基-4-哌啶基氨基)-1,3,5-三嗪。
[0016]
进一步地,1,2,2,6,6-五甲基-4-哌啶酮和正丁胺在加氢催化剂的作用下进行加氢取代反应;优选地,加氢催化剂包括骨架镍催化剂、钯碳催化剂、铂碳催化剂中的一种或多种。
[0017]
进一步地,1,2,2,6,6-五甲基-4-哌啶酮和正丁胺的摩尔比为1:(0.9~1.2);优选地,加氢催化剂的用量为原料(1,2,2,6,6-五甲基-4-哌啶酮和正丁胺)总重量的10~20%。
[0018]
进一步地,1,2,2,6,6-五甲基-4-哌啶酮和正丁胺的反应温度为50~120℃,氢气压力为1~4mpa。
[0019]
进一步地,中间体1与三聚氯氰在第一碱金属催化剂的作用下进行取代反应;优选地,第一碱金属催化剂包括第一碱金属氢氧化物和/或第一碱金属盐;优选地,第一碱金属氢氧化物包括氢氧化钠和/或氢氧化钾;优选地,第一碱金属盐包括碳酸钠、碳酸氢钠、碳酸钾、碳酸氢钾的一种或多种。
[0020]
进一步地,三聚氯氰与中间体1的摩尔比为1:(1.8~2.2);优选地,第一碱金属催化剂与中间体1的摩尔比为(1.0~1.2):1。
[0021]
进一步地,中间体1与三聚氯氰的反应温度为50~100℃。
[0022]
根据本发明的另一方面,进一步提供了一种受阻胺光稳定剂的制备方法,该受阻胺光稳定剂为1,5,8,12-四[2,4-双(n-丁基-n-1,2,2,6,6-五甲基-4-哌啶基氨基)-1,3,5-三嗪-6-基]-1,5,8,12-四氮杂十二烷,其包括以下步骤:采用上述的制备方法制备得到2-氯-4,6-二(n-丁基-n-1,2,2,6,6-五甲基-4-哌啶基氨基)-1,3,5-三嗪;将2-氯-4,6-二(n-丁基-n-1,2,2,6,6-五甲基-4-哌啶基氨基)-1,3,5-三嗪与n,n-二(3-氨丙基)乙二胺进行取代反应,得到受阻胺光稳定剂。
[0023]
进一步地,2-氯-4,6-二(n-丁基-n-1,2,2,6,6-五甲基-4-哌啶基氨基)-1,3,5-三嗪与n,n-二(3-氨丙基)乙二胺在第二碱金属催化剂的作用下进行取代反应;优选地,第二碱金属催化剂包括第二碱金属氢氧化物和/或第二碱金属盐;优选地,第二碱金属氢氧化物
三嗪,其结构式为该制备方法包括以下步骤:在氢气的存在下,将1,2,2,6,6-五甲基-4-哌啶酮和正丁胺进行加氢取代反应,得到中间体1,中间体1具有以下结构:
[0032][0033]
将中间体1与三聚氯氰进行取代反应,得到2-氯-4,6-二(n-丁基-n-1,2,2,6,6-五甲基-4-哌啶基氨基)-1,3,5-三嗪。
[0034]
上述反应路线如下:
[0035][0036]
不同于传统制备过程中需要用到甲醛或甲酸进行n-甲基化,本发明以1,2,2,6,6-五甲基-4-哌啶酮为反应底物,通过其与正丁胺的加氢取代制备中间体1后,进一步将中间体1与三聚氯氰进行取代反应,得到2-氯-4,6-二(n-丁基-n-1,2,2,6,6-五甲基-4-哌啶基氨基)-1,3,5-三嗪。使用该中间体后续进一步反应,即可得到受阻胺光稳定剂uv-119。上述制备过程中无需采用甲醛或甲酸,避免了水解副产物以及含甲醛废水的生成,具有环境污染小、设备腐蚀小的优点,且用于受阻胺光稳定剂119的反应制备后,119产品的纯度高,产品色泽好,熔程短。与此同时,该制备过程中因不产生水解副产物,大大降低后处理工序,各中间体无需复杂分离提纯,只需简单油水分离即可用于下一部反应,有效简化了反应工序,提高了生产效率。
[0037]
为了进一步提高加氢取代反应的效率,在一种优选的实施方式中,1,2,2,6,6-五甲基-4-哌啶酮和正丁胺在加氢催化剂的作用下进行加氢取代反应。在实际操作过程中,可以预先将1,2,2,6,6-五甲基-4-哌啶酮、正丁胺、加氢催化剂等原料置于反应釜中,然后用氢气置换反应器中的空气。优选先使用惰性气体置换反应器中的空气,再使用氢气置换,以便于提高操作安全性。另外,为了提高催化剂的可重复利用性,并达到催化剂易分离的目的,优选地,加氢催化剂包括骨架镍催化剂、钯碳催化剂、铂碳催化剂中的一种或多种。骨架镍催化剂可以采用雷尼镍催化剂等。
[0038]
当然,上述加氢取代反应优选在第一溶剂中进行,这样有利于提高反应的稳定性
和安全性。具体采用的第一溶剂优选为甲苯、二甲苯和均三甲苯中的一种或几种。
[0039]
在一种优选的实施方式中,1,2,2,6,6-五甲基-4-哌啶酮和正丁胺的摩尔比为1:(0.9~1.2);优选地,加氢催化剂的用量为所述原料(1,2,2,6,6-五甲基-4-哌啶酮和正丁胺)总重量的10~20%。将各反应原料控制在上述范围内,有利于进一步提高反应转化率和产物收率。更优选地,1,2,2,6,6-五甲基-4-哌啶酮和正丁胺的反应温度为50~120℃,氢气压力为1~4mpa。具体反应过程中可以进行反应器内氢气压力检测,待氢气压力不再降低时表明加氢取代反应结束。
[0040]
如前文所述,正是由于本发明采用了1,2,2,6,6-五甲基-4-哌啶酮作为反应底物,有效避免了反应过程中的水解副产物,从而有效降低了各阶段反应产物体系的杂质。在此基础上,只需简单分离即可进行下一步反应。待上述加氢取代反应结束后,可以过滤去除加氢催化剂后,得到中间体1的反应液用于后续反应即可。
[0041]
在一种优选的实施方式中,上述中间体1与三聚氯氰在第一碱金属催化剂的作用下进行取代反应。利用碱金属催化剂,能够促进反应正向进行,以便进一步提高反应效率。优选地,第一碱金属催化剂包括第一碱金属氢氧化物和/或第一碱金属盐。上述第一碱金属氢氧化物和/或第一碱金属盐可以以粉末形式直接加入反应体系,也可以以水溶液的形式加入。且为了提高反应稳定性,可以一次性加入,优选以批次或滴加的形式加入。优选地,第一碱金属氢氧化物包括但不限于氢氧化钠和/或氢氧化钾;优选地,第一碱金属盐包括但不限于碳酸钠、碳酸氢钠、碳酸钾、碳酸氢钾的一种或多种。
[0042]
为了进一步提高反应效率和转化率,在一种优选的实施方式中,三聚氯氰与中间体1的摩尔比为1:(1.8~2.2);优选地,第一碱金属催化剂与中间体1的摩尔比为(1.0~1.2):1。将各原料用量关系控制在上述范围内,2-氯-4,6-二(n-丁基-n-1,2,2,6,6-五甲基-4-哌啶基氨基)-1,3,5-三嗪的收率更高,相应后续制备的受阻胺光稳定剂uv-119的收率更高。
[0043]
在一种优选的实施方式中,中间体1与三聚氯氰的反应温度为50~100℃。具体反应过程中,反应时长可进行调整,优选在上述温度条件下反应3~8h。结束后进行分液,有机相水洗后即可得到含2-氯-4,6-二(n-丁基-n-1,2,2,6,6-五甲基-4-哌啶基氨基)-1,3,5-三嗪的反应液,可以直接投入到后续受阻胺光稳定剂uv-119的制备中,也可以经提纯制备相应中间体产品。
[0044]
上述取代反应优选在第二溶剂中进行,第二溶剂包括但不限于甲苯、二甲苯、均三甲苯中的一种或多种。优选第一溶剂和第二溶剂相同,这样经简单分离后,能够采用“一锅法”进行制备,有利于进一步简化工序,提高生产效率。且具体操作时,为了进一步提高反应稳定性,优选反应过程中将中间体1以滴加的方式投入到三聚氯氰中进行反应。
[0045]
根据本发明的另一方面,还提供了一种受阻胺光稳定剂119,即1,5,8,12-四[2,4-双(n-丁基-n-1,2,2,6,6-五甲基-4-哌啶基氨基)-1,3,5-三嗪-6-基]-1,5,8,12-四氮杂十二烷的制备方法,其包括以下步骤:采用上述制备方法制备得到2-氯-4,6-二(n-丁基-n-1,2,2,6,6-五甲基-4-哌啶基氨基)-1,3,5-三嗪;将2-氯-4,6-二(n-丁基-n-1,2,2,6,6-五甲基-4-哌啶基氨基)-1,3,5-三嗪与n,n-二(3-氨丙基)乙二胺进行取代反应,得到受阻胺光稳定剂uv-119。
[0046]
上述反应式如下:
[0047][0048]
其中r为
[0049]
如前文所述,不同于传统制备过程中需要用到甲醛或甲酸进行n-甲基化,本发明以1,2,2,6,6-五甲基-4-哌啶酮为反应底物,通过其与正丁胺的加氢取代制备中间体1后,进一步将中间体1与三聚氯氰进行取代反应,得到2-氯-4,6-二(n-丁基-n-1,2,2,6,6-五甲基-4-哌啶基氨基)-1,3,5-三嗪。然后将该中间体与n,n-二(3-氨丙基)乙二胺进行取代反应,得到受阻胺光稳定剂119。上述制备过程中无需采用甲醛或甲酸,避免了水解副产物以及含甲醛废水的生成,具有环境污染小、设备腐蚀小的优点,且制备的受阻胺光稳定剂uv-119的纯度高,产品色泽好,熔程短。与此同时,该制备过程中因不产生水解副产物,大大降低后处理工序,各中间体无需复杂分离提纯,只需简单油水分离即可用于下一部反应,采用“一锅法”的反应模式,有效简化了反应工序,提高了生产效率。
[0050]
在一种优选的实施方式中,2-氯-4,6-二(n-丁基-n-1,2,2,6,6-五甲基-4-哌啶基氨基)-1,3,5-三嗪与nn-二(3-氨丙基)乙二胺在第二碱金属催化剂的作用下进行取代反应。利用第二碱金属催化剂可以有效提高反应效率。优选地,第二碱金属催化剂包括第二碱金属氢氧化物和/或第二碱金属盐。上述第二碱金属氢氧化物和/或第二碱金属盐可以以粉末形式直接加入反应体系,也可以以水溶液的形式加入。且为了提高反应稳定性,可以一次性加入,优选以批次或滴加的形式加入。优选地,第二碱金属氢氧化物包括但不限于氢氧化钠和/或氢氧化钾;优选地,第二碱金属盐包括但不限于碳酸钠、碳酸氢钠、碳酸钾、碳酸氢钾的一种或多种。
[0051]
在一种优选的实施方式中,n,n-二(3-氨丙基)乙二胺与2-氯-4,6-二(n-丁基-n-1,2,2,6,6-五甲基-4-哌啶基氨基)-1,3,5-三嗪的摩尔比为1:(3.7~4.2);优选地,第二碱金属催化剂与2-氯-4,6-二(n-丁基-n-1,2,2,6,6-五甲基-4-哌啶基氨基)-1,3,5-三嗪的摩尔比为(1.0~2.0):1。将各原料用量控制在上述范围内,有利于进一步提高反应的转化率和收率。优选地,2-氯-4,6-二(n-丁基-n-1,2,2,6,6-五甲基-4-哌啶基氨基)-1,3,5-三嗪与n,n-二(3-氨丙基)乙二胺的反应温度为160~220℃。具体的反应时间可以调整,优选上述反应时间为8~20h。
[0052]
在实际操作过程中,可以将制备2-氯-4,6-二(n-丁基-n-1,2,2,6,6-五甲基-4-哌啶基氨基)-1,3,5-三嗪过程中得到的含有其的反应液直接用于与n,n-二(3-氨丙基)乙二胺反应,只需最后进行分液、有机相水洗、脱除溶剂、干燥,即可得到纯度较高的目标产物受阻胺光稳定剂uv-119。
[0053]
以下结合具体实施例对本申请作进一步详细描述,这些实施例不能理解为限制本申请所要求保护的范围。
[0054]
实施例1
[0055]
将33.8g(0.2mol)1,2,2,6,6-五甲基-4-哌啶酮,14.6g(0.2mol)正丁胺,5.0g骨架镍催化剂和200ml甲苯投入到高压釜中,依次用氮气、氢气置换空气,在90℃,3.0mpa下反应至氢气压力不再降低为止,反应结束,过滤除去催化剂,得到中间体1的反应液;
[0056]
将18.4g(0.1mol)三聚氯氰溶于300ml甲苯中,冰水浴降温至10℃以下,滴加中间体1的反应液,滴加完毕后,搅拌1小时,再滴加36ml 20%氢氧化钠水溶液,其中氢氧化钠与中间体1的摩尔比为1.1:1,三聚氯氰与中间体1的摩尔比为1:2;升温至60℃反应8h,反应结束后分液,有机相经水洗后得到2-氯-4,6-二(n-丁基-n-1,2,2,6,6-五甲基-4-哌啶基氨基)-1,3,5-三嗪的反应液;
[0057]
将2-氯-4,6-二(n-丁基-n-1,2,2,6,6-五甲基-4-哌啶基氨基)-1,3,5-三嗪的反应液,4.4g(0.025mol)n,n-二(3-氨丙基)乙二胺和12ml 30%氢氧化钠水溶液投入到高压釜中,依次用氮气、氢气置换反应体系中的空气,其中氢氧化钠与2-氯-4,6-二(n-丁基-n-1,2,2,6,6-五甲基-4-哌啶基氨基)-1,3,5-三嗪的摩尔比为1.3:1,n,n-二(3-氨丙基)乙二胺与2-氯-4,6-二(n-丁基-n-1,2,2,6,6-五甲基-4-哌啶基氨基)-1,3,5-三嗪的摩尔比为1:4;在200℃下反应18h,反应结束后,反应液分液,有机相经水洗,脱除二甲苯后,在120℃下真空干燥8h,得到淡黄色受阻胺光稳定剂119固体53.2g,总收率93.1%,hplc纯度为95.3%,熔程为130-135℃。
[0058]
图1、图2和图3示出了上述制备的受阻胺光稳定剂119的maldi-tof-ms(质谱)谱图,分子量为2284.8364处的物质是受阻胺光稳定剂119主产物。
[0059]
说明:产物熔程的高低与溶剂的种类和残留有关;产物熔程的长短与产物的纯度有一定关系。
[0060]
实施例2
[0061]
将33.8g(0.2mol)1,2,2,6,6-五甲基-4-哌啶酮,15.3g(0.21mol)正丁胺,6.0g骨架镍催化剂和300ml二甲苯投入到高压釜中,依次用氮气、氢气置换空气,在100℃,4.0mpa下反应至氢气压力不再降低为止,反应结束,过滤除去催化剂,得到中间体1的反应液;
[0062]
将18.4g(0.1mol)三聚氯氰溶于200ml二甲苯中,冰水浴降温至10℃以下,滴加中间体1的反应液,滴加完毕后,搅拌1小时,再滴加20.5ml 30%氢氧化钠水溶液,其中氢氧化钠与中间体1的摩尔比为1.1:1,三聚氯氰与中间体1的摩尔比为1:2;升温至80℃反应12h,反应结束后分液,有机相经水洗后得到2-氯-4,6-二(n-丁基-n-1,2,2,6,6-五甲基-4-哌啶基氨基)-1,3,5-三嗪的反应液;
[0063]
将2-氯-4,6-二(n-丁基-n-1,2,2,6,6-五甲基-4-哌啶基氨基)-1,3,5-三嗪的反应液,4.5g(0.025mol)n,n-二(3-氨丙基)乙二胺和5.2g氢氧化钠固体投入到高压釜中,依次用氮气、氢气置换反应体系中的空气,其中氢氧化钠与2-氯-4,6-二(n-丁基-n-1,2,2,6,6-五甲基-4-哌啶基氨基)-1,3,5-三嗪的摩尔比为1.3:1,n,n-二(3-氨丙基)乙二胺与2-氯-4,6-二(n-丁基-n-1,2,2,6,6-五甲基-4-哌啶基氨基)-1,3,5-三嗪的摩尔比为1:4;在220℃下反应14h,反应结束后,反应液分液,有机相经水洗,脱除二甲苯后,在120℃下真空干燥8h,得到淡黄色受阻胺光稳定剂119固体53.8g,总收率94.2%,hplc纯度为94.7%,熔
程为137-141℃。
[0064]
实施例3
[0065]
将33.8g(0.2mol)1,2,2,6,6-五甲基-4-哌啶酮,15.0g(0.205mol)正丁胺,7.3g骨架镍催化剂和300ml均三甲苯投入到高压釜中,依次用氮气、氢气置换空气,在80℃,3.0mpa下反应至氢气压力不再降低为止,反应结束,过滤除去催化剂,得到中间体1的反应液;
[0066]
将18.4g(0.1mol)三聚氯氰溶于200ml均三甲苯中,冰水浴降温至10℃以下,滴加中间体1的反应液,滴加完毕后,搅拌1小时,再滴加61.6g 20%氢氧化钾水溶液,其中氢氧化钾与中间体1的摩尔比为1.1:1,三聚氯氰与中间体1的摩尔比为1:2;升温至70℃反应10h,反应结束后分液,有机相经水洗后得到2-氯-4,6-二(n-丁基-n-1,2,2,6,6-五甲基-4-哌啶基氨基)-1,3,5-三嗪的反应液;
[0067]
将2-氯-4,6-二(n-丁基-n-1,2,2,6,6-五甲基-4-哌啶基氨基)-1,3,5-三嗪的反应液,4.0g(0.023mol)n,n-二(3-氨丙基)乙二胺和28g 30%氢氧化钾水溶液投入到高压釜中,依次用氮气、氢气置换反应体系中的空气,其中氢氧化钾与2-氯-4,6-二(n-丁基-n-1,2,2,6,6-五甲基-4-哌啶基氨基)-1,3,5-三嗪的摩尔比为1.5:1,n,n-二(3-氨丙基)乙二胺与2-氯-4,6-二(n-丁基-n-1,2,2,6,6-五甲基-4-哌啶基氨基)-1,3,5-三嗪的摩尔比为1:4.3;在180℃下反应16h,反应结束后,反应液分液,有机相经水洗,脱除二甲苯后,在120℃下真空干燥8h,得到淡黄色受阻胺光稳定剂119固体52.7g,总收率92.4%,hplc纯度为94.3%,熔程为136-140℃。
[0068]
实施例4
[0069]
将33.8g(0.2mol)1,2,2,6,6-五甲基-4-哌啶酮,14.6g(0.2mol)正丁胺,4.9g钯碳催化剂和200ml甲苯投入到高压釜中,依次用氮气、氢气置换空气,在60℃,1.0mpa下反应至氢气压力不再降低为止,反应结束,过滤除去催化剂,得到中间体1的反应液;
[0070]
将18.4g(0.1mol)三聚氯氰溶于300ml甲苯中,冰水浴降温至10℃以下,滴加中间体1的反应液,滴加完毕后,搅拌1小时,再滴加63.6g 20%碳酸钠水溶液,其中碳酸钠与中间体1的摩尔比为1.2:1,三聚氯氰与中间体1的摩尔比为1:2;升温至60℃反应8h,反应结束后分液,有机相经水洗后得到2-氯-4,6-二(n-丁基-n-1,2,2,6,6-五甲基-4-哌啶基氨基)-1,3,5-三嗪的反应液;
[0071]
将2-氯-4,6-二(n-丁基-n-1,2,2,6,6-五甲基-4-哌啶基氨基)-1,3,5-三嗪的反应液,4.4g(0.025mol)n,n-二(3-氨丙基)乙二胺和74.2g 20%碳酸钠水溶液投入到高压釜中,依次用氮气、氢气置换反应体系中的空气,其中碳酸钠与2-氯-4,6-二(n-丁基-n-1,2,2,6,6-五甲基-4-哌啶基氨基)-1,3,5-三嗪的摩尔比为1.4:1,n,n-二(3-氨丙基)乙二胺与2-氯-4,6-二(n-丁基-n-1,2,2,6,6-五甲基-4-哌啶基氨基)-1,3,5-三嗪的摩尔比为1:4;在140℃下反应10h,反应结束后,反应液分液,有机相经水洗,脱除二甲苯后,在120℃下真空干燥8h,得到淡黄色受阻胺光稳定剂119固体52.1g,总收率91.2%,hplc纯度为85.2%,熔程为120-125℃。
[0072]
实施例5
[0073]
将33.8g(0.2mol)1,2,2,6,6-五甲基-4-哌啶酮,14.6g(0.2mol)正丁胺,8.1g铂碳催化剂和300ml二甲苯投入到高压釜中,依次用氮气、氢气置换空气,在65℃,1.0mpa下反应至氢气压力不再降低为止,反应结束,过滤除去催化剂,得到中间体1的反应液;
[0074]
将18.4g(0.1mol)三聚氯氰溶于150ml二甲苯中,冰水浴降温至10℃以下,滴加中间体1的反应液,滴加完毕后,搅拌1小时,再滴加92.4g 20%碳酸氢钠水溶液,其中碳酸氢钠与中间体1的摩尔比为1.1:1,三聚氯氰与中间体1的摩尔比为1:2;升温至60℃反应8h,反应结束后分液,有机相经水洗后得到2-氯-4,6-二(n-丁基-n-1,2,2,6,6-五甲基-4-哌啶基氨基)-1,3,5-三嗪的反应液;
[0075]
将2-氯-4,6-二(n-丁基-n-1,2,2,6,6-五甲基-4-哌啶基氨基)-1,3,5-三嗪的反应液,4.4g(0.024mol)n,n-二(3-氨丙基)乙二胺和42g 30%碳酸氢钠水溶液投入到高压釜中,依次用氮气、氢气置换反应体系中的空气,其中碳酸氢钠与2-氯-4,6-二(n-丁基-n-1,2,2,6,6-五甲基-4-哌啶基氨基)-1,3,5-三嗪的摩尔比为1.5:1,n,n-二(3-氨丙基)乙二胺与2-氯-4,6-二(n-丁基-n-1,2,2,6,6-五甲基-4-哌啶基氨基)-1,3,5-三嗪的摩尔比为1:4.2;在240℃下反应12h,反应结束后,反应液分液,有机相经水洗,脱除二甲苯后,在120℃下真空干燥8h,得到淡黄色受阻胺光稳定剂119固体50.8g,总收率88.9%,hplc纯度为90.3%,熔程为145-150℃。
[0076]
实施例6
[0077]
将33.8g(0.2mol)1,2,2,6,6-五甲基-4-哌啶酮,14.6g(0.19mol)正丁胺,6.4g骨架镍催化剂和200ml甲苯投入到高压釜中,依次用氮气、氢气置换空气,在50℃,0.4mpa下反应至氢气压力不再降低为止,反应结束,过滤除去催化剂,得到中间体1的反应液;
[0078]
将18.4g(0.1mol)三聚氯氰溶于300ml甲苯中,冰水浴降温至10℃以下,滴加中间体1的反应液,滴加完毕后,搅拌1小时,再滴加82.8g 20%碳酸钾水溶液,其中碳酸钾与中间体1的摩尔比为1.2:1,三聚氯氰与中间体1的摩尔比为1:1.9;升温至60℃反应8h,反应结束后分液,有机相经水洗后得到2-氯-4,6-二(n-丁基-n-1,2,2,6,6-五甲基-4-哌啶基氨基)-1,3,5-三嗪的反应液;
[0079]
将2-氯-4,6-二(n-丁基-n-1,2,2,6,6-五甲基-4-哌啶基氨基)-1,3,5-三嗪的反应液,4.4g(0.025mol)n,n-二(3-氨丙基)乙二胺和61.2g 30%碳酸钾水溶液投入到高压釜中,依次用氮气、氢气置换反应体系中的空气,其中碳酸钾与2-氯-4,6-二(n-丁基-n-1,2,2,6,6-五甲基-4-哌啶基氨基)-1,3,5-三嗪的摩尔比为1.4:1,n,n-二(3-氨丙基)乙二胺与2-氯-4,6-二(n-丁基-n-1,2,2,6,6-五甲基-4-哌啶基氨基)-1,3,5-三嗪的摩尔比为1:3.8;在185℃下反应14h,反应结束后,反应液分液,有机相经水洗,脱除二甲苯后,在120℃下真空干燥8h,得到淡黄色受阻胺光稳定剂119固体52.5g,总收率91.9%,hplc纯度为88.2%,熔程为125-130℃。
[0080]
实施例7
[0081]
将33.8g(0.2mol)1,2,2,6,6-五甲基-4-哌啶酮,14.6g(0.2mol)正丁胺,8.1g铂碳催化剂和300ml二甲苯投入到高压釜中,依次用氮气、氢气置换空气,在60℃,1.0mpa下反应至氢气压力不再降低为止,反应结束,过滤除去催化剂,得到中间体1的反应液;
[0082]
将18.4g(0.08mol)三聚氯氰溶于150ml二甲苯中,冰水浴降温至10℃以下,滴加中间体1的反应液,滴加完毕后,搅拌1小时,再滴加80g 30%碳酸氢钾水溶液,其中碳酸氢钾与中间体1的摩尔比为1.2:1,三聚氯氰与中间体1的摩尔比为1:2.5;升温至60℃反应8h,反应结束后分液,有机相经水洗后得到2-氯-4,6-二(n-丁基-n-1,2,2,6,6-五甲基-4-哌啶基氨基)-1,3,5-三嗪的反应液;
[0083]
将2-氯-4,6-二(n-丁基-n-1,2,2,6,6-五甲基-4-哌啶基氨基)-1,3,5-三嗪的反应液,4.4g(0.025mol)n,n-二(3-氨丙基)乙二胺和70g 20%碳酸氢钾水溶液投入到高压釜中,依次用氮气、氢气置换反应体系中的空气,其中碳酸氢钾与2-氯-4,6-二(n-丁基-n-1,2,2,6,6-五甲基-4-哌啶基氨基)-1,3,5-三嗪的摩尔比为1.4:1,n,n-二(3-氨丙基)乙二胺与2-氯-4,6-二(n-丁基-n-1,2,2,6,6-五甲基-4-哌啶基氨基)-1,3,5-三嗪的摩尔比为1:4;在190℃下反应12h,反应结束后,反应液分液,有机相经水洗,脱除二甲苯后,在120℃下真空干燥8h,得到淡黄色受阻胺光稳定剂119固体47.5g,总收率83.1%,hplc纯度为91.1%,熔程为128-132℃。
[0084]
实施例8
[0085]
将33.8g(0.2mol)1,2,2,6,6-五甲基-4-哌啶酮,15.3g(0.21mol)正丁胺,6.8g骨架镍催化剂和300ml二甲苯投入到高压釜中,依次用氮气、氢气置换空气,在80℃,2.5mpa下反应至氢气压力不再降低为止,反应结束,过滤除去催化剂,得到中间体1的反应液;
[0086]
将18.4g(0.1mol)三聚氯氰溶于300ml二甲苯中,冰水浴降温至10℃以下,滴加中间体1的反应液,滴加完毕后,搅拌1小时,再滴加20.5ml 30%氢氧化钠水溶液,其中氢氧化钠与中间体1的摩尔比为1.1:1,三聚氯氰与中间体1的摩尔比为1:2;升温至80℃反应12h,反应结束后分液,有机相经水洗后得到2-氯-4,6-二(n-丁基-n-1,2,2,6,6-五甲基-4-哌啶基氨基)-1,3,5-三嗪的反应液;
[0087]
将2-氯-4,6-二(n-丁基-n-1,2,2,6,6-五甲基-4-哌啶基氨基)-1,3,5-三嗪的反应液,4.5g(0.029mol)n,n-二(3-氨丙基)乙二胺和5.2g氢氧化钠固体投入到高压釜中,依次用氮气、氢气置换反应体系中的空气,其中氢氧化钠与2-氯-4,6-二(n-丁基-n-1,2,2,6,6-五甲基-4-哌啶基氨基)-1,3,5-三嗪的摩尔比为1.3:1,n,n-二(3-氨丙基)乙二胺与2-氯-4,6-二(n-丁基-n-1,2,2,6,6-五甲基-4-哌啶基氨基)-1,3,5-三嗪的摩尔比为1:3.4;在220℃下反应14h,反应结束后,反应液分液,有机相经水洗,脱除二甲苯后,在120℃下真空干燥8h,得到淡黄色受阻胺光稳定剂119固体52.3g,总收率91.5%,hplc纯度为86.7%,熔程为128-133℃。
[0088]
以上所述仅为本发明的优选实施例而已,并不用于限制本发明,对于本领域的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询

tips


 商标分类
商标分类  商标转让
商标转让 



