利用YPB肽段抑制乳腺癌细胞增殖及肿瘤生长的方法和应用与流程
 2021-02-02 11:02:51|
2021-02-02 11:02:51| 521|
521| 起点商标网
起点商标网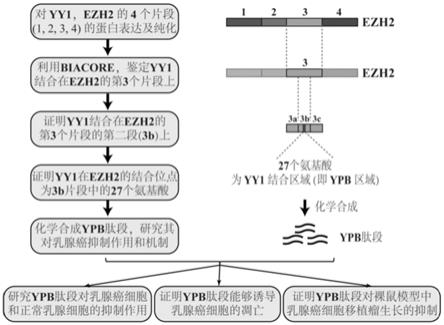
利用ypb肽段抑制乳腺癌细胞增殖及肿瘤生长的方法和应用
技术领域
[0001]
本发明涉及利用ypb肽段抑制乳腺癌细胞增殖及肿瘤生长的方法和应用。
背景技术:
[0002]
ezh2(enhancer of zeste homolog 2)是一种组蛋白甲基转移酶,催化组蛋白h3上的第27位赖氨酸(即h3k27)的三甲基化修饰,这一修饰是基因沉默的重要标志[kim and roberts 2016,nat med]。ezh2是polycomb group(pcg)蛋白家族中的一员,其功能为通过调节染色质重塑来抑制基因表达。ezh2还是polycomb repressive complex 2(prc2,抑制复合体2)中重要的功能组成部分,负责维持基因表达的抑制。pcg蛋白参与表观遗传修饰。从功能上,pcg蛋白可以分为prc1和prc2两个核心蛋白复合体,二者能够抑制数百种基因,包括大量的转录调节因子。由于ezh2本身没有dna结合区域,因此需要被yy1等分子招募到靶基因上,以行使其在组蛋白h3k27位点上的甲基转移酶功能[pan et al.2013,embo j]。除了调节正常的生长发育之外,ezh2在很多形成实体瘤的癌细胞中过量表达,并与癌症的不良临床预后呈正相关性。因此,ezh2在实体瘤中被认为是一个原癌基因或促癌基因。在乳腺癌中,ezh2也存在高表达,并通过多个信号通道促进肿瘤细胞的增殖和癌转移,因而被认为是一个癌症治疗中潜在的靶基因。目前,已经有多种ezh2抑制剂被用于抑制肿瘤细胞的增殖,例如gsk343和epz005687[kim and roberts 2016,nat med]。
[0003]
yy1最早是由shi等人[shi et al.1991,cell]作为一个含有414个氨基酸的dna结合蛋白而被发现的。作为一个转录因子,yy1具有“阴阳(yin yang)”的特性,即可以抑制或激活靶基因的表达。yy1是一个重要的表观遗传学调节因子,其所调节的基因具有多种生物学功能,包括细胞生长,分化以及胚胎的发育。yy1可以结合多个参与表观遗传学的重要蛋白因子,包括调节组蛋白乙酰化的p300/cbp、pcaf、hdacs,组蛋白甲基化的ezh2、ezh11、prmt4,dna甲基化的dnmts(见综述[zhang et al.2011,crit rev oncog])。
[0004]
yin yang 1(yy1)是一个多功能蛋白,具有促进肿瘤细胞增殖的活性。如图1所示,yy1蛋白分子上,有一个opb(onco-protein binding)区域,可以结合多个促进癌症发生及发展的蛋白(癌蛋白),包括akt,mdm2,e1a和ezh2[zhang et al.2016,j mol cell biol]。
[0005]
在早期的研究中,人们对于yy1在癌症发生中的作用一直不够明确。直到2004年,我们发现了yy1可以负调节抑癌基因p53[sui et al.2004,cell],其促癌或刺激细胞生长的功能才被意识到。值得注意的是,yy1的这一功能并不依赖于其调节转录的活性,这也就扩展了yy1的功能及调节范围。与此同时,yy1对原癌基因ezh2功能的调节及促进作用也被发现。这些进一步加强了yy1的原癌基因地位,也增强了其作为癌症治疗中靶基因的可能性。有研究已经证实ezh2在功能上依赖于yy1的opb区域。yy1所调节的ezh2功能对肿瘤的形成和发展过程中的基因异常表达、抑制细胞凋亡和促进细胞增殖及生存等方面起到了重要的作用。因此,阻遏yy1与ezh2的相互作用将可能在多个信号通路上抑制肿瘤细胞的发展,以此分子原理为基础的抑制剂将可能成为有效的抗癌药物。
技术实现要素:
[0006]
本发明的目的是为了提供一种能够通过阻遏yy1和ezh2两个分子的结合进而抑制乳腺癌细胞增殖及肿瘤生长的物质,即提供一种利用ypb肽段抑制乳腺癌细胞增殖及肿瘤生长的方法和应用。
[0007]
一种ypb肽段,其序列为p-p-r-k-k-k-r-k-h-r-l-w-a-a-h-c-r-k-i-q-l-k-k-d-g-s-s。
[0008]
ypb肽段的应用,通过ypb肽段与tat和ggg合成,再标记上带有荧光的fitc,得到fitc-tat-ggg-ypb多肽;所述fitc-tat-ggg-ypb多肽用于阻遏yy1和ezh2的结合,进而抑制乳腺癌细胞增殖及肿瘤的生长。
[0009]
ypb肽段的筛选及fitc-tat-ggg-ypb多肽的合成的方法,按以下步骤进行:
[0010]
一、利用大肠杆菌表达his
×
6-yy1蛋白并进行纯化;将ezh2功能区域分为4个片段,构建gst-融合蛋白,并利用大肠杆菌进行蛋白表达和纯化,得到纯化后的gst-ezh2-mut1、mut2、mut3和mut4蛋白;
[0011]
二、通过胺类偶合法将纯化后的his
×
6-yy1蛋白偶联到偶联用芯片上,然后利用生物大分子互作仪分别测定纯化后的gst-ezh2-mut1、mut2、mut3和mut4蛋白与his
×
6-yy1蛋白的结合程度,经过筛选,得到ezh2上一段负责与yy1的结合序列,将这一段序列命名为ypb肽段,其序列为p-p-r-k-k-k-r-k-h-r-l-w-a-a-h-c-r-k-i-q-l-k-k-d-g-s-s;最后将ypb肽段与tat和ggg合成,再标记上带有荧光的fitc,得到fitc-tat-ggg-ypb多肽;所述fitc-tat-ggg-ypb多肽的序列为fitc-ygrkkrrqrrr-ggg-pprkkkrkhrlwaahcrkiqlkkdgss。
[0012]
本发明的有益效果:
[0013]
一、本发明通过对蛋白分子间相互作用的研究,鉴定了两个促癌蛋白(yy1和ezh2)之间的相互结合区域,并通过yy1在ezh2蛋白分子上结合区域的序列(即ypb)合成了含有ypb的fitc-tat-ggg-ypb多肽,该多肽能够通过干扰yy1和ezh2两个分子的结合,阻遏它们的功能,进而抑制乳腺癌细胞的增殖以及裸鼠中移植瘤的生长。
[0014]
二、在本发明中得出的ypb序列,是基于精细的蛋白质互作研究得出的,因此具有很坚实的理论根据。ypb活性肽段影响的是yy1对ezh2的调节,而这两个蛋白在乳腺癌等癌细胞中大量表达,但在正常乳腺细胞中表达量较低,因此,理论上ypb多肽可以特异性地抑制乳腺癌细胞的增殖,但对正常乳腺细胞的影响相对较小。这一点在实验中也得到了证实,意味着将来利用ypb多肽制成的抑癌药物应该可以选择性杀伤乳腺癌细胞,而对正常乳腺细胞具有较低的毒性或副作用。yy1和ezh2在多种固态肿瘤中的表达量,与相应的正常细胞相比都有升高,意味着ypb多肽可能对其它的癌症也具有抑制作用。
[0015]
三、ypb肽段的长度为27个氨基酸,对于一个肽段来讲,长度属于中等。在今后的研究中,我们会将ypb肽段逐渐缩短,然后检测缩短后的肽段对乳腺癌细胞的抑制活性,以期得到最短的ypb抑癌肽段,这样可以降低今后生产基于ypb的抑癌药物时的成本。目前仅对乳腺癌细胞及成瘤进行了研究,但尚未对多种癌细胞进行鉴定,预期ypb肽段会影响多种癌细胞的增殖。
[0016]
四、本发明通过20年有关yy1的研究,第一次报道了yy1促进mdm2介导的p53泛素化降解[sui et al.2004,cell],并报道了yy1的sumo化(sumoylation)对其转录活性的调节[deng et al.2007,mol cell biol],yy1对雄激素受体(androgen receptor)功能的促进
[deng et al.2009,oncogene],yy1在乳腺癌细胞和组织中的高表达以及促进乳腺细胞增殖的作用和其高表达对肿瘤形成的必要性[wan et al.2012,am j pathol],yy1启动子区域含有癌基因特有的标志性结构g-quadruplex[huang et al.2012,nucleic acids res],yy1对促进细胞增殖及存活的蛋白akt的磷酸化激活的促进作用[zhang et al.2016,j mol cell biol]。
[0017]
本发明可获得利用ypb肽段抑制乳腺癌细胞增殖及肿瘤生长的方法和应用。
附图说明
[0018]
图1为yy1的功能结构区域及opb(onco-protein binding)区域的序列;
[0019]
图2为ezh2的功能结构区域及ezh2上负责与yy1结合的ypb(yy1 protein binding)区域的序列;
[0020]
图3为化学合成fitc-tat-ggg-ypb荧光标记多肽的序列示意图;
[0021]
图4为gst-ezh2-mut1、mut2、mut3和mut4蛋白对应的ezh2蛋白区域示意图;
[0022]
图5为利用biacore检测gst-ezh2片段中的gst-ezh2-mut1与his
×
6-yy1的结合情况;
[0023]
图6为利用biacore检测gst-ezh2片段中的gst-ezh2-mut2与his
×
6-yy1的结合情况;
[0024]
图7为利用biacore检测gst-ezh2片段中的gst-ezh2-mut3与his
×
6-yy1的结合情况;
[0025]
图8为利用biacore检测gst-ezh2片段中的gst-ezh2-mut4与his
×
6-yy1的结合情况;
[0026]
图9为利用biacore检测his
×
6-yy1与对照组的结合情况;
[0027]
图10为gst-ezh2-mut3a、mut3b和mut3c对应的ezh2区域示意图;
[0028]
图11为利用biacore检测gst-ezh2-mut3a与his
×
6-yy1的结合情况;
[0029]
图12为利用biacore检测gst-ezh2-mut3b与his
×
6-yy1的结合情况;
[0030]
图13为利用biacore检测gst-ezh2-mut3c与his
×
6-yy1的结合情况;
[0031]
图14为利用biacore检测对照组与his
×
6-yy1的结合情况;
[0032]
图15为将ezh2-mut3b进一步缩短为ezh2-mut3b-s1和ezh2-mut3b-s2的示意图;
[0033]
图16为进行体外gst pull-down实验,检测ezh2-mut3b-s1、ezh2-mut3b-s2以及对照组与his
×
6-yy1的结合情况;
[0034]
图17为化学合成的fitc-tat-ggg-ypb肽段和对照肽段及序列的示意图;
[0035]
图18为用ypb多肽及对照肽段处理乳腺癌mda-mb-231细胞的细胞存活率(以wst-1试剂进行检测),**p<0.01,***p<0.001,
●
代表ypb多肽,
▼
代表对照肽段;
[0036]
图19为用ypb多肽及对照肽段处理正常乳腺mcf-10a细胞的细胞存活率(以wst-1试剂进行检测),**p<0.01,
●
代表ypb多肽,
▼
代表对照肽段;
[0037]
图20为流式细胞仪检测外源表达未处理组是否诱导人乳腺癌mda-mb-231细胞的凋亡;
[0038]
图21为流式细胞仪检测外源表达对照肽段是否诱导人乳腺癌mda-mb-231细胞的凋亡;
[0039]
图22为流式细胞仪检测外源表达ypb多肽是否诱导人乳腺癌mda-mb-231细胞的凋亡,其中,圆圈圈定位置为发生凋亡的乳腺癌细胞;
[0040]
图23为检测ypb多肽和对照肽段分别对乳腺癌mda-mb-231细胞在裸鼠中形成移植瘤的生长抑制情况(*p<0.001);
[0041]
图24为ypb区域的鉴定过程和研究ypb多肽抑制乳腺癌的实验流程图。
具体实施方式
[0042]
具体实施方式一:本实施方式一种ypb肽段,其序列为p-p-r-k-k-k-r-k-h-r-l-w-a-a-h-c-r-k-i-q-l-k-k-d-g-s-s。
[0043]
具体实施方式二:本实施方式ypb肽段的应用,通过ypb肽段与tat和ggg合成,再标记上带有荧光的fitc,得到fitc-tat-ggg-ypb多肽;所述fitc-tat-ggg-ypb多肽用于阻遏yy1和ezh2的结合,进而抑制乳腺癌细胞增殖及肿瘤的生长。
[0044]
具体实施方式三:本实施方式与具体实施方式二不同点是:所述fitc-tat-ggg-ypb多肽的序列为fitc-ygrkkrrqrrr-ggg-pprkkkrkhrlwaahcrkiqlkkdgss。
[0045]
其他步骤与具体实施方式二相同。
[0046]
具体实施方式四:本实施方式ypb肽段的筛选及fitc-tat-ggg-ypb多肽的合成的方法,按以下步骤进行:
[0047]
一、利用大肠杆菌表达his
×
6-yy1蛋白并进行纯化;将ezh2功能区域分为4个片段,构建gst-融合蛋白,并利用大肠杆菌进行蛋白表达和纯化,得到纯化后的gst-ezh2-mut1、mut2、mut3和mut4蛋白;
[0048]
二、通过胺类偶合法将纯化后的his
×
6-yy1蛋白偶联到偶联用芯片上,然后利用生物大分子互作仪分别测定纯化后的gst-ezh2-mut1、mut2、mut3和mut4蛋白与his
×
6-yy1蛋白的结合程度,经过筛选,得到ezh2上一段负责与yy1的结合序列,将这一段序列命名为ypb肽段,其序列为p-p-r-k-k-k-r-k-h-r-l-w-a-a-h-c-r-k-i-q-l-k-k-d-g-s-s;最后将ypb肽段与tat和ggg合成,再标记上带有荧光的fitc,得到fitc-tat-ggg-ypb多肽;所述fitc-tat-ggg-ypb多肽的序列为fitc-ygrkkrrqrrr-ggg-pprkkkrkhrlwaahcrkiqlkkdgss。
[0049]
具体实施方式五:本实施方式与具体实施方式四不同点是:步骤一中所述利用大肠杆菌表达his
×
6-yy1蛋白并进行纯化的步骤如下:
[0050]
(1)将yy1连接到phis
×
6的原核表达载体上,构建得到phis
×
6-yy1表达载体;将phis
×
6-yy1表达载体转入到大肠杆菌bl21 tuners菌株内,在含有50μg/ml卡那霉素的lb培养基中,在37℃的摇床中以220rpm的转速过夜培养;将过夜培养后的菌液按1:50的比例加入到含有50μg/ml卡那霉素的lb培养基中,在37℃下培养2h~3h;
[0051]
(2)将步骤(1)培养后的菌液降至16℃,加入浓度为0.2mm的异丙基-β-d-硫代半乳糖苷,在16℃下继续培养6h~8h或过夜;将菌液在4,000
×
g、4℃下离心20min,收集细菌,然后用25ml的缓冲液i重悬,缓冲液i由20mm tris
·
hcl、200mm nacl、1mm dtt和ph7.5、1
×
蛋白酶抑制剂组成;将装有菌液的离心管在冰水的环境下进行超声波处理,每处理30s间歇1min,直至菌体完全裂解;用20,000
×
g在4℃下离心30min,保留上清液,将上清液与1ml带有镍的树脂混合,在4℃下滚动结合2h,然后将树脂装入层析柱,先用20mm的咪唑洗涤层析柱两次、每次10ml,然后用40mm的咪唑洗涤层析柱两次、每次10ml,再用200mm的咪唑洗脱层
析柱10次、每次200μl,得到含有his
×
6-yy1的洗脱样品;
[0052]
(3)将含有his
×
6-yy1的洗脱样品合并,在4℃条件下进行透析,每隔5小时更换一次透析液,共更换三次透析液,透析液由1.5m nacl、0.05m tris-hcl和1mm dtt组成,ph为7.5;将透析后的样品分装后冻存于-80℃下。
[0053]
其他步骤与具体实施方式四相同。
[0054]
具体实施方式六:本实施方式与具体实施方式四或五不同点是:步骤一中所述将ezh2功能区域分为4个片段,构建gst-融合蛋白,并进行蛋白表达和纯化,其步骤如下:
[0055]
(1)将ezh2的4个片段的编码序列分别连接到pgex-4t-1表达载体上,构建得到pgex-ezh2-mut1、mut2、mut3和mut4表达载体,分别将pgex-ezh2-mut1、2、3和4表达载体转入到大肠杆菌bl21 tuners菌株内,在含有50μg/ml卡那霉素的lb培养基中,在37℃的摇床中以220rpm的转速过夜培养;将培养后的菌液按1:50的比例加入到含有50μg/ml卡那霉素的lb培养基中,在37℃下培养2h~3h;
[0056]
(2)将步骤(1)培养后的菌液降至16℃,加入浓度为0.2mm的异丙基-β-d-硫代半乳糖苷(iptg),在16℃下继续培养6h~8h或过夜;将菌液在4,000
×
g、4℃下离心20min,收集细菌,然后用25ml的缓冲液i重悬,缓冲液i由20mm tris
·
hcl、200mm nacl、1mm dtt和ph7.5、1
×
蛋白酶抑制剂组成;将装有菌液的离心管在冰水的环境下进行超声波处理,每处理30s间歇1min,直至菌体完全裂解;用20,000
×
g在4℃下离心30min,保留上清液,将上清液与1ml偶联有谷胱甘肽的树脂混合,在4℃下滚动结合2h,然后将该树脂装入层析柱,样品在层析柱下端流出后,用10ml pbs洗涤两次层析柱,用洗脱液洗脱10次,每次200μl,得到洗脱后的样品,洗脱液由20mm谷胱甘肽和50mm tris
·
hcl组成,ph为9.0;将洗脱后的样品合并,分装后冻存于-80℃下。
[0057]
其他步骤与具体实施方式四或五相同。
[0058]
具体实施方式七:本实施方式与具体实施方式四至六之一不同点是:步骤二中所述通过胺类偶合法将纯化后的his
×
6-yy1蛋白偶联到偶联用芯片上,然后在生物大分子互作仪上,利用该芯片分别测定纯化后的gst-ezh2-mut1、mut2、mut3和mut4蛋白与偶联在芯片上的his
×
6-yy1蛋白的结合情况,得出gst-ezh2-mut3能够与his
×
6-yy1蛋白结合;进一步将gst-ezh2-mut3平均分成gst-ezh2-mut3a、gst-ezh2-mut3b和gst-ezh2-mut3c,然后在生物大分子互作仪上,利用所述芯片分别测定gst-ezh2-mut3a、gst-ezh2-mut3b和gst-ezh2-mut3c与his
×
6-yy1蛋白的结合情况,得出gst-ezh2-mut3b能够与his
×
6-yy1蛋白结合;再进一步将ezh2-mut3b缩短为ezh2-mut3b-s1和ezh2-mut3b-s2,并分别表达gst-ezh2-mut3b、gst-ezh2-mut3b-s1和gst-ezh2-mut3b-s2,然后经纯化后,与his
×
6-yy1蛋白进行体外蛋白结合,使用带有镍的树脂拉下上述gst-融合蛋白,使用yy1抗体对拉下的样品进行检测,得出gst-ezh2-mut3b-s1能够结合his
×
6-yy1,而gst-ezh2-mut3b-s2不能结合his
×
6-yy1;再将gst-ezh2-mut3b-s1和gst-ezh2-mut3b-s2的序列进行对比,得到ypb肽段。
[0059]
其他步骤与具体实施方式四至六相同。
[0060]
具体实施方式八:本实施方式与具体实施方式四至七之一不同点是:步骤二中所述纯化后的his
×
6-yy1蛋白与芯片偶联前,使用10mm、ph为4.5的naoac缓冲液进行稀释;步骤二中所述纯化后的gst-ezh2-mut1、mut2、mut3和mut4蛋白进行测定前,使用10mm、ph为7.4的hepes缓冲液进行稀释。
[0061]
其他步骤与具体实施方式四至七相同。
[0062]
具体实施方式九:本实施方式与具体实施方式四至八之一不同点是:步骤二中所述利用偶联his
×
6-yy1蛋白的芯片分别测定纯化后的gst-ezh2-mut1、mut2、mut3和mut4蛋白与his
×
6-yy1蛋白的结合能力,其结合时间为90s,解离时间为120s。
[0063]
其他步骤与具体实施方式四至八相同。
[0064]
具体实施方式十:本实施方式与具体实施方式四至九之一不同点是:步骤二中所述的tat的序列为y-g-r-k-k-r-r-q-r-r-r。
[0065]
其他步骤与具体实施方式四至九相同。
[0066]
采用以下实施例验证本发明的有益效果:
[0067]
实施例一:ypb肽段抑制乳腺癌细胞增殖及肿瘤生长的方法,按以下步骤进行:
[0068]
一、利用大肠杆菌表达his
×
6-yy1蛋白并进行纯化:
[0069]
(1)将yy1连接到phis
×
6(即带有连续6个组氨酸序列)的原核表达载体上,构建得到用于细菌中表达的phis
×
6-yy1表达载体;将phis
×
6-yy1表达载体转入到大肠杆菌bl21(de3)tuners菌株内,在含有50μg/ml卡那霉素的lb培养基中,在37℃的摇床中以220rpm的转速过夜培养;将过夜培养后的菌液按1:50的比例加入到新鲜的含有50μg/ml卡那霉素的lb培养基中,在37℃下培养2h~3h,至菌液的600nm的光吸收值为0.6~0.8之间。
[0070]
(2)将步骤(1)培养后的菌液降至16℃,加入浓度为0.2mm的异丙基-β-d-硫代半乳糖苷(iptg),在16℃下继续培养6h~8h或过夜;将菌液在4,000
×
g、4℃下离心20min,收集细菌,然后用25ml的缓冲液i重悬,缓冲液i由20mm tris
·
hcl、200mm nacl、1mm dtt和ph7.5、1
×
蛋白酶抑制剂组成;将装有菌液的离心管在冰水的环境下进行超声波处理(超声波仪的输出为20%)以破碎细菌,每处理30s间歇1min,共处理15~20次,用5μl的裂解菌液加入到1ml的bradford试剂中测定蛋白浓度,以鉴定细菌的裂解情况,直至达到最大程度的蛋白释放,直至菌体完全裂解。用20,000
×
g在4℃下离心30min,保留上清液(为蛋白粗提液),将上清液与1ml的ni sepharose 6fast flow(ge公司)树脂混合,在4℃下滚动结合2h,然后将树脂及样品混合液装入塑料层析柱,样品在柱体下端流出后,先用20mm的咪唑(用缓冲液i配制)洗涤层析柱两次、每次10ml,然后用40mm的咪唑(用缓冲液i配制)洗涤层析柱两次、每次10ml,再用200mm的咪唑(用缓冲液i配制)洗脱层析柱10次、每次200μl,得到含有his
×
6-yy1的洗脱样品。
[0071]
(3)利用sds-聚丙烯酰胺凝胶电泳,检测被洗脱蛋白的纯度,然后将蛋白纯度较高的含有his
×
6-yy1的洗脱样品进行合并,在4℃条件下进行透析,每隔5小时更换一次透析液,共更换三次透析液,透析液由1.5m nacl、0.05m tris-hcl和1mm dtt组成,ph为7.5;将透析后的样品分装后冻存于-80℃下。
[0072]
二、如图4所示,将ezh2功能区域(functional domain)分为4个片段,构建gst-融合蛋白,并进行蛋白表达和纯化:
[0073]
(1)将ezh2的4个片段的编码序列分别连接到pgex-4t-1表达载体上,构建得到pgex-ezh2-mut1、mut2、mut3和mut4表达载体,用于表达gst-ezh2-mut1、mut2、mut3和mut4蛋白;分别将pgex-ezh2-mut1、2、3和4表达载体转入到大肠杆菌bl21 tuners菌株内,在含有50μg/ml卡那霉素的lb培养基中,在37℃的摇床中以220rpm的转速过夜培养;将培养后的菌液按1:50的比例加入到新鲜的含有50μg/ml卡那霉素的lb培养基中,在37℃下培养2h~
v-fitc用于检测早期凋亡的细胞,propidium iodide用于检测晚期凋亡的细胞。
[0097]
(4)利用流式细胞仪检测发现,如图20-图22所示,经过30μm ypb多肽处理48h后的乳腺癌细胞与对照肽段相比出现了明显的细胞凋亡。
[0098]
八、利用小鼠模型研究ypb多肽对裸鼠移植瘤生长实验:
[0099]
选取6周龄裸鼠14只,在其后腿内侧的腹部皮下接种乳腺癌mda-mb-231细胞,每只小鼠接种一次,接种量为2
×
10
6
细胞/只。当移植细胞成瘤,并肿瘤体积达到50-100立方毫米时(第14天),对裸鼠随机分组为两组:对照组和ypb多肽组,每组7只。随后,每48h一次,对两组小鼠的移植瘤分别做瘤内注射对照肽段和ypb多肽(50μl,浓度为0.6μm/μl)。当两组小鼠中移植瘤的最大体积达到1000立方毫米后(第22天),同时牺牲两组的所有小鼠,并取出移植瘤,测量肿瘤相关参数。实验结果显示,与对照肽段相比,ypb多肽对小鼠成瘤具有明显的抑制作用(p<0.001,如图23所示)。
[0100]
综合以上所有实验结果,我们证实了ezh2蛋白上由27个氨基酸组成的ypb区域,负责ezh2与yy1的结合。基于细胞和小鼠的实验结果,合成的ypb多肽能够抑制乳腺癌细胞的增殖,并促进其凋亡,ypb多肽也能够显著抑制乳腺癌细胞在裸鼠中移植瘤的生长。
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询

tips


 商标分类
商标分类  商标转让
商标转让 



