一种基于杂交和级联信号放大原理的多重核酸检测方法及试剂盒与流程
 2021-02-02 11:02:19|
2021-02-02 11:02:19| 241|
241| 起点商标网
起点商标网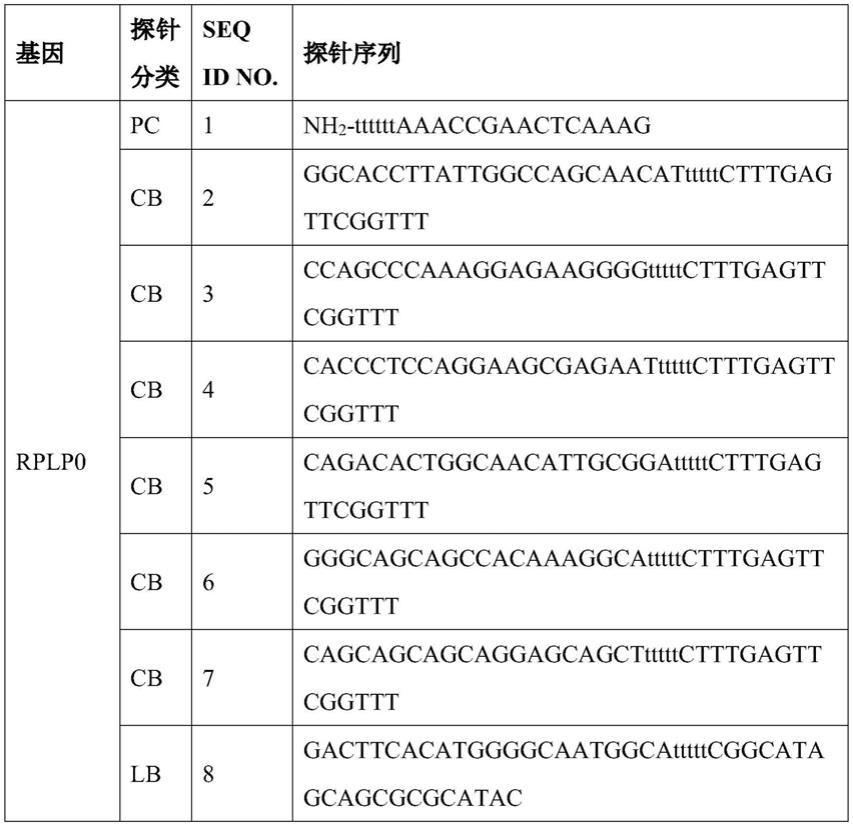
[0001]
本发明涉及生物技术领域,特别地,涉及一种用于检测和/或定量样本中目标核酸分子的方法、组合物以及试剂盒。该检测方法可以对一个样本中的多个目标核酸分子同时进行检测。
背景技术:
[0002]
特定核酸分子的检测已被广泛应用于疾病或疾病亚型的鉴定、病程监控以及预后评估等。目前核酸检测的常用手段包括:实时荧光定量pcr(qpcr)技术、基因芯片、基因测序等。但这些技术或操作繁琐,或费时费力,或检测成本高,或对样本有较高的要求等。
[0003]
目前临床医学检验中应用最广的qpcr技术,属于一种模板扩增技术,利用酶促反应进行模板扩增,然后再进行荧光检测过程。该技术对模板完整性要求高,反应受样本中pcr抑制剂影响较为严重,因而对样本类型、样本处理过程有较为严格的限制;另外,受仪器荧光检测通道数量及反应扩增体系中荧光标记的限制,该技术不适用于在一个样本中同时检测大量目标核酸分子。
[0004]
众所周知,福尔马林固定石蜡包埋(ffpe)组织样本由其可长期常温保存的特点被全球的医院或组织样本库大量采用,供组织学诊断及研究使用。这些珍贵并来源广泛的医学研究材料为回顾性研究、阐明疾病发病机理、生物标志物筛查、预后指示等提供了宝贵的资源;特别是这些标本的临床结局已得到充分记录,因此对于回顾性研究临床研究而言是最佳选择。然而,ffpe样本中不易留存高品质核酸,即便经过了特殊的核酸提取过程,qpcr技术对ffpe样本中的核酸定量仍然存在准确度低和重现性差的问题。
[0005]
公开号为cn105087772a的发明专利公开了一种液相基因芯片检测方法,虽然该专利文献提供了一种透过有引物功能的微珠-引物偶联物扩增待检测样本dna的方法来降低假阳性的风险,但该方法依然需要进行pcr反应,导致产品成本增加,同时存在难以检测少量样本或样本中包含的少量核酸的问题,并且不能够实现对单个样本同时检测多个目标核酸分子。
技术实现要素:
[0006]
为了解决现有技术进行核酸检测过程中的不足,本发明提供了一种基于杂交和级联信号放大原理的多重核酸检测方法,该方法利用多组可区分的微球,通过多组特异性的探针组合的杂交捕获核酸分子,然后经过级联信号放大,使用已商业化的检测仪器,可以在不进行pcr反应的前提下实现在同一个孔中对单个样本中的多个目标核酸分子进行多重检测,特别适用于大量样本中多个目的基因的高通量检测,并且提供与该方法有关的组合物以及试剂盒。
[0007]
为了实现上述目的,本发明提供如下技术方案:
[0008]
在实施方案中,本发明提供一种多重核酸检测方法,包括如下步骤:
[0009]
1)获得含有目标核酸分子的样本;
[0010]
2)上述样本与至少一组预包被目标核酸分子特异性探针的微球混合,并加入与目标核酸分子对应的至少一组特异性探针组合,该特异性探针组合包括捕获桥接探针和标记桥接探针;
[0011]
3)加入至少一组级联信号放大系统,该级联信号放大系统包括初级信号放大分子、次级信号放大分子和信号探针;
[0012]
检测过程中,目标核酸分子通过上述捕获桥接探针与预包被探针互补杂交,从而固定在微球上;且目标核酸分子通过标记桥接探针与级联信号放大系统相连接;上述信号探针提供待检测信号,进而对目标核酸分子进行检测,通过检测系统检测样本中的目标核酸。
[0013]
优选地,上述微球带有可分辨标记。
[0014]
更优选地,上述可分辨标记为条码或荧光染料编码。
[0015]
优选地,上述微球表面带有化学修饰和/或磁性。
[0016]
更优选地,上述微球表面的化学修饰为羟基修饰。
[0017]
优选地,上述探针组合还包括屏蔽探针,该屏蔽探针用来屏蔽目标核酸分子上的一些序列区域,从而减少非特异性杂交。
[0018]
优选地,上述捕获桥接探针、标记桥接探针和屏蔽探针均具有与目标核酸分子互补的区域,互补区域序列长度为15-30个核苷酸。
[0019]
优选地,每组捕获桥接探针包含2-10个不同的捕获桥接探针,该捕获桥接探针具有两个序列区域,一个序列区域为目标核酸分子特异性结合区,能够与目标核酸分子的特定序列区域杂交,另一个序列区域为预包被探针结合区,能够与预包被目标核酸分子特异性探针杂交。
[0020]
优选地,每组标记桥接探针均包含2-10个不同的标记桥接探针,该标记桥接探针均具有两个序列区域,一个序列区域为目标核酸分子特异性结合区,能够与目标核酸分子的特定序列区域杂交,另一个序列区域为级联信号放大系统结合区,能够与级联信号放大系统杂交。
[0021]
优选地,每组屏蔽探针均包含2-10个不同的屏蔽探针,该屏蔽探针能够与目标核酸分子中未与捕获桥接探针、标记桥接探针杂交的序列区域杂交。
[0022]
优选地,上述初级信号放大分子具有两个序列区域,一个序列区域是能够与标记桥接探针互补杂交的前导区,另一个序列区域是由多个能够与初级信号放大分子杂交的重复序列组成。
[0023]
优选地,上述次级信号放大分子具有两个序列区域,一个序列区域是能够与初级信号放大分子杂交的前导区,另一个序列区域是由多个能够与信号探针杂交的重复序列组成。
[0024]
优选地,上述信号探针具有两个序列区域,一个序列区域能够与次级信号放大分子互补杂交,另一个序列区域包含直接或间接提供可检测信号的报告分子,或者包含可以与报告分子结合或反应的标记物。
[0025]
更优选地,前述检测系统可以为具有荧光读数、化学发光读数或放射读数功能的仪器。
[0026]
更优选地,上述检测系统包括电脑和检测分析软件。
[0027]
优选地,上述样本包含dna。
[0028]
优选地,上述样本包含rna。
[0029]
优选地,上述样本为受损样本。
[0030]
更优选地,上述受损样本包含石蜡包埋样本。
[0031]
优选地,上述至少一组预包被目标核酸分子特异性的探针、至少一组特异性探针组合,以及至少一组级联信号放大系统,是指一组或多组。
[0032]
在另一实施方案中,本发明还提供一种用于多重核酸检测方法的组合物,该组合物包括:至少一组预包被目标核酸特异性探针的微球、至少一组特异性探针组合,以及至少一组级联信号放大系统;其中特异性探针组合包括捕获桥接探针和标记桥接探针;级联信号放大系统包括初级信号放大分子、次级信号放大分子和信号探针。
[0033]
优选地,上述特异性探针组合还包括屏蔽探针。
[0034]
在另一实施方案中,本发明还提供一种多重核酸检测试剂盒,该试剂盒的组成包括上述的组合物。
[0035]
本发明所提供的方法其流程可划分为以下三个步骤:
[0036]
(1)目标核酸分子分离:针对不同种类的样本,可以使用相应的商品化的试剂盒对样本进行裂解以释放其中的核酸分子,获得含有目标核酸分子的样本裂解液。
[0037]
(2)目标核酸分子捕获:目标核酸分子特异性的探针组合,经过与目标核酸分子和包被在可区分的微球载体上的预包被探针(pc)的互补杂交,将上述步骤(1)中样本裂解液中的目标核酸分子捕获固定于微球载体上。上述探针组合通常包括捕获桥接探针(cb)、标记桥接探针(lb)和屏蔽探针(bl)。
[0038]
(3)信号放大和检测:利用级联信号放大系统,实现对上述步骤(2)中捕获到的目标核酸分子的信号放大过程,然后通过合适的检测仪器获取信号强度,实现对样本中目标核酸分子的定性或定量分析。
[0039]
具体地,针对样本中含有或疑似含有的n个待检测核酸分子,选用n组任意可以区分的微球载体,例如,n种不同荧光编码的微球,或者n组带有不同条码的微球(n为大于或等于2的正整数)。每一组微球载体都与一种不同的预包被探针相连接。另外,通常情况下,对于每一个目标核酸分子中的m个不同序列区域可以设计m种捕获桥接探针,该m种捕获桥接探针组成了该目标核酸分子的特异性捕获桥接探针组,并且该组捕获桥接探针都可以与同一种预包被探针互补杂交(m为大于或等于2的正整数。一般来说,m不超过10)。因此,样本中的每一个目标核酸分子通过与其对应的一组特异性捕获桥接探针互补杂交,再通过该组捕获桥接探针与相应的一种预包被探针互补杂交,实现了一个目标核酸分子与一种微球的一一对应关系。
[0040]
样本中的多个目标核酸分子,分别经过相应的捕获桥接探针和相应的预包被探针杂交后固定于多组可以区分的微球载体上。之后通过标记桥接探针与目标核酸分子以及级联信号放大系统的互补杂交,形成“荧光编码的荧光微球-预包被探针-捕获桥接探针-目标核酸分子-标记桥接探针-级联信号放大系统”形式的偶联物。利用信号检测仪器,通过检测该偶联物上的级联信号放大系统中的标记及标记的信号强度,可以实现对样本中目标核酸分子的定性和定量检测。同时,通过对微球载体的识别区分,可以对样本中的多种荧光微球
及与之对应的目标核酸分子的区分。因此,通过上述技术方案,可以实现对单个样本中的多个核酸分子的多重检测。
[0041]
在上述技术方案中,可区分的微球载体可以是任意可以区分的固相微球,通常具有平坦的表面并具有刚性。用于微球制造的材料包括但不限于玻璃、硅、二氧化硅、石英和聚苯乙烯。各组微球之间可以根据其荧光发射光谱、直径大小、打印条形码或者以上方式的组合等进行区分。微球载体通常具有表面修饰,便于结合预包被探针。例如,在一些实施例中,微球表面为羟基修饰的,可以通过化学反应包被氨基修饰的探针。优选地,微球具有磁性,以便于从溶液中进行分离。
[0042]
在上述技术方案中,预包被探针是一种多核苷酸,一个预包被探针通常包含与至少一种捕获桥接探针的部分多核苷酸序列互补的至少一种多核苷酸序列,该互补杂交的部分长度一般为15-25个核苷酸。预包被探针可以通过共价或非共价、直接或通过接头分子连接到微球载体上。例如,在一些实施例方式中,预包被探针可以是经过氨基修饰的,通过化学反应可以结合于表面羟基修饰的微球上。例如,在一些实施方式中,预包被探针序列可以包括但不限于为:(5
’→
3
’
)nh
2-ttttttaaaccgaactcaaag(seq id no:1)、nh
2-ttttttgaaaacggtaacttc(seq id no:29)、nh
2-ttttttaggctaacatttgaa(seq id no:53)、nh
2-ttttttaatgctttgactcag(seq id no:79)、nh
2-ttttttactttctttccaagag(seq id no:104)等等。优选地,预包被探针为单链多核苷酸。
[0043]
在上述技术方案中,捕获桥接探针是一种多核苷酸,一个捕获桥接探针具有两个序列区域,其中一个序列区域为目标核酸分子特异性结合区,能够与目标核酸分子的特定序列区域杂交,另一个序列区域为预包被探针结合区,能够与预包被探针杂交。通常情况下,针对同一个目标核酸分子,设计使用2个或以上(通常不超过10个)的针对目标核酸分子不同序列区域的捕获桥接探针,每个捕获桥接探针具有不同的特异性结合区,但具有相同的预包被探针结合区,因此,同一个目标核酸分子的多个捕获桥接探针可以通过预包被探针结合区结合到同一种微球载体上。优选地,捕获桥接探针为单链多核苷酸。例如,在一些实施例中,捕获桥接探针的一般序列结构为:(5
’→
3
’
)tttttttcaaatgttagcct,其中,代表目标核酸分子特异性结合区,需要根据目标核酸分子进行特异性设计;ttcaaatgttagcct为预包被探针结合区,在其他实施例中,可根据不同预包被探针的序列设计能够与预包被探针互补杂交的预包被探针结合区;ttttt代表核苷酸序列ttttt,为区分目标核酸分子特异性结合区和预包被探针结合区的间隔序列(spacer)。总地来说,捕获桥接探针的设计是基于目标核酸序列以及预包被探针序列而定的。
[0044]
在上述技术方案中,标记桥接探针是一种多核苷酸,一个标记桥接探针具有两个序列区域,其中一个序列区域为目标核酸分子特异性结合区,可以与目标核酸分子的特定序列区域杂交,另一个序列区域为级联信号放大系统桥接区,能够与级联信号放大系统中的初级信号放大分子杂交。优选地,标记桥接探针为单链多核苷酸。例如,在一些实施例中,标记桥接探针的一般序列结构为:(5
’→
3
’
)tttttgtatgcgcgctgctatgccg,其中,代表目标核酸分
子特异性结合区,需要根据目标核酸分子进行特异性设计;gtatgcgcgctgctatgccg为级联信号放大系统桥接区,可以作为通用设计;ttttt代表核苷酸序列ttttt,为区分目标核酸分子特异性结合区和级联信号放大系统桥接区的间隔序列(spacer)。
[0045]
在上述技术方案中,屏蔽探针是一种多核苷酸,其能够与目标核酸分子上未与捕获桥接探针和标记桥接探针杂交的序列区域杂交,从而减少非特异性的目标核酸分子和探针的结合,降低检测背景噪音。优选地,屏蔽探针为单链多核苷酸。
[0046]
在上述技术方案中,由捕获桥接探针、标记桥接探针和屏蔽探针组成的探针组合,是目标核酸分子序列特异性的。捕获桥接探针、标记桥接探针和屏蔽探针与目标核酸分子上的非重叠的序列区域互补,并且区域排布通常(但不一定)是连续的。优选地,捕获桥接探针、标记桥接探针和屏蔽探针与目标核酸分子互补序列长度为15-30个核苷酸。
[0047]
在上述技术方案中,级联信号放大系统包括初级信号放大分子、次级信号放大分子和信号探针,其中初级信号放大分子能够与标记桥接探针和次级信号放大分子杂交,次级信号放大分子在与信号探针杂交。
[0048]
在上述技术方案中,初级信号放大分子是一种多核苷酸。一个初级信号放大分子具有两个序列区域,其中一个序列区域为先导区,能够与标记桥接探针互补杂交;另一个序列区域为重复序列区域,能够与一个或多个次级信号放大分子互补杂交。例如,在一些实施例中,初级信号放大分子前导区序列为:(5
’→
3
’
)cggcatagcagcgcgcatac;初级信号放大分子重复序列为:(5
’→
3
’
)tccacggccctagggacaacg,重复次数为20次。优选地,初级信号放大分子为单链多核苷酸。
[0049]
在上述技术方案中,次级信号放大分子是一种多核苷酸。一个次级信号放大分子具有两个序列区域,其中一个序列区域为先导区,至少含有一个能够与初级信号放大分子互补杂交的多核苷酸序列,另一个序列区域为重复序列区域,含有多个通常(但不是必须)相同的能够与信号探针互补杂交的多核苷酸序列。例如,在一些实施例中,次级信号放大分子前导区序列为:(5
’→
3
’
)cgttgtccctagggccgtgga;次级信号放大分子重复序列为:(5
’→
3
’
)agtcagcgccgtaccaagtgc,重复次数为20次。优选地,次级信号放大分子为单链多核苷酸。
[0050]
在上述技术方案中,一分子的目标核酸分子,经过级联信号放大系统的作用,其信号可以放大400倍(初级信号放大分子20倍,次级信号放大分子20倍)。
[0051]
在上述技术方案中,信号探针是一种多核苷酸,其具有两个序列区域,一个序列区域可以与次级信号放大分子互补杂交,另一个序列区域包含直接或间接提供可检测信号的报告分子,或者包含可以与报告分子结合或反应的标记物。例如,在一些实施方式中,信号探针直接偶联有可供检测信号的报告分子,包括(但不限于)荧光分子、化学发光分子、放射性分子等。例如,在一些实施方式中,信号探针偶联的标记物包括(但不限于)生物素、辣根过氧化物酶、碱性磷酸酶等,相应地,报告分子可以是链霉亲和素标记的报告分子或各种酶的底物。更进一步地,用于生物素检测的亲和素或链霉亲和素可标记具有二次扩增能力的酶(辣根过氧化物酶或碱性磷酸酶),进行信号的二次放大。例如,在一些实施方式中,信号探针的序列为:(5
’→
3
’
)biotin(dt)-gcacttggtacggcgctgact(seq id no:129),报告分子为藻红蛋白修饰的链霉亲和素(sape)。
[0052]
在上述技术方案中,上述检测仪器根据级联信号放大系统中报告分子的不同,相
应的可以是具有荧光读数、化学发光读数、放射读数等功能的仪器。
[0053]
在上述技术方案中,上述捕获桥接探针、标记桥接探针、屏蔽探针、初级信号放大分子、次级信号放大分子和信号探针,其序列中可以(但不是必须)包含有经过化学修饰的核苷酸或脱氧核苷酸。化学修饰方式包括但不限于:骨架修饰、碱基修饰、核糖糖修饰、桥连核酸、异碱基等。上述捕获桥接探针、标记桥接探针、屏蔽探针、初级信号放大分子、次级信号放大分子和信号探针,均可以通过商业公司进行化学合成获得。
[0054]
在上述技术方案中,在各个步骤中的任意一步中,未杂交固定于微球载体上的组分均可以与已结合于微球载体上的组分相分离。例如,捕获桥接探针、标记桥接探针、屏蔽探针、样本中的目标核酸分子以及预包被于微球载体上的预包被探针杂交后,未能杂交的捕获桥接探针、标记桥接探针、屏蔽探针和样本中的核酸分子通过可以洗涤从系统中清除;初级信号放大分子、次级信号放大分子、信号探针与前述步骤(2)所得的偶联物杂交后,未能杂交的初级信号放大分子、次级信号放大分子、信号探针通过可以洗涤从系统中清除;在前述步骤(3)中,在一些实施方式中,报告分子杂交后,未能杂交的报告分子通过洗涤可以从系统中清除。
[0055]
为了实现在对单个样本的多重核酸检测,本发明设计了一套多组分的检测方案,包括:含有或疑似含有的n个待检测核酸分子的样本、n组任意可以区分的微球载体、n组预包被探针、n组捕获桥接探针、n组标记桥接探针,以及级联信号放大系统和信号检测系统。可选的,还包括屏蔽探针。
[0056]
在上述技术方案下的一个优选技术方案中,可区分的荧光编码的荧光微球,是美国luminex公司的magplex微球,其特征在于,微球直径5.6μm,带有磁性,经过不同比例的两种荧光染料进行荧光编码,表面带有羟基修饰。上述检测系统为美国luminex公司的magpix或luminex 100/200或bio-rad公司的bio-plex 200。
[0057]
在上述技术方案下的一个优选技术方案中,级联信号放大系统包括初级信号放大分子、次级信号放大分子、偶联信号放大标记物的信号探针和报告分子。其中,每个初级信号放大分子具有20个重复序列区域,每个次级信号放大分子具有20个重复序列区域;信号探针偶联的信号放大标记物为生物素,每个信号探针带有1个生物素分子;上述信号放大标记物的报告分子是藻红蛋白标记的链霉亲和素(sape)。
[0058]
更进一步的,为了减少检测系统背景噪音以及假阳性结果,提高系统的准确性和灵敏性,在上述技术方案中,设计初级信号放大分子、次级信号放大分子和信号探针时,可以加入5%~50%的异碱基,具体地,异碱基是异胞嘧啶(isoc)及异鸟苷酸(isog)。优选地,异碱基的比例为20~30%。
[0059]
本发明还提供了一套试剂盒和检测系统,用于实现本发明的目的,即在单一孔中对单个样本的多个目标核酸分子进行多重检测。该试剂盒包括:n组任意可以区分的微球载体、特异性探针组合(包括n组预包被探针、n组捕获桥接探针、n组标记桥接探针),以及级联信号放大系统和信号检测系统。可选的,还包括屏蔽探针。另外,该试剂盒还任选地包括样本裂解液、裂解缓冲液、稀释液、杂交缓冲液和/或洗涤缓冲液,以及已知浓度的一个或多个核酸标准品。本发明的试剂盒可以根据需要追加含有用于各成分的混合的管、微孔板、试纸条和记载使用方法的指示资料等。根据级联信号放大系统中报告分子的不同,检测系统可以为具有荧光读数、化学发光读数、放射读数等功能的仪器。可选的,检测系统还包括电脑
和检测分析软件。
[0060]
本专利的多重核酸检测方法能够应用于多项领域,例如遗传分析、基因表达分析、癌症或疾病检测、法医分析(包括亲子鉴定或刑事调查)、手术移植筛选、用于产品或工艺的质量控制和认证等。
[0061]
定义
[0062]
探针
[0063]
本文中使用的术语“探针”表示多核苷酸,优选为单链的脱氧核糖核苷酸(deoxyribonucleoside),包括天然(naturally occurring)dnmp(damp、dgmp、dcmp和dtmp)、变形核苷酸或非天然核苷酸,此外,还可以包含核糖核苷酸(ribonucleoside)。
[0064]
当多核苷酸由字母序列(例如“aggctaacatttgaa”)表示时,应理解除非另有说明,否则核苷酸从左到右依次为5'至3',或者本领域技术人员从上下文中可明确判断。
[0065]
互补
[0066]
本文中所述的“互补”是指在杂交条件下,探针与目标核酸序列选择性地进行杂交的充分互补,具有将实质上互补(substantially complementary)和完全互补(perfectly complementary)全部包括在内的含义,优选地为完全互补。本说明书中使用的术语“实质上互补的序列”不仅包括完全一致的序列,也包括能够在特定目标序列上发挥探针的作用且与作为比较对象的序列有部分不一致的序列。
[0067]
探针的序列不需要具有与模板的一部分序列完全互补的序列,只要在能够与模板杂交从而发挥其固有作用的范围内具有充分的互补性即可。因此,本发明中的探针不需要具有与作为模板的上述核苷酸序列完全互补的序列,只要在能够与模板杂交从而发挥其固有作用的范围内具有充分的互补性即可。探针的设计为本领域技术人员所掌握的技能,例如可以利用引物设计程序。
[0068]
样本
[0069]
本文中所述的“样本”可以是任意含有或可能含有目标核酸分子的样本,可以包括至少一种细胞、细胞培养物、组织样本、裂解物、提取物、溶液或怀疑含有目标核酸的反应混合物。在一些实施方式中,样本可以来源于动物、人、植物、培养的细胞系、病毒、细菌、真菌等。在其他非限制性实施方式中,样本可以是细胞裂解液、细胞间液、体液(包括但不限于血液、血清、唾液、尿液、粪便、喉咙或鼻拭子、脊髓液、淋巴液、腹膜液、玻璃体液、泪液、精液、阴道分泌物、肺积液、浆膜液、支气管肺泡灌洗液等)、细胞培养液等。在另一些实施方式中,样本可以来源于新鲜组织样本、冻存组织、活检样本、ffpe样本等。
[0070]
本文中所述的“受损样本”是指具有降解的核酸的样品。受损样本可能是由于暴露于物理力(如剪切力)、恶劣环境(如热或紫外线)、化学降解、生物降解或纯化分离技术等因素,与天然环境中核酸的正常形式相比,降解的核酸具有断裂、缺口或化学修饰。
[0071]
用于保存生物组织样品的标准保存技术通常使用福尔马林、甲醛或多聚甲醛进行固定,用石蜡、丙烯酰胺或纤维素进行包埋的。一些保存过程会使用高温,例如石蜡渗透,这种处理可能损害样品,导致dna和rna发生化学修饰。福尔马林固定和石蜡包埋(ffpe)的样品中,rna或dna通常含有核苷酸-核苷酸和核苷酸-蛋白质交联,以及其他影响核酸完整性的化学修饰,例如甲醛和核苷酸之间的反应会在两个核苷酸的氨基之间形成亚甲基桥,该修饰会中断逆转录反应(masuda等,nucleic acids res.27(22):4436-4443,1999)。此外,
随着时间的推移,ffpe样品中的核酸通常会持续降解,导致核酸片段化,特别是rna的片段化。这些dna和rna的修饰会影响传统聚合酶连锁反应中复制模板序列的步骤,从而导致不准确的测量和不可靠的数据。
[0072]
目标核酸分子
[0073]
本文中所述的“目标核酸分子”包含待检测的特定核酸序列,可以是任意期望的核酸分子。核酸的来源可以是动物、人、植物、培养的细胞系、病毒、细菌、真菌等。目标核酸分子可以是单链或双链dna、dna:rna杂合体或rna,包括但不限于rrna、trna、strna、snrna、短干扰rna(sirna)、信使rna(mrna)、小rna(microrna)、长链非编码rna(lncrna)等,“目标”部分可以是双链、单链或与双链和单链部分重叠。
[0074]
有益效果
[0075]
本发明提供了一种基于杂交和级联信号放大原理的多重核酸检测方法,该方法利用多组可区分的微球,通过多组特异性的探针组合的杂交捕获核酸分子,然后经过级联信号放大后进行检测,可以在不进行pcr反应的前提下实现在同一个孔中对单个样本中的多个目标核酸分子进行多重检测,并且能够针对少量样本或样本中包含的少量核酸进行检测,实现节省成本并降低假阳性的目的。
附图说明
[0076]
图1,本发明方法原理示意图,显示微球-特异性探针组合-目标核酸-级联信号放大系统复合物的组成。
[0077]
图2a-2c,本发明方法核酸特异性探针组合示意图。图2a以目标核酸分子1为例,设计多个捕获桥接探针、多个标记桥接探针以及多个屏蔽探针;图2b为标记桥接探针示意图,包含目标核酸分子特异性结合区和初级信号放大分子结合区;图2c为捕获桥接探针示意图,包含目标核酸分子特异性结合区和预包被探针结合区。
[0078]
图3a-3c,本发明方法级联信号放大系统示意图。图3a为初级信号放大分子和次级信号放大分子结合的示意图,其中初级信号放大分子包括初级信号放大分子前导区和多个重复序列;图3b为次级信号放大分子和信号探针结合示意图,其中次级信号放大分子包括次级信号放大分子前导区和多个重复序列;图3c为信号探针示意图,带有与次级信号放大分子重复序列互补的序列和信号放大标记物或报告分子。
[0079]
图4,管家基因信号强度(net mfi)与rna浓度之间的关系。
[0080]
目标核酸分子:1、10,微球:2、11,预包被探针:3、12,捕获桥接探针:4(4-1、4-2)、13,捕获桥接探针目标核酸分子特异性结合区:4-2-2,捕获桥接探针预包被探针结合区:4-2-1,标记桥接探针:5(5-1、5-2)、14,标记桥接探针目标核酸分子特异性结合区:5-1-1,标记桥接探针初级信号放大分子结合区:5-1-2,屏蔽探针:6(6-1、6-2)、15,初级信号放大分子:7,次级信号放大分子:8,信号探针:9。
具体实施方式
[0081]
以下结合附图与具体实施例对本发明做进一步的描述,本发明的保护内容不局限于以下实施例。还应该理解,本发明实施例中使用的术语是为了描述特定的具体实施方案,而不是为了限制本发明的保护范围。在不背离发明构思的精神和范围下,本领域技术人员
能够想到的变化和优点都被包括在本发明中,并且以所附的权利要求及其任何等同物为本发明的保护范围。在本发明的说明书和权利要求书中,除非文中另外明确指出,单数形式“一个”、“一”和“这个”包括复数形式,例如,“至少一组特异性探针”是指可以存在一组和多于一组的寡核苷酸探针。下列实施例中未注明具体条件的实验方法,均为本领域技术人员的普遍知识和公知常识,包含本领域技术人员所熟知的各种替代、修改/修饰和等同物,或按照制造厂商所建议的条件。如无特别说明,实施例所用的所有材料和试剂均为市售产品。
[0082]
如图1所示,针对待检测的目标核酸分子1和目标核酸分子10,分别选用两组可以区分的微球2和微球11其中,微球2上结合预包被探针3,微球11上结合有预包被探针12。针对核酸分子1的不同序列区域,设计了一组特异性探针组合:捕获桥接探针4、标记桥接探针5和屏蔽探针6。目标核酸分子1通过捕获桥接探针4与预包被探针3互补杂交,从而固定在微球2上。类似地,目标核酸分子10倍固定在微球11上。由于微球2和微球11是可以区分,因此,目标核酸分子1和10也可以通过检测微球2和微球11各自不同的标记而得以区分。
[0083]
目标核酸分子1通过标记桥接探针5与级联信号放大系统相连接。该信号放大系统由初级信号放大分子7、次级信号放大分子8和信号探针9等组成。通过检测信号探针9携带的信号放大标记物或报告分子的信号强度,就可以对目标核酸分子1进行定量。同理,也可以对目标核酸分子10进行定量。
[0084]
屏蔽探针6和屏蔽探针15可以屏蔽掉目标核酸分子上的一些序列区域,从而减少非特异性杂交,提高整个检测系统的特异性。
[0085]
图2进一步解释了本发明所述的特异性探针组合的捕获目标核酸分子的原理。以目标核酸分子1为例,设计多个捕获桥接探针(4-1、4-2)、多个标记桥接探针(5-1、5-2)以及多个屏蔽探针(6-1、6-2),进一步提高系统的特异性和灵敏性。其中,每个捕获桥接探针(以4-2为例),均包含目标核酸分子特异性结合区(4-2-2)和预包被探针结合区(4-2-1);每个标记桥接探针(以5-1为例),均包含目标核酸分子特异性结合区(5-1-1)和初级信号放大分子结合区(5-1-2)。多个屏蔽探针(6-1和6-2)可以进一步减少非特异性结合。
[0086]
图3进一步解释了本发明所述的级联信号放大系统的进行信号放大的原理。所述级联信号放大系统包括初级信号放大分子7、次级信号放大分子8和信号探针9。其中,每个初级信号放大分子均含有初级信号放大分子前导区7-1和多个重复序列7-2,7-1可以与标记桥接探针的初级信号放大分子结合区(例如,5-1-2)杂交,7-2可以与次级信号放大分子前导区8-1杂交。每个次级信号放大分子均含有次级信号放大分子前导区8-1和多个重复序列8-2,8-1可以与初级信号放大分子重复序列(7-2)杂交,8-2可以与信号探针9杂交结合。每个信号探针9带有与8-2互补的序列9-1和信号放大标记物或报告分子9-2。图3a、b分别展示了各带有20个重复序列的初级和次级信号放大分子,因此,信号可以放大400倍。
[0087]
实施例1:5个管家基因检测试剂盒(hk5)的配制
[0088]
我们以5个管家基因(rplp0、gapdh、actb、gusb、tfrc)为例,设计并配制上述5个基因的检测试剂盒。
[0089]
该试剂盒组分包括:预包被探针的微球载体、特异性探针组合、初级信号放大分子、次级信号放大分子、信号探针、报告分子、裂解液、稀释液、洗涤液以及标准品等。
[0090]
在本实施例中所用到的5个管家基因的相关信息,见表1。
[0091]
表1、5个管家基因的相关信息
[0092]
基因名称nm编号微球编号rplp0nm_001002.435gapdhnm_002046.736actbnm_001101.547gusbnm_000181.438tfrcnm_003234.461
[0093]
(1)探针设计:依据本发明所描述的各探针的特征,设计的5个管家基因的探针组合信息,见表2。
[0094]
表2、5个管家基因的探针组合信息
[0095]
[0096]
[0097]
[0098]
[0099]
[0100]
[0101][0102]
pc:微球载体上的预包被探针,cb:捕获桥接探针,lb:标记桥接探针,bl:屏蔽探针。
[0103]
(2)特异性探针组的制备:由商业化基因合成公司合成表2中所列探针,并用1
×
te
溶解混合,cb、lb和bl三种探针的终浓度分别为50fmol/l、200fmol/l和100fmol/l。
[0104]
(3)微球组的制备:选用美国luminex公司的表面羟基修饰的magplex微球,5种微球编号分别为35、36、47、38和61号。每种微球分别用1
×
pbs清洗后,加入0.1m mes(2-吗啉乙磺酸)(ph 4.5)处理。去除mes溶液后,每5
×
10
6
个微球,加入0.5nmol的相应的预包被探针,在2mg/ml 1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐溶液中,避光包被4小时。包被结束后,加入10%的bsa(牛血清白蛋白)封闭,然后用1
×
pbs进行清洗后保存于1
×
te溶液中备用。将5种微球等比例进行混合,得到hk5微球组,终浓度为每种微球2000个/μl。
[0105]
其中,1
×
te溶液组成为:10mm tris-hcl(ph 7.5-8.0),1mm edta(ph 7.5-8.0)。
[0106]
(4)初级信号放大分子和次级信号放大分子的设计:
[0107]
初级信号放大分子(seq id no:127):
[0108]
ttttttccacggccctagggacaacgtttt(20
×
)。
[0109]
次级信号放大分子(seq id no:128):
[0110]
tttttagtcagcgccgtaccaagtgctttt(20
×
)。
[0111]
(5)信号探针的设计:
[0112]
biotin(dt)-gcacttggtacggcgctgact。(seq id no:129)
[0113]
(6)报告分子:20μg/ml sape(藻红蛋白标记的链霉亲和素)。
[0114]
(7)缓冲体系配制(以下溶液浓度均为终浓度):
[0115]
裂解液:1m hepes[4-(2-羟乙基)-1-哌嗪乙磺酸](ph 8.0),10%月桂基硫酸锂,0.25m edta(乙二胺四乙酸),5m氯化锂,600mg/l蛋白酶k。
[0116]
洗涤液:0.1
×
ssc,0.1%sds(十二烷基磺酸钠)。
[0117]
次级信号放大分子稀释液:50%马血清,0.5mg/ml蛋白酶k,5
×
ssc,1.3%sds,6mm tris
–
hcl,65℃孵育2小时,然后添加6mm苯甲基磺酰氟,0.05%叠氮化钠,0.05%proclin 300和10%硫酸葡聚糖。
[0118]
标准品稀释液:133mm hepes(ph 7.5),532mm氯化锂,10.6mm edta,1.3%月桂基硫酸锂,16mg/ml鲑鱼精子dna,0.04%叠氮化钠,0.04%proclin 300。
[0119]
封闭液:10%bsa。
[0120]
sape稀释液:3m四甲基氯化铵,0.01%月桂酰肌氨酸钠,50mm tris(三羟甲基氨基甲烷),4mm edta。
[0121]
其中,20
×
ssc缓冲液组成为:3m氯化钠,0.3m柠檬酸钠,ph6.9~7.1。
[0122]
一般地,上述试剂盒使用方法介绍如下:
[0123]
步骤1:参照下表配制微球工作液,确保避光,置于室温。
[0124]
表3、工作液配置表
[0125][0126][0127]
步骤2:对于细胞样本或血液样本,每孔加入20μl微球工作液,80μl样本;对于ffpe样本,每孔加入60μl微球工作液,40μl样本。封板后,600rpm,54℃孵育18-22小时。
[0128]
步骤3:使用96微孔板磁力架吸附磁珠1分钟,然后弃掉板孔中液体,使用200μl洗涤液洗板3次。
[0129]
步骤4:每孔加入100μl(0.8fmol)初级信号放大分子溶液,封板后,600rpm,50℃孵育1小时。
[0130]
步骤5:使用96微孔板磁力架吸附磁珠1分钟,然后弃掉板孔中液体,使用200μl洗涤液洗板3次。
[0131]
步骤6:每孔加入100μl(1fmol)次级信号放大分子溶液,封板后,600rpm,50℃孵育1小时。
[0132]
步骤7:使用96微孔板磁力架吸附磁珠1分钟,然后弃掉板孔中液体,使用200μl洗涤液洗板3次。
[0133]
步骤8:每孔加入100μl(0.4fmol)信号探针,封板后,600rpm,50℃孵育1小时。
[0134]
步骤9:使用96微孔板磁力架吸附磁珠1分钟,然后弃掉板孔中液体,使用200μl洗涤液洗板3次。
[0135]
步骤10:每孔加入100μl报告分子sape,封板后,600rpm,室温孵育30分钟。
[0136]
步骤11:使用96微孔板磁力架吸附磁珠1分钟,然后弃掉板孔中液体,使用200μl洗涤液2洗板3次。
[0137]
步骤12:每孔中加入130μl洗涤液2,800rpm室温震荡3分钟,然后使用luminex 100/200或bio-plex 200系统读取信号强度。
[0138]
实施例2:微球体悬浮芯片方法的灵敏度、线性动态范围、精确度
[0139]
利用从基因合成公司合成的5个管家基因(prlp0、gapdh、actb、gusb、tfrc)标准品,使用实施例1中设计的hk5检测试剂盒,对微球体悬浮芯片技术的灵敏度、线性动态范围、精确度和特异性等性能参数进行测试。结果见表4。
[0140]
表4、微球体悬浮芯片方法检测5个管家基因的性能参数
[0141][0142]
(1)灵敏度和线性动态范围:将5个管家基因(prlp0、gapdh、actb、gusb、tfrc)标准品等量混合,并3倍梯度稀释,得到10个梯度标准品稀释液,范围分别为(单位amol/μl):240.00、80.00、26.67、8.89、2.96、0.99、0.33、0.11、0.04、0.01,并依次记为std1、std2、std3、std4、std5、std6、std7、std8、std9、std10。
[0143]
使用实施例1中设计的hk5检测试剂盒,对所述10个梯度浓度的标准品稀释液和1个空白对照进行检测。每个管家基因信号强度(net mfi)与rna浓度之间的关系如图4所示。动态线性范围约为0.11-120amol/μl,线性相关系数0.997。同时,5个管家基因检测的lod为0.04amol/μl。
[0144]
另外,通过对空白对照(样本稀释液)的信号强度测定,5个管家基因(prlp0、gapdh、actb、gusb、tfrc)其平均背景强度(mfi)分别为5.9、6.8、5.1、4.6和5.8。
[0145]
(2)精确度:进行灵敏度和线性动态范围实验时,分别在3块96微孔板,每块微孔板进行了3个复孔的重复实验。测试计算得出的板内cv小于10%,板间cv小于15%,表明本发明方法具有良好的精确度。
[0146]
实施例3:不同保存时间的卵巢癌ffpe样本中5个管家基因的检测
[0147]
本实施例中,测试了不同保存时间的卵巢癌ffpe样本,共198例,对5个管家基因(prlp0、gapdh、actb、gusb、tfrc)的表达量进行了检测。样本信息表见表5。
[0148]
同时,为了验证本发明核酸检测的灵活性和准确性,上述5个管家基因分别代表了在常规组织中不同相对表达水平的基因。其中,actb、gapdh、prlp0相对表达量高,tfrc相对表达量中等,gusb相对表达量低。
[0149]
上述198例样本在肿瘤分期中均为ii期。每个ffpe样本通过组织切片机切片,经he染色确认切片肿瘤组织面积大于70%,每个样本切片数量为10片,总切片厚度为50μm。将上述组织切片经过ffpe组织裂解液消化处理离心后,取上清进行核酸检测实验,检测试剂盒为实施例1中设计的hk5检测试剂盒。检测结果见表6。
[0150]
表5、卵巢癌ffpe样本信息表
[0151]
保存时间样本数量5年5710年5015年50
20年41合计198
[0152]
表6、卵巢癌ffpe样本5个管家基因检测结果
[0153][0154][0155]
实验结果表明,本发明的方法对于ffpe组织样本中不同相对表达量的基因,能够进行很好的区分。另外,即使对于保存时间达到20年的ffpe组织样本中相对表达量低的基因(如gusb),使用本发明的方法,依然可以进行准确测定其表达量。
[0156]
在本发明提及的所有文献都在本申请中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询

tips


 商标分类
商标分类  商标转让
商标转让 


