聚丙烯腈膜固定化海藻糖合酶催化麦芽糖产海藻糖的方法与流程
 2021-02-02 11:02:37|
2021-02-02 11:02:37| 223|
223| 起点商标网
起点商标网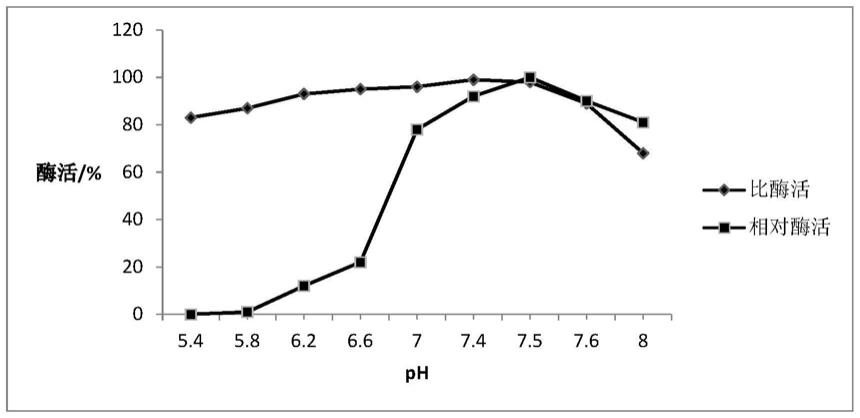
[0001]
本发明属于酶固定化技术领域,具体涉及以聚丙烯腈膜为载体,采用吸附法固定化海藻糖合酶,用于催化麦芽糖产海藻糖的方法。
背景技术:
[0002]
海藻糖是由两个吡喃型葡萄糖单体通过α,α-1,-1糖苷键连结而成的二糖。广泛存在于细菌、霉菌、藻类、酵母、低等植物以及些无脊椎动物等,具有独特的生物抗逆保护作用以及低甜度、非还原性等,在分子生物学、食品、化妆品、医药行业等各个领域应用广泛。海藻糖生产方法主要有化学合成法、微生物抽提法、微生物发酵法、酶法等,其中双酶法是目前工业化生产海藻糖的主要方法,但存在着酶需要精制、反应中间产物多、产物分离提取过程复杂等问题,而海藻糖合酶能够以廉价的麦芽糖为底物一步生成海藻糖,具有工艺简单、底物廉价、易于调控等特性,是工业上生产海藻糖的常见方法。但是,依然存在酶制备工艺复杂、游离酶稳定性差、不能重复利用、与底物分离困难等许多缺陷,但通过结合固定化技术可以有效解决以上不足。
[0003]
目前国内外固定化海藻糖合酶的报道中以介孔分子筛、细菌纤维素、壳聚糖、磁性feo纳米材料、eupergit c250l为载体、多孔聚苯乙烯离子交换树脂为载体进行海藻糖合酶的固定化研究,解决了固定化酶操作稳定性及转化率等问题,但同时还存在固定化酶制备周期长、方法重复性差以及副产物含量高等问题。
[0004]
聚丙烯腈是指由85%以上丙烯腈与第二、第三单体聚合而成的高聚物,具有易成膜、抗菌性、成本低以及良好的物理化学稳定性等优点,常用作工业化生产分离膜材料;同时,利用聚丙烯腈纤维上的多孔性以及弱酸性基团如羧酸根、磺酸根等可以进行吸附染色。
[0005]
本发明以聚丙烯腈膜为载体,采用吸附法固定化海藻糖合酶,用于催化麦芽糖产海藻糖,载体材料制备方法简单、操作容易、易于控制、成本低、可规模化生产且固定化条件简单、时间短、无污染,能获得具有良好酶学特性的固定化海藻糖合酶,海藻糖合酶固定化时使用粗酶液,无需纯化,且反应液中副产物葡萄糖的含量大大降低,具有很可观的工业化应用价值。
技术实现要素:
[0006]
本发明的目的在于提供聚丙烯腈膜固定化海藻糖合酶催化麦芽糖产海藻糖的方法。为实现上述目的,本发明采用如下技术方案:
[0007]
(1)聚丙烯腈膜制备
[0008]
在250ml蓝盖瓶中加入55ml二甲基甲酰胺和5ml聚乙二醇400轻轻混匀,加入10g聚丙烯腈粉末,搅拌均匀,加盖拧紧置于65℃反应,再于室温下放置24h除去气泡,倒入具有0.44mm深度槽的玻璃板上,用玻璃棒刮膜,并立即将玻璃板放入去离子水中,形成薄膜后,将薄膜放置于新的去离子水中24h以上,中间换3次水,得聚丙烯腈膜材料;
[0009]
(2)游离酶液制备
[0010]
将产酶菌种接种到30ml的tb培养基中,37℃、200r/min摇瓶至od值为0.6,加入诱导剂iptg至终浓度为1mmol/l,发酵18h,所得发酵液离心收集菌体,用磷酸氢二钠-柠檬酸缓冲液清洗后重悬,超声破碎离心取上清,即得海藻糖合酶酶液;
[0011]
(3)海藻糖合酶固定化
[0012]
取制备好的聚丙烯腈膜于烧杯中,加入去离子水超声处理20min后,去除表面水分,取30cm
2
面积的膜,裁剪为0.5cm
2
面积,放置于50ml离心管中,加入3ml磷酸氢二钠-柠檬酸缓冲液制备的海藻糖合酶酶液,在25℃水浴中吸附反应3h后,用磷酸氢二钠-柠檬酸缓冲液清洗载体,除去表面附着的游离酶,离心、抽滤即得固定化海藻糖合酶;
[0013]
(4)固定化酶反应
[0014]
取步骤(3)所得的固定化海藻糖合酶,加入8ml5%的麦芽糖底物,在20~60℃下反应12h,沸水煮沸10min终止反应,用hplc法测定海藻糖的含量。
[0015]
进一步优选的,所述步骤(1)中反应40~50h至黄色均匀粘稠液体。
[0016]
进一步优选的,所述步骤(2)中所采用的产酶菌种选用玫瑰链霉菌或节杆菌属,于25℃、200r/min条件下发酵,发酵液800r/min离心5min收集菌体。
[0017]
进一步优选的,所述步骤(3)中磷酸氢二钠-柠檬酸缓冲液的ph为7.6,去离子水超声处理功率为100w,频率40khz。
[0018]
进一步优选的,所述步骤(4)中高效液相色谱柱选用xbridge amide氨基柱,流动相为乙腈:水=80:20,流速1.0ml/min,进样量20μl,柱温为37℃,反应后的载体用缓冲液清洗除去表面水分后可再次循环使用。
[0019]
采用本发明固定化海藻糖合酶的方法,使用的载体材料制备方法简单、操作容易、易于控制、成本低、可规模化生产且固定化条件简单、时间短、无污染等,同时,海藻糖合酶固定化时使用粗酶液即可,无需纯化,得到的固定化海藻糖合酶具有更好的耐热性和酸碱稳定性,重复使用6次后仍能保持初始酶活的64.4%,具有良好的操作稳定性,且反应液中副产物葡萄糖的含量大大降低,固定化后海藻糖合酶更加稳定。
附图说明
[0020]
图1为ph对固定化效果的影响
[0021]
图2为固定化温度对固定化酶酶活的影响
[0022]
图3为固定化时间对固定化酶酶活的影响
[0023]
图4为固定化加酶量对固定化酶酶活的影响
[0024]
图5为固定化酶与游离酶最适反应ph
[0025]
图6为固定化酶与游离酶最适反应温度
[0026]
图7为固定化酶与游离酶最适初始底物浓度
[0027]
图8为固定化酶40℃条件下重复使用稳定性
[0028]
图9为金属离子对固定化酶以及游离酶的影响
[0029]
图10为固定化酶与游离酶反应进程曲线
[0030]
(注:a为固定化酶反应进程;b为游离酶反应进程)
具体实施方式
[0031]
本发明用下列实施例来进一步说明本发明,但本发明的保护范围并不限于下列实施例,本发明还可通过不同的实施方式加以实现或运用,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
[0032]
(1)聚丙烯腈膜制备
[0033]
在250ml蓝盖瓶中加入55ml二甲基甲酰胺和5ml聚乙二醇400轻轻混匀,加入10g聚丙烯腈粉末,搅拌均匀,加盖拧紧置于65℃反应反应40~50h至黄色均匀粘稠液体,再于室温下放置24h除去气泡,倒入具有0.44mm深度槽的玻璃板上,用玻璃棒刮膜,并立即将玻璃板放入去离子水中,形成薄膜后,将薄膜放置于新的去离子水中24h以上,中间换3次水,得聚丙烯腈膜材料。
[0034]
(2)游离酶液制备
[0035]
将产酶菌种接种到30ml的tb培养基中,37℃、200r/min摇瓶至od值为0.6,加入诱导剂iptg至终浓度为1mmol/l,于25℃、200r/min条件下发酵18h,所得发酵液800r/min离心5min收集菌体,用磷酸氢二钠-柠檬酸缓冲液清洗后重悬,超声破碎离心取上清,即得海藻糖合酶酶液。
[0036]
(3)海藻糖合酶固定化
[0037]
取制备好的聚丙烯腈膜于烧杯中,加入去离子水超声处理20min后(功率100w,频率40khz),去除表面水分,取30cm
2
面积的膜,裁剪为0.5cm
2
面积,放置于50ml离心管中,加入3ml磷酸氢二钠-柠檬酸缓冲液制备的海藻糖合酶酶液,在25℃水浴中吸附反应3h后,用磷酸氢二钠-柠檬酸缓冲液清洗载体,除去表面附着的游离酶,离心、抽滤即得固定化海藻糖合酶。
[0038]
(4)固定化酶反应
[0039]
取步骤(3)所得的固定化海藻糖合酶,加入8ml5%的麦芽糖底物,在20~60℃下反应12h,沸水煮沸10min终止反应,用hplc法测定海藻糖的含量,高效液相色谱柱选用xbridge amide氨基柱,流动相为乙腈:水=80:20,流速1.0ml/min,进样量20μl,柱温为37℃。
[0040]
(5)海藻糖、麦芽糖、葡萄糖标准曲线制作
[0041]
根据海藻糖标准曲线,求岀样品中海藻糖的含量。
[0042]
(6)游离酶酶活测定
[0043]
取制备的游离酶酶液稀释一定倍数,取1ml于50ml离心管中,加入8ml5%的麦芽糖底物,30℃条件下反应12h,沸水浴煮沸10min终止反应,离心过膜后,用hplc法测定反应液中海藻糖含量。
[0044]
(7)固定化酶酶活测定
[0045]
取步骤(3)所制的固定化酶,加入8ml5%的麦芽糖底物,在20~60℃下反应12h,沸水煮沸10min终止反应,离心过膜后,用hplc法测定反应液中海藻糖含量。
[0046]
(8)酶活有关定义
[0047]
a.酶活单位定义:在以上反应条件下每分钟生成lμumol海藻糖为一个单位酶活。
[0048]
b.相对酶活定义:以反应条件中酶活最大的反应为100%,计算其余反应酶活相对百分比。
[0049]
c.比酶活:反应总的酶活与酶总蛋白含量的比值。
[0050]
d.相对比酶活定义:以反应条件中比酶活最大的反应为100%,计算其余反应比酶活相对百分比。
[0051]
实施例1
[0052]
固定化条件优化
[0053]
取30cm
2
面积的膜,裁剪为0.5cm
2
面积,放置于50ml离心管中,依次考察在ph5.4~8.0的酶液、10~45℃震荡水浴、吸附反应时间0.5~5.0h、给酶量0.04~0.42mg/cm
2
等不同条件下固定化酶的总酶活,考察其对固定化效果的影响,选择最佳固定化ph、温度、吸附时间、给酶量。
[0054]
(1)ph对固定化效果的影响
[0055]
取ph5.4~8.0磷酸氢二钠-柠檬酸缓冲液制备的酶液,在25℃震荡水浴锅中吸附反应3h,考察ph对固定化酶活性的影响,结果见图1。
[0056]
如图1所示,随着ph值的升高,固定化酶活性逐渐升高,在ph7.6时酶活最高;比酶活在ph7.4后急剧下降,由于聚丙烯腈膜材料上带有弱酸性基团,ph较低时影响弱酸性基团的电离,所以,偏碱性的环境有利于酶分子中氨基与载体上的羧酸基结合,因此选择最佳固定化反应ph为7.6。
[0057]
(2)固定化温度对固定化酶酶活的影响
[0058]
取相同的聚丙烯腈膜载体在ph7.6条件下,分别在10、25、30、35、40、45℃震荡反应3h,制备固定化酶,考察温度对固定化酶酶活的影响,结果见图2。
[0059]
如图2所示,随着固定化温度的升高,固定化酶酶活逐渐升高,在35℃时酶活性最高,随着温度的继续升高固定化酶酶活性急剧下降;固定化酶比酶活随着温度的升高先升高后急剧下降,在30℃时比酶活达到最大。由此可知,随着温度的升高,偶联到载体上的蛋白含量增多,同时由于游离酶对温度的敏感性,温度的改变使酶的空间构象发生变化,导致酶活性的变化。因此选择30℃作为固定化温度。
[0060]
(3)固定化时间对固定化酶酶活的影响
[0061]
取相同膜面积的聚丙烯腈载体,在ph7.6、温度30℃条件下,加入3ml酶液,在相同条件下分别固定化吸附0.5~5.0h,通过测量不同不固定化时间条件的见固定化蛋白量和固定化酶总酶活,考察固定化时间对固定化酶的影响,结果见图3。
[0062]
如图3所示,随着固定化时间的延长,固定化酶活逐渐增加,并逐渐平稳;而相对比酶活先增加后逐渐降低,由此可知,随着固定化时间的延长,载酶量逐渐增加,酶活趋于稳定,说明酶分子开始从表层扩散进入载体空隙内,但有效酶仅与载体表面积有关。因此,选择固定化时间为3.0h。
[0063]
(4)固定化加酶量对固定化酶酶活的影响
[0064]
取相同膜面积的聚丙烯腈载体,在ph7.6、温度30℃条件下,分别加入0.04~0.42mg/cm
2
的酶液,固定化反应3h,考察加酶量对固定化酶酶活的影响,结果见图4。
[0065]
如图4所示,随着加酶量的逐渐增大,固定化酶活逐渐增大最后基本不变,而相对比酶活呈逐渐下降的趋势,由此可知,固定化酶有效载酶量仅与膜表面积有关。因此,选择最适加酶量为0.1mg/cm
2
。
[0066]
得到最佳固定化条件为;ph7.6、30℃、加酶量0.1mg/cm
2
条件下震荡吸附3h。
[0067]
实施例2
[0068]
固定化酶的酶学性质
[0069]
在最佳固定化条件下制备固定化酶,取相同面积的固定化酶膜以及相同蛋白含量的游离酶,依次考察在:ph5.4~8.0的5%(w/v)麦芽糖底物、20~60℃、麦芽糖底物质量浓度50~350g/l以及cu
2+
、co
2+
、zn
2+
、ni
2+
、al
3+
、ca
2+
、ba
2+
、mg
2+
、fe
2+
、mn
2+
等不同金属离子溶液的条件下的总酶活,分析固定化酶的最适反应ph、温度、初始底物浓度、稳定性、抑制剂和激活剂和反应副产物等酶学特性。
[0070]
(1)固定化酶的最适反应ph
[0071]
制备固定化酶以及取相同偶联蛋白含量的游离酶,分别加入不同ph缓冲液配制的底物,在25℃条件下反应12h,采用hplc法测定酶活,结果见图5。
[0072]
如图5所示,固定化酶的最适反应ph为7.4,与游离酶相比,固定化酶ph稳定性在ph5.4~8.2范围均保持良好的稳定性,说明经过固定化后,使得酶活性中心对环境ph的敏感性变弱,酶分子更加稳定。
[0073]
(2)固定化酶的最适反应温度
[0074]
制备固定化酶以及取相同偶联蛋白含量的游离酶,分别加入ph7.4缓冲液配制的麦芽糖底物,分别在20~60℃之间反应12h,采用hplc法测定酶活,结果见图6。
[0075]
如图6所示,固定化酶的最适反应温度为40℃,且在25~45℃范围内均保持较高的酶活,相对于游离酶最适温度30℃,最适温度提高了10℃,且在50、60℃比游离酶耐热性高,经过固定化后,酶的热稳定性得到提高。
[0076]
(3)固定化酶反应的最适初始底物浓度
[0077]
制备固定化酶以及取相同固定化蛋白含量的游离酶,分别加入ph7.4与ph7.0缓冲液配制的质量浓度为50~350g/l梯度的麦芽糖底物,在40℃反应12h,采用hplc法测定酶活,结果见图7。
[0078]
如图7所示,固定化酶最适初始底物浓度为200g/l,随着底物浓度的升高,有略微的下降。
[0079]
(4)固定化酶的稳定性
[0080]
制备固定化酶,在ph7.4、40℃、麦芽糖200g/l的条件下反应12h,反应结束后,取出反应液煮沸10min,用hplc法测定反应总酶活,将载体用ph7.4的缓冲液进行清洗,除去表面水分,重复上述操作共15次,考察固定化酶的重复稳定性,结果见图8。
[0081]
如图8所示,固定化酶随着使用次数的增多,酶活逐渐下降,在最适反应温度40℃条件下使用6次后,固定化酶活仍保持初始酶活的64.4%。
[0082]
(5)金属离子对固定化酶的影响
[0083]
制备固定化酶,同时取相同固定化酶含量的游离酶酶液,分别加入200g/l、ph7.4的麦芽糖底物和25%、ph6.6的麦芽糖底物,以及配制的10mmol/l浓度的cu
2+
、co
2+
、zn
2+
、ni
2+
、al
3+
、ca
2+
、ba
2+
、mg
2+
、fe
2+
、mn
2+
溶液,使得金属离子终浓度为0.4mmol/l,固定化酶与游离酶分别在40、30℃条件下反应12h,用hplc法测定酶活,以不加入金属离子的反应为空白对照,结果见图9。
[0084]
如图9所示,对于游离酶而言,ni
2+
具有激活作用,cu
2+
、fe
2+
、co
2+
均具有轻微的抑制作用,其余的金属离子基本无影响;对于固定化酶而言,仅cu
2+
具有轻微的抑制作用,ca
2+
、
zn
2+
具有激活作用,而其余的金属离子对酶活基本无影响,说明固定化后酶的空间构象发生改变,金属离子对酶的作用发生变化,固定化后提高了酶的稳定性。
[0085]
(6)固定化酶与游离酶反应进程
[0086]
制备相同的固定化酶膜,加入8ml200g/l的麦芽糖底物,在40℃、ph7.4条件分别反应4~70h;同时取相同蛋白含量的游离酶酶液,加入8ml 250g/l的麦芽糖底物,在30℃、ph6.6条件分别反应4~70h,取固定化酶和游离酶不同反应时间的反应液,沸水浴10min,离心、过膜,用hplc法测不同反应时间各个成分的含量,结果见图10。
[0087]
如图10所示,对于固定化酶、游离酶而言,随着反应时间的进行,海藻糖含量逐渐升高,伴随着麦芽糖含量的降低以及副产物葡萄糖的增加,最终基本趋于稳定状态;相比之下,经过固定化后的海藻糖合酶,海藻糖含量变化趋势较游离酶的缓慢,同时副产物葡萄糖的含量较游离酶而言减少近6%左右,说明,经过固定化后的海藻糖合酶相对于游离酶结构状态更为稳定,副产物葡萄糖含量减少。
[0088]
因此在最佳固定化条件下制备的固定化酶最适反应条件为:40℃、ph7.4、初始麦芽糖底物浓度200g/l。
[0089]
以上所述实施例仅是为充分说明本发明所举的较佳实施例,不能以此来限定本发明的权利范围,本领域的技术人员在此基础上所作的修改和等同变化,仍在本发明的保护范围之内。
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
相关标签:
 热门咨询
热门咨询

tips


 商标分类
商标分类  商标转让
商标转让 



