双膦配体化合物、铬化合物、乙烯低聚催化体系以及乙烯低聚物的制备方法与流程
 2021-02-02 11:02:10|
2021-02-02 11:02:10| 74|
74| 起点商标网
起点商标网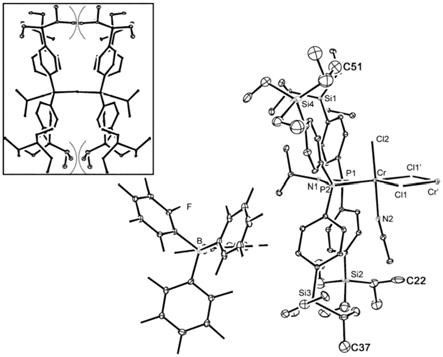
[0001]
本发明涉及一种适用于大规模生产和商业化生产过程的双膦配体化合物,该化合物可以确保极高的活性与优良的经济效益之间的兼容性,并且可以提高乙烯低聚反应的选择性,从而可用于以高产率制备1-己烯和/或1-辛烯;用该化合物制备的铬化合物;包含所述铬化合物的乙烯低聚催化体系;以及使用该化合物的乙烯低聚物的制备方法。
背景技术:
[0002]
乙烯低聚物1-己烯和/或1-辛烯是在聚烯烃(例如聚乙烯)的聚合中大量用作共聚单体的化合物。近年来,随着使用均相茂金属催化剂的聚烯烃的生产的增加,对于乙烯低聚物中的特别是1-己烯和1-辛烯的需求增加。
[0003]
在相关技术中,利用基于镍催化剂的壳牌高级烯烃工艺(shop)通过乙烯的低聚反应来制备具有约4至约30个碳原子的1-烯烃,并且可以从这些1-烯烃中分离出1-己烯和/或1-辛烯。此后,发明了能够通过提高乙烯低聚反应的选择性,从而以高产率制备1-己烯或1-己烯和1-辛烯的催化体系。
[0004]
举例来说,由sassol有限公司开发的一种催化体系由作为铬(iii)化合物的crcl
3
或cr(acac)
3
、作为双膦配体的iprn(pph
2
)
2
以及作为助催化剂的甲基铝氧烷(mao)或改性甲基铝氧烷(mmao)组成,并且该催化体系选择性地产生1-辛烯和1-己烯(专利文献1和2)。
[0005]
但是,这样的常规催化体系具有以下缺点,例如对于市售可得的活性需要大量昂贵的mao或mmao(al/cr=300至500),最佳活性温度低(约60℃),并且不需要的聚乙烯(pe)副产物的生产率高,这导致制造成本增加且生产率低,同时阻碍了催化体系的商业化(非专利文献1和2)。
[0006]
具体而言,当将活性转化为相对于mao或mmao的输入量的活性时,常规的催化体系由于使用了大量昂贵的mao或mmao,因此具有较低的商业优势。此外,约60℃的低的最佳活性温度导致通过空冷或水冷控制反应热的效率迅速降低,甚至在产生少量聚乙烯副产物的情况下也产生了气球效应,从而损害了大规模生产的优势。
[0007]
尽管已经积极地进行了不需要使用昂贵的mao的催化体系的开发,但是这种催化体系的活性通常比使用mao的催化体系的活性低得多,并且它们不适合商业用途(非专利文献3至5)。
[0008]
由于这些原因,本领域技术人员已经进行了各种尝试来开发不使用mao或mmao的催化体系,该催化体系具有约80℃的高的最佳活性温度,并且可以极大地抑制聚乙烯副产物的产生。然而,对于常规技术,在不使用mao或mmao的情况下,要实现足够高的活性、特别是这种高活性催化剂的大规模生产是非常困难的。
[0009]
因此,对开发乙烯低聚技术的需求日益增加,该技术可以在与乙烯单体接触时以高选择性和良好的生产率制备1-己烯和/或1-辛烯,同时确保高活性与经济可行性之间的兼容性。
[0010]
(现有技术文献)
[0011]
专利文献1:韩国专利待审查公开no.10-2006-0002742
[0012]
专利文献2:美国专利no.7,511,183b2
[0013]
非专利文献1:organometallics,27(2008)5712-5716
[0014]
非专利文献2:organometallics,31(2012)6960-6965
[0015]
非专利文献3:organometallics,26(2007)1108-1111
[0016]
非专利文献4:organometallics,26(2007)2561-2569
[0017]
非专利文献5:organometallics,26(2007)2782-2787
[0018]
非专利文献6:acs omega,2(2017)765-773
[0019]
非专利文献7:angewandte chemie international edition 2016,55,12351
技术实现要素:
[0020]
【技术问题】
[0021]
本发明的一个方面是提供了一种具有有利特性的双膦配体化合物,以用于制备铬化合物和包含该铬化合物的乙烯低聚催化体系。
[0022]
本发明的另一个方面是提供一种铬化合物,即使不使用甲基铝氧烷(mao)或改性甲基铝氧烷(mmao),该铬化合物也可以确保使乙烯低聚反应的活性和选择性得到显著提高,从而允许以高产率制备1-己烯和/或1-辛烯。
[0023]
本发明的另一个方面是提供了一种乙烯低聚体系,该乙烯低聚体系在乙烯低聚反应的应用中可以实现对1-己烯和/或1-辛烯的良好选择性,并通过确保高活性和优异的经济可行性之间的兼容性而适合于大规模生产。
[0024]
本发明的又一方面是提供一种适合于大规模生产的乙烯低聚物制备方法,该方法能够确保极高的活性和优异的经济可行性之间的兼容性,同时确保乙烯低聚反应的活性和选择性得到显著提高,即使不使用甲基铝氧烷(mao)或改性甲基铝氧烷(mmao),也可以以高产率制备1-己烯和/或1-辛烯。
[0025]
通过以下实施方案的详细描述,本发明的上述和其他方面将变得显而易见。
[0026]
【技术方案】
[0027]
本发明的一个实施方案涉及一种由式a表示的双膦配体化合物。
[0028]
[式a]
[0029]
[0030]
其中,在式a中,r为取代或未取代的c
1
至c
60
烷基或取代或未取代的c
6
至c
60
芳基,并且r
1
为取代或未取代的c
1
至c
60
烷基或取代或未取代的c
6
至c
60
芳基。
[0031]
在式a中,r可以为[ch
3
(ch
2
)
d
]
2
ch-*(d为0至20中的整数),并且r
1
可以各自独立地为乙基、异丙基或正丁基。
[0032]
另一个实施方案涉及一种由式1表示的铬化合物。
[0033]
[式1]
[0034][0035]
其中,在式1中,r为取代或未取代的c
1
至c
60
烷基或取代或未取代的c
6
至c
60
芳基;r
1
为取代或未取代的c
1
至c
60
烷基或取代或未取代的c
6
至c
60
芳基;x各自独立地为卤原子、c
2
至c
30
羧化物、乙酰丙酮化物、或包含或不含选自醚基和胺基中的至少一种的c
1
至c
30
羟基;a为硼或铝;并且y为氟取代的c
6
至c
20
芳基、氟取代的c
6
至c
20
芳氧基或氟取代的c
1
至c
20
烷氧基。
[0036]
在式1中,[ay
4
]-可以为[b(c
6
f
5
)
4
]-。
[0037]
在式1中,r可以为[ch
3
(ch
2
)
d
]
2
ch-*(d为0至20中的整数),并且r
1
可以各自独立地为乙基、异丙基或正丁基。
[0038]
在式1中,r可以为异丙基;r
1
可以为正丁基;x可以为cl;并且[ay
4
]-可以为[b(c
6
f
5
)
4
]-。
[0039]
本发明的另一个实施方案涉及一种乙烯低聚催化体系,该催化体系包含:由式1表示的铬化合物;和由式2表示的有机铝化合物。
[0040]
[式2]
[0041]
(r
2
)
3
al
[0042]
其中,在式2中,r
2
是c
1
至c
20
烷基。
[0043]
在式2中,r
2
可以为异丁基或乙基。
[0044]
在乙烯低聚催化体系中,在式1中,r可以为异丙基;并且r
1
可以各自独立地为乙基、异丙基或正丁基;x可以为cl;并且[ay
4
]-可以为[b(c
6
f
5
)
4
]-。
[0045]
本发明的另一个实施方案涉及一种乙烯低聚物制备方法,该方法包括:通过使催化体系与乙烯单体接触而选择性地制备1-己烯和/或1-辛烯。
[0046]
【有益效果】
[0047]
本发明提供了具有有利特性的双膦配体化合物,以用于制备铬化合物和包含该铬化合物的乙烯低聚催化体系。
[0048]
本发明提供了一种铬化合物,即使不使用甲基铝氧烷(mao)或改性甲基铝氧烷(mmao),该铬化合物也可以确保使乙烯低聚反应的活性和选择性得到显著提高,从而允许
以高产率制备1-己烯和/或1-辛烯。
[0049]
本发明提供了一种乙烯低聚体系,该乙烯低聚体系在乙烯低聚反应的应用中可以实现对1-己烯和/或1-辛烯的良好选择性,并通过确保高活性与优异的经济可行性之间兼容性而适合于大规模生产。
[0050]
本发明提供了一种适合于大规模生产的乙烯低聚物制备方法,该方法能够确保极高的活性和优异的经济可行性之间的兼容性,同时确保使乙烯低聚反应的活性和选择性得到显著提高,即使不使用甲基铝氧烷(mao)或改性甲基铝氧烷(mmao),也可以以高产率制备1-己烯和/或1-辛烯。
附图说明
[0051]
图1示出了通过x射线晶体学分析的实施例5中制备的铬化合物的结构。
[0052]
图2示出了实施例1中制备的铬化合物的
31
p nmr谱、
1
h nmr谱、
19
f nmr谱和epr谱的分析结果。
具体实施方式
[0053]
在本文中,除非另有说明,否则在下式中,诸如h、b、c、n、o、f、p、cr、cl、si等的符号表示由相应元素符号表示的元素。
[0054]
在本文中,除非另有说明,否则下式中的“*”是指相应化学结构中的连接位点。
[0055]
在本文中,除非另有说明,否则下式中的
“-”
是指相应化学结构中的键合位点。
[0056]
在本文中,在下式中,me表示甲基,et表示乙基,pr表示丙基,ipr表示异丙基,bu表示丁基,ph表示苯基,acac表示乙酰丙酮化物,并且thf表示四氢呋喃。
[0057]
<乙烯低聚反应用双膦配体化合物>
[0058]
本发明的一个实施方案涉及一种由式a表示的双膦配体化合物。
[0059]
[式a]
[0060][0061]
在式a中,r为取代或未取代的c
1
至c
60
烷基或取代或未取代的c
6
至c
60
芳基,并且r
1
为取代或未取代的c
1
至c
60
烷基或取代或未取代的c
6
至c
60
芳基。
[0062]
具体而言,在式a中,r可以为[ch
3
(ch
2
)
d
]
2
ch-*(d为0至20中的整数)。根据该实施方案,当将由式a表示的双膦配体化合物应用于乙烯低聚反应的催化体系时,可以实现高活性,同时进一步改善在脂族烃溶剂中的溶解性、聚合反应和反应产物的均质性。
[0063]
由式a表示的双膦配体化合物可以包括甲硅烷基(*-si-(r
1
)
3
),该甲硅烷基的磷末端被三个r
1
基团取代,从而在应用于乙烯低聚反应的催化体系时实现活性的显著提高。在这种情况下,例如,双膦配体化合物可以提高活性,而无需使用昂贵的助催化剂,例如甲基铝氧烷(mao)和改性甲基铝氧烷(mmao)。因此,由式a表示的双膦配体化合物可以确保高活性和经济可行性之间的兼容性,从而提供更适合于大规模生产的乙烯低聚催化体系和使用该体系的乙烯低聚物的制备方法。此外,由式a表示的双膦配体化合物抑制了高分子量副产物的产生,并且适合用于工艺的稳定运行。
[0064]
在式a中,被三个r
1
基团取代的甲硅烷基(*-si-(r
1
)
3
)可以键合至双膦配体的苯环(-c
6
h
4-)的对位。在该实施方案中,与其中被三个r
1
基团取代的甲硅烷基(*-si-(r
1
)
3
)键合至苯环的邻位或间位的化合物相比,当将由式a表示的双膦配体化合物应用于乙烯低聚反应的催化体系时,可以显著提高活性,同时进一步抑制1-己烯的生成,从而进一步提高对1-辛烯的选择性。
[0065]
在被三个r
1
基团取代的甲硅烷基(*-si-(r
1
)
3
)中,三个r
1
基团可以各自独立并且可以具有相同或不同的烷基。
[0066]
在一个实施方案中,在式a中,被三个r
1
基团取代的甲硅烷基(*-si-(r
1
)
3
)可以总共有4至50个碳原子。在由式1表示的铬化合物中,当被三个r
1
基团取代的甲硅烷基(*-si-(r
1
)
3
)为具有小于4个碳原子、例如具有3个碳原子的甲基甲硅烷基(例如*-sime
3
)时,由于空间位阻不足,因而不能阻止铬化合物转化为具有两个与其配位的配体并表现为无活性的化合物,从而使铬化合物不能实现高活性。
[0067]
具体而言,在式a中,r
1
为取代或未取代的c
1
至c
60
烷基或取代或未取代的c
6
至c
60
芳基,其中对于取代基的种类没有特别的限制。每个r
1
可以具有直链结构、支链结构、环结构和/或其他结构等。
[0068]
更具体而言,在式a中,r
1
各自独立地为选自甲基、乙基、丙基、异丙基、丁基、异丁基、戊基、异戊基、新戊基、己基、庚基、辛基、壬基以及它们的组合的组中的烷基。在该实施方案中,式a的双膦配体在限制分子结构中与p-n键相邻的部分的旋转方面可以具有进一步改善的效果。
[0069]
例如,在式a中,r
1
可以各自独立地为乙基、异丙基或正丁基。在该实例中,当将其应用于乙烯低聚反应的催化体系时,由式a表示的双膦配体化合物可以显著提高活性,同时抑制高分子量副产物的产生,从而适用于商业化生产过程。
[0070]
由式a表示的双膦配体化合物可以通过本领域已知的任何方法制备而没有限制。
[0071]
具体而言,可以通过使包括r基团的胺化合物与包括被三个r
1
基团取代的甲硅烷基(*-si-(r
1
)
3
)的膦化合物反应来制备由式a表示的双膦配体化合物。在这种情况下,胺化合物可将r基团赋予式a的化合物,而膦化合物可将被三个r
1
基团取代的甲硅烷基(*-si-(r
1
)
3
)赋予式a的化合物。或者,可以通过使能够将r基团赋予式a的化合物的其他有机化合物与包括被三个r
1
基团取代的甲硅烷基(*-si-(r
1
)
3
)的膦化合物反应来制备由式a表示的双膦配体化合物。
[0072]
更具体而言,可以通过使作为具有r基团的胺化合物的r-nh
2
与x-p(-c
6
h
4-p-si-(r
1
)
3
)
2
反应来制备由式a表示的双膦配体化合物,x-p(-c
6
h
4-p-si-(r
1
)
3
)
2
为包括被三个r
1
基团取代的甲硅烷基(*-si-(r
1
)
3
)的膦化合物。
[0073]
在一个实施方案中,可以通过使作为胺化合物的([ch
3
(ch
2
)
d
]
2
ch-nh
2
)与作为膦化合物的((r
1
)
3-si-c
6
h
4
)
2
p-cl)进行反应,从而容易地制备由式a表示的双膦配体化合物,其中r为[ch
3
(ch
2
)
d
]
2
ch-*(d为0至20中的整数)。此处,[ch
3
(ch
2
)
d
]
2
ch-nh
2
可以容易地获得并且具有良好的经济可行性以确保在商业化生产过程中的更高可用性。
[0074]
<铬化合物>
[0075]
本发明的另一个实施方案涉及一种具有由非配位阴离子和三价铬阳离子组成的新结构的铬(iii)化合物,并且该化合物用式1表示。
[0076]
[式1]
[0077][0078]
在式1中,r为取代或未取代的c
1
至c
60
烷基或取代或未取代的c
6
至c
60
芳基;r
1
为取代或未取代的c
1
至c
60
烷基或取代或未取代的c
6
至c
60
芳基;x各自独立地为卤原子、c
2
至c
30
羧化物、乙酰丙酮化物、或包含或不含选自醚基和胺基中的至少一种的c
1
至c
30
羟基;a为硼或铝;并且y为氟取代的c
6
至c
20
芳基、氟取代的c
6
至c
20
芳氧基或氟取代的c
1
至c
20
烷氧基。
[0079]
由于铬(iii)化合物通常具有6配位几何形状,因此式1的铬(iii)化合物另外与醚、硫化物、胺、腈、h
2
o和/或其他等进行配位,或者可以以μ2-cl双核化合物的形式存在,其中式1的铬(iii)化合物中包含的cl配体被两个铬原子或铝原子共享以形成桥。
[0080]
当应用于乙烯低聚催化体系时,通过使由式2表示的有机铝化合物与由式1的化合物接触而进行活化,从而经由解配而除去与式1的化合物另外配位的醚、硫化物、胺、腈、h
2
o配体,并且由式2表示的有机铝化合物将形成桥的c
l
配体转化为烷基,从而对乙烯低聚催化反应的实现产生很小的负面影响。
[0081]
图1示出了式1的铬化合物的一个实例的结构(在实施例5中制备的式1-4的化合物[(iprn[p(c
6
h
4-p-si(ipr)et
2
]
2
)-crcl
2
]
+
[b(c
6
f
5
)
4
]-),该结构通过x-射线晶体学分析得到。参见图1可以看出,根据本发明的式1的铬化合物具有与铬原子另外配位的腈配体并且以μ2-cl双核化合物的形式存在,其中cl配体被两个铬原子共享以形成桥。
[0082]
此外,在图1的左上角由矩形框表示的结构是配位有两个双膦配体的非活性化合物的结构,基于通过x射线晶体学分析的结构而任意地构建了该结构,并且表明了由于(r
1
)
3
si-*基团之间的碰撞而不能获得这种结构。
[0083]
因此,当应用于乙烯低聚反应时,即使不使用甲基铝氧烷(mao)或改性甲基铝氧烷(mmao),根据本发明的铬化合物也可以显著提高乙烯低聚反应的活性和选择性,从而允许以高产率制备1-己烯和/或1-辛烯。
[0084]
在乙烯低聚反应中,根据本发明的铬化合物的最佳活性温度可以为60℃或更高,
具体地为70℃或更高,更具体地为80℃至100℃,例如70℃、80℃或90℃。在此范围内,根据本发明的铬化合物可进一步提高通过空冷或水冷控制反应热的效率,以适合于大规模生产,同时进一步提高了商业效益。
[0085]
在乙烯低聚反应中,与现有技术相比,根据本发明的铬化合物可以显著抑制聚乙烯副产物的产生。作为结果,根据本发明的铬化合物可以有效地防止由于副产物在大规模生产中的积累而引起的气球效应,同时进一步提高了商业效益。
[0086]
具体而言,在式1中,r可以为c
1
至c
30
烷基或c
6
至c
30
芳基。更具体而言,在式1中,r可以为由[ch
3
(ch
2
)
d
]
2
ch-*(d为0至20中的整数)表示的烷基。在该实施方案中,当应用于乙烯低聚反应的催化体系时,式1的铬化合物可以确保进一步改善在脂族烃溶剂中的溶解性,同时进一步改善聚合反应和反应产物的均质性。
[0087]
在一个实施方案中,式1的r可以为异丙基((ch
3
)
2
ch-*)。在这种情况下,可以使用廉价的异丙胺作为原料来制备式1的铬化合物。此外,当将式1的铬化合物应用于乙烯低聚反应的催化体系时,实现了对1-辛烯高活性和高选择性。
[0088]
式1的铬化合物包括键合至与磷(p)原子键合的苯基部分(-c
6
h
4-)的对位(-p-)的有机甲硅烷基。由不含有机甲硅烷取代基的配体组成的常规铬化合物(例如[{iprn(p(c
6
h
5
)
2
)
2
}-crcl
2
]
+
[ay
4
]-)很容易转化为具有与两个配体配位的6-配位几何形状的化合物(即,[{iprn(p(c
6
h
5
)
2
)
2
}
2-crcl
2
]
+
[ay
4
]-)。已知具有与两个配体配位的6-配位几何形状的化合物不具有催化活性。相反,在根据本发明的式1的铬化合物中,键合至苯基部分的对位上的有机甲硅烷基实现了位阻,以防止式1的铬化合物转化为具有与两个配体配位的6-配位几何形状的非活性化合物(即,[{r-n-[p(-c
6
h
4-p-si-(r
1
)
3
)
2
]
2
}
2-crx
2
]
+
[ay
4
]-),由此可以获得具有高活性的铬化合物。此外,在式1的铬化合物中,有机甲硅烷基的哈米特取代基常数(σ)为-0.07,其类似于哈米特取代基常数(σ)为0的氢,从而通过空间位阻使实现高活性的效果最大化,同时使电子对膦配体的影响最小化。
[0089]
在式1的铬化合物中,有机甲硅烷基键合至与磷(p)原子键合的苯基部分的对位,从而通过限制与式1的铬化合物配位的双膦配体(r-n-(p(c
6
h
4-(r
1
)
3
)
2
)
2
)中p-n键的旋转而使配体与铬牢固键合。当式1的铬化合物中的苯基部分的对位上具有氢(h)(即,当铬化合物包括具有r-n-(p(c
6
h
5
)
2
)
2
结构的配体时)而不是有机甲硅烷基时,这种结构可使p-n键相对容易地旋转。作为结果,可能发生配体与铬的解配,并且使用包含引入氢(h)的配体(即r-n-(p(c
6
h
5
)
2
)
2
)的铬化合物制备的催化体系在高温下会生成大量的聚乙烯(pe)副产物。相反,根据本发明,包括具有有机甲硅烷基的双膦配体的式1的铬化合物具有相对稳定的配位体,从而即使在高温下也能实现高活性,同时使pe副产物的产生最小化。
[0090]
具体地,在式1中,r
1
为取代或未取代的c
1
至c
60
烷基或取代或未取代的c
6
至c
60
芳基,其中取代基的种类不受特别限制。此外,每个r
1
可以具有直链结构、支链结构、环结构和/或其他结构等。
[0091]
更具体而言,在式1中,r
1
各自独立地为选自由甲基、乙基、丙基、异丙基、丁基、异丁基、戊基、异戊基、新戊基、己基、庚基、辛基、壬基以及它们的组合组成的组中的烷基。在该实施方案中,式1的铬化合物可以进一步改善限制分子结构中与p-n键相邻的部分的旋转的效果。
[0092]
例如,在式1中,r
1
可以各自独立地为乙基、异丙基或正丁基。在这种情况下,当将
[0105]
在式i-1中,r
4
为取代或未取代的c
6
至c
60
芳基;r
5
各自独立地为取代或未取代的c
1
至c
60
烷基;a为硼或铝;并且y为氟取代的c
6
至c
20
芳基、氟取代的c
6
至c
20
芳氧基或氟取代的c
1
至c
20
烷氧基。a和y的细节与上述相同。
[0106]
[式cr]
[0107]
cr(x
2
)
3
(x
3
)
m
[0108]
在式cr中,x
2
各自独立地为卤素基团、乙酰丙酮化物基团和羧化物基团中的至少一者,x
3
为c
2
至c
20
的含醚官能团或乙腈,并且m为0或3。
[0109]
[式a]
[0110][0111]
在式a中,r为取代或未取代的c
1
至c
60
烷基或取代或未取代的c
6
至c
60
芳基,并且r
1
为取代或未取代的c
1
至c
60
烷基或取代或未取代的c
6
至c
60
芳基。r和r
1
的细节与上述相同。
[0112]
用这种方法,本发明可以提供一种铬化合物,该化合物可以在乙烯低聚反应中实现对1-己烯和/或1-辛烯的显著良好的反应活性和选择性。
[0113]
在一个实施方案中,c
2
至c
20
的含醚官能团可包括四氢呋喃。
[0114]
使由式i-1表示的离子化合物与由式cr表示的铬前体化合物反应可以包括,例如,将由式i-1表示的离子化合物和由式cr表示的铬前体化合物中的每一种分散或溶解在溶剂中,然后将所得化合物混合以相互反应。此处,反应可以在室温(20℃)至100℃,具体而言20℃至50℃,更具体而言20℃的温度下进行1小时至24小时,具体地1小时至12小时,更具体地12小时,但不限于此。
[0115]
添加由式a表示的双膦配体化合物可以包括,例如,将分散或溶解在溶剂中的双膦配体化合物添加到式i-1的离子化合物和式cr的铬前体化合物的反应产物中,使其反应。此处,反应可以在室温(20℃)至100℃,具体地20℃至50℃,更具体地20℃的温度下进行10分钟至5小时,具体地10分钟至3小时,更具体地2小时,但不限于此。
[0116]
溶剂可以不受限制地选自任何溶剂,只要该溶剂在表现出良好的分散性或溶解性的同时不妨碍组分之间的反应即可。具体而言,溶剂可以为乙腈(ch
3
cn)、二氯甲烷(ch
2
cl
2
)和/或其他溶剂等。
[0117]
在一个实施方案中,制备式1的铬化合物的反应可以用反应式1表示。
[0118]
[反应式1]
[0119][0120]
反应式1示出了例如当式i-1的化合物为[phn(h)me
2
]
+
[b(c
6
f
5
)
4
]-,式cr的化合物为crcl
3
(thf)
3
,并且式a的化合物为iprn[p(c
6
h
4-p-si(nbu)
3
)
2
]
2
时的反应。
[0121]
在反应式1的该实例中,将[phn(h)me
2
]
+
[b(c
6
f
5
)
4
]-和crcl
3
(thf)
3
分别溶解在乙腈(ch
3
cn)中,并相互混合,然后将得到的混合物在室温下搅拌约12小时至30小时。然后,从所得混合物中蒸发溶剂并将所得混合物溶解于二氯甲烷(ch
2
cl
2
)后,将溶解于二氯甲烷(ch
2
cl
2
)的iprn[p(c
6
h
4-p-si(nbu)
3
)
2
]
2
添加到所得混合物中,接着在室温下使其反应约1小时至5小时,从而制备了由[(iprn[p(c
6
h
4-p-si(nbu)
3
)
2
]
2
)-crcl
2
]
+
[b(c
6
f
5
)
4
]-表示的铬化合物。
[0122]
在反应式1的该实例中,由[(iprn[p(c
6
h
4-p-si(nbu)
3
)
2
]
2
)-crcl
2
]
+
[b(c
6
f
5
)
4
]-表示的最终铬化合物可溶解于例如甲基环己烷之类的溶剂中,而作为副产物获得的[phn(h)me
2
]
+
[cl]-不溶于甲基环己烷,从而提供了分离和纯化的优点。
[0123]
在另一个实施方案中,制备由式1表示的铬化合物的方法包括:使由式i-cr表示的离子化合物与由式a表示的双膦配体化合物反应。
[0124]
[式i-cr]
[0125]
[crcl
2
(ncch
3
)
4
]
+
[ay]-[0126]
在式i-cr中,a为硼或铝;y为氟取代的c
6
至c
20
芳基、氟取代的c
6
至c
20
芳氧基或氟取代的c
1
至c
20
烷氧基。a和y的细节与上述相同。
[0127]
利用这种方法,本发明可以提供一种铬化合物,该化合物可以在乙烯低聚反应中实现对1-己烯和/或1-辛烯的显著良好的反应活性和选择性。
[0128]
使由式i-cr表示的离子化合物与由式a表示的双膦配体化合物反应可以包括,例如,将式i-cr的离子化合物和式a的双膦配体化合物中的每一种分散或溶解在溶剂中,然后将所得化合物混合以相互反应。在此,反应可以在室温(20℃)至50℃,具体地20℃至30℃,更具体地20℃的温度下进行10分钟至5小时,具体地30分钟至3小时,更具体地2小时至3小时,但不限于此。
[0129]
溶剂可以不受限制地选自任何溶剂,只要该溶剂在表现出良好的分散性或溶解性的同时不妨碍组分之间的反应即可。具体地,溶剂可以为二氯甲烷(ch
2
cl
2
)。
[0130]
在该实施方案中,用于制备式1的铬化合物的反应可以由反应式2表示。
[0131]
[反应式2]
[0132][0133]
反应式2示出了例如当式i-cr的化合物为[crcl
2
(ncch
3
)
4
]
+
[b(c
6
f
5
)
4
]-,并且式a的化合物为iprn[p(c
6
h
4-p-si(nbu)
3
)
2
]
2
时的反应。在反应式2的该实例中,[crcl
2
(ncch
3
)
4
]
+
[b(c
6
f
5
)
4
]-和iprn[p(c
6
h
4-p-si(nbu)
3
)
2
]
2
分别溶于二氯甲烷(ch
2
cl
2
)中,并相互混合,然后将所得混合物在室温下搅拌约2小时至3小时,从而制备了由[(iprn[p(c
6
h
4-p-si(nbu)
3
)
2
]
2
)-crcl
2
]
+
[b(c
6
f
5
)
4
]-表示的化合物。
[0134]
<乙烯低聚催化体系>
[0135]
本发明的另一个实施方案涉及一种乙烯低聚催化体系,该乙烯低聚催化体系包含:作为主催化剂的由式1表示的铬化合物;以及作为助催化剂的由式2表示的有机铝化合物。催化体系对于选择性转化为1-己烯和1-辛烯的反应非常有用。另外,这种催化体系适用于大规模生产,并且可以通过显著提高乙烯低聚反应的活性和选择性,以使得即使不使用甲基铝氧烷(mao)或改性甲基铝氧烷(mmao)也能够以高产率制备1-己烯和/或1-辛烯,从而确保高活性和优异的经济可行性之间的兼容性。。
[0136]
在根据本发明的乙烯低聚催化体系中,由式1表示的铬化合物与上述相同,因此在此省略其详细描述。
[0137]
[式2]
[0138]
(r
2
)
3
al
[0139]
在式2中,r
2
是c
1
至c
20
烷基。
[0140]
具体而言,在式2中,r
2
可以为甲基、乙基、正丙基、异丙基、正丁基、异丁基或戊基,更具体地说是乙基或异丁基。
[0141]
根据本发明的催化体系是非常有用的,因为当使用由式2表示的化合物时,该催化体系可以实现高活性,其中r
2
是乙基或异丁基。由式2表示的化合物(其中r
2
为乙基或异丁基)包括三乙基铝或三异丁基铝,它们在工业上以低成本生产且用于大规模生产。因此,根据本发明的催化体系可以使用式2表示的化合物实现对1-己烯和1-辛烯的高活性和选择性,即使不使用昂贵的改性甲基铝氧烷(mmao)也可以低成本地生产,并易于供应原料。
[0142]
具体而言,在催化体系中,由式1表示的铬化合物和由式2表示的有机铝化合物可以以1:50至1:500的摩尔比(cr:al)存在。在此范围内,催化体系可以进一步提高活性。
[0143]
具体而言,催化体系可以进一步包含卤素取代或未取代的烃溶剂。使用这种溶剂,催化体系可以以均相溶液的形式存在,其中反应产物均匀地溶解在溶剂中。
[0144]
更具体而言,卤素取代或未取代的烃溶剂可以包括(例如)甲苯、二甲苯、氯苯、二氯苯、二氯甲烷、甲基环己烯、环己烯、己烷和/或其他溶剂等。在示例性的溶剂中,根据本发明的催化体系可以容易地形成并且具有用于将溶剂与1-己烯和1-辛烯分离的更有利的性
质,所述1-己烯和1-辛烯是低聚反应后的反应产物。
[0145]
<乙烯低聚物的制备方法>
[0146]
本发明的又一个实施方案涉及一种乙烯低聚物的制备方法,该方法包括:通过使包括由式1表示的铬化合物和作为助催化剂的由式2表示的有机铝化合物的催化体系与乙烯单体接触,从而选择性地制备1-己烯和1-辛烯。
[0147]
由于根据本发明的乙烯低聚催化体系不仅可以以均相溶液的形式存在,而且可以以负载在载体上的形式、以载体的不溶性颗粒的形式和/或其他形式存在,因此乙烯低聚物制备方法(乙烯低聚反应)可以为液相或淤浆相反应。
[0148]
在乙烯低聚物制备方法中,反应条件可以根据催化剂组合物的相(均相或非均相(载体类型))和聚合方法(溶液聚合、淤浆聚合)以各种方式改变。本领域技术人员可以容易地进行反应条件的改变。
[0149]
具体而言,当在液相或淤浆相中进行乙烯低聚反应(聚合)时,可以使用卤素取代或未取代的烃溶剂作为介质。
[0150]
更具体而言,所述烃溶剂可包括c
4
至c
20
脂族烃溶剂、c
6
至c
20
芳族烃溶剂以及它们的混合物。例如,卤素取代或未取代的烃溶剂可包括甲苯、二甲苯、氯苯、二氯苯、二氯甲烷、甲基环己烯、环己烯、己烷和/或其他溶剂等。在示例性的溶剂中,催化体系可以确保高聚合活性,并且可以容易地将溶剂与低聚反应后的反应产物1-己烯和1-辛烯分离。
[0151]
在乙烯低聚物的制备方法中,尽管对催化体系的量没有特别限制,但是根据本发明的催化体系可以实现高活性,从而即使在少量催化体系的条件下进行反应也可以实现良好的产率。
[0152]
在一个实施方案中,当通过溶液聚合方法进行乙烯低聚反应时,可以以使摩尔密度(以铬计)为0.001mmol/l至0.02mmol/l,例如0.05mmol/l至0.015mmol/l来添加催化体系,随后向催化体系中连续添加乙烯单体以进行反应10分钟至1小时,从而制备了1-己烯和1-辛烯。可以在15巴至80巴,特别是40巴至60巴,例如45巴的压力下连续添加乙烯单体。
[0153]
另外,乙烯低聚反应可以在室温(20℃)至110℃,例如60℃至90℃的温度下进行。
[0154]
此外,在乙烯低聚反应中,最佳活性温度可以为60℃或更高,特别是70℃至100℃,例如80℃至90℃。在这种条件下,该乙烯低聚物制备方法可以进一步提高通过空冷或水冷进行反应热控制的效率,从而确保在大规模生产过程中的优异适用性,同时进一步提高了商业优势。
[0155]
此外,乙烯低聚反应可以以间歇型、半连续型或连续型进行。
[0156]
例子
[0157]
接下来,将参照一些实例更详细地描述本发明。应当理解,提供这些实例仅用于说明,而不是以任何方式解释为限制本发明。
[0158]
实施例和比较例中使用的组分的细节如(1)至(4)所示。
[0159]
(1)由tci制备由[phn(h)me
2
]
+
[b(c
6
f
5
)
4
]-表示的离子化合物。
[0160]
(2)基于文献(非专利文献6:acs omega 2017,2,765-773)中公开的方法制备了由[crcl
2
(ncch
3
)
4
]
+
[b(c
6
f
5
)
4
]-表示的化合物。
[0161]
(3)基于文献(非专利文献7:angewandte chemie international edition 2016,55,12351)中公开的方法制备了由clp[c
6
h
4-p-si(r
1
)
3-n
(r
2
)
n
]
2
表示的化合物。
[0162]
[反应式a]
[0163][0164]
(4)基于文献(非专利文献6:acs omega 2017,2,765-773)中公开的方法制备了由[(ch
3
)(ch
2
)
16
]
2
c(h)n(pph
2
)
2
表示的化合物。
[0165]
制备例1:
[0166]
将通过使iprnh
2
(0.174g,2.94mmol)溶解在ch
2
cl
2
(10ml)中而获得的溶液滴加到包含clp[c
6
h
4-p-si(nbu)
3
]
2
(3.64g,5.89mmol)和et
3
n(2.98g,29.4mmol)的ch
2
cl
2
(30ml)溶液中。将所得溶液在室温下放置一天(过夜),同时搅拌所得溶液,然后通过真空管线从所得化合物中除去挥发性组分。用己烷(40ml)处理剩余的物质后,通过硅藻土辅助过滤从其中除去不溶性副产物((et
3
nh)
+
cl-)。使过滤后的溶液通过用己烷/et
3
n(v/v,50:1)预处理的硅胶短垫。
[0167]
通过以上方法,制备了不含溶剂的无色油状化合物(2.72g,70%)。nmr谱分析表明所制备的化合物具有不需要进一步纯化的纯度水平。确认了所制备的化合物具有由式c1表示的结构。
[0168]
[式c1]
[0169]
iprn[p(c
6
h
4-p-si(nbu)
3
)
2
]
2
[0170]
1
h nmr(600mhz,c
6
d
6
):δ8.10-7.27(br,8h),7.50(d,j=7.2hz,8h),3.86(m,nch,1h),1.42-1.33(br,48h),1.24(d,j=7.2hz,nchch
3
,6h),0.92(t,j=6.6hz,ch
3
,36h),0.87-0.82(br,sich
2
,24h)ppm.
13
c{
1
h}nmr(150mhz,c
6
d
6
):δ12.58(nbu),14.05(nbu),14.37,23.07,24.51(t,j
p-c
=7.2hz),26.54(nbu),27.22(nbu),31.99,132.4-133.0(br),134.2(d,j
p-c
=5.7hz),138.83ppm.
31
p(243mhz,c
6
d
6
):δ42.17,54.96ppm.hrms(fab):m/z计算值:(m
+
c
75
h
131
np
2
si
4
)1219.8834,实测值:1219.8829。
[0171]
制备例2:
[0172]
按照与制备例1相同的方式制备化合物,不同之处在于,使用clp[c
6
h
4-p-si(ipr)
3
]
2
(1.00g,1.88mmol)代替clp[c
6
h
4-p-si(nbu)
3
]
2
。
[0173]
通过上述方法进行制备,在-30℃的甲苯中重结晶,获得了具有可分析的纯度水平的化合物(0.160g,19%)。确认了所制备的化合物具有由式c2表示的结构。
[0174]
[式c2]
[0175]
iprn[p(c
6
h
4-p-si(ipr)
3
)
2
]
2
[0176]
1
h nmr(600mhz,c
6
d
6
):δ8.12-7.26(br,8h),7.45(d,j=6.6hz,8h),3.83(m,nch,1h),1.32(m,sich,12h),1.23(d,j=6.6hz,nchch
3
,6h),1.10(t,j=7.8hz,ch
3
,72h)ppm.
13
c{
1
h}nmr(150mhz,c
6
d
6
):δ11.10,18.83,21.44,24.41(t,j
p-c
=5.7hz),132.1-132.9(br),135.33(d,j
p-c
=5.7hz),135.49-135.65(br)ppm.
31
p(243mhz,c
6
d
6
):δ43.63,54.34ppm。
[0177]
制备例3:
[0178]
按照与制备例1相同的方式制备化合物,不同之处在于,使用clp[c
6
h
4-p-siet
3
]
2
(1.00g,2.23mmol)代替clp[c
6
h
4-p-si(nbu)
3
]
2
。
[0179]
通过上述方法制得无色粘稠油状化合物(0.428g,50%)。确认了所制备的化合物具有由式c3表示的结构。
[0180]
[式c3]
[0181]
iprn[p(c
6
h
4-p-siet
3
)
2
]
2
[0182]
1
h nmr(600mhz,c
6
d
6
):8.16-7.20(br,8h),7.44(d,j=6.6hz,8h),3.87(m,nch,1h),1.32(m,sich,12h),1.27(d,j=6.0hz,nchch
3
,6h),0.98(t,j=7.8hz,ch
3
,36h),0.74(q,j=7.2hz,sich
2
,24h)ppm.
13
c{
1
h}nmr(150mhz,c
6
d
6
):δ3.70,7.72,24.58(t,j
p-c
=5.7hz),133.1-132.5(br),134.32,137.97,141.02-141.58(br)ppm.
31
p(243mhz,c
6
d
6
):δ43.01,54.90ppm。
[0183]
制备例4:
[0184]
按照与制备例1相同的方式制备化合物,不同之处在于,使用clp[c
6
h
4-p-si(ipr)et
2
](1.58g,3.30mmol)代替clp[c
6
h
4-p-si(nbu)
3
]
2
。
[0185]
通过上述方法制得白色玻璃状固体化合物(1.02g,68%)。确认了所制备的化合物具有由式c4表示的结构。
[0186]
[式c4]
[0187]
iprn[p(c
6
h
4-p-si(ipr)et
2
]
2
[0188]
1
h nmr(600mhz,c
6
d
6
):8.05-7.24(br,8h),7.44(d,j=7.2hz,8h),3.85(m,nch,1h),1.25(d,j=6.6hz,nchch
3
,6h),1.06-0.95(br,52h),0.80(q,j=7.2hz,sich
2
,24h)ppm.
13
c{
1
h}nmr(150mhz,c
6
d
6
):δ2.28,7.89,12.12,18.19,24.53(t,j
p-c
=5.7hz),52.70(t,j
p-c
=10.1hz),132.22-133.09(br),134.70(d,j
p-c
=5.7hz),137.07ppm.
31
p(243mhz,c
6
d
6
):δ43.18,54.62ppm。
[0189]
制备例5:
[0190]
按照与制备例1相同的方式制备化合物,不同之处在于,使用clp[c
6
h
4-p-si(ipr)me
2
]
2
(0.56g,1.3mmol)代替clp[c
6
h
4-p-si(nbu)
3
]
2
。
[0191]
通过上述方法制得白色玻璃状固体化合物(0.25g,45%)。确认了所制备的化合物具有由式c5表示的结构。
[0192]
[式c5]
[0193]
iprn[p(c
6
h
4-p-si(ipr)me
2
]
2
[0194]
1
h nmr(600mhz,c
6
d
6
):8.09-7.20(br,8h),7.44(d,j=6.0hz,8h),3.90(m,nch,1h),1.29(d,j=6.hz,nchch
3
,6h),0.97(d,j=6.0hz,24h),0.89(m,sich,4h),0.19(d,j=4.8hz,sich
3
,24h)ppm.
13
c{
1
h}nmr(150mhz,c
6
d
6
):δ-5.2,14.09,17.84,24.64(t,j
p-c
=5.7hz),132.41-132.89(br),134.07(d,j
p-c
=5.9hz),139.17ppm.
31
p(243mhz,c
6
d
6
):δ43.43,54.23ppm。
[0195]
制备例6:
[0196]
按照与制备例1相同的方式制备化合物,不同之处在于,使用clp[c
6
h
4-p-si(1-辛基)me
2
]
2
(1.82g,3.24mmol)代替clp[c
6
h
4-p-si(nbu)
3
]
2
。
[0197]
通过上述方法制得无色粘稠油状化合物(1.22g,68%)。确认了所制备的化合物具有由式c6表示的结构。
[0198]
[式c6]
[0199]
iprn[p(c
6
h
4-p-si(1-辛基)me
2
]
2
[0200]
1
h nmr(600mhz,c
6
d
6
):8.14-7.22(br,8h),7.48(d,j=6.6hz,8h),3.92(m,nch,1h),1.41-1.19(br,48h),1.31(d,j=6.6hz,nchch
3
,6h),0.92(t,j=7.2hz,ch
3
,12h),0.78-0.72(br,sich
2
,8h),0.25(d,j=1.8hz,sich
3
,24h)ppm.
13
c{
1
h}nmr(150mhz,c
6
d
6
):δ-2.82,14.41,16.07,23.14,24.38,24.69,29.8(d,j
p-c
=5.7hz),32.39,34.10,132.8(d,j
p-c
=21.45hz),133.73(d,j
p-c
=5.7hz),140.32ppm.
31
p(243mhz,c
6
d
6
):δ42.90,54.96ppm。
[0201]
制备例7:
[0202]
按照与制备例1相同的方式制备化合物,不同之处在于,使用clp[c
6
h
4-p-sime
3
]
2
(1.54g,4.23mmol)代替clp[c
6
h
4-p-si(nbu)
3
]
2
。
[0203]
通过上述方法制得无色粘稠油状化合物(0.564g,37%)。确认了所制备的化合物具有由式c7表示的结构。
[0204]
[式c7]
[0205]
iprn[p(c
6
h
4-p-sime
3
)
2
]
2
[0206]
1
h nmr(600mhz,c
6
d
6
):7.93-7.32(br,8h),7.43(d,j=7.2hz,8h),3.94(m,nch,1h),1.33(d,j=6.6hz,nchch
3
,6h),0.20(s,j=7.2hz,sich
3
,36h)ppm.
13
c{
1
h}nmr(150mhz,c
6
d
6
):δ-1.10,23.15,24.76(t,j
p-c
=5.7hz),26.66,26.82,33.02,35.71,52.52(t,j
p-c
=10.1hz),132.80(d,j
p-c
=20.1hz),133.50(d,j
p-c
=4.2hz),140.98ppm.
31
p(243mhz,c
6
d
6
):δ43.40,54.62ppm。
[0207]
实施例1
[0208]
通过以下方法制备具有由式1-1表示的结构的铬化合物。
[0209]
[式1-1]
[0210]
[(iprn[p(c
6
h
4-p-si(nbu)
3
)
2
]
2
)-crcl
2
]
+
[b(c
6
f
5
)
4
]-[0211]
将通过使[phn(h)me
2
]
+
[b(c
6
f
5
)
4
]-(0.15g,0.23mmol)溶解在乙腈(2.9ml)中获得的溶液添加到通过在乙腈(2.9ml)中溶解crcl
3
(thf)
3
(0.085g,0.23mmol)而获得的溶液中。将所得溶液在25℃下放置一天(过夜),同时搅拌所得溶液,然后通过真空管线从所得溶液中除去挥发性组分。通过使获得的绿色剩余化合物溶解在ch
2
cl
2
(2.0ml)中而获得溶液,并且将制备例1中制备的iprn[p(c
6
h
4-p-si(nbu)
3
)
2
]
2
(0.28g,0.23mmol)溶解在ch
2
cl
2
(4.6ml)中而获得的溶液逐滴加入所得溶液中。作为结果,所获得的溶液立即从绿色变为蓝绿色。然后,在25℃搅拌溶液2小时后,通过真空管线从溶液中除去溶剂。用甲基环己烷处理剩余物质后,通过硅藻土辅助过滤从其中除去不溶物质。作为结果,制备了不含溶剂的蓝绿色粘稠油状化合物(0.46g,基于式[(iprn[p(c
6
h
4-p-si(nbu)
3
)
2
]
2
)-crcl
2
]
+
[b(c
6
f
5
)
4
]-为99%)。
[0212]
使用ch
2
cl
2
从硅藻土过滤器的顶部获得不溶性物质(白色固体与少量绿色固体混合,分离出的固体)。
[0213]
从剩余产物中除去溶剂后,通过
1
h nmr谱分析确认了对应于n,n-二甲基苯胺单元的信号。分离出的固体的重量(41mg)与副产物([phn(h)me
2
]
+
cl-)的理论预期重量(36mg)大致相符。将分离出的固体溶解在ch
3
cn(1.0ml)中,并用通过将agno
3
(78mg,0.46mmol)溶解在ch
3
cn(1.0ml)中获得的溶液进行处理。产生白色固体沉淀物(38mg),其量大致相当于agcl
的理论预期重量(33mg)。
[0214]
图2示出了实施例1中制备的铬化合物的
31
p nmr谱、
1
h nmr谱、
19
f nmr谱和epr谱的分析结果。
[0215]
实施例2
[0216]
通过以下方法制备具有由式1-1表示的结构的铬化合物。
[0217]
[式1-1]
[0218]
[(iprn[p(c
6
h
4-p-si(nbu)
3
)
2
]
2
)-crcl
2
]
+
[b(c
6
f
5
)
4
]-[0219]
将通过使制备例1中制备的iprn[p(c
6
h
4-p-si(nbu)
3
)
2
]
2
(0.10g,0.082mmol)溶解在ch
2
cl
2
(1.8ml)中而获得的溶液滴加到通过将[crcl
2
(ncch
3
)
4
]
+
[b(c
6
f
5
)
4
]-(0.079g,0.082mmol)溶解在ch
2
cl
2
(0.5ml)中而得到的溶液中。
[0220]
将所得溶液在室温下搅拌2.5小时,然后通过真空管线从所得溶液中除去溶剂,从而制备亮绿色的粘稠油状化合物(0.16mg,基于式:[(iprn[p(c
6
h
4-p-si(nbu)
3
)
2
]
2
)-crcl
2
]
+
[b(c
6
f
5
)
4
]-为99%)。
[0221]
确认了实施例2中制备的铬化合物的
31
p nmr谱、
1
h nmr谱、
19
f nmr谱和epr谱的分析结果与在实施例1中制备的铬化合物的波谱分析结果(图2)基本上相同。
[0222]
实施例3
[0223]
按照与实施例2相同的方式制备具有由式1-2表示的结构的铬化合物,不同之处在于,使用制备例2中制备的双膦配体代替制备例1中制备的双膦配体。制得暗绿色固体化合物(0.086g,98%)。
[0224]
[式1-2]
[0225]
[(iprn[p(c
6
h
4-p-si(ipr)
3
)
2
]
2
)-crcl
2
]
+
[b(c
6
f
5
)
4
]-[0226]
实施例4
[0227]
按照与实施例2相同的方式制备具有由式1-3表示的结构的铬化合物,不同之处在于,使用制备例3中制备的双膦配体代替制备例1中制备的双膦配体。制得暗绿色固体化合物(0.052g,98%)。
[0228]
[式1-3]
[0229]
[(iprn[p(c
6
h
4-p-siet
3
)
2
]
2
)-crcl
2
]
+
[b(c
6
f
5
)
4
]-[0230]
实施例5
[0231]
按照与实施例2相同的方式制备具有由式1-4表示的结构的铬化合物,不同之处在于,使用制备例4中制备的双膦配体代替制备例1中制备的双膦配体。制得暗绿色固体化合物(0.092g,99%)。
[0232]
[式1-4]
[0233]
[(iprn[p(c
6
h
4-p-si(ipr)et
2
]
2
)-crcl
2
]
+
[b(c
6
f
5
)
4
]-[0234]
图1示出了通过x射线晶体学分析的实施例5中制备的铬化合物的结构。
[0235]
实施例6
[0236]
按照与实施例2相同的方式制备具有由式1-5表示的结构的铬化合物,不同之处在于,使用制备例5中制备的双膦配体代替制备例1中制备的双膦配体。制得暗绿色固体化合物(0.096g,98%)。
[0237]
[式1-5]
[0238]
[(iprn[p(c
6
h
4-p-si(ipr)me
2
]
2
)-crcl
2
]
+
[b(c
6
f
5
)
4
]-[0239]
实施例7
[0240]
按照与实施例2相同的方式制备具有由式1-6表示的结构的铬化合物,不同之处在于,使用制备例6中制备的双膦配体代替制备例1中制备的双膦配体。制得绿色粘稠油状化合物(0.084g,98%)。
[0241]
[式1-6]
[0242]
[(iprn[p(c
6
h
4-p-si(1-辛基)me
2
]
2
)-crcl
2
]
+
[b(c
6
f
5
)
4
]-[0243]
比较例1
[0244]
按照与实施例2相同的方式制备具有由式1-7表示的结构的铬化合物,不同之处在于,使用制备例7中制备的且具有显示出不明显空间位阻的-sime
3
取代基的双膦配体代替制备例1中制备的双膦配体。制得暗绿色固体化合物(0.103g,97%)。
[0245]
[式1-7]
[0246]
[(iprn[p(c
6
h
4-p-sime
3
)
2
]
2
)-crcl
2
]
+
[b(c
6
f
5
)
4
]-[0247]
比较例2
[0248]
通过文献(非专利文献6:acs omega,2017,2,765-773)中公开的方法,使用iprn[p(c
6
h
5
)
2
]
2
和[crcl
2
(ncch
3
)
4
]
+
[b(c
6
f
5
)
4
]-来制备具有由式1-8表示的结构的铬化合物。
[0249]
[式1-8]
[0250]
[(iprn[p(c
6
h
5
)
2
]
2
)-crcl
2
]
+
[b(c
6
f
5
)
4
]-[0251]
比较例3
[0252]
通过文献(非专利文献6:acs omega,2017,2,765-773)中公开的方法,使用[ch
3
(ch
2
)
16
]
2
chn[p(c
6
h
5
)
2
]
2
和[crcl
2
(ncch
3
)
4
]
+
[b(c
6
f
5
)
4
]-来制备具有由式1-9表示的结构的铬化合物。
[0253]
[式1-9]
[0254]
{[ch
3
(ch
2
)
16
]
2
chn[p(c
6
h
5
)
2
]
2
)-crcl
2
}
+
[b(c
6
f
5
)
4
]-[0255]
实施例8:乙烯低聚反应
[0256]
在手套箱内的干燥反应器(75ml弹式反应器)中,放入甲基环己烷(19ml)和实施例1中制备的式1-1的铬化合物(0.41mg,0.20μmol)。组装反应器后,将反应器从手套箱中取出。将ibu
3
al(15.9mg,0.080mmol)溶解于甲基环己烷(1ml)中,并在室温下通过注射器注入反应器中,随后在45巴的压力下立即将乙烯气体注入反应器中。通过放热反应,使反应器的温度经过3.5分钟从20℃自然升高至90℃。当反应器的温度达到90℃时,运行风扇以从中除去热量。将反应器的温度经过5分钟而另外升高至96℃,并且经过25分钟而缓慢降低至88℃。乙烯低聚反应进行25分钟后,将反应器浸入装有冰的水箱中冷却,并将乙烯气体从反应器中排出以完成反应。
[0257]
为了对产生的物质进行气相色谱分析(gc分析),根据内标将壬烷(0.700g)添加到最终反应产物中。通过气相色谱分析(gc分析)测定生成的各低聚物(1-辛烯(1-c8)、1-己烯(1-c6)、甲基环戊烷+亚甲基环戊烷(cy-c6)以及高于c10(>c10)的更高的低聚物)的含量后,将生成的各低聚物的含量换算成基于其重量的百分比。在80℃通过过滤分离出所生成的具有固相的聚乙烯(pe),以测定分离出的pe副产物的重量,然后基于下式计算pe的重量%:[生成的pe的重量(g)/反应中使用的乙烯的重量(g)]。
[0258]
实施例9:乙烯低聚反应
[0259]
按照与实施例8相同的方法进行乙烯低聚反应,不同之处在于,使用实施例2中制备的式1-1的铬化合物代替实施例1中制备的式1-1的铬化合物,将反应温度调整至24℃至98℃的温度,并将反应时间调整至30分钟。
[0260]
实施例10:乙烯低聚反应
[0261]
按照与实施例9相同的方法进行乙烯低聚反应,不同之处在于,将反应温度调整至28℃至75℃的温度,并将反应时间调整至30分钟。
[0262]
实施例11:乙烯低聚反应
[0263]
按照与实施例9相同的方法进行乙烯低聚反应,不同之处在于,将反应温度调整至26℃至60℃的温度,并将反应时间调整至30分钟。
[0264]
实施例12:乙烯低聚反应
[0265]
按照与实施例8相同的方法进行乙烯低聚反应,不同之处在于,使用式1-2的铬化合物代替式1-1的铬化合物,将反应温度调整至25℃至84℃的温度,并将反应时间调整至30分钟。
[0266]
实施例13:乙烯低聚反应
[0267]
按照与实施例8相同的方法进行乙烯低聚反应,不同之处在于,使用式1-3的铬化合物代替式1-1的铬化合物,将反应温度调整至25℃至85℃的温度,并将反应时间调整至30分钟。
[0268]
实施例14:乙烯低聚反应
[0269]
按照与实施例8相同的方法进行乙烯低聚反应,不同之处在于,使用式1-4的铬化合物代替式1-1的铬化合物,将反应温度调整至22℃至89℃的温度,并将反应时间调整至30分钟。
[0270]
实施例15:乙烯低聚反应
[0271]
按照与实施例8相同的方法进行乙烯低聚反应,不同之处在于,使用式1-5的铬化合物代替式1-1的铬化合物,将反应温度调整至25℃至79℃的温度,并将反应时间调整至30分钟。
[0272]
实施例16:乙烯低聚反应
[0273]
按照与实施例8相同的方法进行乙烯低聚反应,不同之处在于,使用式1-6的铬化合物代替式1-1的铬化合物,将反应温度调整至24℃至82℃的温度,并将反应时间调整至30分钟。
[0274]
比较例4:乙烯低聚反应
[0275]
按照与实施例8相同的方法进行乙烯低聚反应,不同之处在于,使用式1-7的铬化合物代替式1-1的铬化合物,将反应温度调整至25℃至35℃的温度,并将反应时间调整至35分钟。
[0276]
比较例5:乙烯低聚反应
[0277]
按照与实施例8相同的方法进行乙烯低聚反应,不同之处在于,使用式1-8的铬化合物代替式1-1的铬化合物,将反应温度调整至45℃,并将反应时间调整至30分钟。
[0278]
比较例6:乙烯低聚反应
[0279]
按照与实施例8相同的方法进行乙烯低聚反应,不同之处在于,使用式1-9的铬化
合物代替式1-1的铬化合物,将反应温度调整至45℃,并将反应时间调整至30分钟。
[0280]
表1中示出了实施例8至16和比较例4至6的烯烃聚合反应的活性以及制得的烯烃的组成。
[0281]
表1
[0282][0283]
从表1所示的实验结果可以看出,根据本发明的式1-1至1-6的铬化合物具有c
4
至c
50
甲硅烷基(*-si(r
1
)
3
)取代基,该取代基使其对位上显示出明显的空间位阻,当将根据本发明的式1-1至1-6的铬化合物应用于乙烯低聚反应的催化体系时,该催化体系表现出在2400kg/g-cr/h至6300kg/g-cr/h的范围内的优异的活性。相反,可以看出,在使用具有显示出不明显的空间位阻的c
3
有机甲硅烷基(*-sime
3
)的式1-7的铬化合物以及不含*-si(r
1
)
3
取代基的式1-8和1-9的铬化合物的比较例4至6的乙烯低聚反应中,催化体系的反应活性(1/30至1/250)比实施例8至16的催化体系低得多。
[0284]
特别地,可以看出,由于根据本发明的式1-1的铬化合物具有显示出明显位阻的*-si(nbu)
3
取代基,进而包括根据本发明的式1-1的铬化合物的用于乙烯低聚反应的催化体系具有非常高的最大活性(6300kg/g-cr/h),产生极少量的聚乙烯(pe)副产物(0.01重量%),并且可以在大约90℃的高温下毫无问题地用作催化剂,因此式1-1的铬化合物适用于商业化生产过程。
[0285]
应当理解,本领域技术人员在不脱离本发明的精神和范围的情况下,可以作出各种修改、改变,变更和等同的实施方案。
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
相关标签: 乙烯
 热门咨询
热门咨询

tips


 商标分类
商标分类  商标转让
商标转让 


