细胞培养系统及细胞培养方法与流程
 2021-02-02 11:02:18|
2021-02-02 11:02:18| 293|
293| 起点商标网
起点商标网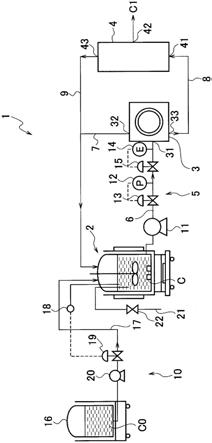
[0001]
本发明涉及用于通过细胞培养而有效获取有用的物质的细胞培养系统及细胞培养方法。
背景技术:
[0002]
近年来,在以医药品行业为首的广泛的领域中,关注利用动物细胞所产生的抗体物质、功能性物质等有用的物质。为了实现有用物质的市场供给,在细胞培养中的条件的合理化及效率化、所产生的有用物质的离析精制方法等中进行了各种各样的努力、改良。
[0003]
细胞的培养方法通常分为批量式和连续式两种。批量式培养方法中,将预定量的液体培养基和细胞投入于培养槽,当细胞增殖至某一程度的密度时,因营养素的不足或代谢物导致的中毒而停止增殖,因此会在该时间点结束培养。连续式培养方法中,将预定量的液体培养基和细胞投入于培养槽而使细胞增殖,并且提取液体培养基中的一部分而更换投入新的液体培养基,利用补充的营养素继续细胞培养。由于提取的液体培养基中含有细胞所产生的有用物质,因此在从液体培养基将细胞去除后会通过适宜实施精制处理来回收有用物质。
[0004]
作为从液体培养基将细胞去除的固液分离方法,可以利用利用分离膜的过滤分离、离心分离。离心分离在分离时需要时间,即便实验水平的少量分离是良好的,但对于实际使用的适用性并不太高。为此,一般利用过滤分离来从液体培养基将培养细胞去除。
[0005]
日本特表2017-502666号公报(专利文献1)涉及一种用于细胞培养的装置,记载了在生物反应器的出口流通的声驻波细胞分离器。在借助声驻波的分离中,如果通过作用来自不同方向的高频的波动而产生驻波,则粒子会集中于驻波的节点。利用该现象,从而使细胞集中于驻波的节点,将细胞从液体培养基分离。
[0006]
另一方面,作为涉及流体所含的粒子的分离的文献,有日本特表2016-526479号公报(专利文献2),其记载了具有弯曲通道的流体力学的分离设备。该设备中,将含有粒子的流体供给于弯曲通道,利用作用于在弯曲通道中流动的流体的力而能够将粒子分离。
[0007]
现有技术文献
[0008]
专利文献
[0009]
专利文献1:日本特表2017-502666号公报
[0010]
专利文献2:日本特表2016-526479号公报
技术实现要素:
[0011]
发明所要解决的课题
[0012]
根据从提取的液体培养基将细胞分离时的作业效率,细胞培养的经济合理性发生变化,左右实用化的可否。但是,细胞的过滤分离容易发生分离膜的堵塞,且易于损伤细胞。对于分离膜的堵塞,只要液体培养基所含的培养细胞的密度低就可以避免,因此会采用将培养槽中的液体培养基的细胞密度维持在能够避免分离膜的堵塞的密度的这样一种方法。
但是,就该方法而言,难以实现以作为连续培养的优点的高密度进行细胞培养所带来的生产率的提高。因此,为了确保盈利性,需要极其高精度地控制液体培养基的培养细胞密度,严格管理培养槽中的培养条件。
[0013]
此外,在连续进行培养期间,不仅活细胞因增殖而增加,死细胞也增加。一般而言,如果培养槽中的培养细胞的密度超过适宜范围,则将培养槽内的液体培养基的一部分直接排出,通过投入新的液体培养基来调节细胞的密度。该所排出的液体培养基被称为“排放液(bleed)”,排放液所含的有用物质只要将细胞去除,就能够进行回收以及精制。对于试验规模而言,可以通过深层过滤器从排放液将细胞去除,但是在实用化时,能够应对细胞密度高的排放液的分离膜的规模以及费用会成为问题,实际情况是会废弃排放液。
[0014]
关于上述问题,在上述专利文献1所记载的装置中,因高频的波动的作用而导致对于细胞的物理影响大。如果因细胞的破损而产生细小的细胞片,则分离更加困难,会对从所回收的液体培养基精制有用物质的作业造成影响,或者可能使精制效率下降。
[0015]
专利文献2所记载的分离技术涉及固体粒子的分离,因此在应用于细胞培养的情况下,有必要研究对于细胞的影响。
[0016]
如此,从液体培养基将培养细胞分离去除的技术在将细胞培养带来的有用物质的生产实用化方面是重要的。只要可以从含有细胞的液体培养基将细胞有效地分离去除,就能够提高连续培养时的生产率以及作业性,扩大细胞所产生的物质的供给及利用。
[0017]
本公开的课题在于,提供一种通过将细胞与液体培养基的分离技术而有助于细胞的连续培养的实用化,能够有效获得细胞所产生的有用物质的细胞培养系统及细胞培养方法。
[0018]
解决课题的方法
[0019]
为了解决上述课题,对于能够消除分离膜的堵塞所导致的作业性的问题的方法进行了研究,发现利用流体力分离技术能够改善连续培养中的效率以及作业性。
[0020]
根据本公开的一方式,细胞培养系统的要点在于,具有:培养槽,其收容含有所培养的细胞的液体培养基;流体力分离装置,其具备具有矩形截面的弯曲流路,利用在前述弯曲流路中流动而产生的涡流,将从前述培养槽供给的液体培养基分离为细胞密度相对高的富细胞级分(fraction)以及细胞密度相对低的贫细胞级分;以及过滤分离装置,其具有从由前述流体力分离装置分离的贫细胞级分将细胞去除而回收液体培养基的过滤器。
[0021]
细胞培养系统应当进一步构成为:具有将前述流体力分离装置与前述培养槽连接且将前述富细胞级分向前述培养槽供给的第一回送路、以及将前述过滤分离装置与前述培养槽连接且将从前述贫细胞级分去除的细胞向前述培养槽供给的第二回送路。进一步可以构成为:具有将含有细胞的液体培养基的一部分作为排放液向外部排出的排出路,且前述排出路从前述第一回送路分支而设,将前述富细胞级分的一部分或全部废弃。
[0022]
此外,细胞培养系统的过滤分离装置的过滤器可以为深层过滤器,进一步可以构成为具有将前述富细胞级分作为排放液向外部废弃的排出路。而且,进一步可以构成为:具有将新的液体培养基供给于前述培养槽的培养基补给路;以及具有从前述培养槽所供给的液体培养基将细胞去除而回收液体培养基的过滤器的追加的过滤分离装置。
[0023]
此外,根据本公开的另一方式,细胞培养系统的要点在于,具有:培养槽,其收容含有所培养的细胞的液体培养基;流体力分离装置,其具备具有矩形截面的弯曲流路,利用在
前述弯曲流路中流动而产生的涡流,将从前述培养槽供给的液体培养基分离为细胞密度相对高的富细胞级分以及细胞密度相对低的贫细胞级分;培养基回送路,其将前述流体力分离装置与前述培养槽连接,通过将前述贫细胞级分向前述培养槽供给,从而使前述培养槽的液体培养基的细胞密度下降;以及过滤分离装置,其具有从前述培养槽所供给的液体培养基将细胞去除而回收液体培养基的过滤器。
[0024]
上述细胞培养系统进一步可以具有将前述过滤分离装置与前述培养槽连接,且将含有被前述过滤分离装置去除的细胞的剩余部分的液体培养基向前述培养槽供给的回送路。前述流体力分离装置具有导入前述液体培养基的单一的导入口以及将分离的液体培养基排出的至少两个导出口,且从前述导出口中的一个排出前述富细胞级分,从另一个导出口排出前述贫细胞级分。细胞培养系统进一步可以构成为:具有将用于向前述流体力分离装置供给液体培养基的流动压施加于液体培养基的施力装置、以及以向前述流体力分离装置导入的液体培养基与从前述流体力分离装置导出的液体培养基的压力差成为预定值以下的方式控制压力环境的压力控制机构。
[0025]
此外,根据本公开的一方式,细胞培养方法的要点在于,包括:细胞培养,其利用液体培养基培养细胞;流体力分离,其利用在具有矩形截面的弯曲流路中流动而产生的涡流,将从前述细胞培养供给的液体培养基分离为细胞密度相对高的富细胞级分以及细胞密度相对低的贫细胞级分;以及过滤分离,其从由前述流体力分离分离的贫细胞级分使用过滤器将细胞去除而回收液体培养基。
[0026]
此外,根据本公开的另一方式,细胞培养方法的要点在于,包括:细胞培养,其利用液体培养基培养细胞;流体力分离,其利用在具有矩形截面的弯曲流路中流动而产生的涡流,将从前述细胞培养供给的液体培养基分离为细胞密度相对高的富细胞级分以及细胞密度相对低的贫细胞级分;培养基回送,其通过将前述贫细胞级分向前述细胞培养供给,从而使前述细胞培养的液体培养基的细胞密度下降;以及过滤分离装置,其从前述细胞培养所供给的液体培养基使用过滤器将细胞去除而回收液体培养基。
[0027]
发明效果
[0028]
根据本公开,提供能够从含有培养细胞的液体培养基有效地将细胞分离去除而回收液体培养基,利用连续培养的优点而能够有效实施细胞培养的细胞培养系统及细胞培养方法,从而能够高效地获得细胞所产生的有用物质。
附图说明
[0029]
图1为示出细胞培养系统的第一实施方式的概略构成图。
[0030]
图2为示出细胞培养系统的第二实施方式的概略构成图。
[0031]
图3为示出细胞培养系统的第三实施方式的概略构成图。
[0032]
图4为示出细胞培养系统的第四实施方式的概略构成图。
[0033]
图5为示出利用流体力分离装置的细胞分离时的de数与分离效率的关系的图表。
[0034]
图6为示出细胞分离中所使用的泵与细胞的存活率的关系的图表。
具体实施方式
[0035]
对于本公开的实施方式,以下,参照附图来详细说明。予以说明的是,实施方式中
所示的尺寸、材料、其具体的数值等为了便于理解内容的记载,除非特别提及的情况,则不会限定本公开。此外,本说明书以及附图中,对于具有实质相同的功能和构成的要素,通过赋予相同的符号而省略重复说明,与本公开没有直接关系的要素省略附图。
[0036]
作为将液体中所含的粒子分离的分离技术之一,有利用流体所产生的迪恩(dean)涡的作用的技术(参照前述专利文献2。以下,将该技术称为流体力分离)。这是利用在与流动方向垂直的截面为矩形且一侧弯曲的弯曲流路中流动的液体中产生迪恩涡来使液体中的粒子的分布发生偏移的分离技术。在弯曲流路中流动的粒子在流路中的分布会根据其大小而发生不同的变化(参照前述专利文献2)。具体而言,在弯曲流路的截面中会形成画圆圈一样的粒子分布,从而粒子以螺旋状在流路中流动,此时,相对大的粒子位于圆圈的外侧,相对小的粒子位于内侧。进一步,通过设定预定的分离条件,从而粒子的分布形态进一步变化,超过一定大小的粒子向流路的外周侧收敛。因此,如果将流体分割为外周侧的级分和内周侧的级分,则两个级分中,所含的粒子的大小、密度出现差异。即,外周侧的级分包含相对大的粒子,而且粒子的密度相对变高。内周侧的级分包含相对小的粒子,而且粒子的密度相对变低。
[0037]
在弯曲流路的外周侧收敛的固体粒子的大小可以通过设定流体的供给流速(流量)以及弯曲流路的尺寸来调整,因而流体力分离能够用于基于固体粒子大小的分类,或者能够用于固体粒子的分离或浓缩。因此,如果将流体力分离应用于包含培养细胞的液体培养基,则可以实施基于细胞大小的分类以及细胞的浓缩,至于实施哪一项,则可以根据使液体培养基流通的条件设定来决定。根据分离条件的设定,能够将液体培养基所含的细胞的大部分浓缩至外周侧的级分。
[0038]
本公开中,在应用流体力分离时以比较高的流速将液体培养基供给于弯曲流路,利用液体培养基所含的细胞容易偏集于弯曲流路的外周侧的现象,从而将液体培养基所含的培养细胞进行浓缩且分离。所供给的液体培养基在弯曲流路中流动期间,相对大的细胞偏集于弯曲流路的外周侧。因此,在流路的外周侧出现细胞密度(单位容积的细胞数)相对高的富细胞级分,在内周侧出现细胞密度相对低的贫细胞级分。即,液体培养基分离为富细胞级分和贫细胞级分,富细胞级分中细胞浓缩,贫细胞级分中细胞的密度下降。因此,如果在弯曲流路的出口分割为富细胞级分和贫细胞级分而各自分取,则贫细胞级分由于细胞密度低而能够在避免堵塞的同时进行过滤分离,能够从贫细胞级分有效回收液体培养基。由于流体力分离时的细胞的侵袭少,因而富细胞级分所含的细胞能够回送至培养槽而继续培养。至于贫细胞级分的过滤分离,由于以低密度实施过滤分离,因而能够减少细胞侵袭,分离后的剩余部分中所含的细胞能够在培养槽中进行培养。
[0039]
如上所述,利用流体力分离,能够消除从液体培养基去除培养细胞的过滤分离时的堵塞,有效回收液体培养基所含的有用物质。此外,利用流体力分离,也能够进行排放液的浓缩废弃。即,在培养槽的液体培养基中的细胞密度超过预定量的情况下,如果提取作为排放液而排出的液体培养基来实施流体力分离,则细胞会被浓缩成富细胞级分。因此,能够减少与细胞一起废弃的液体培养基。通过将贫细胞级分回送至培养槽,从而能够使培养槽中的细胞密度降低至预定量。或者,贫细胞级分由于能够以可适用过滤分离的细胞密度获得,因而深层过滤器的应用变得容易,能够通过滤取液体培养基来回收有用物质。
[0040]
以下,对于细胞培养系统的构成,参照图1所示的第一实施方式进行说明。图1的细
胞培养系统1具备:收容含有所培养的细胞的液体培养基的培养槽2、流体力分离装置3以及过滤分离装置4。培养槽2的液体培养基c通过送液部5而被供给至流体力分离装置3。
[0041]
流体力分离装置3在内部具备具有垂直于流动方向的一定的矩形截面的弯曲流路,在弯曲流路的一端具有导入液体培养基c的单一的导入口31,并且在弯曲流路的另一端具有将液体培养基分离而排出的至少两个导出口32、33。流体力分离装置3通过利用在弯曲流路中流动而按一个方向回旋的液体所产生的涡流,从而使液体培养基c所含的细胞偏集于流路的外侧(外周侧)。因此,通过将从弯曲流路排出的液体培养基分割为外周侧的级分和内周侧的级分,从而分离为细胞密度相对高的富细胞级分和细胞密度相对低的贫细胞级分。从一个导出口32排出细胞密度相对高的液体培养基,从另一个导出口33排出细胞密度相对低的液体培养基。
[0042]
流体力分离装置3的弯曲流路的弯曲形状可以例举大致圆周状、大致圆弧(部分圆周)状、螺旋状等,可以为这些形状中的任一种。流体力分离装置3可以将具有一个弯曲流路的流路单元作为构成单元进行设计。具体而言,作为流路单元,以塑料等形成在内部形成有一个弯曲流路的平层状的成型体,此时,弯曲流路的两末端在成型体的端面开口以具有一个导入口和至少两个导出口的方式构成。通过将这样的成型体用作流路单元,从而能够利用一个流路单元或者多个流路单元的组合来构成流体力分离装置。通过将多个流路单元层叠而构成并联状的流路,从而能够提高液体培养基的处理流量。
[0043]
送液部5具有由连接培养槽2和流体力分离装置3的配管构成的供给路6,培养槽2的包含细胞的液体培养基c通过供给路6而向流体力分离装置3输送。图1的细胞培养系统1具有连接流体力分离装置3的导出口32和培养槽2的配管,由此构成将富细胞级分向培养槽2回送的第一回送路7。通过供给路6和第一回送路7,从而在培养槽2和流体力分离装置3之间形成可将液体培养基循环的循环系统。
[0044]
由流体力分离装置3分离的富细胞级分通过第一回送路7回送至培养槽2,进而继续细胞培养。贫细胞级分(内周侧的级分)从流体力分离装置3通过供给路8向过滤分离装置4供给。
[0045]
过滤分离装置4具有导入液体培养基的单一的导入口41以及将液体培养基分离而排出的至少两个导出口42、43,且在内部具有能够从液体培养基将细胞分离的过滤器。供给路8与导入口41连接,供给来自流体力分离装置3的贫细胞级分。贫细胞级分分离为透过过滤器的液体培养基c1和剩余部分的液体培养基,由过滤器去除的细胞被浓缩至剩余部分的液体培养基,从而细胞密度增加。透过过滤器的液体培养基c1从导出口42排出,剩余部分的液体培养基从导出口43排出。由于液体培养基含有培养细胞产生的有用物质,因而从导出口42排出的液体培养基c1可视需要实施用于回收有用物质的分离处理以及精制处理。
[0046]
本公开中,通过流体力分离装置而将细胞密度降低了的液体培养基供给至过滤分离装置4。因此,作为过滤分离装置4,可以适宜使用一般用于培养细胞的分离的过滤分离装置,能够在避免堵塞的同时,良好地回收液体培养基。从防止细胞侵袭的观点考虑,适用错流过滤方式的过滤分离装置,作为过滤器模块的结构,可以例举多层板结构、螺旋状片结构、中空线束结构等。作为分离细胞的过滤器,可以从具有合适的孔径且适合于细胞处理的材料的各种过滤器中选择使用,作为过滤器的种类,可以例举精密过滤膜、超滤膜等分离膜。孔径为0.01~10μm程度的精密过滤膜合适于细胞的去除,如果将孔径为0.2~0.45μm程
度的精密过滤膜作为过滤器使用,则能够有效地将细胞分离。如果使用表面实施了亲水化处理的过滤器,则容易抑制细胞的损伤、堵塞。根据需要,可以使用孔径不同的多个过滤器,也可以构成为多阶段的分离。此时,也可以将由细胞培养生成的代谢物、废物的微小凝缩物、死细胞片(碎屑)等从液体培养基去除,根据去除对象,可以从例如精密过滤膜、超滤膜等中选择合适的孔径的过滤器。
[0047]
细胞培养系统1具有连接过滤分离装置4的导出口43和培养槽2的配管,由此构成将从贫细胞级分去除的细胞向培养槽2供给的第二回送路9。该实施方式中,第二回送路9与第一回送路7合流而构成循环系统的一部分,但也可以按照单独向培养槽2供给而不与第一回送路7合流的方式构成。
[0048]
进一步,为了将与从过滤分离装置4排出的液体培养基c1的量相对应的新的液体培养基c0补充至培养槽2,会具备培养基补充部10,培养槽2内的液体培养基c由于新的液体培养基c0的补充而被维持在一定量。
[0049]
流体力分离装置3中的细胞的分离效率会随着供给于弯曲流路的液体中的de数以及压力而发生变化,存在可适宜分离的de数以及压力的合理范围。迪恩数de由式:de=re(d/2rc)
1/2
表示(re:雷诺数(-),d:代表长度(m),rc:流路的回旋半径(m))。de数与液体的流速成比例,因而通过合理控制供给于流体力分离装置的液体的流速以及压力,可以实施适宜的细胞分离。总的来说,de数优选为30以上且100以下,更优选为50~80程度。因此,以成为这样的范围的de数的方式来设定液体培养基的流速(流量)。
[0050]
细胞培养系统1的送液部5具有将用于向流体力分离装置3供给液体培养基c的流动压施加于液体培养基c的施力装置、具体为泵11。借助泵11所赋予的流动压,从而液体培养基c向流体力分离装置3供给的流量以及流压发生变化。将所分离的细胞回送至培养槽2而继续细胞培养时,细胞的存活率是重要的。关于此点,细胞的存活率随着流体力分离装置3中的分离期间的压力变动的大小而发生变化。即,为了防止存活率的下降,使细胞分离时的压力变动小是有效的。因此,基于此点,送液部5使液体培养基c流通至流体力分离装置3的压力环境以抑制流通流体力分离装置3期间的液体培养基中的压力变动导致的细胞存活率的下降的方式进行控制。
[0051]
因此,送液部5具有压力控制机构,由此,以向流体力分离装置3导入的液体培养基与从流体力分离装置3导出的液体培养基的压力差成为预定值以下的方式控制压力环境。压力控制机构可以使用压力计以及压力调节阀来构成。具体而言,图1的细胞培养系统1中,压力计12以及压力调节阀13设于供给路6上。
[0052]
动物细胞在较高压下也具有耐受性,例如,在1mpa程度的加压供给时也维持细胞的存活率。但是,如果压力变动大,则即使0.6mpa程度的供给压力(入口压力),细胞的损伤也大,存活率下降。因此,应当以在流体力分离中施加于细胞的压力的变动(入口压力与出口压力之差)成为预定值以下的方式控制液体培养基的供给。具体而言,以压力变动(压力差)小于0.60mpa的方式控制,优选以成为0.45mpa以下、更优选以成为0.40mpa以下的方式来设定。在如上抑制了压力变动的分离条件中,细胞的存活率能够维持在98%程度以上,因而能够将所浓缩分离的细胞回送至培养槽而维持增殖效率。
[0053]
细胞培养系统1中,由于流体力分离装置3的导出口32、33中的导出侧压力向大气压开放,因而所导入的液体培养基与所导出的液体培养基的压力差等于由压力计12测定的
压力(表压)。因此,基于该测定值来进行压力控制。为了防止分离中的细胞中的存活率的下降,要以压力差小于0.60mpa的方式控制压力环境,优选以成为0.45mpa以下、更优选以成为0.40mpa以下的方式进行控制。
[0054]
如果从流体力分离装置3排出的液体培养基中的压力高,则可应用于向流体力分离装置3导入的液体培养基的压力范围的上限变高。因此,对于施加于向流体力分离装置3导入的液体培养基的压力成为0.6mpa以上的条件设定,也可以通过使液体培养基的导入时与排出时的压力差减小来应对。即,只要将压力调节阀设于第一回送路7和供给路8,使从流体力分离装置3的导出口32、33排出的液体培养基中的出口压力增加而使压力差减小即可。该情况下,适宜将压力计设置于第一回送路7和供给路8,以成为合适的压力差的方式监控排出压力。此时,对于在第一回送路7中流动的液体培养基,也应当以不发生剧烈的压力变动的方式确认压力环境。但是,第一回送路7和供给路8中的压力要考虑适合于过滤分离装置4的分离处理的范围来设定。
[0055]
如上所述,流体力分离装置3中的分离效率依赖于流通弯曲流路的液体培养基的流速。因此,送液部5进一步具有控制向流体力分离装置3供给的液体培养基的流量的流量控制机构,以流通流体力分离装置3的弯曲流路的液体培养基成为适宜的流速的方式控制流通供给路6的液体培养基的流量。流量控制机构由流量计14和流量调节阀15构成。流量计14监控向流体力分离装置3供给的液体培养基c的流量,流量调节阀15基于由流量计14监控的流量来调节向流体力分离装置3供给的液体培养基c的流量。按照使适合于过滤分离的细胞密度的液体培养基供给至过滤分离装置的方式调节向流体力分离装置3供给的液体培养基的流量。
[0056]
细胞培养系统1中,在能够借助泵11的驱动控制来适宜调节向流体力分离装置3供给的液体培养基的流量的情况下,可以省略流量调节阀15。此外,在能够借助泵11的驱动控制来适宜调节向流体力分离装置3供给的液体培养基的供给压力的情况下,可以省略压力调节阀13。因此,基于流体力分离装置3中的处理能力(流路截面的大小以及流路数),合理设计供给路6和第一回送路7的尺寸,从而能够将细胞培养系统的构成简化。
[0057]
细胞培养系统1的培养基补充部10具有收容新的液体培养基c0的培养基罐16以及连接培养基罐16和培养槽2的培养基补给路17。将培养基罐16的新的液体培养基c0补充至培养槽2,从而将培养槽2内的液体培养基维持在一定量。即,与从过滤分离装置4回收的液体培养基c1的量相对应的量的新的液体培养基c0从培养基罐16通过培养基补给路17进行补充。为此,图1的细胞培养系统1中,培养基补充部10具有设置于培养槽2的液面计18以及设置于培养基补给路17的流量调节阀19。根据液面计18所检测的液面水平,控制流量调节阀19,调节由附设于培养基罐16的滚柱泵20供给的液体培养基c0的量,以便培养槽2的液体培养基的液面恒定地维持。由于从流体力分离装置3以及过滤分离装置4向培养槽2回送的液体培养基的量只减少从过滤分离装置4回收的液体培养基c1的量,因而可通过维持培养槽2内的液面来实现与回收的液体培养基c1相对应的补充。
[0058]
除了液面计以外,使用测定培养槽2的重量的重量计,也可以进行这样的补充,只要以恒定地维持重量的方式补充新的液体培养基即可。或者,也可以使用测定从过滤分离装置4回收的液体培养基的重量或流量的测量仪。或者,也可以使用测定回送至培养槽2的第一回送路7的富细胞级分的量以及从过滤分离装置4回送的第二回送路9的液体培养基的
量的测量仪(流量计)来进行这样的补充。
[0059]
培养槽2和培养基罐16是能够防止微生物污染的容器。它们各自使用加热器或冷却器、以及装有温度调节功能的装置,内部的液体培养基维持在适合于细胞培养或保管的温度。培养槽2具备能够以不损伤细胞的合适的速度进行搅拌的搅拌装置,将液体培养基均匀化。此外,根据需要,可以适当利用具备调整氧/二氧化碳/空气的量、ph、导电率、光量等的功能的装置,以便能够调节至适合于所培养的细胞的培养环境。
[0060]
培养槽2与将含有增殖的细胞的液体培养基作为排放液向外部排出的排出路21连接,在培养槽2的液体培养基中细胞过度增殖的情况下,会将液体培养基的一部分从排出路21排出至外部。根据该排出量而从培养基罐16供给新的液体培养基c0,将培养槽2内的液体培养基的量维持在预定量,从而液体培养基的细胞密度降低。排出路21上设有开关阀22,通过该开关能够调节排放液的排出量,因而能够以适宜量调节培养槽2中的液体培养基的细胞密度。细胞培养系统1中,在过滤分离装置4中实施分离处理的液体培养基是在流体力分离装置3中细胞密度降低了的贫细胞级分,因而培养槽2中的液体培养基的细胞密度可以高于适合于过滤分离的液体培养基的细胞密度。即,通过斟酌流体力分离装置中的分离效率,可以较高地设定培养槽2中的液体培养基的细胞密度的上限。因此,作为排放液排出的液体培养基的细胞密度也变高,排放液的废弃导致的液体培养基的损失变少。在细胞的存活率下降时定期进行排放液的提取,能够改善存活率,因而作为排放液排出的液体培养基的减量是非常有用的。
[0061]
如上所述,细胞培养系统中,为了适宜地维持细胞的存活率,会控制向流体力分离装置3供给的液体培养基的压力环境。细胞的存活率也受到将流动压供给于含有细胞的液体培养基的泵11的影响,因而在维持细胞的存活率方面优选选择合适的送液机构作为泵11。为了抑制对于细胞的存活率的影响,优选为不会对细胞施加剪切应力的方式的泵,具体而言,使用利用往复运动或旋转运动带来的容积变化而将一定容积的液体挤出的容积式泵为佳。作为容积式泵,例如,可以举出活塞泵、柱塞泵、隔膜泵、轮翼泵等往复泵,齿轮泵、叶片泵、螺旋泵等旋转泵。作为一实施方式,可以例举利用附设有压缩机的加压罐的泵,利用压缩机对收容在加压罐中的液体培养基进行加压,从而能够从加压罐向流体力分离装置压送液体培养基。
[0062]
流体力分离装置中的细胞的浓缩状态以及分取比率随着出口中的导出口的分割位置的不同而不同。即,通过设计弯曲流路的末端出口中的导出口的分割位置,能够调整外周侧的级分与内周侧的级分的分割比率。图1的细胞培养系统中,流体力分离装置作为弯曲流路的出口具有两个导出口,但也可以分割为三个以上的导出口。在将末端出口分割为三个以上的导出口的情况下,可以根据状况来改变回送至培养槽的级分的量以及供给于过滤分离装置的级分的量。
[0063]
以下记载在上述那样的细胞培养系统1中可实施的细胞培养方法。细胞培养方法具有:利用液体培养基培养细胞的细胞培养工序;利用弯曲流路的流体力分离工序;以及利用过滤器的过滤分离工序。细胞培养工序在培养槽2中进行,流体力分离工序在流体力分离装置3中实施。过滤分离工序通过过滤分离装置4来实施。在流体力分离工序中,利用在具有矩形截面的弯曲流路中流动而产生的涡流,将从细胞培养工序供给的液体培养基分离为富细胞级分和贫细胞级分。富细胞级分的细胞密度相对高,贫细胞级分的细胞密度相对低。在
过滤分离工序中,从通过流体力分离工序而分离的贫细胞级分将细胞去除而回收液体培养基。
[0064]
在细胞培养工序中,在调节至合适于培养细胞的环境的液体培养基中开始细胞培养,培养中,监控液体培养基的葡萄糖浓度以及细胞密度。随着培养进行,葡萄糖被消耗,细胞增殖而细胞密度增加。随之,细胞所产生的抗体等有用物质增加。细胞培养工序中的葡萄糖浓度如果开始低于预定浓度、例如1g/l,则连续供给新的液体培养基。此时,以恢复至葡萄糖不会枯竭和过剩的预定浓度以下的范围的方式调节供给。如果与此同时启动泵11而开始向流体力分离工序以及后续的过滤分离工序供给液体培养基,则会从流体力分离工序以及过滤分离工序回送细胞密度增加了的液体培养基。在从过滤分离工序回收的液体培养基c1含有期望浓度的有用物质的情况下,进行回收而实施有用物质的分离精制。在此期间,以供给于培养工序的新的液体培养基c0的量与从过滤分离工序回收的液体培养基c1的量相对应的方式控制向流体力分离工序的供给。
[0065]
在从过滤工序回收的液体培养基的有用物质的浓度低的情况下,可以考虑其葡萄糖浓度等进行废弃或供给于培养槽2而再利用。例如,在培养槽所需的新的液体培养基的供给流量低、且如果维持流体力分离工序中的额定流量而进行连续处理时难以恒定地维持培养槽中的液体培养基的量的情况下,可以间歇地进行向流体力分离工序的供给。由此能够维持流体力分离工序中的额定流量而适宜地进行分离,并且能够维持培养槽的液体培养基量。在进行间歇的流体力分离的情况下,如果提高向流体力分离工序的供给的转换频率而加快进行断续,则在抑制培养槽的液体培养基的浓度变动方面是有效的。
[0066]
如果细胞培养工序中的液体培养基达到预定的细胞密度,则基于增殖带来的细胞密度的增加预测,将剩余量的细胞作为排放液排出,并且调整新的液体培养基的供给量,将培养槽内的液体培养基的液量以及细胞密度维持在预定量。
[0067]
细胞密度的测量可以为基于液体培养基的样品的测量,也可以为基于细胞测量装置的检测器的直接测量。细胞培养系统1中,供给于过滤分离工序的液体培养基是通过流体力分离而得到的贫细胞级分,因而细胞培养工序中的液体培养基的细胞密度可以设定得高于适合于过滤分离的液体培养基的细胞密度。适合于过滤分离的细胞密度根据所使用的过滤器等的不同而不同,但总的来说,可以设为5
×
10
7
细胞/ml左右,考虑到流体力分离时的分离,可以将更高的细胞密度作为细胞培养工序中的预定量来设定。为此,能够减少作为排放液排出的液体培养基量。
[0068]
另外,为了不使细胞存活率因流通弯曲流路期间的液体培养基中的压力变动而下降,使用压力计12以及压力调节阀13来控制液体培养基的供给压力。此时,以流体力分离时的压力变动(压力差)小于0.60mpa、优选成为0.45mpa以下、更优选成为0.40mpa以下的方式进行调节。
[0069]
在流体力分离工序中,包含细胞的液体培养基向具有矩形截面的弯曲流路从单一的导入口导入,以均匀的状态供给于弯曲流路。流体力分离装置的弯曲流路是与流动方向垂直的截面(径向截面)为矩形的流路。在均匀的液体培养基在弯曲流路中流动期间,相对小的细胞及微小粒子踏着迪恩涡而在矩形截面中其分布以画圆圈的方式发生变化,另一方面,相对大的细胞由于积聚于流路的外周侧的升力较强地发挥作用而分布集中于外周侧。如果该作用变强,则细胞向外周侧的偏集倾向变大。在弯曲流路的末端,从外周侧的导出口
32排出细胞密度相对高的富细胞级分、即细胞浓缩了的液体培养基。从内周侧的导出口33排出剩余部分的液体培养基、即细胞减少而细胞密度相对低的贫细胞级分。
[0070]
如前述式所示的那样,de数随着弯曲流路的回旋半径rc以及流路的截面尺寸而发生变化(前述式中的代表长度d可以看做弯曲流路的宽度)。因此,基于弯曲流路的设计,能够以de数成为合适的值的方式进行调整,由此,流体力分离装置能够以良好的分离效率实施细胞的浓缩分离。此外,流体的流量是可以通过设定弯曲流路的截面的宽度(径向)和高度中的任一者来调节的,因而,基于弯曲流路的设计,能够以可按照适宜的压力和期望的流量实施细胞的分离处理的方式构成流体力分离装置。因此,弯曲流路的设计可以根据分离对象的条件(细胞的尺寸分布、培养基的粘度等)以能够进行适宜分离的方式进行适宜变更。从细胞的分离效率的观点考虑,优选具有纵横比(宽度/高度)为10以上的长方形截面的弯曲流路。通过将液体培养基以100~500ml/分钟程度的流量供给于这样的弯曲流路,从而细胞良好地偏集,能够以50亿~250亿细胞/分钟程度的效率进行细胞的浓缩分离。如果将这样的流体力分离应用于例如5
×
10
7
细胞/ml程度的液体培养基,则能够分离为细胞密度7
×
10
7
细胞/ml程度以上的富细胞级分以及1
×
10
7
细胞/ml程度以下的贫细胞级分。
[0071]
根据流体力分离装置的弯曲流路的末端出口中的导出口的分割位置,可以调整外周侧的富细胞级分与内周侧的贫细胞级分的分割比率,基于此能够调节细胞的浓缩分离的程度。总的来说,如果以外周侧级分/内周侧级分的分割比率(容积比)成为90/10~50/50程度的方式设计流路出口中的截面积比,则对于上述那样的细胞的浓缩分离是合适的,能够实现将细胞的95%程度以上浓缩至富细胞级分的分离。从流体力分离工序排出的富细胞级分被回送至培养槽中的细胞培养工序,贫细胞级分被供给于过滤分离工序。大的细胞与小的细胞相比,存活率以及活性更高,富细胞级分相对多地包含大的细胞。因此,如果将富细胞级分回送至细胞培养工序而使液体培养基在细胞培养工序和流体力分离工序之间循环,则细胞的培养效率提高。
[0072]
在过滤分离工序中,使用不使细胞透过的孔径的过滤器,回收透过过滤器的液体培养基c1。精密过滤膜通常孔径为0.01~10μm程度,合适于细胞的分离去除。如果孔径为0.2~0.45μm程度,则细胞与蛋白质、多糖类等物质的分离良好。在细胞的过滤分离时,适合应用使液体培养基平行于膜面流通的错流过滤方式。由于回收了液体培养基c1的剩余部分的液体培养基中被过滤器去除的细胞发生浓缩,因而剩余部分的液体培养基中的细胞密度高于贫细胞级分。剩余部分的液体培养基被回送至细胞培养工序而继续培养。在过滤分离中,考虑过滤压力以及剪切应力导致的细胞损伤而适宜调节贫细胞级分的供给流量以及供给压力。由于贫细胞级分的细胞密度低,因而过滤时的负荷小,堵塞被消除。
[0073]
透过过滤器而回收的液体培养基c1视需要实施用于有用物质的分离精制的处理。由此,将由细胞培养产生的代谢物、废物的微小凝缩物、死细胞片(碎片)等从液体培养基去除。以进行这样的分离精制中的一部分为目的,可以在使用孔径不同的多个过滤器的多阶段的分离中配置过滤分离工序。例如,孔径为0.001~0.01μm程度的超滤膜可以使氨基酸、肽、糖类、抗生物质等透过,将高分子、蛋白质、多糖类等去除。
[0074]
从流体力分离工序以及过滤分离工序回送至培养工序的液体培养基的总量仅减少过滤分离工序中作为透过液而回收的液体培养基的量。因此,以与该量相对应的新的液体培养基c0补充至培养工序的方式调节液体培养基c0的供给量。由此,能够继续补充细胞
所使用的营养素而稀释代谢物的浓度,进行连续培养。
[0075]
从流体力分离工序以及过滤分离工序将细胞回送至细胞培养工序,继续细胞培养。监控培养槽内的液体培养基的细胞密度,在将液体培养基的细胞密度维持在预定量的状态下,从培养基罐供给的新的液体培养基c0的量相当于从过滤分离工序回收的液体培养基的量。在细胞过度增殖而细胞密度超过预定量的状态下,为了调节细胞密度,液体培养基c的一部分作为排放液排出,因而与此相对新的液体培养基c0的供给量增加。如此操作,培养槽2内的液体培养基的量被恒定地维持,液体培养基的细胞密度下降至预定量。排放液的排出量可以基于细胞的增加预测来决定,应当基于细胞密度的监控结果,以细胞密度维持在预定量的方式适宜校正排出量。培养槽2中的液体培养基的细胞密度可以设定得高于适合于过滤分离的液体培养基的细胞密度,应当考虑流体力分离时的分离程度,决定培养槽中的细胞密度的预定量。因此,作为排放液排出的液体培养基的细胞密度也变高,排放液的废弃导致的液体培养基的损失变少。经过期望的培养时间后,可以停止适宜培养,通常可以持续培养10~30天左右。
[0076]
通过流体力分离而得到的富细胞级分中的细胞密度高于培养槽中的液体培养基的细胞密度。因此,富细胞级分作为排放液来废弃是合适的。作为细胞培养系统的第二实施方式,图2示出了以将富细胞级分作为排放液排出的方式构成的细胞培养系统。
[0077]
图2的细胞培养系统50中,用于将排放液排出的排出路21a以从流体力分离装置3将富细胞级分排出的第一回送路7分支的方式设置,而非培养槽2。排出路21a上设置有开关阀22a,以培养槽2中的液体培养基的细胞密度超过预定量时将富细胞级分废弃的方式控制开关阀22a。或者,可以设置流量调节阀来代替开关阀22a,从而以能够调节及变更作为排放液排出的富细胞级分的比例的方式构成。如此操作,能够将从流体力分离装置排出的富细胞级分的一部分或全部作为排放液从排出路21a排出。
[0078]
关于流体力分离装置3,存在使分离效率最大化的最佳的运转流量(额定流量)。因此,在应当作为排放液排出的流量少的情况下,可以通过以间歇地进行从排出路21a的富细胞级分的排出的方式控制开关阀22a来应对。或者,也可以间歇地进行流体力分离装置3本身的运转。由于应对排放液的排出而将新的液体培养基供给于培养槽2,因而培养槽2中的液体培养基的液质会发生变动。因此,在进行间歇的排放液排出的情况下,为了尽可能减少培养槽2的液体培养基的液质变动,应当提高转换频率而加快调节。除了用于将排放液排出的构成以外,细胞培养系统50与图1的细胞培养系统1相同,因而省略关于相同的装置以及构件的说明。
[0079]
图1和图2的实施方式中,以将流体力分离与回收含有有用物质的液体培养基的过滤分离组合的方式构成,使过滤分离时的负荷减轻。流体力分离与关于废弃的排放液的过滤分离组合也是有效的,过滤分离时的负荷同样减轻,能够削减液体培养基的回收所需的费用。作为细胞培养系统的第三实施方式,图3示出了以在排放液的排出中利用流体力分离的方式构成的细胞培养系统。该实施方式中,利用深层过滤器作为过滤分离装置的过滤器,将液体培养基从排放液回收,且为了从包含培养中的细胞的液体培养基将细胞去除而回收液体培养基,使用追加的过滤分离装置。
[0080]
详细而言,图3的细胞培养系统51具有培养槽2、流体力分离装置3、过滤分离装置4、培养基补充部10以及深层过滤器52。细胞培养系统51在流体力分离装置3设置于将排放
液排出的排出路21b而与深层过滤器52连接的方面与图1的细胞培养系统1不同。过滤分离装置4与培养槽2直接连接。
[0081]
在培养槽2中的液体培养基的细胞密度超过预定量时,作为排放液排出的液体培养基c借助泵11的运转从培养槽2通过排出路21b而供给于流体力分离装置3的导入口31。排放液的排出可以基于细胞的增加预测来设定,可以通过监控培养槽2中的细胞密度而适宜校正。向流体力分离装置的液体培养基的供给与图1、2的细胞培养系统同样,可以利用压力调节阀13以及流量调节阀15来控制,使用压力计12以及流量计14调节为合适的流量(额定流量)以及压力。为了以合适的流量供给排放液,根据状况进行连续供给或间歇供给。在流体力分离装置3中,液体培养基c分离为富细胞级分和贫细胞级分。流体力分离装置3的导出口33通过供给路53与深层过滤器52连接,将贫细胞级分供给于深层过滤器52。予以说明的是,在该实施方式中,为了暂时储存贫细胞级分c
’
,将能够防止微生物污染的容器54设于供给路53,从而构成为能够调节向深层过滤器52的供给。但是,也可以省略容器54。
[0082]
深层过滤器52过滤细胞密度低的贫细胞级分c
’
,因而不易发生堵塞,也容易应对过滤器的处理容量。因此,能够从培养槽2所供给的液体培养基的贫细胞级分c
’
将细胞去除而高效地回收液体培养基。流体力分离装置3具有与导出口32连接的排出路55,富细胞级分作为排放液从排出路55向外部废弃。由于细胞浓缩在富细胞级分侧,因而作为排放液废弃的液体培养基的量被减少。
[0083]
另一方面,过滤分离装置4的导入口41以及导出口43通过供给路56以及回送路57与培养槽2直接连接。培养槽2内的液体培养基c借助泵58的运转向过滤分离装置4连续供给,透过过滤器的液体培养基c1从导出口42回收。细胞密度增加了的液体培养基从导出口43通过回送路57向培养槽2回送。通过液体培养基c在培养槽2和过滤分离装置4中循环,从而液体培养基的细胞密度以及有用物质的浓度比培养开始时的值增加。在培养初期,液体培养基c的有用物质的浓度低,葡萄糖等营养素没有枯竭,因而从过滤分离装置4回收的液体培养基c1可以向培养槽2供给而再利用。由此,能够抑制液体培养基的消耗。
[0084]
在细胞培养系统51中,培养槽2内的液体培养基c向过滤分离装置4直接供给。因此,为了供给适合于过滤分离的细胞密度的液体培养基c,培养槽2中的液体培养基c的细胞密度会成为适合于过滤分离的适宜量,并以此作为预定量来监控培养槽2的液体培养基。因此,不将从培养槽2作为排放液排出的液体培养基直接废弃,而通过流体力分离以及深层过滤器52进行回收的构成在抑制液体培养基被无端废弃方面是有用的。深层过滤器是在表面以及内部均捕捉过滤对象的过滤器,结构上可以看做是孔径不同的多种过滤器或分离膜的组合。
[0085]
在图3的细胞培养系统51中,从过滤分离装置4的导出口42连续回收液体培养基c1,作为排放液排出的处理,从深层过滤器52间断地回收液体培养基c2。对应于液体培养基c1的回收量以及排放液排出量,从培养基补充部10的培养基罐16通过培养基补给路17补充新的液体培养基c0,维持培养槽2的液体培养基量。剩余的细胞作为利用流体力分离的富细胞级分以及深层过滤器52的过滤物而得到。以培养槽2的细胞增殖活跃的状态排出的排放液含有丰富的有用物质,因而利用深层过滤器52的液体培养基c2的回收在提高有用物质的回收率方面是有用的。关于此点,由于在图1的细胞培养系统1中,可以较高地设定培养槽2中的液体培养基的细胞密度,因而如果在细胞培养系统1中从排放液回收液体培养基,则对
于提高有用物质的回收效率是有利的。因此,如果将利用流体力分离和过滤而从排放液回收液体培养基的图3的构成与图1的细胞培养系统1合并,则在减少液体培养基的废弃量以及提高有用物质的回收效率方面是非常有效的。
[0086]
图4示出了细胞培养系统的第四实施方式。在该实施方式中,也在排放液的排出中利用流体力分离。但是,在图4的细胞培养系统60中,设有将通过流体力分离而得到的贫细胞级分向培养槽2回送的培养基回送路。即,使用贫细胞级分来使培养槽的液体培养基的细胞密度下降,而不进行贫细胞级分的过滤分离。
[0087]
详细而言,图4的细胞培养系统60具有培养槽2、流体力分离装置3、过滤分离装置4以及培养基补充部10。培养槽2收容包含所培养的细胞的液体培养基,流体力分离装置3与前述同样利用通过在具有矩形截面的弯曲流路中流动而产生的涡流进行液体培养基的分离处理。即,将从培养槽2作为排放液供给的液体培养基分离为细胞密度相对高的富细胞级分以及细胞密度相对低的贫细胞级分。向流体力分离装置3的液体培养基的供给与图1~3的细胞培养系统同样,可以通过压力调节阀13以及流量调节阀15进行控制,使用压力计12以及流量计14调节为适宜的流量(额定流量)。
[0088]
过滤分离装置4与细胞培养系统51同样,通过供给路56以及回送路57与培养槽2直接连接,从培养槽2所连续供给的液体培养基将细胞去除,从而回收透过过滤器的液体培养基c1。含有被过滤器去除的细胞的剩余部分的液体培养基被回送至培养槽2。因此,与图3的情况同样,培养槽2中的液体培养基的细胞密度被调节至适合示于过滤分离的范围。
[0089]
流体力分离装置3设置于将排放液排出的排出路21b,根据培养槽2中的细胞的增殖状况,作为排放液排出的液体培养基借助泵11的运转而向流体力分离装置3供给。向流体力分离装置的液体培养基的供给与图1~3的细胞培养系统同样,可以通过压力调节阀13以及流量调节阀15进行控制,使用压力计12以及流量计14调节为适宜的流量(额定流量)以及压力。在流体力分离装置3中分离的液体培养基的富细胞级分从与导出口32连接的排出路55废弃。另一方面,流体力分离装置的导出口33通过回送路61与培养槽2连接,贫细胞级分通过回送路61向培养槽2供给。由此,培养槽2的液体培养基的细胞密度降低。在该构成中,伴随排放液排出的液体培养基的减量相当于从排出路55废弃的富细胞级分的量。因此,为了维持培养槽2的液体培养基量而所需的新的液体培养基c0的补充量与图3的细胞培养系统51相比减少,其减少量相当于贫细胞级分的量。因此,是能够抑制细胞培养所消耗的液体培养基的量不必要地增加的构成。此外,通过将贫细胞级分而非新的液体培养基供给于培养槽2,从而能够抑制培养槽2中的有用物质的浓度下降,并且将液体培养基的细胞密度维持在预定量。因此,从过滤分离装置4回收的液体培养基在将有用物质分离精制的效率等方面变得有利。
[0090]
上述实施方式的构成可以以使用多个流体力分离装置的方式变更。如果将多个流体力分离装置串联配置,则能够多阶段地分离液体培养基。例如,如果将两个流体力分离装置串联配置,将从第1段的流体力分离装置排出的富细胞级分供给于第2段的流体力分离装置,则能够得到细胞以更高密度浓缩的富细胞级分。这应用于排放液的排出时有用性变高,能够将以更高密度浓缩的细胞废弃。此外,如果将贫细胞级分供给于第2段的流体力分离装置,则可得到细胞密度进一步下降的贫细胞级分,因而能够提高过滤分离的效率。借助2阶段的流体力分离,液体培养基被分离为3个级分,因而通过合理调节各阶段中的分割比率,
从而能够针对各级分的目的在废弃、再利用或液体培养基的回收方面实施专门化的分离。此外,如果将多个流体力分离装置并联配置,则能够使液体培养基的处理流量增加,因而能够以超出额定流量的流量进行处理。
[0091]
细胞在活性高的状态下生长得大,但当活性下降时,会以较小的状态死亡并分解。相对小的细胞多数为死细胞或死细胞片(碎片),dna合成途中的活性细胞所含的比例少。流体力分离能够基于使液体培养基流通的条件而分离出相对大的粒子和小的粒子。因此,以单一的处理就能够分离为活性高的细胞与死细胞或死细胞片,如果利用上述的以多阶段构成的流体力分离,则分离会变得容易。因此,也能够将死细胞以及死细胞片、代谢物的凝缩物浓缩而成的级分分取而作为排放液废弃。通过设定所供给的液体培养基的流速(流量)以及弯曲流路中的截面的大小,能够调整分离状态。
[0092]
在细胞培养系统的系统设计中,流体力分离装置中的适宜的处理流量(额定流量)是基本,因此应当以恰当地达到培养槽2的容量与流体力分离装置的处理流量的平衡的方式构成细胞培养系统。在培养槽2的液体培养基的容量较少且连续进行流体力分离装置中的处理时超出适宜的培养基交换率的情况下,会进行间歇处理。即,应当以培养槽中的培养基交换率达到适宜值的方式设定流体力分离装置中的处理量,基于额定流量计算处理时间,将分离处理分成多次而每隔一定时间间断地实施。
[0093]
使用上述那样的细胞培养系统,能够对各种各样的细胞实施细胞培养方法,能够将培养细胞所产生的蛋白质、酶等各种有用物质回收而用于制造医药品等。具体而言,可以适用于动物细胞(哺乳类、鸟类或昆虫的细胞)那样的真核细胞以及真菌细胞(大肠杆菌等菌类或酵母的细胞)的培养。例如,可以举出中国仓鼠的卵巢细胞、幼仓鼠肾脏(bhk)细胞、per.c.6细胞、骨髓瘤细胞、her细胞等。作为通过这样的细胞培养而得到的有用物质,例如,可以举出免疫球蛋白(单克隆抗体或抗体片段)、融合蛋白、胰岛素类、生长激素类、细胞因子类、干扰素类、胰高血糖素、白蛋白、溶酶体、人血清白蛋白、hpv疫苗、凝血因子、促红细胞生成素类、ns0、sp2/0等的抗体等。细胞培养只要基于对于各细胞已知的培养条件根据常规方法进行培养即可。关于细胞培养中所使用的液体培养基,可以为合成培养基、半合成培养基、天然培养基中的任何液体培养基,只要恰当地选择使用适合于培养的细胞的液体培养基即可。总的来说,适合使用经配方的选择增菌培养基、选择分离培养基以使特定的菌种增殖。可以从市售的液体培养基中适宜地选择使用,或者,可以根据已知的配方使用营养素和精制水等进行调制。可以根据需要添加以检测为目的的鉴定剂(ph指示剂、酶基质、糖类等)、抑制目标外微生物的生长的选择剂等。为了有效进行流体力分离,优选使用粘性不太高的液体培养基。
[0094]
培养细胞产生且液体培养基所含的有用物质可以通过将由流体力分离以及过滤分离回收的内周侧级分的液体培养基精制而回收。在所产生的有用物质也存在于培养细胞内的情况下,只要不废弃排放液而从细胞将有用物质回收即可。图2~4的细胞培养系统能够从流体力分离装置所排出的富细胞级分的浓缩了的细胞回收有用物质,在从细胞回收时是有效的构成。
[0095]
图5是示出调查流体力分离装置中的分离效率与de数的关系的结果的图表。图5中,使用流路的尺寸不同的5种流体力分离装置(装置a1~a5)中任一种来进行流体力分离。作为分离对象,示出了使用聚合物粒子(苯乙烯-二乙烯基苯共聚物)或cho细胞(中国仓鼠
的卵巢细胞)中的任一种进行分离的结果。任何的分离对象的平均粒径均处于14~18μm的范围。分离效率是以[1-(x/x)]
×
100(%)计算的值,计算式中的x表示分离前的液体中所含的分离对象的浓度,x表示分离后的内周侧的级分中所含的分离对象的浓度。由于任何的分离对象的粒径分布均窄,因此是将粒子或细胞的所有量浓缩于外周侧的级分的状态的分离效率看做100%的评价。如从图表理解的那样,不论聚合物粒子还是动物细胞,de数均在70左右时分离效率最高,总的来说,在de数处于50~80的范围的条件下能够实现高分离效率。因此,可以理解从流体力分离装置得到的内周侧的贫细胞级分适合于过滤分离。
[0096]
图6示出了调查根据向流体力分离装置输送液体培养基的泵的种类的对于细胞的存活率的影响。将培养了细胞的液体培养基使用泵以0.3mpa的排出压向流体力分离装置供给,将从分离装置排出的液体培养基汇集为两个级分而回收。从回收的液体培养基中取少量样品且利用细胞测量装置(贝克曼库尔特公司制,制品名:vi-cell)测量细胞的存活率(%,所有细胞中的活细胞的比例)的结果即为图6的图表。图表中的“气体压送”是从连接有压缩机的加压罐将液体培养基利用压缩空气进行压送的形态,可以作为容积式泵进行分类。从图6可知,在离心泵中细胞中的损伤大,在分类为容积式泵的其他泵中防止存活率的下降。
[0097]
流体力分离与离心分离相比可以极其有效地进行细胞的浓缩分离,与过滤分离等相比,能够以高存活率进行浓缩分离而不损伤细胞。如上所述,利用流体力分离技术,能够将培养中的液体培养基分离为细胞密度相对高的富细胞级分以及细胞密度相对低的贫细胞级分。因此,使用贫细胞级分,能够通过过滤分离而将液体培养基有效回收。通过将所回收的液体培养基精制,从而能够将有用成分回收。此外,在排放液的处理中,通过利用贫细胞级分,也可以应用深层过滤器,能够回收有用物质的浓度高的液体培养基。因此,能够改善有用物质的生产效率。此外,通过将细胞浓缩了的富细胞级分废弃,从而能够减少无端废弃的液体培养基。在本公开的细胞培养系统中,在流体力分离时,由于将液体培养基以较高的速度向弯曲流路供给,因而进行细胞的浓缩分离的处理能力高,能够充分适用于实际使用规模的细胞培养。流体力分离能够以高存活率将细胞回收,因而通过将新的液体培养基与回收的细胞一起供给于培养槽,能够在维持高增殖力的同时持续细胞培养。
[0098]
产业上的可利用性
[0099]
能够消除从培养了细胞的液体培养基中将细胞去除的过滤分离中的堵塞,从而实现有效的液体培养基的回收以及有用物质的生产。通过用于利用生物技术的医药品的制造中,在提供激素、细胞因子、酶、抗体、疫苗等制品时,有助于经济性、品质的提高,能够促进目前稀少或高价的医药品的普及、推广。
[0100]
符号说明
[0101]
1、50、51、60 细胞培养系统
[0102]
2 培养槽
[0103]
3 流体力分离装置
[0104]
4 过滤分离装置
[0105]
5 送液部
[0106]
6、8、53、56 供给路
[0107]
7 第一回送路
[0108]
9 第二回送路
[0109]
10 培养基补充部
[0110]
11、58 泵
[0111]
12 压力计
[0112]
13 压力调节阀
[0113]
14 流量计
[0114]
15、19 流量调节阀
[0115]
16 培养基罐
[0116]
17 培养基补给路
[0117]
18 液面计
[0118]
20 滚柱泵
[0119]
21、21a、55 排出路
[0120]
22、22a 开关阀
[0121]
31、41 导入口
[0122]
32、33、42、43 导出口
[0123]
52 深层过滤器
[0124]
54 容器
[0125]
57、61 回送路
[0126]
c、c0、c1、c2 液体培养基
[0127]
c
’ꢀ
贫细胞级分
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询

tips


 商标分类
商标分类  商标转让
商标转让 



