化合物、有机电致发光器件及显示装置的制作方法
 2021-02-02 11:02:07|
2021-02-02 11:02:07| 260|
260| 起点商标网
起点商标网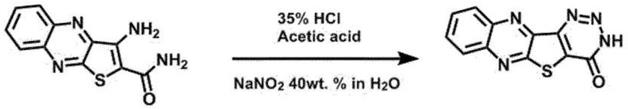
[0001]
本发明涉及能够用作用于有机电致发光器件的材料的新颖的有机化合物、包括其的有机电致发光器件及显示装置。
背景技术:
[0002]
有机电致发光现象是指使用有机材料将电能转换为光能的现象。使用有机电致发光现象的有机电致发光器件通常具有包含阳极、阴极和置于两者之间的有机材料层的结构。在此,有机材料层通常具有由不同材料构成的多数层组成的多层结构以增加有机发光器件的效率和稳定性,例如,有机材料层可由空穴注入层、空穴传输层、发光层、电子传输层及电子注入层等组成。
[0003]
在上述有机发光器件的结构中,当在两电极之间施加电压,来自阳极的空穴通过空穴注入层和空穴传输层被注入到发光层,且来自阴极的电子通过电子注入层和电子传输层被注入到发光层,然后所注入的空穴和电子再组合(recombination)形成激子(exciton),随后当该激子再降至基态就会发出光。
[0004]
有机电致发光器件的电子传输材料需要具有优异的对于电子的稳定性和电子迀移特性,作为上述电子传输材料,alq
3
、黄酮(flavon)衍生物或锗和硅氯戊二烯衍生物等是众所周知的。并且,连接至螺环(spiro)化合物的2-联苯基-4-基-5-(4-叔丁基苯基)-1,3,4-噁二唑(2-biphenyl-4-yl-5-(4-t-butylphenyl)-1,3,4-oxadiazole,pbd)衍生物和2,2',2"-(苯-1,3,5-三基)-三(1-苯基-1h-苯并咪唑)(2,2',2"-(benzene-1,3,5-triyl)-tris(1-phenyl-1h-benzimidazole,tpbi)等是众所周知的。
[0005]
但是,上述现有电子传输材料在效率和驱动电压方面需要进一步改善。
[0006]
尤其,在现有有机电致发光器件中,在发光层产生的激子扩散到电子传输层,在与电子传输层之间的界面发光,因此导致发光效率降低、寿命缩短的问题。
技术实现要素:
[0007]
技术问题
[0008]
本发明的目的在于提供一种具有较高的对于电子的稳定性和电子迀移特性且能够抑制激子扩散到电子传输层的化合物以及通过采用该化合物来具有高效率和低驱动电压的有机电致发光器件及使用其的显示装置。
[0009]
解决问题的方案
[0010]
为了达到上述目的,本发明提供由下述化学式1表示的化合物。
[0011]
[化学式1]
[0012][0013]
其中,a
1
为由下述化学式2表示的基团,
[0014]
[化学式2]
[0015][0016]
y为o或s,
[0017]
a
11
和a
12
各自独立地选自苯、萘、吡啶、嘧啶、吡嗪、哒嗪、1,2,3-三嗪、喹啉、异喹啉、2,6-萘啶(naphthyridine)、1,8-萘啶、1,5-萘啶、1,6-萘啶、1,7-萘啶、2,7-萘啶、噌啉、喹喔啉、酞嗪、喹唑啉及吩嗪中;
[0018]
a
11
和a
12
中的至少一个是含有氮(n)的芳香族杂环化合物,
[0019]
l为直接键;取代或未取代的亚芳基;取代或未取代的杂亚芳基;或取代或未取代的c
9
~c
60
稠合多环基,
[0020]
a
2
为氢;氘;卤素基;腈基;硝基;羟基;羰基;酯基;酰亚胺基;氨基;取代或未取代的甲硅烷基;取代或未取代的硼基;取代或未取代的烷基;取代或未取代的烷基硫氧基;取代或未取代的芳硫氧基;取代或未取代的烯基;取代或未取代的芳烷基;取代或未取代的芳烯基;取代或未取代的烷基芳基;取代或未取代的烷基胺基;取代或未取代的芳烷基胺基;取代或未取代的杂芳基胺基;取代或未取代的芳胺基;取代或未取代的芳基膦基;取代或未取代的氧化膦基;取代或未取代的芳基;或取代或未取代的杂环基,
[0021]
l或a
2
键合到a
1
的碳位置。
[0022]
发明的效果
[0023]
本发明的由化学式1表示的新颖化合物尤其在用作电子传输层或电子传输辅助层的材料时,可以制造与现有材料相比具有更优异的发光性能、低驱动电压、高效率及长寿命的有机电致发光器件,进而可以制造性能和寿命大大得到改善的全彩显示面板。
附图说明
[0024]
图1为本发明的一实施例的有机电致发光器件的示意性截面图。
[0025]
附图标记
[0026]
1:有机电致发光器件
[0027]
10:阳极、第一电极
[0028]
20:阴极、第二电极
[0029]
30:有机材料层
[0030]
310:空穴注入层
[0031]
320:空穴传输层
[0032]
330:空穴传输辅助层
[0033]
350:发光层
[0034]
360:电子传输辅助层
[0035]
370:电子传输层
[0036]
380:电子注入层
具体实施方式
[0037]
下文中,将参照附图详细描述本发明的实施例。在为附图中的元件分配参考标记时,尽管在不同附图中示出,但将尽可能通过相同的参考标记表示相同的元件。此外,在本发明的以下描述中,当在此引入的对己知构造和功能的详细描述反而会使本发明的主题模糊时,将省略此详细描述。
[0038]
并且,在描述本发明的元件时,在描述某一元件“连接到”、“结合到”或“耦合到”另一元件的情形中,应当理解的是,该某一元件不仅能够直接地连接到或耦合到该另一元件,而且还能够在这些元件之间“连接”、“结合”或“耦合”另外的元件。
[0039]
除非另有说明,否则本说明书和所附权利要求书中使用的下列术语的含义如下:
[0040]
除非另有说明,本说明书所用的术语“卤”或“卤素”包括氟(f)、溴(br)、氯(cl)和碘(i)。
[0041]
除非另有说明,本文所用的术语“烷基”或“烷基基团”具有1至60个碳原子的单键,并且是指包括直链烷基、支链烷基、环烷基(脂环族)基团、被烷基取代的环烷基、被环烷基取代的烷基的饱和脂族官能团的基团。烷基的具体实例包括甲基、乙基、丙基、正丙基、异丙基、丁基、正丁基、异丁基、叔丁基、仲丁基、1-甲基丁基、1-乙基丁基、戊基、正戊基、异戊基、新戊基、叔戊基、己基、正己基、1-甲基戊基、2-甲基戊基、4-甲基-2-戊基、3,3-二甲基丁基、2-乙基丁基、庚基、正庚基、1-甲基己基、环戊基甲基、环己基甲基、辛基、正辛基、叔辛基、1-甲基庚基、2-乙基己基、2-丙基戊基、正壬基、2,2-二甲基庚基、1-乙基-丙基、1,1-二甲基-丙基、异己基、2-甲基戊基、4-甲基己基、5-甲基己基等,但不限于此。
[0042]
除非另有说明,本文所用的术语“卤烷基”或“卤素烷基”是指被卤素取代的烷基。
[0043]
本文所用的术语“杂烷基”是指构成烷基的碳原子中至少一个被杂原子取代的烷基。
[0044]
除非另有说明,本文所用的术语“烯基”或“炔基”各自具有2至60个碳原子的双键或三键,并且包括直链基团或支链基团,但不限于此。其具体实例包括乙烯基、1-丙烯基、异丙烯基、1-丁烯基、2-丁烯基、3-丁烯基、1-戊烯基、2-戊烯基、3-戊烯基、3-甲基-1-丁烯基、1,3-丁二烯基、烯丙基、1-苯基乙烯基-1-基、2-苯基乙烯基-1-基、2,2-二苯基乙烯基-1-基、2-苯基-2-(萘-1-基)乙烯基-1-基、2,2-双(二苯基-1-基)乙烯基-1-基、苯乙烯苄基、苯乙烯基等,但不限于此。
[0045]
除非另有说明,本文所用的术语“环烷基”是指形成具有3至60个碳原子的环的烷基,但不限于此。其具体实例包括环丙基、环丁基、环戊基、3-甲基环戊基、2,3-二甲基环戊基、环己基、3-甲基环己基、4-甲基环己基、2,3-二甲基环己基、3,4,5-三甲基环己基、4-叔丁基环己基、环庚基、环辛基等,但不限于此。
[0046]
本文所用的术语“烷氧基基团”、“烷氧基”或“烷基氧基”是指连接氧自由基的烷基,并且除非另有说明,具有1至60个碳原子,但不限于此。
[0047]
本文所用的术语“稀氧基基团”、“稀氧基”、“烯基氧基基团”或“烯基氧基”是指连接氧自由基的烯基,并且除非另有说明,具有2至60个碳原子,但不限于此。
[0048]
本文所用的术语“芳基氧基基团”或“芳氧基”是指连接氧自由基的芳基,并且除非
另有说明,具有6至60个碳原子,但不限于此。
[0049]
除非另有说明,本文所用的术语“芳基”和“亚芳基”各自具有6至60个碳原子,但不限于此。本文的芳基或亚芳基是指单环或多环芳族基团,并且包括与连接到其上或参与反应的相邻取代基结合形成的芳环。例如,芳基可以包括苯基、联苯基及三联苯基作为单环芳族基团,但不限于此。芳基可以包括萘基、蒽基、菲基、芘基、苝基、基、芴基及螺芴基作为多环芳族基团,但不限于此。
[0050]
在本说明书中,芴基可以被取代,并且两个取代基可以彼此结合以形成螺线结构。当芴基被取代时,其可以具有下述结构,但不限于此。
[0051][0052]
前缀“芳基”或“芳(ar)”是指被芳基取代的基团。例如,芳基烷基是被芳基取代的烷基,芳基烯基是被芳基取代的烯基,并且被芳基取代的基团具有如本说明书所定义的碳原子数。
[0053]
此外,当前缀被随后命名时,其表示取代基以首先描述的顺序列出。例如,芳基烷氧基是指被芳基取代的烷氧基,烷氧基羰基是指被烷氧基取代的羰基,芳基羰基烯基也指被芳基羰基取代的烯基,其中芳基羰基是被芳基取代的羰基。
[0054]
除非另有说明,本文所用的术语“杂芳基”或“杂亚芳基”是指各自含有一个或多个杂原子且具有2至60个碳原子的芳基或亚芳基,但不限于此,包括单环和多环中的至少一个,并且还可以与相邻基团结合形成。
[0055]
除非另有说明,本文所用的术语“杂环基”含有一个或多个杂原子,具有2至60个碳原子,包括单环和多环中的至少一个,并且包括杂脂族环和杂芳族环,还可以与相邻基团结合形成。除非另有说明,术语“杂原子”表示n、o、s、p或si。另外,“杂环基”还可以包括含有so
2
取代形成环的碳的环。
[0056]
杂环基的实例包括噻吩基、呋喃基、吡咯基、咪唑基、噻唑基、恶唑基、恶二唑基、三唑基、吡啶基、联吡啶基、嘧啶基、三嗪基、三唑基、吖啶基、哒嗪基、吡嗪基、喹啉基、喹唑啉基、喹喔啉基、酞嗪基、吡啶基嘧啶基、吡啶基吡嗪基、吡嗪并吡嗪基、异喹啉基、吲哚基、咔唑基、苯并恶唑基、苯并咪唑基、苯并噻唑基、苯并咔唑基、苯并噻吩基、二苯并噻吩基、苯并呋喃基、菲咯啉(phenanthroline)基、噻唑基、异恶唑基、恶二唑基、噻二唑基、苯并噻唑基、吩噻嗪基及二苯并呋喃基,但不限于此。
[0057]
除非另有说明,本文所用的术语“脂族”是指具有1至60个碳原子的脂族烃,本文所用的术语“脂族环”是指具有3至60个碳原子的脂族烃环。
[0058]
除非另有说明,本文所用的术语“环”是指具有3至60个碳原子的脂族环、具有6至60个碳原子的芳环、具有2至60个碳原子的杂环或由它们的组合形成的稠合的环,并且包括饱和或不饱和的环。
[0059]
除了上述杂化合物之外的杂化合物或杂基团各自包含一个或多个杂原子,但不限于此。
[0060]
除非另有说明,本文所用的术语“羰基”由-cor'表示,其中r'是氢、具有1至20个碳
原子的烷基、具有6至30个碳原子的芳基、具有3至30个碳原子的环烷基、具有2至20个碳原子数的烯基、具有2至20个碳原子数的炔基或它们的组合。
[0061]
除非另有说明,本文所用的术语“醚”由-r-o-r'表示,其中r或r
’
各自独立地位氢、具有1至20个碳原子的烷基、具有6至30个碳原子的芳基、具有3至30个碳原子的环烷基、具有2至20个碳原子的烯基、具有2至20个碳原子的炔基或它们的组合。
[0062]
并且,除非另有明确说明,本文所用的术语“取代或未取代”中的“取代”是指通过至少一个取代基进行取代,所述取代基选自由氘、卤素、氨基、腈基、硝基、c
1
~c
20
烷基、c
1
~c
20
烷氧基、c
1
~c
20
烷基胺基、c
1
~c
20
烷基硫基、c
6
~c
20
芳基硫基、c
2
~c
20
烯基、c
2
~c
20
炔基、c
3
~c
20
环烷基、c
6
~c
20
芳基、被氘取代的c
6
~c
20
芳基、c
8
~c
20
芳基烯基、硅烷基、硼基、锗基及c
2
~c
20
杂环基组成的组中,但本发明不限于上述取代基。
[0063]
除非另有明确说明,本发明中使用的化学式定义为下述化学式的取代基的索引定义(index definition)。
[0064][0065]
其中,当a是整数0时,取代基r
1
不存在,当a是整数1时,作为一个取代基的r
1
与构成苯环的碳原子中的任何一个碳原子连接,当a是整数2或3时,各自如下连接,其中,取代基r
1
可以相同和不同,当a是4至6的整数时,以与上述类似的方式连接到苯环的碳原子上,而连接到构成苯环的碳原子上的氢原子省略表示。
[0066][0067]
图1为本发明的一实施例的有机电致发光器件的示意性截面图。
[0068]
如图1所示,根据本发明的有机电致发光器件1包括形成在基板上的第一电极10、第二电极20及形成在第一电极10和第二电极20之间的有机材料层30,有机材料层30包括由上述化学式1表示的化合物。第一电极10可以是阳极(正极),第二电极20可以是阴极(负极),在反向有机电致发光器件的情况下,第一电极可以是阴极,第二电极可以是阳极。
[0069]
作为阳极材料,具有大功函的材料是优选的,以使得向有机材料层顺利注入空穴。可用于本发明的阳极材料的具体实例包括如钒、铬、铜、锌及金等的金属或其合金;如氧化锌、氧化铟、氧化铟锡(ito)及氧化铟锌(izo)等的金属氧化物;如zno:al或sno
2
:sb等的金属和氧化物的组合;如聚(3-甲基噻吩)、聚[3、4-(乙烯-1,2-二氧基)噻吩](pedot)、聚吡咯及聚苯胺等的导电聚合物等,但不限于此。
[0070]
作为阴极材料,具有小功函的材料是优选的,以使得向有机材料层顺利注入电子。阴极材料的具体实例包括如镁、钙、钠、钾、钛、铟、钇、锂、钆、铝、银、锡及铅等的金属或其合金;如lif/al或lio
2
/al等的多层结构材料,但不限于此。
[0071]
有机材料层30可以从第一电极10上依次包括空穴注入层310、空穴传输层320、发
光层350、电子传输层370及电子注入层380。其中,可以不形成除了发光层350之外的剩余层中至少一部分。在有机材料层中,形成在第一电极10与发光层350之间的层构成空穴传输区域,形成在发光层350和第二电极20之间的层构成电子传输区域。
[0072]
空穴注入层310为用于容易注入来自第一电极10的空穴的层,且空穴注入材料优选为来自阳极的空穴注入效果和薄膜形成能力优异的化合物。为此,空穴注入材料的最高占据分子轨道(highest occupied molecular orbital,homo)优选介于阳极材料的功函数和周围有机材料层的homo之间。空穴注入材料的具体实例包括金属卟啉(porphyrin)、低聚噻吩、芳胺基有机材料、六腈六氮杂三亚苯基有机材料、喹吖啶酮(quinacridone)基有机材料、苝(perylene)基有机材料、蒽醌基及聚苯胺基和聚噻吩基导电聚合物等,但不限于此。
[0073]
空穴传输层320为用于接收来自空穴注入层310的空穴并将该空穴传输至发光层350的层,作为空穴传输材料,具有高空穴迀移率的材料是合适的。其具体实例包括芳胺基有机材料、导电聚合物及同时具有共辄部分和非共辄部分的嵌段共聚物等,但不限于此。
[0074]
发光层350是通过分别从空穴传输层320和电子传输层370接受空穴和电子并使空穴和电子结合而在可见光区内发光的层,发光材料优选为对焚光或磷光具有高量子效率的材料。其具体实例包括8-羟基喹啉铝络合物(alq
3
);咔唑基化合物;二聚苯乙烯(dimerized styryl)化合物;balq;10-羟基苯并喹啉金属化合物;基于苯并恶唑、苯并噻唑及苯并咪唑的化合物;基于聚(对亚苯基亚乙烯基)(ppv)的聚合物;螺环(spiro)化合物;聚芴、红荧烯等,但不限于此。
[0075]
发光层350可包含主体材料和掺杂材料。主体材料包括稠合的芳环衍生物或含杂环的化合物等。具体而言,稠合芳环衍生物包括蒽衍生物、芘衍生物、萘衍生物、并五苯衍生物、菲化合物、荧蒽化合物等,且含杂环的化合物包括咔唑衍生物、二苯并咲喃衍生物、梯型(ladder-type)咲喃化合物、啼啶衍生物等,但不限于此。
[0076]
掺杂材料包括芳族胺衍生物、苯乙烯胺化合物、硼络合物、荧蒽化合物、金属络合物等。具体而言,芳族胺衍生物的实例包括含芳基氨基的芘、蒽、及二茚并芘等作为含有取代或未取代的芳基氨基的稠合芳环衍生物,且苯乙烯胺化合物的实例包括如下化合物:其中取代或未取代的芳基胺被至少一个芳基乙烯基取代,且被选自由芳基、甲硅烷基、烷基、环烷基及芳基氨基组成的组中的一个或两个以上的取代基取代或未取代。具体而言,苯乙烯胺化合物的实例包括苯乙烯胺、苯乙烯二胺、苯乙烯三胺、苯乙烯四胺等,但不限于此。此外,金属络合物的实例包括铱络合物、铂络合物等,但不限于此。
[0077]
电子传输层370为用于接收来自电子注入层380的电子并将该电子传输至发光层350的层,作为电子传输材料,具有高电子迀移率的材料是合适的。其具体实例包括8-羟基喹啉的铝络合物;含alq
3
的络合物;有机自由基化合物;羟基黄酮金属络合物等,但不限于此。本发明的由化学式1表示的化合物可以用作电子传输材料,下面将对此进行描述。
[0078]
电子注入层380为用于容易注入来自第二电极20的电子的层,且电子注入材料优选为具有电子传输能力、优异的来自阴极的电子注入效果和薄膜形成能力的化合物。其具体实例包括荷酮、蒽醌二甲烷、联苯醌酮、噻喃二氧化物、噁挫、噁二挫、三唑、咪唑、花四羧酸、亚芴基甲烷、蒽酮等及其衍生物、金属络合物及含氮五元环衍生物等,但不限于此。金属络合物的实例包括8-羟基喹啉锂、双(8-羟基喹啉)锌、双(8-羟基喹啉)铜、双(8-羟基喹啉)锰、三(8-羟基喹啉)铝、三(2-甲基-8-羟基喹啉)铝、三(8-羟基喹啉)镓、双(10-羟基苯并
[h]喹啉)铍、双(10-羟基苯并[h]喹啉)锌、双(2-甲基-8-喹啉)氯化镓、双(2-甲基-8-喹啉)(邻-甲酸)镓、双(2-甲基-8-喹啉)(1-萘酸)铝、双(2-甲基-8-喹啉)(2-萘酸)镓等,但不限于此。
[0079]
有机材料层30在空穴传输层320和发光层350之间还可包括空穴传输辅助层330,且在电子传输层370和发光层350之间还可包括电子传输辅助层360。
[0080]
空穴传输辅助层330和电子传输辅助层360是防止在发光层350中产生的激子扩散到与发光层350相邻的电子传输层370或空穴传输层320的层,从而,在发光层中参与发光的激子的数量增加,引起器件的发光效率可以得到改善,且可以降低驱动电压,还可以提高器件的耐久性和稳定性,从而可以有效地延长器件的寿命。本发明的由化学式1表示的化合物可以优选用作电子传输辅助层的材料。
[0081]
有机材料层30在空穴传输辅助层330和发光层350之间可以进一步包括发光辅助层(图中未示出),并且在电子传输辅助层360和发光层350之间可以进一步包括寿命改善层(图中未示出)。
[0082]
发光辅助层可以用于将空穴传输至发光层350并调节有机层30的厚度。发光辅助层可以包括空穴传输材料,并且可以由与空穴传输层320相同的材料制成。
[0083]
寿命改善层通过防止传输到发光层350的空穴扩散或移动到电子传输层370而执行将空穴限制在发光层的功能。电子传输层370通过还原来使电子移动,当空穴扩散到电子传输层中时,由于氧化而发生不可逆分解反应,导致寿命降低。因此,通过提供抑制空穴扩散到电子传输层370的寿命改善层,可以有助于改善有机发光器件的寿命。
[0084]
并且,尽管未示出,根据本发明的有机电致发光器件还可以包括形成在第一电极10和第二电极20的至少一面中与上述有机材料层相反的一面上的保护层或光效率改善层(capping layer,覆盖层)。
[0085]
在本说明书中,以根据本发明的化合物用于如电子传输层370、电子传输辅助层360等的电子传输区域中的实施例为中心进行说明,但本发明不限于此,根据本发明的化合物也可以用作发光层350的主体(尤其,n型主体)材料。
[0086]
根据本发明的一实施例的有机电致发光器件1可以使用真空蒸发法制造。例如,可以在真空室中通过有机材料的蒸发将包括空穴注入层310、空穴传输层320、发光层350、电子传输层370及电子注入层380的有机材料层形成在形成有阳极10的基板上,然后在其上沉积可用作阴极20的材料来制造上述有机电致发光器件。
[0087]
并且,有机材料层可以如下方式制造,即,使用各种聚合物材料来通过溶液工艺或溶剂工艺(solvent process)形成较少数量的层,所述工艺例如为旋涂工艺、喷嘴印刷工艺、喷墨印刷工艺、条缝涂布工艺、浸涂工艺、卷对卷工艺、刮刀涂布工艺、丝网印刷工艺或热转印法等,而不是沉积法。由于根据本发明的有机材料层可以以各种方式形成,但本发明的保护范围不受形成有机材料层的方法的限制。
[0088]
根据使用的材料,根据本发明的有机电致发光器件可以是顶部发射型、底部发射型或双发射型。
[0089]
白色有机发光器件(white organic light emitting device,woled)具有如下优点,即,容易实现高清晰度,具有优异的可加工性,且可使用用于lcd的现有滤色器技术制造。白色有机电致发光器件的各种结构已经被提出。具代表性的结构包括将r(红色)、g(绿
色)、b(蓝色)发光部相互平面地并排布置(side-by-side)的方式、将r、g、b发光层垂直堆叠的堆叠(stacking)方式及利用来自蓝色(b)有机发光层的电致发光和来自使用电致发光的无机荧光体的自光致发光(photo-luminescence)的颜色转换材料(color conversion material,ccm)方式等,本发明可适用于这些woled。
[0090]
本发明的另一实施例可以包括一种电子器件,其包括具有上述本发明的有机电致发光器件的显示装置和用于控制该显示装置的控制单元。其中,电子器件可以是当前正在使用或将来将使用的有线无线通信终端,并且包括如手机等的移动通信终端、个人数字助理(personal digital assistant,pda)、电子词典、个人多媒体播放器(personal multimedia player,pmp)、遥控器、导航单元、游戏机、各种tv和各种计算机等所有电子器件。
[0091]
下面将说明根据本发明的一个方面的化合物。
[0092]
根据本发明的一个方面,提供由下述化学式1表示的化合物。
[0093]
[化学式1]
[0094][0095]
其中,a
1
为由下述化学式2表示的基团,
[0096]
[化学式2]
[0097][0098]
y为o或s,
[0099]
a
11
和a
12
各自独立地选自苯、萘、吡啶、嘧啶、吡嗪、哒嗪、1,2,3-三嗪、喹啉、异喹啉、2,6-萘啶(naphthyridine)、1,8-萘啶、1,5-萘啶、1,6-萘啶、1,7-萘啶、2,7-萘啶、噌啉、喹喔啉、酞嗪、喹唑啉及吩嗪中;
[0100]
a
11
和a
12
中的至少一个是含有氮(n)的芳香族杂环化合物,
[0101]
l为直接键;取代或未取代的亚芳基;取代或未取代的杂亚芳基;或取代或未取代的c
9
~c
60
稠合多环基,
[0102]
a
2
为氢;氘;卤素基;腈基;硝基;羟基;羰基;酯基;酰亚胺基;氨基;取代或未取代的甲硅烷基;取代或未取代的硼基;取代或未取代的烷基;取代或未取代的烷基硫氧基;取代或未取代的芳硫氧基;取代或未取代的烯基;取代或未取代的芳烷基;取代或未取代的芳烯基;取代或未取代的烷基芳基;取代或未取代的烷基胺基;取代或未取代的芳烷基胺基;取代或未取代的杂芳基胺基;取代或未取代的芳胺基;取代或未取代的芳基膦基;取代或未取代的氧化膦基;取代或未取代的芳基;或取代或未取代的杂环基,
[0103]
l或a
2
键合到a
1
的碳位置。
[0104]
根据本发明的优选实施例,a
11
和a
12
中的一个选自1,5-萘啶、1,6-萘啶、1,7-萘啶、1,8-萘啶及喹喔啉中。
[0105]
根据本发明的优选实施例,a
1
由下述结构中的一种表示。
[0106][0107]
根据本发明的优选实施例,l可以具有下述结构,l
1
~l
3
可以各自独立地选自直接键;取代或未取代的亚芳基;取代或未取代的杂亚芳基;或取代或未取代的c
9
~c
60
稠合多环基。
[0108]-l
1-l
2-l
3-[0109]
根据本发明的优选实施例,a
2
为选自以下结构中的一种。
[0110][0111]
其中,x
1
~x
3
各自独立地为c或n,x
1
~x
3
中的至少一个为n,ar
1
和ar
2
各自独立地为氢、氘、卤素基、氰基、取代或未取代的c
1
~c
60
烷基、取代或未取代的c
3
~c
10
环烷基、取代或未取代的c
6
~c
60
芳基或取代或未取代的c
1
~c
60
杂芳基。
[0112]
本发明的由化学式1表示的化合物可以由下述化合物中的一种表示,但本发明不限于此。
[0113]
[0114]
[0115]
[0116]
[0117]
[0118]
[0119]
[0120]
[0121]
[0122]
[0123]
[0124]
[0125]
[0126]
[0127]
[0128]
[0129]
[0130]
[0131]
[0132]
[0133]
[0134]
[0135]
[0136]
[0137]
[0138]
[0139]
[0140]
[0141]
[0142]
[0143]
[0144]
[0145]
[0146][0147]
根据本发明的另一方面,提供一种有机电致发光器件,其特征在于,包括:第一电极;第二电极,与上述第一电极相对;及有机层,介于上述第一电极与上述第二电极之间,上述有机层包括上述化学式1的化合物。
[0148]
并且,在上述有机电致发光器件中,上述第一电极为阳极,上述第二电极为阴极,上述有机层包括:i)发光层;ii)空穴输送区域,介于上述第一电极与上述发光层之间,且包括空穴注入层、空穴传输层及空穴传输辅助层中的至少一种;及iii)电子输送区域,介于上述发光层与上述第二电极之间,且包括电子传输辅助层、电子传输层及电子注入层中的至少一种,上述电子输送区域包括上述化学式1的化合物。
[0149]
并且,在上述有机电致发光器件中,上述电子传输层或上述电子传输辅助层包括上述化学式1的化合物。
[0150]
根据本发明的再一方面,提供一种显示装置,其特征在于,包括上述有机电致发光器件,上述有机电致发光器件的第一电极与薄膜晶体管的源极或漏极电连接。
[0151]
下面,将通过实施例对根据本发明的由化学式1表示的化合物的合成例和有机电子器件的制造例进行具体说明,但本发明并不限于下述实施例。
[0152]
[中间产物的合成方法和fdms数据]
[0153]
(1)用于核1-1至核1-13的中间体的合成
[0154]
可以通过下述合成方法合成用于核1-4的中间体。
[0155][0156]
将3-氯苯并[b]噻吩-2-羰基氯(3-chlorobenzo[b]thiophene-2-carbonyl chloride)(1)(15.2g,65.8mmol)和2-氨基吡啶(6.2g,65.8mmol)溶于苯中,添加三乙胺(triethylamine)(9.4ml,67.8mmol),回流搅拌1小时。当反应结束时,减压除去苯,用m.c和水进行萃取,用mgso
4
干燥并浓缩,然后将所产生的有机物用乙醇重结晶,从而获得15.2g的产物即3-氯-n-(吡啶-2-基)苯并[b]噻吩-2-羧酰胺(3-chloro-n-(pyridin-2-yl)benzo[b]thiophene-2-carboxamide)(收率:80%)。
[0157][0158]
将3-氯-n-(吡啶-2-基)苯并[b]噻吩-2-羧酰胺(12.9g,44.6mmol)溶于苯中并搅拌,添加三乙胺(4.7g,4.64mmol),然后照射450瓦高压汞灯10小时。当反应结束时,通过减压蒸馏除去苯,将固体用水洗涤几次,然后干燥,从而获得9.4g的产物即苯并噻吩并[2,3-c][1,8]萘啶-6(5h)-酮(benzothieno[2,3-c][1,8]naphthyridin-6(5h)-one)(收率:83%)。
[0159][0160]
在苯并噻吩并[2,3-c][1,8]萘啶-6(5h)-酮(10.0g,39.6mmol)中添加氯氧化磷(phosphorus oxychloride),回流搅拌4小时。当反应结束时,通过减压蒸馏除去氯氧化磷,加冰水搅拌。滴加氢氧化铵(ammonium hydroxide)以碱化至ph9。将所产生的棕色固体过滤,用水洗涤几次,然后用苯重结晶,从而获得7.8g的用于核1-4的中间体即6-氯苯并[4,5]噻吩并[2,3-c][1,8]萘啶(6-chlorobenzo[4,5]thieno[2,3-c][1,8]naphthyridine)(收率:73%)。
[0161]
可以根据下述反应式并通过与合成用于核1-4的中间体的方法相同的方法合成用于核1-2的中间体。
[0162][0163]
作为用于核1-1和核1-3的中间体,将通过与用于核1-4的中间体的合成方法相同的方法进行处理而获得的化合物用m.c/甲醇硅胶柱色谱法纯化,从而以20%的收率获得用于核1-1的中间体,以70%的收率获得用于核1-3的中间体。
[0164][0165]
可以通过如下反应合成用于核1-5的中间体。
[0166][0167]
将1-氯-4-异硫氰酸根合苯(1-chloro-4-isothiocyanatobenzene)(15g,88.43mmol)溶于吡啶中,搅拌并冷却至-20℃后,滴加2-氰基苯重氮四氟硼酸盐(2-cyanobenzenediazonium tetrafluoroborate)(21.1g,97.27mmol)1小时。此时,温度保持
在-20℃。当反应结束时,将温度升至室温并减压除去吡啶,用二氯甲烷进行重结晶,然后过滤除去异硫氰酸根合苯,并用水洗涤几次。通过m.c和甲醇硅胶柱色谱法纯化所得到的有机物,从而获得9-氯苯并[4,5]噻吩并[2,3-b]喹喔啉(9-chlorobenzo[4,5]thieno[2,3-b]quinoxaline)(15g,62%)。
[0168]
可以通过如下反应合成用于核1-6的中间体。
[0169][0170]
也就是说,将异硫氰酸根合苯(16.1g,119.4mmol)溶于吡啶中并搅拌,冷却至-20℃,滴加四氟硼酸盐(10g,39.8mmol)1小时。此时,温度保持在-20℃。当反应结束时,将温度升至室温并减压除去吡啶,用二氯甲烷进行重结晶,然后过滤除去异硫氰酸根合苯,并用水洗涤几次。通过m.c和甲醇硅胶柱色谱法纯化所得到的有机物,从而获得6.46g的3-氯苯并[4,5]噻吩并[2,3-b]喹喔啉(3-chlorobenzo[4,5]thieno[2,3-b]quinoxaline)(收率:60%)。
[0171]
可以通过如下反应式合成用于核1-13的中间体。
[0172][0173]
将3-氨基-2-氨基甲酰基噻吩并[2,3-b]喹喔啉(3-amino-2-carbamoyl thieno[2,3-b]quinoxaline)(2.44g,10mmol)和35%hcl混合并搅拌,然后在-5℃下乙酸(10ml)中混合氮化钠(20ml),逐滴添加并搅拌1小时。当反应结束时,将固体过滤并在乙酸中重结晶,从而获得2.08g的[1,2,3]三嗪[4',5':4,5]噻吩并[2,3-b]喹喔啉-4(3h)-酮([1,2,3]triazino[4',5':4,5]thieno[2,3-b]quinoxalin-4(3h)-one)(收率:80%)。
[0174][0175]
将1,2,3-三嗪[4',5':4,5]噻吩并吡[2,3-b]喹喔啉-4(3h)酮(1,2,3-triazino[4',5':4,5]thieno[2,3-&]quinoxalin-4(3h_)one)(5.10g,20.0mmol)溶解于三氯氧磷(phosphorous oxychloride)(30ml)中,然后回流搅拌3小时。当反应结束时,将温度冷却至室温,通过减压蒸馏除去三氯氧磷,并添加冰水。将所产生的黄色固体过滤,用水洗涤几次,干燥,并用乙醇进行重结晶,从而获得4g的4-氯-[1,2,3]三嗪[4',5':4,5]噻吩并[2,3-b]喹喔啉(4-chloro-[1,2,3]triazino[4',5':4,5]thieno[2,3-b]quinoxaline)(收率:72%)。
[0176]
可以根据如下反应式合成用于核1-11和核1-12的中间体。
[0177][0178]
表1
[0179][0180]
(2)用于核2-1至核2-13的中间体的合成
[0181]
可以根据如下反应式合成用于核2-10的中间体。
[0182][0183]
将2,3-二氯喹喔啉(2,3-dichloroquinoxaline)(5.1g,25.6mmol,1.0当量)和6-溴萘-2-醇(6-bromonaphthalen-2-ol)(5.7g,25.6mmol,1当量)溶于1,2-二氯乙烷(1,2-dichloroethane)中,并添加alcl
3
(1.0当量),在80℃下回流搅拌30分钟,冷却至室温,再次添加alcl
3
(1.0当量),再在80℃下回流搅拌30分钟。用m.c和水萃取后,将其浓缩,并将所产生的有机物经过硅胶柱并重结晶,从而获得7.2g的3-溴萘并[1',2':4,5]呋喃[2,3-b]喹喔啉(3-bromonaphtho[1',2':4,5]furo[2,3-b]quinoxaline)(收率:81%)。
[0184]
与此相同地,可以根据如下反应式合成用于核2-3、核2-5及核2-11的中间体。
[0185][0186]
可以通过如下合成方法合成用于核2-9的中间体。
[0187][0188]
将二苯并[b,d]呋喃-4-胺(dibenzo[b,d]furan-4-amine)(32g,174.66mmol)溶于2,5-二氯硝基苯(36g,187.5mmol)中,然后添加乙酸钠(sodium acetate)(30g,365.72mmol)并在210℃下回流搅拌4小时。当反应结束时,通过减压蒸馏除去2,5-二氯硝基苯,并用m.c和水萃取。浓缩有机层,并用m甲醇重结晶,从而获得47.5g的n-(5-氯-2-硝基苯基)二苯并[b,d]呋喃-4-胺(n-(5-chloro-2-nitrophenyl)dibenzo[b,d]furan-4-amine)(收率:80%)。
[0189][0190]
在n-(5-氯-2-硝基苯基)二苯并[b,d]呋喃-4-胺(5g,14.76mmol)中添加草酸亚铁二水合物(ferrous oxalate dihydrate)(6.5g,36.13mmol)和50g的颗粒状铅(granulated lead),在270℃下回流搅拌15分钟。当反应结束时,通过升华纯化分离化合物,然后用苯进行重结晶,从而获得2.4g的2-氯苯并呋喃[2,3-a]吩嗪(2-chlorobenzofuro[2,3-a]phenazine)(收率:54%)。
[0191]
与此相同地,可以根据如下反应式合成用于核2-7和核2-8的中间体。
[0192][0193]
可以通过如下合成方法合成用于核2-4的中间体。
[0194][0195]
将3-氨基吡啶甲酸乙酯(ethyl 3-aminopicolinate)(100g,602mmol)和邻甲氧基苯基乙酰氯(o-methoxyphenylacetyl chloride)(180g,974.6mmol)溶于吡啶(pyridine)中,并回流搅拌30分钟。当反应结束时,将反应混合物冷却至室温,并用水和氯仿(chloroform)萃取。将所得橙色层用水洗涤并用mgso
4
干燥。将干燥的化合物浓缩,然后进行硅胶柱色谱和重结晶,得到3-(2-(2-甲氧基苯基)乙酰胺基)吡啶甲酸乙酯(ethyl 3-(2-(2-methoxyphenyl)acetamido)picolinate)(142g,75%)。
[0196]
将3-(2-(2-甲氧基苯基)乙酰胺基)吡啶甲酸乙酯(140g,462.2mmol)和乙醇钠(无水乙醇和30g na金属)溶于苯中,并回流搅拌5小时。当反应结束时,将其冷却至室温,然后通过添加水和乙酸进行中和。将沉淀物用乙酸和乙醇重结晶,得到无色的4-羟基-3-(2-甲氧基苯基)-1,5-萘啶-2(1h)-酮(4-hydroxy-3-(2-methoxyphenyl)-1,5-naphthyridin-2(1h)-one)(87.2g,73%)。
[0197]
在4-羟基-3-(2-甲氧基苯基)-1,5-萘啶-2(1h)-酮(80g,280mmol)中添加过量的磷酰氯(phosphoryl chloride),并回流搅拌6小时。当反应结束时,冷却,然后添加水和氨
三嗪(10.0g,21.53mmol),然后添加双(频哪醇)二硼(9.14g,32.3mmol)、pd(dppf)cl
2
(1.24g,1.69mmol)(0.03当量)及koac(23.34g,168.9mmol),在130℃下回流搅拌4小时。当反应结束时,通过蒸馏除去dmf,并用ch
2
cl
2
和水萃取。将有机层以mgso
4
干燥及浓缩,将所得化合物经过硅胶柱并重结晶,从而得到2-([1,1'-联苯]-4-基)-4-苯基-6-(3-(4,4,5,5-四甲基-1,3,2-二氧杂硼烷-2-基)苯基)-1,3,5-三嗪(2-([1,1'-biphenyl]-4-yl)-4-phenyl-6-(3-(4,4,5,5-tetramethyl-1,3,2-dioxaborolan-2-yl)phenyl)-1,3,5-triazine)(7g,63.55%)。
[0212][0213]
将2-([1,1'-联苯]-4-基)-4-苯基-6-(4-(4,4,5,5-四甲基-1,3,2-二氧杂硼烷-2-基)苯基)-1,3,5-三嗪(20g,39.11mmol)溶于thf中,然后添加1-溴-4-碘苯(13.28g,46.93mmol)、pd(pph
3
)
4
(1.95g,1.69mmol)、k
2
co
3
(23.34g,168.9mmol)及水,并在100℃下回流搅拌3小时。当反应结束时,以e.a和水萃取,将有机层以mgso
4
干燥及浓缩,通过硅胶柱分离和纯化所得有机物,从而得到2-([1,1'-联苯]-4-基)-4-(4'-溴-[1,1'-联苯]-4-基)-6-苯基-1,3,5-三嗪(2-([1,1'-biphenyl]-4-yl)-4-(4'-bromo-[1,1'-biphenyl]-4-yl)-6-phenyl-1,3,5-triazine)(14g,66.24%))。
[0214][0215]
在圆底烧瓶中用dmf溶解2-([1,1'-联苯]-4-基)-4-(4'-溴-[1,1'-联苯]-4-基)-6-苯基-1,3,5-三嗪(10.0g,18.5mmol),然后添加双(频哪醇)二硼(7.05g,27.75mmol)、pd(dppf)cl
2
(1.24g,1.69mmol)(0.03当量)及koac(23.34g,168.9mmol),在130℃下回流搅拌4小时。当反应结束时,通过蒸馏除去dmf,并用ch
2
cl
2
和水萃取。将有机层以mgso
4
干燥及浓缩,将所得化合物经过硅胶柱并重结晶,从而得到2-([1,1'-联苯]-4-基)-4-苯基-6-(4'-(4,4,5,5-四甲基-1,3,2-二氧杂硼烷-2-基)-[1,1'-联苯]-4-基)-1,3,5-三嗪(2-([1,1'-biphenyl]-4-yl)-4-phenyl-6-(4'-(4,4,5,5-tetramethyl-1,3,2-dioxaborolan-2-yl)-[1,1'-biphenyl]-4-yl)-1,3,5-triazine(7g,64.39%)。
[0216][0217]
将2-([1,1'-联苯]-4-基)-4-苯基-6-(4-(4,4,5,5-四甲基-1,3,2-二氧杂硼烷-2-基)苯基)-1,3,5-三嗪(20g,39.11mmol)溶于thf中,然后添加1-溴-3-碘苯(16.6g,58.66mmol)、pd(pph
3
)
4
(1.95g,1.69mmol)、k
2
co
3
(23.34g,168.9mmol)及水,并在100℃下回流搅拌3小时。当反应结束时,以e.a和水萃取,将有机层以mgso
4
干燥及浓缩,通过硅胶柱分离和纯化所得有机物,从而得到2-([1,1'-联苯]-4-基)-4-(3'-溴-[1,1'-联苯]-4-基)-6-苯基-1,3,5-三嗪(2-([1,1'-biphenyl]-4-yl)-4-(3'-bromo-[1,1'-biphenyl]-4-yl)-6-phenyl-1,3,5-triazine)(14g,66.24%)。
[0218][0219]
在圆底烧瓶中用dmf溶解2-([1,1'-联苯]-4-基)-4-(3'-溴-[1,1'-联苯]-4-基)-6-苯基-1,3,5-三嗪(10.0g,18.5mmol),然后添加双(频哪醇)二硼(5.64g,22.2mmol)、pd(dppf)cl
2
(1.24g,1.69mmol)(0.03当量)及koac(23.34g,168.9mmol),在130℃下回流搅拌4小时。当反应结束时,通过蒸馏除去dmf,并用ch
2
cl
2
和水萃取。将有机层以mgso
4
干燥及浓缩,将所得化合物经过硅胶柱并重结晶,从而得到2-([1,1'-联苯]-4-基)-4-苯基-6-(3'-(4,4,5,5-四甲基-1,3,2-二氧杂硼烷-2-基)-[1,1'-联苯]-4-基)-1,3,5-三嗪(2-([1,1'-biphenyl]-4-yl)-4-phenyl-6-(3'-(4,4,5,5-tetramethyl-1,3,2-dioxaborolan-2-yl)-[1,1'-biphenyl]-4-yl)-1,3,5-triazine)(7g,64.39%)。
[0220][0221]
将2-([1,1'-联苯]-4-基)-4-苯基-6-(3-(4,4,5,5-四甲基-1,3,2-二氧杂硼烷-2-基)苯基-1,3,5-三嗪(20g,39.11mmol)溶于thf中,然后添加1-溴-4-碘苯(13.28g,
46.93mmol)、pd(pph
3
)
4
(1.95g,1.69mmol)、k
2
co
3
(23.34g,168.9mmol)及水,并在100℃下回流搅拌3小时。当反应结束时,以e.a和水萃取,将有机层以mgso
4
干燥及浓缩,通过硅胶柱分离和纯化所得有机物,从而得到2-([1,1'-联苯]-4-基)-4-(4'-溴-[1,1'-联苯]-3-基)-6-苯基-1,3,5-三嗪(2-([1,1'-biphenyl]-4-yl)-4-(4'-bromo-[1,1'-biphenyl]-3-yl)-6-phenyl-1,3,5-triazine)(15g,70.97%)。
[0222][0223]
在圆底烧瓶中用dmf溶解2-([1,1'-联苯]-4-基)-4-(4'-溴-[1,1'-联苯]-3-基)-6-苯基-1,3,5-三嗪(10.0g,18.50mmol),然后添加双(频哪醇)二硼(7.05g,27.75mmol)、pd(dppf)cl
2
(1.24g,1.69mmol)(0.03当量)及koac(23.34g,168.9mmol),在130℃下回流搅拌4小时。当反应结束时,通过蒸馏除去dmf,并用ch
2
cl
2
和水萃取。将有机层以mgso
4
干燥及浓缩,将所得化合物经过硅胶柱并重结晶,从而得到2-([1,1'-联苯]-4-基)-4-苯基-6-(4'-(4,4,5,5-四甲基-1,3,2-二氧杂硼烷-2-基)-[1,1'-联苯]-3-基)-1,3,5-三嗪(2-([1,1'-biphenyl]-4-yl)-4-phenyl-6-(4'-(4,4,5,5-tetramethyl-1,3,2-dioxaborolan-2-yl)-[1,1'-biphenyl]-3-yl)-1,3,5-triazine)(8g,73.59%)。
[0224][0225]
将2-([1,1'-联苯]-4-基)-4-苯基-6-(3-(4,4,5,5-四甲基-1,3,2-二氧杂硼烷-2-基)苯基)-1,3,5-三嗪(20g,39.11mmol)溶于thf中,然后添加1-溴-3-碘苯(13.28g,46.93mmol)、pd(pph
3
)
4
(1.95g,1.69mmol)、k
2
co
3
(23.34g,168.9mmol)及水,并在100℃下回流搅拌3小时。当反应结束时,以e.a和水萃取,将有机层以mgso
4
干燥及浓缩,通过硅胶柱分离和纯化所得有机物,从而得到2-([1,1'-联苯]-4-基)-4-(3'-溴-[1,1'-联苯]-3-基)-6-苯基-1,3,5-三嗪(2-([1,1'-biphenyl]-4-yl)-4-(3'-bromo-[1,1'-biphenyl]-3-yl)-6-phenyl-1,3,5-triazine)(13g,61.51%)。
[0226][0227]
在圆底烧瓶中用dmf溶解2-([1,1'-联苯]-4-基)-4-(3'-溴-[1,1'-联苯]-3-基)-6-苯基-1,3,5-三嗪(10.0g,18.50mmol),然后添加双(频哪醇)二硼(7.05g,27.75mmol)、pd(dppf)cl
2
(1.24g,1.69mmol)(0.03当量)及koac(23.34g,168.9mmol),在130℃下回流搅拌4小时。当反应结束时,通过蒸馏除去dmf,并用ch
2
cl
2
和水萃取。将有机层以mgso
4
干燥及浓缩,将所得化合物经过硅胶柱并重结晶,从而得到2-([1,1'-联苯]-4-基)-4-苯基-6-(3'-(4,4,5,5-四甲基-1,3,2-二氧杂硼烷-2-基)-[1,1'-联苯]-3-基)-1,3,5-三嗪(2-([1,1'-biphenyl]-4-yl)-4-phenyl-6-(3'-(4,4,5,5-tetramethyl-1,3,2-dioxaborolan-2-yl)-[1,1'-biphenyl]-3-yl)-1,3,5-triazine)(7g,64.39%)。
[0228][0229]
将2-([1,1'-联苯]-4-基)-4-苯基-6-(4'-(4,4,5,5-四甲基-1,3,2-二氧杂硼烷-2-基)-[1,1'-联苯]-4-基)-1,3,5-三嗪(20g,34.04mmol)溶于thf中,然后添加1-溴-4-碘苯(11.56g,40.85mmol)、pd(pph
3
)
4
(1.95g,1.69mmol)、k
2
co
3
(23.34g,168.9mmol)及水,并在100℃下回流搅拌3小时。当反应结束时,以e.a和水萃取,将有机层以mgso
4
干燥及浓缩,通过硅胶柱分离和纯化所得有机物,从而得到2-([1,1'-联苯]-4-基)-4-(4
”-
溴-[1,1':4',1
”-
三联苯]-4-基)-6-苯基-1,3,5-三嗪(2-([1,1'-biphenyl]-4-yl)-4-(4
”-
bromo-[1,1':4',1
”-
terphenyl]-4-yl)-6-phenyl-1,3,5-triazine)(13g,61.93%)。
[0230][0231]
在圆底烧瓶中用dmf溶解2-([1,1'-联苯]-4-基)-4-(4
”-
溴-[1,1':4',1
”-
三联苯]-4-基)-6-苯基-1,3,5-三嗪(10.0g,16.22mmol),然后添加双(频哪醇)二硼(6.18g,24.33mmol)、pd(dppf)cl
2
(1.24g,1.69mmol)(0.03当量)及koac(23.34g,168.9mmol),在130℃下回流搅拌4小时。当反应结束时,通过蒸馏除去dmf,并用ch
2
cl
2
和水萃取。将有机层以mgso
4
干燥及浓缩,将所得化合物经过硅胶柱并重结晶,从而得到2-([1,1'-联苯]-4-基)-4-苯基-6-(4
”-
(4,4,5,5-四甲基-1,3,2-二氧杂硼烷-2-基)-[1,1':4',1
”-
三联苯]-4-基)-1,3,5-三嗪(2-([1,1'-biphenyl]-4-yl)-4-phenyl-6-(4
”-
(4,4,5,5-tetramethyl-1,3,2-dioxaborolan-2-yl)-[1,1':4',1
”-
terphenyl]-4-yl)-1,3,5-triazine)(7g,65.03%)。
[0232][0233]
将2-([1,1'-联苯]-4-基)-4-苯基-6-(4'-(4,4,5,5-四甲基-1,3,2-二氧杂硼烷-2-基)-[1,1'-联苯]-4-基)-1,3,5-三嗪(20g,34.04mmol)溶于thf中,然后添加1-溴-3-碘苯(11.56g,40.85mmol)、pd(pph
3
)
4
(1.95g,1.69mmol)、k
2
co
3
(23.34g,168.9mmol)及水,并在100℃下回流搅拌3小时。当反应结束时,以e.a和水萃取,将有机层以mgso
4
干燥及浓缩,通过硅胶柱分离和纯化所得有机物,从而得到2-([1,1'-联苯]-4-基)-4-(3
”-
溴-[1,1':4',1
”-
三联苯]-4-基)-6-苯基-1,3,5-三嗪(2-([1,1'-biphenyl]-4-yl)-4-(3
”-
bromo-[1,1':4',1
”-
terphenyl]-4-yl)-6-phenyl-1,3,5-triazine)(14g,66.7%)。
[0234][0235]
在圆底烧瓶中用dmf溶解2-([1,1'-联苯]-4-基)-4-(3
”-
溴-[1,1':4',1
”-
三联苯]-4-基)-6-苯基-1,3,5-三嗪(10.0g,16.22mmol),然后添加双(频哪醇)二硼(6.18g,24.33mmol)、pd(dppf)cl
2
(1.24g,1.69mmol)(0.03当量)及koac(23.34g,168.9mmol),在130℃下回流搅拌4小时。当反应结束时,通过蒸馏除去dmf,并用ch
2
cl
2
和水萃取。将有机层以mgso
4
干燥及浓缩,将所得化合物经过硅胶柱并重结晶,从而得到2-([1,1'-联苯]-4-基)-4-苯基-6-(3
”-
(4,4,5,5-四甲基-1,3,2-二氧杂硼烷-2-基)-[1,1':4',1
”-
三联苯]-4-基)-1,3,5-三嗪(2-([1,1'-biphenyl]-4-yl)-4-phenyl-6-(3
”-
(4,4,5,5-tetramethyl-1,3,2-dioxaborolan-2-yl)-[1,1':4',1
”-
terphenyl]-4-yl)-1,3,5-triazine)(7g,65.03%)。
[0236][0237]
将2-([1,1'-联苯]-4-基)-4-苯基-6-(3'-(4,4,5,5-四甲基-1,3,2-二氧杂硼烷-2-基)-[1,1'-联苯]-4-基)-1,3,5-三嗪(20g,34.04mmol)溶于thf中,然后添加1-溴-4-碘苯(11.56g,40.85mmol)、pd(pph
3
)
4
(1.95g,1.69mmol)、k
2
co
3
(23.34g,168.9mmol)及水,并在100℃下回流搅拌3小时。当反应结束时,以e.a和水萃取,将有机层以mgso
4
干燥及浓缩,通过硅胶柱分离和纯化所得有机物,从而得到2-([1,1'-联苯]-4-基)-4-(4
”-
溴-[1,1':3',1
”-
三联苯]-4-基)-6-苯基-1,3,5-三嗪(2-([1,1'-biphenyl]-4-yl)-4-(4
”-
bromo-[1,1':3',1
”-
terphenyl]-4-yl)-6-phenyl-1,3,5-triazine)(14g,66.7%)。
[0238][0239]
在圆底烧瓶中用dmf溶解2-([1,1'-联苯]-4-基)-4-(4
”-
溴-[1,1':3',1
”-
三联
苯]-4-基)-6-苯基-1,3,5-三嗪(10.0g,16.22mmol),然后添加双(频哪醇)二硼(6.18g,24.33mmol)、pd(dppf)cl
2
(1.24g,1.69mmol)(0.03当量)及koac(23.34g,168.9mmol),在130℃下回流搅拌4小时。当反应结束时,通过蒸馏除去dmf,并用ch
2
cl
2
和水萃取。将有机层以mgso
4
干燥及浓缩,将所得化合物经过硅胶柱并重结晶,从而得到2-([1,1'-联苯]-4-基)-4-苯基-6-(4
”-
(4,4,5,5-四甲基-1,3,2-二氧杂硼烷-2-基)-[1,1':3',1
”-
三联苯]-4-基)-1,3,5-三嗪(2-([1,1'-biphenyl]-4-yl)-4-phenyl-6-(4
”-
(4,4,5,5-tetramethyl-1,3,2-dioxaborolan-2-yl)-[1,1':3',1
”-
terphenyl]-4-yl)-1,3,5-triazine)(7g,65.03%)。
[0240][0241]
将2-([1,1'-联苯]-4-基)-4-苯基-6-(3'-(4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷-2-基)-[1,1'-联苯]-3-基)-1,3,5-三嗪(20g,34.04mmol)溶于thf中,然后添加1-溴-4-碘苯(11.56g,40.85mmol)、pd(pph
3
)
4
(1.95g,mmol)、k
2
co
3
(23.34g,168.9mmol)及水,并在100℃下回流搅拌3小时。当反应结束时,以e.a和水萃取,将有机层以mgso
4
干燥及浓缩,通过硅胶柱分离和纯化所得有机物,从而得到2-([1,1'-联苯]-4-基)-4-(4
”-
溴-[1,1':3',1
”-
三联苯]-3-基)-6-苯基-1,3,5-三嗪(2-([1,1'-biphenyl]-4-yl)-4-(4
”-
bromo-[1,1':3',1
”-
terphenyl]-3-yl)-6-phenyl-1,3,5-triazine)(14g,66.7%)。
[0242][0243]
在圆底烧瓶中用dmf溶解2-([1,1'-联苯]-4-基)-4-(4
”-
溴-[1,1':3',1
”-
三联苯]-3-基)-6-苯基-1,3,5-三嗪(10.0g,16.22mmol),然后添加双(频哪醇)二硼(6.18g,24.33mmol)、pd(dppf)cl
2
(1.24g,1.69mmol)(0.03当量)及koac(23.34g,168.9mmol),在130℃下回流搅拌4小时。当反应结束时,通过蒸馏除去dmf,并用ch
2
cl
2
和水萃取。将有机层以mgso
4
干燥及浓缩,将所得化合物经过硅胶柱并重结晶,从而得到2-([1,1'-联苯]-4-基)-4-苯基-6-(4
”-
(4,4,5,5-四甲基-1,3,2-二氧杂硼烷-2-基)-[1,1':3',1
”-
三联苯]-3-基)-1,3,5-三嗪(2-([1,1'-biphenyl]-4-yl)-4-phenyl-6-(4
”-
(4,4,5,5-tetramethyl-1,3,2-dioxaborolan-2-yl)-[1,1':3',1
”-
terphenyl]-3-yl)-1,3,5-triazine)(8g,74.32%)。
[0244][0245]
将2-([1,1'-联苯]-4-基)-4-苯基-6-(4'-(4,4,5,5-四甲基-1,3,2-二氧杂硼烷-2-基)-[1,1'-联苯]-3-基)-1,3,5-三嗪(20g,34.04mmol)溶于thf中,然后添加1-溴-4-碘苯(11.56g,40.85mmol)、pd(pph
3
)
4
(1.95g,1.69mmol)、k
2
co
3
(23.34g,168.9mmol)及水,并在100℃下回流搅拌3小时。当反应结束时,以e.a和水萃取,将有机层以mgso
4
干燥及浓缩,通过硅胶柱分离所得有机物,从而得到2-([1,1'-联苯]-4-基)-4-(4
”-
溴-[1,1':4',1
”-
三联苯]-3-基)-6-苯基-1,3,5-三嗪(2-([1,1'-biphenyl]-4-yl)-4-(4
”-
bromo-[1,1':4',1
”-
terphenyl]-3-yl)-6-phenyl-1,3,5-triazine)(15g,71.47%)。
[0246][0247]
在圆底烧瓶中用dmf溶解2-([1,1'-联苯]-4-基)-4-(4
”-
溴-[1,1':4',1
”-
三联苯]-3-基)-6-苯基-1,3,5-三嗪(10.0g,16.22mmol),然后添加双(频哪醇)二硼(6.18g,24.33mmol)、pd(dppf)cl
2
(1.24g,1.69mmol)(0.03当量)及koac(23.34g,168.9mmol),在130℃下回流搅拌4小时。当反应结束时,通过蒸馏除去dmf,并用ch
2
cl
2
和水萃取。将有机层以mgso
4
干燥及浓缩,将所得化合物经过硅胶柱并重结晶,从而得到2-([1,1'-联苯]-4-基)-4-苯基-6-(4
”-
(4,4,5,5-四甲基-1,3,2-二氧杂硼烷-2-基)-[1,1':4',1
”-
三联苯]-3-基)-1,3,5-三嗪(2-([1,1'-biphenyl]-4-yl)-4-phenyl-6-(4
”-
(4,4,5,5-tetramethyl-1,3,2-dioxaborolan-2-yl)-[1,1':4',1
”-
terphenyl]-3-yl)-1,3,5-triazine)(7g,65.03%)。
[0248][0249]
将2-([1,1'-联苯]-4-基)-4-苯基-6-(3'-(4,4,5,5-四甲基-1,3,2-二氧杂硼烷-2-基)-[1,1'-联苯]-3-基)-1,3,5-三嗪(20g,34.04mmol)溶于thf中,然后添加1-溴-3-碘苯(11.56g,40.85mmol)、pd(pph
3
)
4
(1.95g,1.69mmol)、k
2
co
3
(23.34g,168.9mmol)及水,并在100℃下回流搅拌3小时。当反应结束时,以e.a和水萃取,将有机层以mgso
4
干燥及浓缩,
通过硅胶柱分离和纯化所得有机物,从而得到2-([1,1'-联苯]-4-基)-4-(3
”-
溴-[1,1':3',1
”-
三联苯]-3-基)-6-苯基-1,3,5-三嗪(2-([1,1'-biphenyl]-4-yl)-4-(3
”-
bromo-[1,1':3',1
”-
terphenyl]-3-yl)-6-phenyl-1,3,5-triazine)(15g,71.47%)。
[0250][0251]
在圆底烧瓶中用dmf溶解2-([1,1'-联苯]-4-基)-4-(3
”-
溴-[1,1':3',1
”-
三联苯]-3-基)-6-苯基-1,3,5-三嗪(10.0g,16.22mmol),然后添加双(频哪醇)二硼(6.18g,24.33mmol)、pd(dppf)cl
2
(1.24g,1.69mmol)(0.03当量)及koac(23.34g,168.9mmol),在130℃下回流搅拌4小时。当反应结束时,通过蒸馏除去dmf,并用ch
2
cl
2
和水萃取。将有机层以mgso
4
干燥及浓缩,将所得化合物经过硅胶柱并重结晶,从而得到2-([1,1'-联苯]-4-基)-4-苯基-6-(3
”-
(4,4,5,5-四甲基-1,3,2-二氧杂硼烷-2-基)-[1,1':3',1
”-
三联苯]-3-基)-1,3,5-三嗪(2-([1,1'-biphenyl]-4-yl)-4-phenyl-6-(3
”-
(4,4,5,5-tetramethyl-1,3,2-dioxaborolan-2-yl)-[1,1':3',1
”-
terphenyl]-3-yl)-1,3,5-triazine)(7g,65.03%)。
[0252][0253]
将2-([1,1'-联苯]-4-基)-4-苯基-6-(4'-(4,4,5,5-四甲基-1,3,2-二氧杂硼烷-2-基)-[1,1'-联苯]-3-基)-1,3,5-三嗪(20g,34.04mmol)溶于thf中,然后添加1-溴-3-碘苯(11.56g,40.85mmol)、pd(pph
3
)
4
(11.56g,40.85mmol)、k
2
co
3
(1.95g,1.69mmol)及水,并在100℃下回流搅拌3小时。当反应结束时,以e.a和水萃取,将有机层以mgso
4
干燥及浓缩,通过硅胶柱分离所得有机物,从而得到2-([1,1'-联苯]-4-基)-4-(3
”-
溴-[1,1':4',1
”-
三联苯]-3-基)-6-苯基-1,3,5-三嗪(2-([1,1'-biphenyl]-4-yl)-4-(3
”-
bromo-[1,1':4',1
”-
terphenyl]-3-yl)-6-phenyl-1,3,5-triazine)(14g,66.7%)。
[0254][0255]
在圆底烧瓶中用dmf溶解2-([1,1'-联苯]-4-基)-4-(3
”-
溴-[1,1':4',1
”-
三联苯]-3-基)-6-苯基-1,3,5-三嗪(10.0g,16.22mmol),然后添加双(频哪醇)二硼(6.18g,24.33mmol)、pd(dppf)cl
2
(1.24g,1.69mmol)(0.03当量)及koac(23.34g,168.9mmol),在130℃下回流搅拌4小时。当反应结束时,通过蒸馏除去dmf,并用ch
2
cl
2
和水萃取。将有机层以mgso
4
干燥及浓缩,将所得化合物经过硅胶柱并重结晶,从而得到2-([1,1'-联苯]-4-基)-4-苯基-6-(3
”-
(4,4,5,5-四甲基-1,3,2-二氧杂硼烷-2-基)-[1,1':4',1
”-
三联苯]-3-基)-1,3,5-三嗪(2-([1,1'-biphenyl]-4-yl)-4-phenyl-6-(3
”-
(4,4,5,5-tetramethyl-1,3,2-dioxaborolan-2-yl)-[1,1':4',1
”-
terphenyl]-3-yl)-1,3,5-triazine)(7g,65.03%)。
[0256][0257]
将2-([1,1'-联苯]-4-基)-4-苯基-6-(3'-(4,4,5,5-四甲基-1,3,2-二氧杂硼烷-2-基)-[1,1'-联苯]-4-基)-1,3,5-三嗪(20g,34.04mmol)溶于thf中,然后添加1-溴-3-碘苯(11.56g,40.85mmol)、pd(pph
3
)
4
(1.95g,1.69mmol)、k
2
co
3
(23.34g,168.9mmol)及水,并在100℃下回流搅拌3小时。当反应结束时,以e.a和水萃取,将有机层以mgso
4
干燥及浓缩,通过硅胶柱分离和纯化所得有机物,从而得到2-([1,1'-联苯]-4-基)-4-(3
”-
溴-[1,1':3',1
”-
三联苯]-4-基)-6-苯基-1,3,5-三嗪(2-([1,1'-biphenyl]-4-yl)-4-(3
”-
bromo-[1,1':3',1
”-
terphenyl]-4-yl)-6-phenyl-1,3,5-triazine)(14g,66.7%)。
[0258][0259]
在圆底烧瓶中用dmf溶解2-([1,1'-联苯]-4-基)-4-(3
”-
溴-[1,1':3',1
”-
三联
苯]-4-基)-6-苯基-1,3,5-三嗪(10.0g,16.22mmol),然后添加双(频哪醇)二硼(6.18g,24.33mmol)、pd(dppf)cl
2
(1.24g,1.69mmol)(0.03当量)及koac(23.34g,168.9mmol),在130℃下回流搅拌4小时。当反应结束时,通过蒸馏除去dmf,并用ch
2
cl
2
和水萃取。将有机层以mgso
4
干燥及浓缩,将所得化合物经过硅胶柱并重结晶,从而得到2-([1,1'-联苯]-4-基)-4-苯基-6-(3
”-
(4,4,5,5-四甲基-1,3,2-二氧杂硼烷-2-基)-[1,1':3',1
”-
三联苯]-4-基)-1,3,5-三嗪(2-([1,1'-biphenyl]-4-yl)-4-phenyl-6-(3
”-
(4,4,5,5-tetramethyl-1,3,2-dioxaborolan-2-yl)-[1,1':3',1
”-
terphenyl]-4-yl)-1,3,5-triazine)(7g,65.03%)。
[0260]
[合成例和最终产物的fdms数据]
[0261]
(1)合成例(化合物1-1-1至1-1-13)
[0262][0263]
将6-氯苯并[4,5]噻吩并[2,3-c][1,7]萘啶(6-chlorobenzo[4,5]thieno[2,3-c][1,7]naphthyridine)(20g,73.87mmol)溶于thf中,添加2-([1,1'-联苯]-4-基)-4-苯基-6-(4,4,5,5-四甲基-1,3,2-二氧杂硼烷-2-基))-1,3,5-三嗪(48.24g,110.81mmol)、pd(pph
3
)
4
(2.56g,2.22mmol)、naoh(8.86g,221.62mmol)及水,并在100℃下回流搅拌3小时。当反应结束时,以e.a和水萃取,将有机层以mgso
4
干燥及浓缩,将所产生的有机物经过硅胶柱并重结晶,从而得到25g的最终产物(收率:62.2%)。
[0264]
可以通过使用核1-2至1-13以与化合物1-1-1的合成方法相同的方法合成化合物1-1-2至1-1-13。
[0265]
(2)合成例(化合物1-2-1至1-2-13)
[0266][0267]
将6-氯苯并[4,5]噻吩并[2,3-c][1,7]萘啶(20g,73.87mmol)溶于thf中,添加2-([1,1'-联苯]-4-基)-4-苯基-6-(4-(4,4,5,5-四甲基-1,3,2-二氧杂硼烷-2-基)苯基)-1,3,5-三嗪(56.67g,110.81mmol)、pd(pph
3
)
4
(2.56g,2.22mmol)、naoh(8.86g,221.62mmol)及水,并在100℃下回流搅拌3小时。当反应结束时,以e.a和水萃取,将有机层以mgso
4
干燥及浓缩,将所产生的有机物经过硅胶柱并重结晶,从而得到30g的最终产物(收率:65.5%)。
[0268]
可以通过使用核1-2至1-13以与化合物1-2-1的合成方法相同的方法合成化合物1-2-1至1-2-13。
[0269]
(3)合成例(化合物1-2-14至1-2-26)
([1,1'-联苯]-4-基)-4-苯基-6-(3'-(4,4,5,5-四甲基-1,3,2-二氧杂硼烷-2-基)-[1,1'-联苯]-4-基)-1,3,5-三嗪(65.11g,110.81mmol)、pd(pph
3
)
4
(2.56g,2.22mmol)、naoh(8.86g,221.62mmol)及水,并在100℃下回流搅拌3小时。当反应结束时,以e.a和水萃取,将有机层以mgso
4
干燥及浓缩,将所产生的有机物经过硅胶柱并重结晶,从而得到35g的最终产物(收率:68%)。
[0280]
可以通过使用核1-2至1-13以与化合物1-3-14的合成方法相同的方法合成化合物1-3-15至1-3-26。
[0281]
(6)合成例(化合物1-3-27至1-2-39)
[0282][0283]
将6-氯苯并[4,5]噻吩并[2,3-c][1,7]萘啶(20g,mmol)溶于thf中,添加2-([1,1'-联苯]-4-基)-4-苯基-6-(4'-(4,4,5,5-四甲基-1,3,2-二氧杂硼烷-2-基)-[1,1'-联苯]-3-基)-1,3,5-三嗪(65.11g,110.81mmol)、pd(pph
3
)
4
(2.56g,2.22mmol)、naoh(8.86g,221.62mmol)及水,并在100℃下回流搅拌3小时。当反应结束时,以e.a和水萃取,将有机层以mgso
4
干燥及浓缩,将所产生的有机物经过硅胶柱并重结晶,从而得到32g的最终产物(收率:62.25%)。
[0284]
可以通过使用核1-2至1-13以与化合物1-3-27的合成方法相同的方法合成化合物1-3-28至1-3-39。
[0285]
(7)合成例(化合物1-3-40至1-3-52)
[0286][0287]
将6-氯苯并[4,5]噻吩并[2,3-c][1,7]萘啶(20g,73.87mmol)溶于thf中,添加2-([1,1'-联苯]-4-基)-4-苯基-6-(3'-(4,4,5,5-四甲基-1,3,2-二氧杂硼烷-2-基)-[1,1'-联苯]-3-基)-1,3,5-三嗪(65.11g,110.81mmol)、pd(pph
3
)
4
(2.56g,2.22mmol)、naoh(8.86g,221.62mmol)及水,并在100℃下回流搅拌3小时。当反应结束时,以e.a和水萃取,将有机层以mgso
4
干燥及浓缩,将所产生的有机物经过硅胶柱并重结晶,从而得到34g的最终产物(收率:66.1%)。
[0288]
可以通过使用核1-2至1-13以与化合物1-3-40的合成方法相同的方法合成化合物1-3-41至1-3-52。
[0289]
(8)合成例(化合物1-4-1至1-4-13)
[0290][0291]
将6-氯苯并[4,5]噻吩并[2,3-c][1,7]萘啶(20g,73.87mmol)溶于thf中,添加2-([1,1'-联苯]-4-基)-4-苯基-6-(4
”-
(4,4,5,5-四甲基-1,3,2-二氧杂硼烷-2-基)-[1,1':4',1
”-
三联苯]-4-基)-1,3,5-三嗪(73.54g,110.81mmol)、pd(pph
3
)
4
(2.56g,2.22mmol)、naoh(8.86g,221.62mmol)及水,并在100℃下回流搅拌3小时。当反应结束时,以e.a和水萃取,将有机层以mgso
4
干燥及浓缩,将所产生的有机物经过硅胶柱并重结晶,从而得到35g的最终产物(收率:61.37%)。
[0292]
可以通过使用核1-2至1-13以与化合物1-4-1的合成方法相同的方法合成化合物1-4-2至1-4-13。
[0293]
(9)合成例(化合物1-4-14至1-4-26)
[0294][0295]
将6-氯苯并[4,5]噻吩并[2,3-c][1,7]萘啶(20g,73.87mmol)溶于thf中,添加2-([1,1'-联苯]-4-基)-4-苯基-6-(3
”-
(4,4,5,5-四甲基-1,3,2-二氧杂硼烷-2-基)-[1,1':4',1
”-
三联苯]-4-基)-1,3,5-三嗪(73.54g,110.81mmol)、pd(pph
3
)
4
(2.56g,2.22mmol)、naoh(8.86g,221.62mmol)及水,并在100℃下回流搅拌3小时。当反应结束时,以e.a和水萃取,将有机层以mgso
4
干燥及浓缩,将所产生的有机物经过硅胶柱并重结晶,从而得到37g的最终产物(收率:64.88%)。
[0296]
可以通过使用核1-2至1-13以与化合物1-4-14的合成方法相同的方法合成化合物1-4-15至1-4-26。
[0297]
(10)合成例(化合物1-4-27至1-4-39)
[0298][0299]
将6-氯苯并[4,5]噻吩并[2,3-c][1,7]萘啶(20g,73.87mmol)溶于thf中,添加2-([1,1'-联苯]-4-基)-4-苯基-6-(4
”-
(4,4,5,5-四甲基-1,3,2-二氧杂硼烷-2-基)-[1,1':3',1
”-
三联苯]-4-基)-1,3,5-三嗪(73.54g,110.81mmol)、pd(pph
3
)
4
(2.56g,2.22mmol)、naoh(8.86g,221.62mmol)及水,并在100℃下回流搅拌3小时。当反应结束时,以e.a和水萃取,将有机层以mgso
4
干燥及浓缩,将所产生的有机物经过硅胶柱并重结晶,从而得到39g的最终产物(收率:68.4%)。
[0300]
可以通过使用核1-2至1-13以与化合物1-4-27的合成方法相同的方法合成化合物1-4-28至1-4-39。
[0301]
(11)合成例(化合物1-4-40至1-4-52)
[0302][0303]
将6-氯苯并[4,5]噻吩并[2,3-c][1,7]萘啶(20g,73.87mmol)溶于thf中,添加2-([1,1'-联苯]-4-基)-4-苯基-6-(4
”-
(4,4,5,5-四甲基-1,3,2-二氧杂硼烷-2-基)-[1,1':3',1
”-
三联苯]-3-基)-1,3,5-三嗪(73.54g,110.81mmol)、pd(pph
3
)
4
(2.56g,2.22mmol)、naoh(8.86g,221.62mmol)及水,并在100℃下回流搅拌3小时。当反应结束时,以e.a和水萃取,将有机层以mgso
4
干燥及浓缩,将所产生的有机物经过硅胶柱并重结晶,从而得到39g的最终产物(收率:68.38%)。
[0304]
可以通过使用核1-2至1-13以与化合物1-4-40的合成方法相同的方法合成化合物1-4-41至1-4-52。
[0305]
(12)合成例(化合物1-4-53至1-4-65)
[0306][0307]
将6-氯苯并[4,5]噻吩并[2,3-c][1,7]萘啶(20g,73.87mmol)溶于thf中,添加2-([1,1'-联苯]-4-基)-4-苯基-6-(4
”-
(4,4,5,5-四甲基-1,3,2-二氧杂硼烷-2-基)-[1,1':4',1
”-
三联苯]-3-基)-1,3,5-三嗪(73.54g,110.81mmol)、pd(pph
3
)
4
(2.56g,2.22mmol)、naoh(8.86g,221.62mmol)及水,并在100℃下回流搅拌3小时。当反应结束时,以e.a和水萃取,将有机层以mgso
4
干燥及浓缩,将所产生的有机物经过硅胶柱并重结晶,从而得到36g的最终产物(收率:63.13%)。
[0308]
可以通过使用核1-2至1-13以与化合物1-4-53的合成方法相同的方法合成化合物1-4-54至1-4-65。
[0309]
(13)合成例(化合物1-4-66至1-4-78)
[0310][0311]
将6-氯苯并[4,5]噻吩并[2,3-c][1,7]萘啶(20g,73.87mmol)溶于thf中,添加2-([1,1'-联苯]-4-基)-4-苯基-6-(3
”-
(4,4,5,5-四甲基-1,3,2-二氧杂硼烷-2-基)-[1,1':3',1
”-
三联苯]-3-基)-1,3,5-三嗪(73.54g,110.81mmol)、pd(pph
3
)
4
(2.56g,2.22mmol)、naoh(8.86g,221.62mmol)及水,并在100℃下回流搅拌3小时。当反应结束时,以e.a和水萃取,将有机层以mgso
4
干燥及浓缩,将所产生的有机物经过硅胶柱并重结晶,从而得到36g的最终产物(收率:63.13%)。
[0312]
可以通过使用核1-2至1-13以与化合物1-4-66的合成方法相同的方法合成化合物1-4-67至1-4-78。
[0313]
(14)合成例(化合物1-4-79至1-4-91)
[0314][0315]
将6-氯苯并[4,5]噻吩并[2,3-c][1,7]萘啶(20g,73.87mmol)溶于thf中,添加2-([1,1'-联苯]-4-基)-4-苯基-6-(3
”-
(4,4,5,5-四甲基-1,3,2-二氧杂硼烷-2-基)-[1,1':4',1
”-
三联苯]-3-基)-1,3,5-三嗪(73.54g,110.81mmol)、pd(pph
3
)
4
(2.56g,2.22mmol)、naoh(8.86g,221.62mmol)及水,并在100℃下回流搅拌3小时。当反应结束时,以e.a和水萃取,将有机层以mgso
4
干燥及浓缩,将所产生的有机物经过硅胶柱并重结晶,从而得到37g的最终产物(收率:64.88%)。
[0316]
可以通过使用核1-2至1-13以与化合物1-4-79的合成方法相同的方法合成化合物1-4-80至1-4-91。
[0317]
(15)合成例(化合物1-4-92至1-4-104)
[0318][0319]
将6-氯苯并[4,5]噻吩并[2,3-c][1,7]萘啶(20g,110.81mmol)溶于thf中,添加2-([1,1'-联苯]-4-基)-4-苯基-6-(3
”-
(4,4,5,5-四甲基-1,3,2-二氧杂硼烷-2-基)-[1,1':3',1
”-
三联苯]-4-基)-1,3,5-三嗪(73.54g,110.81mmol)、pd(pph
3
)
4
(2.56g,2.22mmol)、naoh(8.86g,221.62mmol)及水,并在100℃下回流搅拌3小时。当反应结束时,以e.a和水萃取,将有机层以mgso
4
干燥及浓缩,将所产生的有机物经过硅胶柱并重结晶,从而得到37g的最终产物(收率:64.88%)。
[0320]
可以通过使用核1-2至1-13以与化合物1-4-92的合成方法相同的方法合成化合物1-4-93至1-4-104。
[0321]
表3
[0322][0323]
[0324][0325][0326]
(16)合成例(化合物2-1-1至2-1-11)
[0327][0328]
将2-溴苯并呋喃[2,3-b]喹喔啉(2-bromobenzofuro[2,3-b]quinoxaline)(20g,66.86mmol)溶于thf中,添加2-([1,1'-联苯]-4-基)-4-苯基-6-(4,4,5,5-四甲基-1,3,2-二氧杂硼烷-2-基))-1,3,5-三嗪(43.66g,100.29mmol)、pd(pph
3
)
4
(1.95g,1.69mmol)、naoh(6.76g,168.9mmol)及水,并在100℃下回流搅拌3小时。当反应结束时,以e.a和水萃取,将有机层以mgso
4
干燥及浓缩,将所产生的有机物经过硅胶柱并重结晶,从而得到25g的最终
产物(收率:70.9%)。
[0329]
可以通过使用核2-1至2-11以与化合物2-1-3的合成例相同的方法合成化合物2-1-1至2-1-2和化合物2-1-4至2-1-11。
[0330]
(17)合成例(化合物2-2-1至2-2-11)
[0331][0332]
将2-溴苯并呋喃[2,3-b]喹喔啉(20g,66.86mmol)溶于thf中,添加2-([1,1'-联苯]-4-基)-4-苯基-6-(4-(4,4,5,5-四甲基-1,3,2-二氧杂硼烷-2-基)苯基)-1,3,5-三嗪(51.29g,100.29mmol)、pd(pph
3
)
4
(1.95g,1.69mmol)、naoh(6.76g,168.9mmol)及水,并在100℃下回流搅拌3小时。当反应结束时,以e.a和水萃取,将有机层以mgso
4
干燥及浓缩,将所产生的有机物经过硅胶柱并重结晶,从而得到26g的最终产物(收率:64.4%)。
[0333]
可以通过使用核2-1至2-11以与化合物2-2-3的合成例相同的方法合成化合物2-2-1至2-2-2和化合物2-2-4至2-2-11。
[0334]
(18)合成例(化合物2-2-12至2-2-22)
[0335][0336]
将2-溴苯并呋喃[2,3-b]喹喔啉(20g,66.86mmol)溶于thf中,添加2-([1,1'-联苯]-4-基)-4-苯基-6-(3-(4,4,5,5-四甲基-1,3,2-二氧杂硼烷-2-基)苯基)-1,3,5-三嗪(51.29g,100.29mmol)、pd(pph
3
)
4
(1.95g,1.69mmol)、naoh(6.76g,168.9mmol)及水,并在100℃下回流搅拌3小时。当反应结束时,以e.a和水萃取,将有机层以mgso
4
干燥及浓缩,将所产生的有机物经过硅胶柱并重结晶,从而得到27g的最终产物(收率:66.8%)。
[0337]
可以通过使用核2-1至2-11以与化合物2-2-14的合成例相同的方法合成化合物2-2-12至2-2-13和化合物2-2-15至2-2-22。
[0338]
(19)合成例(化合物2-3-1至2-3-11)
基)-1,3,5-三嗪(58.92g,100.29mmol)、pd(pph
3
)
4
(1.95g,1.69mmol)、naoh(6.76g,168.9mmol)及水,并在100℃下回流搅拌3小时。当反应结束时,以e.a和水萃取,将有机层以mgso
4
干燥及浓缩,将所产生的有机物经过硅胶柱并重结晶,从而得到28g的最终产物(收率:61.6%)。
[0349]
可以通过使用核2-1至2-11以与化合物2-3-25的合成例相同的方法合成化合物2-3-23至2-3-24和化合物2-3-26至2-3-33。
[0350]
(22)合成例(化合物2-3-34至2-3-44)
[0351][0352]
将2-溴苯并呋喃[2,3-b]喹喔啉(20g,66.86mmol)溶于thf中,添加2-([1,1'-联苯]-4-基)-4-苯基-6-(3'-(4,4,5,5-四甲基-1,3,2-二氧杂硼烷-2-基)-[1,1'-联苯]-3-基)-1,3,5-三嗪(58.92g,100.29mmol)、pd(pph
3
)
4
(1.95g,1.69mmol)、naoh(6.76g,168.9mmol)及水,并在100℃下回流搅拌3小时。当反应结束时,以e.a和水萃取,将有机层以mgso
4
干燥及浓缩,将所产生的有机物经过硅胶柱并重结晶,从而得到29g的最终产物(收率:63.8%)。
[0353]
可以通过使用核2-1至2-11以与化合物2-3-36的合成例相同的方法合成化合物2-3-34至2-3-35和化合物2-3-37至2-3-44。
[0354]
(23)合成例(化合物2-4-1至2-4-11)
[0355][0356]
将2-溴苯并呋喃[2,3-b]喹喔啉(20g,66.86mmol)溶于thf中,添加2-([1,1'-联苯]-4-基)-4-苯基-6-(4
”-
(4,4,5,5-四甲基-1,3,2-二氧杂硼烷-2-基)-[1,1':4',1
”-
三联苯]-4-基)-1,3,5-三嗪(66.56g,100.29mmol)、pd(pph
3
)
4
(1.95g,1.69mmol)、naoh(6.76g,168.9mmol)及水,并在100℃下回流搅拌3小时。当反应结束时,以e.a和水萃取,将有机层以mgso
4
干燥及浓缩,将所产生的有机物经过硅胶柱并重结晶,从而得到33g的最终产物(收率:65.3%)。
[0357]
可以通过使用核2-1至2-11以与化合物2-4-3的合成例相同的方法合成化合物2-4-1至2-4-2和化合物2-4-4至2-4-11。
[0358]
(24)合成例(化合物2-4-12至2-4-22)
[0359][0360]
将2-溴苯并呋喃[2,3-b]喹喔啉(20g,66.86mmol)溶于thf中,添加2-([1,1'-联苯]-4-基)-4-苯基-6-(3
”-
(4,4,5,5-四甲基-1,3,2-二氧杂硼烷-2-基)-[1,1':4',1
”-
三联苯]-4-基)-1,3,5-三嗪(66.56g,100.29mmol)、pd(pph
3
)
4
(1.95g,1.69mmol)、naoh(6.76g,168.9mmol)及水,并在100℃下回流搅拌3小时。当反应结束时,以e.a和水萃取,将有机层以mgso
4
干燥及浓缩,将所产生的有机物经过硅胶柱并重结晶,从而得到34g的最终产物(收率:67.3%)。
[0361]
可以通过使用核2-1至2-11以与化合物2-4-14的合成例相同的方法合成化合物2-4-12至2-4-13和化合物2-4-15至2-4-22。
[0362]
(25)合成例(化合物2-4-23至2-4-33)
[0363][0364]
将2-溴苯并呋喃[2,3-b]喹喔啉(20g,66.86mmol)溶于thf中,添加2-([1,1'-联苯]-4-基)-4-苯基-6-(4
”-
(4,4,5,5-四甲基-1,3,2-二氧杂硼烷-2-基)-[1,1':3',1
”-
三联苯]-4-基)-1,3,5-三嗪(66.56g,100.29mmol)、pd(pph
3
)
4
(1.95g,1.69mmol)、naoh(6.76g,168.9mmol)及水,并在100℃下回流搅拌3小时。当反应结束时,以e.a和水萃取,将有机层以mgso
4
干燥及浓缩,将所产生的有机物经过硅胶柱并重结晶,从而得到35g的最终产物(收率:69.3%)。
[0365]
可以通过使用核2-1至2-11以与化合物2-4-25的合成例相同的方法合成化合物2-4-23至2-4-24和化合物2-4-26至2-4-33。
[0366]
(26)合成例(化合物2-4-34至2-4-44)
[0367][0368]
将2-溴苯并呋喃[2,3-b]喹喔啉(20g,66.86mmol)溶于thf中,添加2-([1,1'-联苯]-4-基)-4-苯基-6-(4
”-
(4,4,5,5-四甲基-1,3,2-二氧杂硼烷-2-基)-[1,1':3',1
”-
三联苯]-3-基)-1,3,5-三嗪(66.56g,100.29mmol)、pd(pph
3
)
4
(1.95g,1.69mmol)、naoh(6.76g,168.9mmol)及水,并在100℃下回流搅拌3小时。当反应结束时,以e.a和水萃取,将有机层以mgso
4
干燥及浓缩,将所产生的有机物经过硅胶柱并重结晶,从而得到32g的最终产物(收率:63.3%)。
[0369]
可以通过使用核2-1至2-11以与化合物2-4-36的合成例相同的方法合成化合物2-4-34至2-4-35和化合物2-4-37至2-4-44。
[0370]
(27)合成例(化合物2-4-45至2-4-55)
[0371][0372]
将2-溴苯并呋喃[2,3-b]喹喔啉(20g,66.86mmol)溶于thf中,添加2-([1,1'-联苯]-4-基)-4-苯基-6-(4
”-
(4,4,5,5-四甲基-1,3,2-二氧杂硼烷-2-基)-[1,1':4',1
”-
三联苯]-3-基)-1,3,5-三嗪(66.56g,100.29mmol)、pd(pph
3
)
4
(1.95g,1.69mmol)、naoh(6.76g,168.9mmol)及水,并在100℃下回流搅拌3小时。当反应结束时,以e.a和水萃取,将有机层以mgso
4
干燥及浓缩,将所产生的有机物经过硅胶柱并重结晶,从而得到33g的最终产物(收率:65.3%)。
[0373]
可以通过使用核2-1至2-11以与化合物2-4-47的合成例相同的方法合成化合物2-4-45至2-4-46和化合物2-4-48至2-4-55。
[0374]
(28)合成例(化合物2-4-56至2-4-66)
[0375][0376]
将2-溴苯并呋喃[2,3-b]喹喔啉(20g,66.86mmol)溶于thf中,添加2-([1,1'-联
4-78至2-4-79和化合物2-4-81至2-4-88。
[0386]
表4
[0387][0388]
[0389][0390]
(31)合成例(3-1-1至3-2-17)
[0391]
参照下述合成式对化合物3-1-1的合成方法进行说明。
[0392][0393]
在圆底烧瓶中用dmf溶解2-氯-4,6-二苯基-1,3,5-三嗪(2-chloro-4,6-diphenyl-1,3,5-triazine)(20g,74.7mmol),然后添加4,4,4',4',5,5,5',5'-八甲基-2,2'-双(1,3,2-二氧杂硼杂环戊烷)(4,4,4',4',5,5,5',5'-octamethyl-2,2'-bi(1,3,2-dioxaborolane))(6.18g,82.18mmol)、pd(dppf)cl
2
(2.24g,1.64mmol)及koac(22g,224.11mmol),在130℃下回流搅拌4小时。当反应结束时,通过蒸馏除去dmf,并用ch
2
cl
2
和水萃取。将有机层以mgso
4
干燥及浓缩,将所得化合物经过硅胶柱并重结晶,从而得到2,4-二苯基-6-(4,4,5,5-四甲基-1,3,2-二氧杂硼烷-2-基)-1,3,5-三嗪(2,4-diphenyl-6-(4,4,5,5-tetramethyl-1,3,2-dioxaborolan-2-yl)-1,3,5-triazine)(18g,67.07%)。
[0394]
将6-氯苯并[4,5]噻吩并[2,3-c][1,5]萘啶(6-chlorobenzo[4,5]thieno[2,3-c][1,5]naphthyridine)(18g,66.49mmol)溶于thf中,添加2,4-二苯基-6-(4,4,5,5-四甲基-1,3,2-二氧杂硼烷-2-基)-1,3,5-三嗪(26.27g,73.14mmol)、pd(pph
3
)
4
(2.3g,1.99mmol)、naoh(7.98g,199.46mmol)及水,并在100℃下回流搅拌3小时。当反应结束时,以e.a和水萃取,将有机层以mgso
4
干燥及浓缩,将所产生的有机物经过硅胶柱并重结晶,从而得到19g的
最终产物(收率:61%)。
[0395]
参照下述合成式对化合物3-1-5的合成方法进行说明。
[0396][0397]
在圆底烧瓶中用dmf溶解2-氯-4-苯基苯并[4,5]噻吩并[3,2-d]嘧啶(2-chloro-4-phenylbenzo[4,5]thieno[3,2-d]pyrimidine)(20g,67.39mmol),然后添加4,4,4',4',5,5,5',5'-八甲基-2,2'-双(1,3,2-二氧杂硼杂环戊烷)(6.18g,74.13mmol)、pd(dppf)cl
2
(1.48g,2.02mmol)及koac(19.84g,202.18mmol),在130℃下回流搅拌4小时。当反应结束时,通过蒸馏除去dmf,并用ch
2
cl
2
和水萃取。将有机层以mgso
4
干燥及浓缩,将所得化合物经
过硅胶柱并重结晶,从而得到4-苯基-2-(4,4,5,5-四甲基-1,3,2-二氧杂硼烷-2-基)苯并[4,5]噻吩并[3,2-d]嘧啶(4-phenyl-2-(4,4,5,5-tetramethyl-1,3,2-dioxaborolan-2-yl)benzo[4,5]thieno[3,2-d]pyrimidine)(18g,67.07%)。
[0398]
将4-苯基-2-(4,4,5,5-四甲基-1,3,2-二氧杂硼烷-2-基)苯并[4,5]噻吩并[3,2-d]嘧啶(18g,46.36mmol)溶于thf中,添加1-溴-4-碘苯(14.43g,50.99mmol)、pd(pph
3
)
4
(1.61g,1.39mmol)、k
2
co
3
(5.56g,139.07mmol)及水,并在100℃下回流搅拌3小时。当反应结束时,以e.a和水萃取,将有机层以mgso
4
干燥及浓缩,通过硅胶柱分离和纯化所得有机物,从而得到2-(4-溴苯基)-4-苯基苯并[4,5]噻吩并[3,2-d]嘧啶(2-(4-bromophenyl)-4-phenylbenzo[4,5]thieno[3,2-d]pyrimidine)(13g,67.2%)。
[0399]
在圆底烧瓶中用dmf溶解2-(4-溴苯基)-4-苯基苯并[4,5]噻吩并[3,2-d]嘧啶(13g,31.15mmol),然后添加4,4,4',4',5,5,5',5'-八甲基-2,2'-双(1,3,2-二氧杂硼杂环戊烷)(8.7g,34.27mmol)、pd(dppf)cl
2
(0.68g,0.93mmol)及koac(9.17g,93.45mmol),在130℃下回流搅拌4小时。当反应结束时,通过蒸馏除去dmf,并用ch
2
cl
2
和水萃取。将有机层以mgso
4
干燥及浓缩,将所得化合物经过硅胶柱并重结晶,从而得到4-苯基-2-(4-(4,4,5,5-四甲基-1,3,2-二氧杂硼烷-2-基)苯基)苯并[4,5]噻吩并[3,2-d]嘧啶(4-phenyl-2-(4-(4,4,5,5-tetramethyl-1,3,2-dioxaborolan-2-yl)phenyl)benzo[4,5]thieno[3,2-d]pyrimidine)(10g,69.12%)。
[0400]
反复地,将4-苯基-2-(4-(4,4,5,5-四甲基-1,3,2-二氧杂硼烷-2-基)苯基)苯并[4,5]噻吩并[3,2-d]嘧啶(10g,21.53mmol)溶于thf中,添加1-溴-3-碘苯(14.43g,23.69mmol)、pd(pph
3
)
4
(0.75g,0.65mmol)、k
2
co
3
(8.93g,64.6mmol)及水,并在100℃下回流搅拌3小时。当反应结束时,以e.a和水萃取,将有机层以mgso
4
干燥及浓缩,通过硅胶柱分离和纯化所得有机物,从而得到4-苯基-2-(4-(4,4,5,5-四甲基-1,3,2-二氧杂硼烷-2-基)苯基)苯并[4,5]噻吩并[3,2-d]嘧啶)(7.5g,70.58%)。
[0401]
在圆底烧瓶中用dmf溶解4-苯基-2-(4-(4,4,5,5-四甲基-1,3,2-二氧杂硼烷-2-基)苯基)苯并[4,5]噻吩并[3,2-d]嘧啶(7.5g,15.2mmol),然后添加4,4,4',4',5,5,5',5'-八甲基-2,2'-双(1,3,2-二氧杂硼杂环戊烷)(4.25g,16.72mmol)、pd(dppf)cl
2
(0.33g,0.46mmol)及koac(4.48g,45.6mmol),在130℃下回流搅拌4小时。当反应结束时,通过蒸馏除去dmf,并用ch
2
cl
2
和水萃取。将有机层以mgso
4
干燥及浓缩,将所得化合物经过硅胶柱并重结晶,从而得到4-苯基-2-(3'-(4,4,5,5-四甲基-1,3,2-二氧杂硼烷-2-基)-[1,1'-联苯]-4-基)苯并[4,5]噻吩并[3,2-d]嘧啶(4-phenyl-2-(3'-(4,4,5,5-tetramethyl-1,3,2-dioxaborolan-2-yl)-[1,1'-biphenyl]-4-yl)benzo[4,5]thieno[3,2-d]pyrimidine)(5g,60.86%)。
[0402]
将9-氯苯并[4,5]噻吩并[2,3-b]喹喔啉(15g,55.41mmol)溶于thf中,添加4-苯基-2-(3'-(4,4,5,5-四甲基-1,3,2-二氧杂硼烷-2-基)-[1,1'-联苯]-4-基)苯并[4,5]噻吩并[3,2-d]嘧啶(32.94g,60.95mmol)、pd(pph
3
)
4
(1.92g,1.66mmol)、naoh(6.65g,166.22mmol)及水,并在100℃下回流搅拌3小时。当反应结束时,以e.a和水萃取,将有机层以mgso
4
干燥及浓缩,将所产生的有机物经过硅胶柱并重结晶,从而得到25g的最终产物(收率:69.54%)。
[0403]
参照下述合成式对化合物3-1-7的合成方法进行说明。
[0404][0405]
在圆底烧瓶中用dmf溶解4-([1,1'-联苯]-4-基)-2-氯苯并[4,5]噻吩并[3,2-d]嘧啶(4-([1,1'-biphenyl]-4-yl)-2-chlorobenzo[4,5]thieno[3,2-d]pyrimidine)(20g,53.64mmol),然后添加4,4,4',4',5,5,5',5'-八甲基-2,2'-双(1,3,2-二氧杂硼杂环戊烷)(14.98g,59mmol)、pd(dppf)cl
2
(1.18g,1.61mmol)及koac(15.79g,160.91mmol),在130℃下回流搅拌4小时。当反应结束时,通过蒸馏除去dmf,并用ch
2
cl
2
和水萃取。将有机层以mgso
4
干燥及浓缩,将所得化合物经过硅胶柱并重结晶,从而得到4-([1,1'-联苯]-4-基)-2-(4,4,5,5-四甲基-1,3,2-二氧杂硼烷-2-基)苯并[4,5]噻吩并[3,2-d]嘧啶(4-([1,1'-biphenyl]-4-yl)-2-(4,4,5,5-tetramethyl-1,3,2-dioxaborolan-2-yl)benzo[4,5]thieno[3,2-d]pyrimidine)(17.5g,70.25%)。
[0406]
将4-([1,1'-联苯]-4-基)-2-(4,4,5,5-四甲基-1,3,2-二氧杂硼烷-2-基)苯并[4,5]噻吩并[3,2-d]嘧啶(17.5g,37.68mmol)溶于thf中,添加3,3'-二溴-1,1'-联苯(3,3'-dibromo-1,1'-biphenyl)(12.93g,41.45mmol)、pd(pph
3
)
4
(1.31g,1.13mmol)、k
2
co
3
(15.62g,113.05mmol)及水,并在100℃下回流搅拌3小时。当反应结束时,以e.a和水萃取,将有机层以mgso
4
干燥及浓缩,通过硅胶柱分离和纯化所得有机物,从而得到4-([1,1'-联苯]-4-基)-2-(3'-溴-[1,1'-联苯]-3-基)苯并[4,5]噻吩并[3,2-d]嘧啶(4-([1,1'-biphenyl]-4-yl)-2-(3'-bromo-[1,1'-biphenyl]-3-yl)benzo[4,5]thieno[3,2-d]
pyrimidine)(15g,69.89%)。
[0407]
在圆底烧瓶中用dmf溶解4-([1,1'-联苯]-4-基)-2-(3'-溴-[1,1'-联苯]-3-基)苯并[4,5]噻吩并[3,2-d]嘧啶(15g,26.34mmol),然后添加4,4,4',4',5,5,5',5'-八甲基-2,2'-双(1,3,2-二氧杂硼杂环戊烷)(7.36g,28.97mmol)、pd(dppf)cl
2
(0.58g,0.79mmol)及koac(7.76g,79.01mmol),在130℃下回流搅拌4小时。当反应结束时,通过蒸馏除去dmf,并用ch
2
cl
2
和水萃取。将有机层以mgso
4
干燥及浓缩,将所得化合物经过硅胶柱并重结晶,从而得到4-([1,1'-联苯]-4-基)-2-(3'-(4,4,5,5-四甲基-1,3,2-二氧杂硼烷-2-基)-[1,1'-联苯基]-3-基)苯并[4,5]噻吩并[3,2-d]嘧啶(4-([1,1'-biphenyl]-4-yl)-2-(3'-(4,4,5,5-tetramethyl-1,3,2-dioxaborolan-2-yl)-[1,1'-biphenyl]-3-yl)benzo[4,5]thieno[3,2-d]pyrimidine)(11g,67.7%)。
[0408]
将4-氯嘧啶基[4',5':4,5]噻吩并[2,3-b]喹啉(4-chloropyrimido[4',5':4,5]thieno[2,3-b]quinoline)(15g,55.2mmol)溶于thf中,添加4-([1,1'-联苯]-4-基)-2-(3'-(4,4,5,5-四甲基-1,3,2-二氧杂硼杂环烷基-2-基)-[1,1'-联苯]-3-基)苯并[4,5]噻吩并[3,2-d]嘧啶(4-([1,1'-biphenyl]-4-yl)-2-(3'-(4,4,5,5-tetramethyl-1,3,2-dioxaborolan-2-yl)-[1,1'-biphenyl]-3-yl)benzo[4,5]thieno[3,2-d]pyrimidine)(37.44g,60.72mmol)、pd(pph
3
)
4
(1.91g,1.66mmol)、naoh(6.62g,165.61mmol)及水,并在100℃下回流搅拌3小时。当反应结束时,以e.a和水萃取,将有机层以mgso
4
干燥及浓缩,将所产生的有机物经过硅胶柱并重结晶,从而得到25g的最终化合物(收率:62.38%)。
[0409]
参照下述合成式对化合物3-1-9的合成方法进行说明。
1,3,2-二氧杂硼烷-2-基)-1,3,5-三嗪(2,4-di([1,1'-biphenyl]-4-yl)-6-(4,4,5,5-tetramethyl-1,3,2-dioxaborolan-2-yl)-1,3,5-triazine)(17g,69.78%)。
[0412]
将2,4-二([1,1'-联苯]-4-基)-6-(4,4,5,5-四甲基-1,3,2-二氧杂硼烷-2-基)-1,3,5-三嗪(17g,33.24mmol)溶于thf中,添加4-溴-4'-碘-1,1'-联苯(4-bromo-4'-iodo-1,1'-biphenyl)(13.13g,36.56mmol)、pd(pph
3
)
4
(1.15g,1mmol)、k
2
co
3
(13.78g,99.72mmol)及水,并在100℃下回流搅拌3小时。当反应结束时,以e.a和水萃取,将有机层以mgso
4
干燥及浓缩,通过硅胶柱分离和纯化所得有机物,从而得到2,4-二([1,1'-联苯]-4-基)-6-(4'-溴-[1,1'-联苯]-4-基)-1,3,5-三嗪(2,4-di([1,1'-biphenyl]-4-yl)-6-(4'-bromo-[1,1'-biphenyl]-4-yl)-1,3,5-triazine)(14g,68.31%)。
[0413]
在圆底烧瓶中用dmf溶解2,4-二([1,1'-联苯]-4-基)-6-(4'-溴-[1,1'-联苯]-4-基)-1,3,5-三嗪(14g,22.71mmol),然后添加4,4,4',4',5,5,5',5'-八甲基-2,2'-双(1,3,2-二氧杂硼杂环戊烷)(6.34g,24.98mmol)、pd(dppf)cl
2
(0.5g,0.68mmol)及koac(6.69g,68.12mmol),在130℃下回流搅拌4小时。当反应结束时,通过蒸馏除去dmf,并用ch
2
cl
2
和水萃取。将有机层以mgso
4
干燥及浓缩,将所得化合物经过硅胶柱并重结晶,从而得到2,4-二([1,1'-联苯]-4-基)-6-(4'-(4,4,5,5-四甲基-1,3,2-二氧杂硼烷-2-基)-[1,1'-联苯]-4-基)-1,3,5-三嗪(2,4-di([1,1'-biphenyl]-4-yl)-6-(4'-(4,4,5,5-tetramethyl-1,3,2-dioxaborolan-2-yl)-[1,1'-biphenyl]-4-yl)-1,3,5-triazine)(10g,66.36%)。
[0414]
将2,4-二([1,1'-联苯]-4-基)-6-(4'-(4,4,5,5-四甲基-1,3,2-二氧杂硼烷-2-基)-[1,1'-联苯]-4-基)-1,3,5-三嗪(10g,15.07mmol)溶于thf中,添加1-溴-3-碘苯(4.69g,16.58mmol)、pd(pph
3
)
4
(0.52g,0.45mmol)、k
2
co
3
(6.25g,45.21mmol)及水,并在100℃下回流搅拌3小时。当反应结束时,以e.a和水萃取,将有机层以mgso
4
干燥及浓缩,通过硅胶柱分离和纯化所得有机物,从而得到2,4-二([1,1'-联苯]-4-基)-6-(3
”-
溴-[1,1':4',1
”-
三联苯]-4-基)-1,3,5-三嗪(2,4-di([1,1'-biphenyl]-4-yl)-6-(3
”-
bromo-[1,1':4',1
”-
terphenyl]-4-yl)-1,3,5-triazine)(7g,68.32%)。
[0415]
将7-氯吡啶并[2',3':4,5]噻吩并[2,3-b]喹喔啉(7-chloropyrido[2',3':4,5]thieno[2,3-b]quinoxaline)(10g,36.8mmol)溶于thf中,添加2,4-二([1,1'-联苯]-4-基)-6-(3
”-
溴-[1,1':4',1
”-
三联苯]-4-基)-1,3,5-三嗪(27.53g,40.48mmol)、pd(pph
3
)
4
(1.28g,1.1mmol)、naoh(4.42g,110.41mmol)及水,并在100℃下回流搅拌3小时。当反应结束时,以e.a和水萃取,将有机层以mgso
4
干燥及浓缩,将所产生的有机物经过硅胶柱并重结晶,从而得到20g的最终化合物(收率:64%)。
[0416]
参照下述合成式对化合物3-1-13的合成方法进行说明。
二氧杂硼杂环戊烷)(20.87g,82.18mmol)、pd(dppf)cl
2
(1.64g,2.24mmol)及koac(22g,224.11mmol),在130℃下回流搅拌4小时。当反应结束时,通过蒸馏除去dmf,并用ch
2
cl
2
和水萃取。将有机层以mgso
4
干燥及浓缩,将所得化合物经过硅胶柱并重结晶,从而得到4'-(4,4,5,5-四甲基-1,3,2-二氧杂硼烷-2-基)-4,2':6',4
”-
三联吡啶(4'-(4,4,5,5-tetramethyl-1,3,2-dioxaborolan-2-yl)-4,2':6',4
”-
terpyridine)(18g,67.07%)。
[0419]
将4'-(4,4,5,5-四甲基-1,3,2-二氧杂硼烷-2-基)-4,2':6',4
”-
三联吡啶(18g,50.11mmol)溶于thf中,添加3,3'-二溴-1,1'-联苯(17.2g,55.12mmol)、pd(pph
3
)
4
(1.74g,1.5mmol)、k
2
co
3
(20.77g,150.32mmol)及水,并在100℃下回流搅拌3小时。当反应结束时,以e.a和水萃取,将有机层以mgso
4
干燥及浓缩,通过硅胶柱分离和纯化所得有机物,从而得到4'-(3'-溴-[1,1'-联苯]-3-基)-4,2':6',4
”-
4'-(3'-bromo-[1,1'-biphenyl]-3-yl)-4,2':6',4
”-
三联吡啶(4'-(3'-bromo-[1,1'-biphenyl]-3-yl)-4,2':6',4
”-
terpyridine)(16g,68.76%)。
[0420]
在圆底烧瓶中用dmf溶解4'-(3'-溴-[1,1'-联苯]-3-基)-4,2':6',4
”-
4'-(3'-bromo-[1,1'-biphenyl]-3-yl)-4,2':6',4
”-
三联吡啶(16g,34.46mmol),然后添加4,4,4',4',5,5,5',5'-八甲基-2,2'-双(1,3,2-二氧杂硼杂环戊烷)(9.62g,37.9mmol)、pd(dppf)cl
2
(0.76g,1.03mmol)及koac(10.15g,103.37mmol),在130℃下回流搅拌4小时。当反应结束时,通过蒸馏除去dmf,并用ch
2
cl
2
和水萃取。将有机层以mgso
4
干燥及浓缩,将所得化合物经过硅胶柱并重结晶,从而得到4'-(3
”-
溴-[1,1':3',1
”-
三苯基]-3-基)-4,2':6',4
”-
三联吡啶(4'-(3
”-
bromo-[1,1':3',1
”-
terphenyl]-3-yl)-4,2':6',4
”-
terpyridine)(12g,68.09%)。
[0421]
将4'-(3'-((4,4,5,5-四甲基-1,3,2-二氧杂硼烷-2-基)-[1,1'-联苯]-3-基)-4,2':6',4
”-
三联吡啶(4'-(3'-(4,4,5,5-tetramethyl-1,3,2-dioxaborolan-2-yl)-[1,1'-biphenyl]-3-yl)-4,2':6',4
”-
terpyridine)(12g,23.46mmol)溶于thf中,添加1-溴-3-碘苯(7.3g,25.81mmol)、pd(pph
3
)
4
(0.81g,0.7mmol)、k
2
co
3
(2.82g,70.39mmol)及水,并在100℃下回流搅拌3小时。当反应结束时,以e.a和水萃取,将有机层以mgso
4
干燥及浓缩,通过硅胶柱分离和纯化所得有机物,从而得到4'-(3'-溴-[1,1'-联苯]-3-基)-4,2':6',4
”-
三联吡啶(4'-(3'-bromo-[1,1'-biphenyl]-3-yl)-4,2':6',4
”-
terpyridine)(9g,70.97%)。
[0422]
在圆底烧瓶中用dmf溶解4'-(3
”-
溴-[1,1':3',1
”-
三苯基]-3-基)-4,2':6',4
”-
三联吡啶(9g,16.65mmol),然后添加4,4,4',4',5,5,5',5'-八甲基-2,2'-双(1,3,2-二氧杂硼杂环戊烷)(4.65g,18.32mmol)、pd(dppf)cl
2
(0.37g,0.5mmol)及koac(4.9g,49.96mmol),在130℃下回流搅拌4小时。当反应结束时,通过蒸馏除去dmf,并用ch
2
cl
2
和水萃取。将有机层以mgso
4
干燥及浓缩,将所得化合物经过硅胶柱并重结晶,从而得到4'-(3
”-
(4,4,5,5-四甲基-1,3,2-二氧杂硼烷-2-基)-[1,1':3',1
”-
三联苯]-3-基)-4,2':6',4
”-
三联吡啶(4'-(3
”-
(4,4,5,5-tetramethyl-1,3,2-dioxaborolan-2-yl)-[1,1':3',1
”-
terphenyl]-3-yl)-4,2':6',4
”-
terpyridine)(6.5g,66.43%)。
[0423]
将4-氯-[1,2,3]三嗪[4',5':4,5]噻吩并[2,3-b]喹喔啉(10g,36.54mmol)溶于thf中,添加4'-(3
”-
(4,4,5,5-四甲基-1,3,2-二氧杂硼烷-2-基)-[1,1':3',1
”-
三联苯]-3-基)-4,2':6',4
”-
三联吡啶(23.61g,40.19mmol)、pd(pph
3
)
4
(1.27g,1.1mmol)、naoh(4.38g,109.61mmol)及水,并在100℃下回流搅拌3小时。当反应结束时,以e.a和水萃取,将
有机层以mgso
4
干燥及浓缩,将所产生的有机物经过硅胶柱并重结晶,从而得到16g的最终产物(收率:62.7%)。
[0424]
参照下述合成式对化合物3-1-15的合成方法进行说明。
[0425][0426]
在圆底烧瓶中用dmf溶解2-氯-4-苯基苯并[4,5]噻吩并[3,2-d]嘧啶(20g,
67.39mmol),然后添加4,4,4',4',5,5,5',5'-八甲基-2,2'-双(1,3,2-二氧杂硼杂环戊烷)(18.82g,74.13mmol)、pd(dppf)cl
2
(1.48g,2.02mmol)及koac(19.84g,202.18mmol),在130℃下回流搅拌4小时。当反应结束时,通过蒸馏除去dmf,并用ch
2
cl
2
和水萃取。将有机层以mgso
4
干燥及浓缩,将所得化合物经过硅胶柱并重结晶,从而得到4-苯基-2-(4,4,5,5-四甲基-1,3,2-二氧杂硼烷-2-基)苯并[4,5]噻吩并[3,2-d]嘧啶(18g,68.78%)。
[0427]
将作为中间产物的4-苯基-2-(4,4,5,5-四甲基-1,3,2-二氧杂硼烷-2-基)苯并[4,5]噻吩并[3,2-d]嘧啶(18g,46.36mmol)溶于thf中,添加1-溴-4-碘苯(14.43g,50.99mmol)、pd(pph
3
)
4
(1.61g,1.39mmol)、k
2
co
3
(5.56g,139.07mmol)及水,并在100℃下回流搅拌3小时。当反应结束时,以e.a和水萃取,将有机层以mgso
4
干燥及浓缩,通过硅胶柱分离和纯化所得有机物,从而得到2-(4-溴苯基)-4-苯基苯并[4,5]噻吩并[3,2-d]嘧啶(13g,67.19%)。
[0428]
反复地,在圆底烧瓶中用dmf溶解2-(4-溴苯基)-4-苯基苯并[4,5]噻吩并[3,2-d]嘧啶(13g,31.15mmol),然后添加4,4,4',4',5,5,5',5'-八甲基-2,2'-双(1,3,2-二氧杂硼杂环戊烷)(8.7g,34.27mmol)、pd(dppf)cl
2
(0.68g,0.93mmol)及koac(9.17g,93.45mmol),在130℃下回流搅拌4小时。当反应结束时,通过蒸馏除去dmf,并用ch
2
cl
2
和水萃取。将有机层以mgso
4
干燥及浓缩,将所得化合物经过硅胶柱并重结晶,从而得到4-苯基-2-(4-(4,4,5,5-四甲基-1,3,2-二氧杂硼烷-2-基)苯基)苯并[4,5]噻吩并[3,2-d]嘧啶(10g,69.12%)。
[0429]
将4-苯基-2-(4-(4,4,5,5-四甲基-1,3,2-二氧杂硼烷-2-基)苯基)苯并[4,5]噻吩并[3,2-d]嘧啶(10g,21.53mmol)溶于thf中,添加3,3'-二溴-1,1'-联苯(7.39g,23.69mmol)、pd(pph
3
)
4
(0.75g,0.65mmol)、k
2
co
3
(8.93g,64.6mmol)及水,并在100℃下回流搅拌3小时。当反应结束时,以e.a和水萃取,将有机层以mgso
4
干燥及浓缩,通过硅胶柱分离和纯化所得有机物,从而得到2-(3
”-
溴-[1,1':3',1
”-
三联苯基]-4-基)-4-苯基苯并[4,5]噻吩并[3,2-d]嘧啶(2-(3
”-
bromo-[1,1':3',1
”-
terphenyl]-4-yl)-4-phenylbenzo[4,5]thieno[3,2-d]pyrimidine)(8.5g,69.3%)。
[0430]
在圆底烧瓶中用dmf溶解2-(3
”-
溴-[1,1':3',1
”-
三联苯基]-4-基)-4-苯基苯并[4,5]噻吩并[3,2-d]嘧啶(8.5g,14.92mmol),然后添加4,4,4',4',5,5,5',5'-八甲基-2,2'-双(1,3,2-二氧杂硼杂环戊烷)(4.17g,16.42mmol)、pd(dppf)cl
2
(0.33g,0.45mmol)及koac(4.39g,44.77mmol),在130℃下回流搅拌4小时。当反应结束时,通过蒸馏除去dmf,并用ch
2
cl
2
和水萃取。将有机层以mgso
4
干燥及浓缩,将所得化合物经过硅胶柱并重结晶,从而得到4-苯基-2-(3
”-
(4,4,5,5-四甲基-1,3,2-二氧杂硼烷-2-基)-[1,1':3',1
”-
三联苯]-4-基)苯并[4,5]噻吩并[3,2-d]嘧啶(4-phenyl-2-(3
”-
(4,4,5,5-tetramethyl-1,3,2-dioxaborolan-2-yl)-[1,1':3',1
”-
terphenyl]-4-yl)benzo[4,5]thieno[3,2-d]pyrimidine)(6g,65.19%)。
[0431]
将6-氯苯并[4,5]噻吩并[2,3-c][1,6]萘啶(6-chlorobenzo[4,5]thieno[2,3-c][1,6]naphthyridine)(10g,36.94mmol)溶于thf中,添加4-苯基-2-(3
”-
(4,4,5,5-四甲基-1,3,2-二氧杂硼烷-2-基)-[1,1':3',1
”-
三联苯]-4-基)苯并[4,5]噻吩并[3,2-d]嘧啶(25.05g,40.63mmol)、pd(pph
3
)
4
(1.28g,1.11mmol)、naoh(4.43g,110.81mmol)及水,并在100℃下回流搅拌3小时。当反应结束时,以e.a和水萃取,将有机层以mgso
4
干燥及浓缩,将
所产生的有机物经过硅胶柱并重结晶,从而得到17g的最终产物(收率:63.5%)。
[0432]
参照下述合成式对化合物3-2-4的合成方法进行说明。
[0433][0434]
在圆底烧瓶中用dmf溶解2-溴-1-苯基-1h-苯并[d]咪唑(2-bromo-1-phenyl-1h-benzo[d]imidazole)(100g,366.12mmol),然后添加双(频哪醇)二硼(139.46g,549.18mmol)、pd(dppf)cl
2
(8.04g,10.98mmol)及koac(107.8g,1.1mol),在130℃下回流搅拌4小时。当反应结束时,通过蒸馏除去dmf,并用ch
2
cl
2
和水萃取。将有机层以mgso
4
干燥及浓缩,将所得化合物经过硅胶柱并重结晶,从而得到1-苯基-2-(4,4,5,5-四甲基-1,3,2-二氧杂硼烷-2-基)-1h-苯并[d]咪唑(1-phenyl-2-(4,4,5,5-tetramethyl-1,3,2-dioxaborolan-2-yl)-1h-benzo[d]imidazole)(76.2g,65%)。
[0435]
将1-苯基-2-(4,4,5,5-四甲基-1,3,2-二氧杂硼烷-2-基)-1h-苯并[d]咪唑(60g,187.38mmol)溶于thf中,添加4-溴-4'-碘-1,1'-联苯(80.72g,224.86mmol)、pd(pph
3
)
4
(6.5g,5.62mmol)、k
2
co
3
(77.68g,562.14mmol)及水,并在100℃下回流搅拌3小时。当反应结束时,以e.a和水萃取,将有机层以mgso
4
干燥及浓缩,通过硅胶柱分离和纯化所得有机物,从而得到2-(4'-溴-[1,1'-联苯]-4-基)-1-苯基-1h-苯并[d]咪唑(2-(4'-bromo-[1,1'-biphenyl]-4-yl)-1-phenyl-1h-benzo[d]imidazole)(52.6g,66%)。
[0436]
在圆底烧瓶中用dmf溶解2-(4'-溴-[1,1'-联苯]-4-基)-1-苯基-1h-苯并[d]咪唑(50g,117.55mmol),然后添加双(频哪醇)二硼(44.78g,176.33mmol)、pd(dppf)cl
2
(2.58g,
3.53mmol)及koac(34.6g,352.68mmol),在130℃下回流搅拌4小时。当反应结束时,通过蒸馏除去dmf,并用ch
2
cl
2
和水萃取。将有机层以mgso
4
干燥及浓缩,将所得化合物经过硅胶柱并重结晶,从而得到1-苯基-2-(4'-(4,4,5,5-四甲基-1,3,2-二氧杂硼烷-2-基)-[1,1'-联苯基]-4-基)-1h-苯并[d]咪唑(1-phenyl-2-(4'-(4,4,5,5-tetramethyl-1,3,2-dioxaborolan-2-yl)-[1,1'-biphenyl]-4-yl)-1h-benzo[d]imidazole)(36.1g,65%)。
[0437]
将11-氯苯并呋喃[2,3-b][1,5]萘啶(20g,78.53mmol)溶于thf中,添加1-苯基-2-(4'-(4,4,5,5-四甲基-1,3,2-二氧杂硼烷-2-基)-[1,1'-联苯基]-4-基)-1h-苯并[d]咪唑(55.65g,117.8mmol)、pd(pph
3
)
4
(2.72g,2.36mmol)、naoh(9.42g,235.6mmol)及水,并在100℃下回流搅拌3小时。当反应结束时,以e.a和水萃取,将有机层以mgso
4
干燥及浓缩,将所得化合物经过硅胶柱并重结晶,从而得到28.8g的最终产物(收率:65%)。
[0438]
参照下述合成式对化合物3-2-8的合成方法进行说明。
[0439][0440]
在圆底烧瓶中用dmf溶解4-([1,1'-联苯]-4-基)-2-溴喹唑啉(4-([1,1'-biphenyl]-4-yl)-2-bromoquinazoline)(100g,276.82mmol),然后添加双(频哪醇)二硼(105.45g,415.24mmol)、pd(dppf)cl
2
(6.08g,8.3mmol)及koac(81.5g,830.47mmol),在130℃下回流搅拌4小时。当反应结束时,通过蒸馏除去dmf,并用ch
2
cl
2
和水萃取。将有机层以mgso
4
干燥及浓缩,将所得化合物经过硅胶柱并重结晶,从而得到4-([1,1'-联苯]-4-基)-2-(4,4,5,5-四甲基-1,3,2-二氧杂硼烷-2-基)喹唑啉(4-([1,1'-biphenyl]-4-yl)-2-(4,4,5,5-tetramethyl-1,3,2-dioxaborolan-2-yl)quinazoline)(74.6g,66%)。
[0441]
将4-([1,1'-联苯]-4-基)-2-(4,4,5,5-四甲基-1,3,2-二氧杂硼烷-2-基)喹唑啉(70g,171.44mmol)溶于thf中,添加4,4
”-
二溴-1,1':4',1
”-
三联苯(4,4
”-
dibromo-1,1':
4',1
”–
terphenyl)(79.84g,205.73mmol)、pd(pph
3
)
4
(5.94g,5.14mmol)、k
2
co
3
(71.08g,514.32mmol)及水,并在100℃下回流搅拌3小时。当反应结束时,以e.a和水萃取,将有机层以mgso
4
干燥及浓缩,通过硅胶柱分离和纯化所得有机物,从而得到4-([1,1'-联苯]-4-基)-2-(4
”-
溴-[1,1':4',1
”-
三联苯]-4-基)喹唑啉(4-([1,1'-biphenyl]-4-yl)-2-(4
”-
bromo-[1,1':4',1
”-
terphenyl]-4-yl)quinazoline)(66.7g,66%)。
[0442]
在圆底烧瓶中用dmf溶解4-([1,1'-联苯]-4-基)-2-(4
”-
溴-[1,1':4',1
”-
三联苯]-4-基)喹唑啉(60g,101.77mmol),然后添加双(频哪醇)二硼(38.77g,152.66mmol)、pd(dppf)cl
2
(2.23g,3.05mmol)及koac(29.96g,305.32mmol),在130℃下回流搅拌4小时。当反应结束时,通过蒸馏除去dmf,并用ch
2
cl
2
和水萃取。将有机层以mgso
4
干燥及浓缩,将所得化合物经过硅胶柱并重结晶,从而得到4-([1,1'-联苯]-4-基)-2-(4
”-
(4,4,5,5-四甲基-1,3,2-二氧杂硼烷-2-基)-[1,1':4',1
”-
三联苯基]-4-基)喹唑啉(4-([1,1'-biphenyl]-4-yl)-2-(4
”-
(4,4,5,5-tetramethyl-1,3,2-dioxaborolan-2-yl)-[1,1':4',1
”-
terphenyl]-4-yl)quinazoline)(42.4g,65.5%)。
[0443]
将9-氯苯并呋喃[2,3-b]吩嗪(9-chlorobenzofuro[2,3-b]phenazine)(20g,65.63mmol)溶于thf中,添加4-([1,1'-联苯]-4-基)-2-(4
”-
(4,4,5,5-四甲基-1,3,2-二氧杂硼烷-2-基)-[1,1':4',1
”-
三联苯基]-4-基)喹唑啉(62.67g,98.45mmol)、pd(pph
3
)
4
(2.28g,1.97mmol)、naoh(7.88g,196.9mmol)及水,并在100℃下回流搅拌3小时。当反应结束时,以e.a和水萃取,将有机层以mgso
4
干燥及浓缩,将所得化合物经过硅胶柱并重结晶,从而得到34.7g的最终产物(收率:68%)。
[0444]
参照下述合成式对化合物3-2-11的合成方法进行说明。
[0445]
[0446][0447]
在圆底烧瓶中用dmf溶解2-溴-4-苯基喹唑啉(2-bromo-4-phenylquinazoline)(100g,350.7mmol),然后添加双(频哪醇)二硼(133.59g,526.06mmol)、pd(dppf)cl
2
(7.7g,10.52mmol)及koac(103.25g,1.1mol),在130℃下回流搅拌4小时。当反应结束时,通过蒸馏除去dmf,并用ch
2
cl
2
和水萃取。将有机层以mgso
4
干燥及浓缩,将所得化合物经过硅胶柱并重结晶,从而得到4-苯基-2-(4,4,5,5-四甲基-1,3,2-二氧杂硼烷-2-基)喹唑啉(4-phenyl-2-(4,4,5,5-tetramethyl-1,3,2-dioxaborolan-2-yl)quinazoline)(75.7g,65%)。
[0448]
将4-苯基-2-(4,4,5,5-四甲基-1,3,2-二氧杂硼烷-2-基)喹唑啉(70g,210.71mmol)溶于thf中,添加3,3'-二溴-1,1'-联苯(78.89g,252.85mmol)、pd(pph
3
)
4
(7.3g,6.32mmol)、k
2
co
3
(87.36g,632.13mmol)及水,并在100℃下回流搅拌3小时。当反应结束时,以e.a和水萃取,将有机层以mgso
4
干燥及浓缩,通过硅胶柱分离和纯化所得有机物,从而得到2-(3'-溴-[1,1'-联苯]-3-基)-4-苯基喹唑啉(2-(3'-bromo-[1,1'-biphenyl]-3-yl)-4-phenylquinazoline)(62.7g,68%)。
[0449]
在圆底烧瓶中用dmf溶解2-(3'-溴-[1,1'-联苯]-3-基)-4-苯基喹唑啉(60g,137.19mmol),然后添加双(频哪醇)二硼(52.26g,205.79mmol)、pd(dppf)cl
2
(3.01g,4.12mmol)及koac(40.39g,411.58mmol),在130℃下回流搅拌4小时。当反应结束时,通过蒸馏除去dmf,并用ch
2
cl
2
和水萃取。将有机层以mgso
4
干燥及浓缩,将所得化合物经过硅胶柱并重结晶,从而得到4-苯基-2-(3'-(4,4,5,5-四甲基-1,3,2-二氧杂硼烷-2-基)-[1,1'-联
苯基]-3-基)喹唑啉(4-phenyl-2-(3'-(4,4,5,5tetramethyl-1,3,2-dioxaborolan-2-yl)-[1,1'-biphenyl]-3-yl)quinazoline)(42.5g,64%)。
[0450]
将4-苯基-2-(3'-(4,4,5,5-四甲基-1,3,2-二氧杂硼烷-2-基)-[1,1'-联苯基]-3-基)喹唑啉(40g,82.57mmol)溶于thf中,添加1-溴-4-碘苯(28.03g,99.09mmol)、pd(pph
3
)
4
(2.86g,2.48mmol)、k
2
co
3
(34.24g,247.72mmol)及水,并在100℃下回流搅拌3小时。当反应结束时,以e.a和水萃取,将有机层以mgso
4
干燥及浓缩,通过硅胶柱分离和纯化所得有机物,从而得到2-(4
”-
溴-[1,1':3',1
”-
三联苯基]-3-yl)-4-苯基喹唑啉(2-(4
”-
bromo-[1,1':3',1
”-
terphenyl]-3-yl)-4-phenylquinazoline)(27.6g,65%)。
[0451]
在圆底烧瓶中用dmf溶解2-(4
”-
溴-[1,1':3',1
”-
三联苯基]-3-yl)-4-苯基喹唑啉(27.6g,53.76mmol),然后添加双(频哪醇)二硼(20.48g,80.63mmol)、pd(dppf)cl
2
(1.18g,1.61mmol)及koac(15.83g,161.27mmol),在130℃下回流搅拌4小时。当反应结束时,通过蒸馏除去dmf,并用ch
2
cl
2
和水萃取。将有机层以mgso
4
干燥及浓缩,将所得化合物经过硅胶柱并重结晶,从而得到4-苯基-2-(4
”-
(4,4,5,5-四甲基-1,3,2-二氧杂硼烷-2-基)-[1,1':3',1
”-
三联苯]-3-基)喹唑啉(4-phenyl-2-(4
”-
(4,4,5,5-tetramethyl-1,3,2-dioxaborolan-2-yl)-[1,1':3',1
”-
terphenyl]-3-yl)quinazoline)(19g,63%)。
[0452]
将3-溴萘并[1',2':4,5]呋喃[2,3-b]吡啶并[2,3-e]吡嗪(3-bromonaphtho[1',2':4,5]furo[2,3-b]pyrido[2,3-e]pyrazine)(20g,57.11mmol)溶于thf中,添加4-苯基-2-(4
”-
(4,4,5,5-四甲基-1,3,2-二氧杂硼烷-2-基)-[1,1':3',1
”-
三联苯]-3-基)喹唑啉(48.02g,85.67mmol)、pd(pph
3
)
4
(1.98g,1.71mmol)、naoh(6.85g,171.34mmol)及水,并在100℃下回流搅拌3小时。当反应结束时,以e.a和水萃取,将有机层以mgso
4
干燥及浓缩,将所得化合物经过硅胶柱并重结晶,从而得到26.9g的最终产物(收率:67%)。
[0453]
参照下述合成式对化合物3-2-12的合成方法进行说明。
[0454]
(4,4,5,5-tetramethyl-1,3,2-dioxaborolan-2-yl)phenyl)benzo[4,5]thieno[3,2-d]pyrimidine)(19.8g,64%)。
[0459]
将4-([1,1'-联苯]-4-基)-2-(3-(4,4,5,5-四甲基-1,3,2-二氧杂硼烷-2-基)苯基)苯并[4,5]噻吩并[3,2-d]嘧啶(19g,35.15mmol)溶于thf中,添加4,4'-二溴-1,1'-联苯(4,4'-dibromo-1,1'-biphenyl)(13.16g,42.18mmol)、pd(pph
3
)
4
(1.22g,1.05mmol)、k
2
co
3
(14.57g,105.46mmol)及水,并在100℃下回流搅拌3小时。当反应结束时,以e.a和水萃取,将有机层以mgso
4
干燥及浓缩,通过硅胶柱分离和纯化所得有机物,从而得到4-([1,1'-联苯]-4-基)-2-(4
”-
溴-[1,1':4',1
”-
三联苯]-3-基)苯并[4,5]噻吩并[3,2-d]嘧啶(4-([1,1'-biphenyl]-4-yl)-2-(4
”-
bromo-[1,1':4',1
”-
terphenyl]-3-yl)benzo[4,5]thieno[3,2-d]pyrimidine)(14.8g,65%)。
[0460]
在圆底烧瓶中用dmf溶解4-([1,1'-联苯]-4-基)-2-(4
”-
溴-[1,1':4',1
”-
三联苯]-3-基)苯并[4,5]噻吩并[3,2-d]嘧啶(14g,21.68mmol),然后添加双(频哪醇)二硼(8.26g,32.53mmol)、pd(dppf)cl
2
(0.48g,0.65mmol)及koac(6.38g,65.05mmol),在130℃下回流搅拌4小时。当反应结束时,通过蒸馏除去dmf,并用ch
2
cl
2
和水萃取。将有机层以mgso
4
干燥及浓缩,将所得化合物经过硅胶柱并重结晶,从而得到4-([1,1'-联苯]-4-基)-2-(4
”-
(4,4,5,5-四甲基-1,3,2-二氧杂硼烷-2-基)-[1,1':4',1
”-
三联苯]-3-基)苯并[4,5]噻吩并[3,2-d]嘧啶(4-([1,1'-biphenyl]-4-yl)-2-(4
”-
(4,4,5,5-tetramethyl-1,3,2-dioxaborolan-2-yl)-[1,1':4',1
”-
terphenyl]-3-yl)benzo[4,5]thieno[3,2-d]pyrimidine)(10.2g,68%)。
[0461]
将6-氯苯并呋喃[2,3-h]喹唑啉(6-chlorobenzofuro[2,3-h]quinazoline)(20g,78.53mmol)溶于thf中,添加4-([1,1'-联苯]-4-基)-2-(4
”-
(4,4,5,5-四甲基-1,3,2-二氧杂硼烷-2-基)-[1,1':4',1
”-
三联苯]-3-基)苯并[4,5]噻吩并[3,2-d]嘧啶(81.6g,117.8mmol)、pd(pph
3
)
4
(2.72g,2.36mmol)、naoh(9.42g,235.6mmol)及水,并在100℃下回流搅拌3小时。当反应结束时,以e.a和水萃取,将有机层以mgso
4
干燥及浓缩,将所得化合物经过硅胶柱并重结晶,从而得到42.5g的最终产物(收率:69%)。
[0462]
参照下述合成式对化合物3-2-14的合成方法进行说明。
[0463]
[0464][0465]
在圆底烧瓶中用dmf溶解2,4-二([1,1'-联苯]-4-基)-6-氯-1,3,5-三嗪(100g,238.15mmol),然后添加双(频哪醇)二硼(90.71g,357.22mmol)、pd(dppf)cl
2
(5.23g,7.14mmol)及koac(70.12g,714.44mmol),在130℃下回流搅拌4小时。当反应结束时,通过蒸馏除去dmf,并用ch
2
cl
2
和水萃取。将有机层以mgso
4
干燥及浓缩,将所得化合物经过硅胶柱并重结晶,从而得到2,4-二([1,1'-联苯]-4-基)-6-(4,4,5,5-四甲基-1,3,2-二氧杂硼烷-2-基)-1,3,5-三嗪(77g,64%)。
[0466]
将2,4-二([1,1'-联苯]-4-基)-6-(4,4,5,5-四甲基-1,3,2-二氧杂硼烷-2-基)-1,3,5-三嗪(70g,136.87mmol)溶于thf中,添加1-溴-3-碘苯(51.24g,164.25mmol)、pd(pph
3
)
4
(4.74g,4.11mmol)、k
2
co
3
(56.75g,410.61mmol)及水,并在100℃下回流搅拌3小时。当反应结束时,以e.a和水萃取,将有机层以mgso
4
干燥及浓缩,通过硅胶柱分离和纯化所得有机物,从而得到2,4-二([1,1'-联苯]-4-基)-6-(3-溴苯基)-1,3,5-三嗪(2,4-di([1,1'-biphenyl]-4-yl)-6-(3-bromophenyl)-1,3,5-triazine)(48.8g,66%)。
[0467]
在圆底烧瓶中用dmf溶解2,4-二([1,1'-联苯]-4-基)-6-(3-溴苯基)-1,3,5-三嗪(45g,83.26mmol),然后添加双(频哪醇)二硼(31.72g,124.89mmol)、pd(dppf)cl
2
(1.83g,2.50mmol)及koac(24.51g,249.79mmol),在130℃下回流搅拌4小时。当反应结束时,通过蒸馏除去dmf,并用ch
2
cl
2
和水萃取。将有机层以mgso
4
干燥及浓缩,将所得化合物经过硅胶柱并重结晶,从而得到2,4-二([1,1'-联苯]-4-基]-6-(3-(4,4,5,5-四甲基-1,3,2-二氧杂硼
烷-2-基)苯基)-1,3,5-三嗪(2,4-di([1,1'-biphenyl]-4-yl)-6-(3-(4,4,5,5-tetramethyl-1,3,2-dioxaborolan-2-yl)phenyl)-1,3,5-triazine)(31.3g,64%)。
[0468]
将2,4-二([1,1'-联苯]-4-基)-6-(3-(4,4,5,5-四甲基-1,3,2-二氧杂硼烷-2-基)苯基)-1,3,5-三嗪(2,4-di([1,1'-biphenyl]-4-yl)-6-(3-(4,4,5,5-tetramethyl-1,3,2-dioxaborolan-2-yl)phenyl)-1,3,5-triazine)(30g,51.06mmol)溶于thf中,添加1-溴-4-碘苯(17.33g,61.27mmol)、pd(pph
3
)
4
(1.77g,1.53mmol)、k
2
co
3
(21.17g,153.18mmol)及水,并在100℃下回流搅拌3小时。当反应结束时,以e.a和水萃取,将有机层以mgso
4
干燥及浓缩,通过硅胶柱分离和纯化所得有机物,从而得到2,4-二([1,1'-联苯]-4-基)-6-(4'-溴-[1,1'-联苯]-3-基)-1,3,5-三嗪(2,4-di([1,1'-biphenyl]-4-yl)-6-(4'-bromo-[1,1'-biphenyl]-3-yl)-1,3,5-triazine)(20.5g,65%)。
[0469]
在圆底烧瓶中用dmf溶解2,4-二([1,1'-联苯]-4-基)-6-(4'-溴-[1,1'-联苯]-3-基)-1,3,5-三嗪(20g,32.44mmol),然后添加双(频哪醇)二硼(12.36g,48.66mmol)、pd(dppf)cl
2
(0.71g,0.97mmol)及koac(9.55g,97.31mmol),在130℃下回流搅拌4小时。当反应结束时,通过蒸馏除去dmf,并用ch
2
cl
2
和水萃取。将有机层以mgso
4
干燥及浓缩,将所得化合物经过硅胶柱并重结晶,从而得到2,4-二([1,1'-联苯]-4-基)-6-(4'-(4,4,5,5-四甲基-1,3,2-二氧杂硼烷-2-基)-[1,1'-联苯]-3-基)-1,3,5-三嗪(2,4-di([1,1'-biphenyl]-4-yl)-6-(4'-(4,4,5,5-tetramethyl-1,3,2-dioxaborolan-2-yl)-[1,1'-biphenyl]-3-yl)-1,3,5-triazine)(14.6g,68%)。
[0470]
将2,4-二([1,1'-联苯]-4-基)-6-(4'-(4,4,5,5-四甲基-1,3,2-二氧杂硼烷-2-基)-[1,1'-联苯]-3-基)-1,3,5-三嗪(14g,21.1mmol)溶于thf中,添加1-溴-3-碘苯(7.16g,25.32mmol)、pd(pph
3
)
4
(0.73g,0.63mmol)、k
2
co
3
(8.75g,63.29mmol)及水,并在100℃下回流搅拌3小时。当反应结束时,以e.a和水萃取,将有机层以mgso
4
干燥及浓缩,通过硅胶柱分离和纯化所得有机物,从而得到2,4-二([1,1'-联苯]-4-基)-6-(3
”-
溴-[1,1':4',1
”-
三联苯]-3-基)-1,3,5-三嗪(2,4-di([1,1'-biphenyl]-4-yl)-6-(3
”-
bromo-[1,1':4',1
”-
terphenyl]-3-yl)-1,3,5-triazine)(9.5g,65%)。
[0471]
在圆底烧瓶中用dmf溶解2,4-二([1,1'-联苯]-4-基)-6-(3
”-
溴-[1,1':4',1
”-
三联苯]-3-基)-1,3,5-三嗪(9g,12.99mmol),然后添加双(频哪醇)二硼(4.95g,19.49mmol)、pd(dppf)cl
2
(0.29g,0.39mmol)及koac(3.83g,38.98mmol),在130℃下回流搅拌4小时。当反应结束时,通过蒸馏除去dmf,并用ch
2
cl
2
和水萃取。将有机层以mgso
4
干燥及浓缩,将所得化合物经过硅胶柱并重结晶,从而得到2,4-二([1,1'-联苯]-4-基)-6-(3
”-
(4,4,5,5-四甲基-1,3,2-二氧杂硼烷-2-基)-[1,1':4',1
”-
三联苯基]-3-yl)-1,3,5-三嗪(2,4-di([1,1'-biphenyl]-4-yl)-6-(3
”-
(4,4,5,5-tetramethyl-1,3,2-dioxaborolan-2-yl)-[1,1':4',1
”-
terphenyl]-3-yl)-1,3,5-triazine)(6.5g,68%)。
[0472]
将6-氯苯并呋喃[2,3-h]喹唑啉(20g,66.86mmol)溶于thf中,添加2,4-二([1,1'-联苯]-4-基)-6-(3
”-
(4,4,5,5-四甲基-1,3,2-二氧杂硼烷-2-基)-[1,1':4',1
”-
三联苯]-3-基)-1,3,5-三嗪(74.19g,100.29mmol)、pd(pph
3
)
4
(2.32g,2.01mmol)、naoh(8.02g,200.58mmol)及水,并在100℃下回流搅拌3小时。当反应结束时,以e.a和水萃取,将有机层以mgso
4
干燥及浓缩,将所得化合物经过硅胶柱并重结晶,从而得到38.4g的最终产物(收率:69%)。
[0473]
参照下述合成式对化合物3-2-16的合成方法进行说明。
[0474][0475]
在圆底烧瓶中用dmf溶解2-氯-4-苯基喹唑啉(2-chloro-4-phenylquinazoline)
(20g,83.09mmol),然后添加4,4,4',4',5,5,5',5'-八甲基-2,2'-双(1,3,2-二氧杂硼杂环戊烷)(23.21g,91.4mmol)、pd(dppf)cl
2
(1.82g,2.49mmol)及koac(24.47g,249.28mmol),在130℃下回流搅拌4小时。当反应结束时,通过蒸馏除去dmf,并用ch
2
cl
2
和水萃取。将有机层以mgso
4
干燥及浓缩,将所得化合物经过硅胶柱并重结晶,从而得到4-苯基-2-(4,4,5,5-四甲基-1,3,2-二氧杂硼烷-2-基)喹唑啉(19g,68.82%)。
[0476]
将4-苯基-2-(4,4,5,5-四甲基-1,3,2-二氧杂硼烷-2-基)喹唑啉(19g,57.19mmol)溶于thf中,添加1,4-二溴萘(1,4-dibromonaphthalene)(19.63g,62.91mmol)、pd(pph
3
)
4
(1.98g,1.72mmol)、k
2
co
3
(23.71g,171.58mmol)及水,并在100℃下回流搅拌3小时。当反应结束时,以e.a和水萃取,将有机层以mgso
4
干燥及浓缩,通过硅胶柱分离和纯化所得有机物,从而得到2-(4-溴萘-1-基)-4-苯基喹唑啉(2-(4-bromonaphthalen-1-yl)-4-phenylquinazoline)(16g,68.01%)。
[0477]
在圆底烧瓶中用dmf溶解2-(4-溴萘-1-基)-4-苯基喹唑啉(16g,38.9mmol),然后添加4,4,4',4',5,5,5',5'-八甲基-2,2'-双(1,3,2-二氧杂硼杂环戊烷)(10.87g,42.79mmol)、pd(dppf)cl
2
(0.85g,1.17mmol)及koac(11.45g,116.7mmol),在130℃下回流搅拌4小时。当反应结束时,通过蒸馏除去dmf,并用ch
2
cl
2
和水萃取。将有机层以mgso
4
干燥及浓缩,将所得化合物经过硅胶柱并重结晶,从而得到4-苯基-2-(4-(4,4,5,5-四甲基-1,3,2-二氧杂硼烷-2-基)萘-1-基)喹唑啉(4-phenyl-2-(4-(4,4,5,5-tetramethyl-1,3,2-dioxaborolan-2-yl)naphthalen-1-yl)quinazoline)(12g,67.29%)。
[0478]
将4-苯基-2-(4-(4,4,5,5-四甲基-1,3,2-二氧杂硼烷-2-基)萘-1-基)喹唑啉(12g,26.18mmol)溶于thf中,添加1-溴-4-碘苯(8.15g,28.8mmol)、pd(pph
3
)
4
(0.91g,0.79mmol)、k
2
co
3
(10.85g,78.54mmol)及水,并在100℃下回流搅拌3小时。当反应结束时,以e.a和水萃取,将有机层以mgso
4
干燥及浓缩,通过硅胶柱分离和纯化所得有机物,从而得到2-(4-(4-溴苯基)萘-1-基)-4-苯基喹唑啉(2-(4-(4-bromophenyl)naphthalen-1-yl)-4-phenylquinazoline)(8g,62.69%)。
[0479]
在圆底烧瓶中用dmf溶解2-(4-(4-溴苯基)萘-1-基)-4-苯基喹唑啉(8g,16.41mmol),然后添加4,4,4',4',5,5,5',5'-八甲基-2,2'-双(1,3,2-二氧杂硼杂环戊烷)(4.58g,18.05mmol)、pd(dppf)cl
2
(0.36g,0.49mmol)及koac(4.83g,49.24mmol),在130℃下回流搅拌4小时。当反应结束时,通过蒸馏除去dmf,并用ch
2
cl
2
和水萃取。将有机层以mgso
4
干燥及浓缩,将所得化合物经过硅胶柱并重结晶,从而得到4-苯基-2-(4-(4-(4,4,5,5-四甲基-1,3,2-二氧杂硼烷-2-基)苯基)萘-1-基)喹唑啉(4-phenyl-2-(4-(4-(4,4,5,5-tetramethyl-1,3,2-dioxaborolan-2-yl)phenyl)naphthalen-1-yl)quinazoline)(6g,68.39%)。
[0480]
将6-氯苯并[4,5]噻吩并[2,3-c][1,6]萘啶(15g,55.41mmol)溶于thf中,添加4-苯基-2-(4-(4-(4,4,5,5-四甲基-1,3,2-二氧杂硼烷-2-基)苯基)萘-1-基)喹唑啉(32.57g,60.95mmol)、pd(pph
3
)
4
(1.92g,1.66mmol)、naoh(6.65g,166.22mmol)及水,并在100℃下回流搅拌3小时。当反应结束时,以e.a和水萃取,将有机层以mgso
4
干燥及浓缩,所产生的有机物经过硅胶柱并重结晶,从而得到24g的最终产物(收率:67.38%)。
[0481]
参照下述合成式对化合物3-2-17的合成方法进行说明。
[0482]
[0483][0484]
在圆底烧瓶中用dmf溶解2-氯-4,6-二苯基-1,3,5-三嗪(20g,74.7mmol),然后添加4,4,4',4',5,5,5',5'-八甲基-2,2'-双(1,3,2-二氧杂硼杂环戊烷)(20.87g,82.18mmol)、pd(dppf)cl
2
(1.64g,2.24mmol)及koac(22g,224.11mmol),在130℃下回流搅拌4小时。当反应结束时,通过蒸馏除去dmf,并用ch
2
cl
2
和水萃取。将有机层以mgso
4
干燥及浓缩,将所得化合物经过硅胶柱并重结晶,从而得到2,4-二苯基-6-(4,4,5,5-四甲基-1,3,2-二氧杂硼烷-2-基)-1,3,5-三嗪(18g,67.07%)。
[0485]
将2,4-二苯基-6-(4,4,5,5-四甲基-1,3,2-二氧杂硼烷-2-基)-1,3,5-三嗪(18g,50.11mmol)溶于thf中,添加1-溴-4-碘苯(15.59g,55.12mmol)、pd(pph
3
)
4
(1.74g,1.5mmol)、k
2
co
3
(20.77g,150.32mmol)及水,并在100℃下回流搅拌3小时。当反应结束时,以
e.a和水萃取,将有机层以mgso
4
干燥及浓缩,通过硅胶柱分离和纯化所得有机物,从而得到2-(4-溴苯基)-4,6-二苯基-1,3,5-三嗪(2-(4-bromophenyl)-4,6-diphenyl-1,3,5-triazine)(13g,66.82%)。
[0486]
在圆底烧瓶中用dmf溶解2-(4-溴苯基)-4,6-二苯基-1,3,5-三嗪(13g,33.48mmol),然后添加4,4,4',4',5,5,5',5'-八甲基-2,2'-双(1,3,2-二氧杂硼杂环戊烷)(9.35g,36.83mmol)、pd(dppf)cl
2
(0.73g,1mmol)及koac(9.86g,100.45mmol),在130℃下回流搅拌4小时。当反应结束时,通过蒸馏除去dmf,并用ch
2
cl
2
和水萃取。将有机层以mgso
4
干燥及浓缩,将所得化合物经过硅胶柱并重结晶,从而得到2,4-二苯基-6-(4-(4,4,5,5-四甲基-1,3,2-二氧杂硼烷-2-基)苯基)-1,3,5-三嗪(2,4-diphenyl-6-(4-(4,4,5,5-tetramethyl-1,3,2-dioxaborolan-2-yl)phenyl)-1,3,5-triazine)(10g,68.6%)。
[0487]
将2,4-二苯基-6-(4-(4,4,5,5-四甲基-1,3,2-二氧杂硼烷-2-基)苯基)-1,3,5-三嗪(10g,22.97mmol)溶于thf中,添加1,4-二溴萘(7.23g,25.27mmol)、pd(pph
3
)
4
(0.8g,0.69mmol)、k
2
co
3
(9.52g,68.91mmol)及水,并在100℃下回流搅拌3小时。当反应结束时,以e.a和水萃取,将有机层以mgso
4
干燥及浓缩,通过硅胶柱分离和纯化所得有机物,从而得到2-(4-(4-溴萘-1-基)苯基)-4,6-二苯基-1,3,5-三嗪(2-(4-(4-bromonaphthalen-1-yl)phenyl)-4,6-diphenyl-1,3,5-triazine)(8g,67.69%)。
[0488]
在圆底烧瓶中用dmf溶解2-(4-(4-溴萘-1-基)苯基)-4,6-二苯基-1,3,5-三嗪(8g,15.55mmol),然后添加4,4,4',4',5,5,5',5'-八甲基-2,2'-双(1,3,2-二氧杂硼杂环戊烷)(4.34g,17.11mmol)、pd(dppf)cl
2
(0.34g,0.47mmol)及koac(4.58g,46.65mmol),在130℃下回流搅拌4小时。当反应结束时,通过蒸馏除去dmf,并用ch
2
cl
2
和水萃取。将有机层以mgso
4
干燥及浓缩,将所得化合物经过硅胶柱并重结晶,从而得到2,4-二苯基-6-(4-(4-(4,4,5,5-四甲基-1,3,2-二氧杂硼烷-2-基)萘-1-基)苯基)-1,3,5-三嗪(2,4-diphenyl-6-(4-(4-(4,4,5,5-tetramethyl-1,3,2-dioxaborolan-2-yl)naphthalen-1-yl)phenyl)-1,3,5-triazine)(6g,68.6%)。
[0489]
将2,4-二苯基-6-(4-(4-(4,4,5,5-四甲基-1,3,2-二氧杂硼烷-2-基)萘-1-基)苯基)-1,3,5-三嗪(6g,10.69mmol)溶于thf中,添加1-溴-4-碘苯(3.33g,11.75mmol)、pd(pph
3
)
4
(0.37g,0.32mmol)、k
2
co
3
(4.43g,32.06mmol)及水,并在100℃下回流搅拌3小时。当反应结束时,以e.a和水萃取,将有机层以mgso
4
干燥及浓缩,通过硅胶柱分离和纯化所得有机物,从而得到2-(4-(4-(4-溴苯基)萘-1-基)苯基)-4,6-二苯基-1,3,5-三嗪(2-(4-(4-(4-bromophenyl)naphthalen-1-yl)phenyl)-4,6-diphenyl-1,3,5-triazine)(4.2g,66%)。
[0490]
在圆底烧瓶中用dmf溶解2-(4-(4-(4-溴苯基)萘-1-基)苯基)-4,6-二苯基-1,3,5-三嗪(4g,6.77mmol),然后添加4,4,4',4',5,5,5',5'-八甲基-2,2'-双(1,3,2-二氧杂硼杂环戊烷)(1.89g,7.45mmol)、pd(dppf)cl
2
(0.15g,0.2mmol)及koac(1.99g,20.32mmol),在130℃下回流搅拌4小时。当反应结束时,通过蒸馏除去dmf,并用ch
2
cl
2
和水萃取。将有机层以mgso
4
干燥及浓缩,将所得化合物经过硅胶柱并重结晶,从而得到2,4-二苯基-6-(4-(4-(4-(4,4,5,5-四甲基-1,3,2-二氧杂硼烷-2-基)苯基)萘-1-基)苯基)-1,3,5-三嗪(2,4-diphenyl-6-(4-(4-(4-(4,4,5,5-tetramethyl-1,3,2-dioxaborolan-2-yl)phenyl)naphthalen-1-yl)phenyl)-1,3,5-triazine)(2.8g,65%)。
[0491]
将3-氯苯并呋喃[2,3-b]喹喔啉(20g,78.53mmol)溶于thf中,添加2,4-二苯基-6-(4-(4-(4-(4,4,5,5-四甲基-1,3,2-二氧杂硼烷-2-基)苯基)萘-1-基)苯基)-1,3,5-三嗪(55.08g,86.39mmol)、pd(pph
3
)
4
(2.72g,2.36mmol)、naoh(9.42g,235.6mmol)及水,并在100℃下回流搅拌3小时。当反应结束时,以e.a和水萃取,将有机层以mgso
4
干燥及浓缩,所产生的有机物经过硅胶柱并重结晶,从而得到38.4g的最终产物(收率:67%)。
[0492]
剩余化合物也可以以相同的方法被合成。
[0493]
表5
[0494][0495]
[0496]
[有机电致发光器件制造例]
[0497]
实施例1~50(在蓝色有机电致发光器件的电子传输层中的应用例)
[0498]
将科宁(corning)15ω/cm
2
ito玻璃基板浸入溶解有分散剂的蒸馏水中以用超声波进行清洗。此处使用的洗涤剂为购买自fischer co.的产品,蒸馏水为使用购买自millipore co.的过滤器(filter)过滤两次的蒸馏水。将ito洗涤30分钟,然后用蒸馏水重复两次超声波洗涤10分钟。用蒸馏水洗涤完成后,随后依次用异丙醇、丙酮和甲醇溶剂进行超声波洗涤,并进行干燥。
[0499]
通过在ito阳极层上真空沉积2-tnata来形成厚度为60nm的空穴注入层,然后在上述空穴注入层上真空沉积4,4-双[n-(1-萘基)-n-苯基氨基]联苯(以下简称为npb)来形成厚度为30nm的空穴传输层。
[0500]
在上述空穴传输层上以98:2的重量比共沉积作为主体的adn和作为掺杂剂的4,4'-双[2-(4-(n,n-二苯基氨基)苯基)乙烯基]联苯(以下简称为dpavbi),从而形成厚度为30nm的发光层。
[0501]
在上述发光层上真空沉积本发明的化学式1的化合物中的一种来形成厚度为30nm的电子传输层之后,通过在上述电子传输层上真空沉积lif来形成厚度为1nm的电子注入层,然后在上述电子注入层上真空沉积铝来形成厚度为300nm的阴极,从而制成有机电致发光器件。
[0502]
比较例1
[0503]
除了作为电子传输层材料使用下述et1代替本发明的由化学式1表示的化合物之外,其余以与上述实施例相同的方法制造有机电致发光器件。
[0504]
<et1>alq
3
[0505][0506]
比较例2
[0507]
除了作为电子传输层材料使用下述et2代替本发明的由化学式1表示的化合物之外,其余以与上述实施例相同的方法制造有机电致发光器件。
[0508]
<et2>
[0509][0510]
表6
[0511]
[0512][0513][0514]
由上述表6的结果可知,使用本发明的化合物的蓝色有机电致发光器件(oled)与以往作为电子传输层材料广泛使用的alq
3
即et1和et2相比呈现低驱动电压和高效率。
[0515]
实施例51~67(在蓝色有机电致发光器件的电子传输辅助层中的应用例)
[0516]
将科宁(corning)15ω/cm
2
ito玻璃基板浸入溶解有分散剂的蒸馏水中以用超声波进行清洗。此处使用的洗涤剂为购买自fischer co.的产品,蒸馏水为使用购买自millipore co.的过滤器(filter)过滤两次的蒸馏水。将ito洗涤30分钟,然后用蒸馏水重复两次超声波洗涤10分钟。用蒸馏水洗涤完成后,随后依次用异丙醇、丙酮和甲醇溶剂进行超声波洗涤,并进行干燥。
[0517]
通过在ito阳极层上真空沉积2-tnata来形成厚度为60nm的空穴注入层,然后在上述空穴注入层上真空沉积4,4-双[n-(1-萘基)-n-苯基氨基]联苯(以下简称为npb)来形成厚度为30nm的空穴传输层。
[0518]
在上述空穴传输层上以98:2的重量比共沉积作为主体的adn和作为掺杂剂的4,4'-双[2-(4-(n,n-二苯基氨基)苯基)乙烯基]联苯(以下简称为dpavbi),从而形成厚度为30nm的发光层。
[0519]
在上述发光层上真空沉积本发明的化学式1的化合物中的一种来形成厚度为5nm的电子传输辅助层之后,通过在上述电子传输辅助层上真空沉积alq
3
来形成厚度为25nm的电子传输层。在其上真空沉积lif以形成厚度为1nm的电子注入层,然后在上述电子注入层上真空沉积铝来形成厚度为300nm的阴极,从而制成有机电致发光器件。
[0520]
比较例3
[0521]
除了不包括电子传输辅助层且沉积厚度为30nm的alq
3
作为电子传输层之外,其余以与上述实施例相同的方法制造有机电致发光器件。
[0522]
比较例4
[0523]
除了作为电子传输辅助层材料使用bcp代替本发明的由化学式1表示的化合物之外,其余以与上述实施例相同的方法制造有机电致发光器件。
[0524][0525]
表7
[0526]
实施例电子传输辅助层驱动电压(v)电流效率(cd/a)发光色实施例51化合物1-1-56.436.32蓝色实施例52化合物1-2-76.406.31蓝色实施例53化合物1-2-226.426.36蓝色实施例54化合物1-3-86.346.41蓝色实施例55化合物1-3-316.366.41蓝色实施例56化合物1-4-106.316.42蓝色实施例57化合物1-4-506.406.33蓝色实施例58化合物1-4-66.396.40蓝色实施例59化合物2-2-136.346.45蓝色实施例60化合物2-3-276.306.50蓝色
实施例61化合物2-3-496.326.49蓝色实施例62化合物2-4-226.286.50蓝色实施例63化合物2-4-876.326.52蓝色实施例64化合物3-1-56.356.56蓝色实施例65化合物3-1-136.326.58蓝色实施例66化合物3-2-146.306.60蓝色实施例67化合物3-2-166.296.61蓝色比较例3-7.354.13蓝色比较例4bcp7.255.85蓝色
[0527]
由表7的结果可知,使用本发明的化合物作为电子传输辅助层材料的实施例51至67的蓝色有机电致发光器件与不使用电子传输辅助层的比较例3的有机电致发光器件相比具有若干优异的驱动电压,但具有大大提高的电流效率,并且,与使用bcp作为电子传输辅助层的比较例4相比,在电流效率和驱动电压方面都呈现优异的性能。
[0528]
上述说明只是例示性地说明了本发明,在本发明所属技术领域的普通技术人员,能够在不脱离本发明本质特性的范围内,可进行多种变形。因此,本说明书公开的实施例并不在于限定本发明,而是为了说明,本发明的技术思想的范围并不受这种实施例的限定。本发明的保护范围应根据所附的权利要求所解释,与其同等范围内的所有技术思想都包括在本发明的权利范围。
[0529]
产业上可利用性
[0530]
本发明的化合物可用于有机电致发光器件和有机电致发光显示装置。
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
相关标签:
 热门咨询
热门咨询

tips


 商标分类
商标分类  商标转让
商标转让 



