甲基修饰酶的调节剂、其组合物和用途的制作方法
 2021-02-02 11:02:56|
2021-02-02 11:02:56| 396|
396| 起点商标网
起点商标网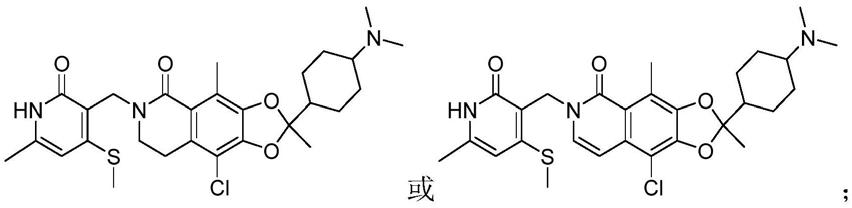
in prostate cancer progression)”,《癌细胞(cancer cell.)》,2010年5月18日;17(5):443-454)。
[0006]
鉴于甲基修饰酶在调节多种生物过程中的作用,甲基修饰酶(特别是ezh2及其突变体)是有吸引力的调节目标。
技术实现要素:
[0007]
现已发现本文所述的化合物和其药学上可接受的组合物能够调节ezh2的活性(参见例如表1)。此类化合物包括结构式i的那些化合物:
[0008][0009]
或其药学上可接受的盐,其中r
1
、r
2
、r
3
、r
4
、r
5
和r
6
中的每个都如本文所定义。
[0010]
所公开的化合物、药学上可接受的盐和药学上可接受的组合物可用于治疗与甲基修饰酶相关的各种病状。这些病状包括例如一种或多种癌症。
具体实施方式
[0011]
1.化合物综述
[0012]
提供了式i的化合物:
[0013][0014]
或其药学上可接受的盐,其中:
[0015]
r
1
是卤基、(c
1-c
4
)烷基、卤基(c
1-c
4
)烷基、(c
1-c
4
)烷氧基或卤基(c
1-c
4
)烷氧基、-s(c
1-c
4
)烷基或-s[卤基(c
1-c
4
)烷基];
[0016]
r
2
是氢、卤基或(c
1-c
4
)烷基;
[0017]
r
3
是(c
1-c
4
)烷基或卤基(c
1-c
4
)烷基;
[0018]
r
4
是卤基、(c
1-c
4
)烷基或卤基(c
1-c
4
)烷基;
[0019]
r
5
是氢、(c
1-c
4
)烷基或卤基(c
1-c
4
)烷基;
[0020]
r
6
是卤基、(c
1-c
4
)烷基或卤基(c
1-c
4
)烷基;或
[0021]
r
5
和r
6
与其所附接的氮原子一起形成任选地经1至3个选自卤基、(c
1-c
4
)烷基、卤基(c
1-c
4
)烷基和-or
7
的基团取代的4至7元杂环基;
[0022]
r
7
是(c
1-c
4
)烷基、卤基(c
1-c
4
)烷基或(c
3-c
7
)环烷基;并且
[0023]
虚线表示单键或双键。
[0024]
2.定义
[0025]
当用于描述可能有多个附接点的化学基团时,连字符(-)表示这一基团与定义其的变量的附接点。例如,-s[卤基(c
1-c
4
)烷基]意指这一基团的附接点发生在硫原子上。
[0026]
如本文所用,术语“卤基”和“卤素”是指选自氟(氟基,-f)、氯(氯基,-cl)、溴(溴基,-br)和碘(碘基,-i)的原子。
[0027]
如本文所用,术语“烷基”是指一价饱和、直链或支链烃基,除非另有说明,否则其具有1-4个碳原子。烷基的实例包括但不限于:甲基、乙基、正-丙基、异丙基、正丁基、异丁基和仲丁基。
[0028]
术语“卤基烷基”包括单卤基烷基、多卤基烷基和全卤基烷基,其中卤素独立地选自氟、氯、溴和碘。
[0029]“烷氧基”是通过氧接头(-o(烷基))附接到另一个部分的烷基。非限制性实例包括甲氧基、乙氧基、丙氧基和丁氧基。
[0030]“卤基烷氧基”是通过氧原子附接到另一部分的卤基烷基,例如但不限于-ochcf
2
或-ocf
3
。
[0031]
术语“4至7元杂环基”是指含有1至4个独立地选自n、o和s的杂原子的4至7元(例如4、5、6和7元)饱和或部分不饱和的单环杂环。术语“杂环”、“杂环基(heterocyclic group)”,“杂环基环”、“杂环基团”、“杂环部分”和“杂环基(heterocyclic radical)”在本文中可互换使用。杂环基环可以在形成稳定结构的任何杂原子或碳原子处与其侧基附接。此类饱和或部分不饱和杂环基的实例包括但不限于四氢呋喃基、四氢噻吩基、四氢吡喃基、吡咯烷基、吡啶基、吡咯烷酮基、哌啶基、噁唑烷基、哌嗪基、二氧杂环己烷基、二氧戊环基、吗啉基、二氢呋喃基、二氢吡喃基、二氢吡啶基、四氢吡啶基、二氢嘧啶基、氧杂环丁烷基、氮杂环丁烷基和四氢嘧啶基。当指定为任选地被取代或被取代时,杂环基上的取代基(例如,在任选地被取代的杂环基的情况下)可以存在于任何可取代的位置上,并且包括例如杂环基附接的位置。
[0032]
如本文所用,“几何异构体”是指取代基原子相对于环烷基环的定向不同的异构体,即顺式或反式异构体。当所公开的化合物由结构命名或描述而没有指明特定顺式或反式几何异构体形式时,应当理解,所述名称或结构涵盖一种几何异构体,其不含其它几何异构体、几何异构体的混合物或相对于其相应的几何异构体富含一种几何异构体的混合物。当描述了特定几何异构体(即顺式或反式几何异构体)时,所描述的异构体相对于其它几何异构体具有按重量计至少60%、70%、80%、90%、99%或99.9%的纯度。
[0033]
除非另有说明,否则当所公开的化合物的立体化学由结构命名或描述时,所命名或描述的立体异构体相对于所有其它立体异构体具有按重量计至少60%、70%、80%、90%、99%或99.9%的纯度。当按照结构命名或描述单一对映体时,所描述或命名的对映体具有按重量计至少60%、70%、80%、90%、99%或99.9%的光学纯度。按重量计的光学纯度百分比是对映体的重量与对映体的重量加上其光学异构体的重量之比。对映体可以通过本领域技术人员已知的方法来溶解,例如通过以下:形成可以通过例如结晶来分离的非对映体盐;形成可以通过例如结晶、超临界流体或液相色谱法分离的非对映体衍生物或复合物;一种对映体与对映体特异性试剂的选择性反应,例如酶促酯化;或者在手性环境中(例如在手性载体上(例如具有结合的手性配体的二氧化硅上))或者在手性溶剂存在下进行超临界
流体或液相色谱法。特定对映体也可以通过使用光学活性试剂、底物、催化剂或溶剂的不对称合成来合成,或者通过不对称转化将一种对映体转化为另一种对映体来合成。
[0034]
除非另有说明,否则当所公开的化合物由结构命名或描述而没有指明立体化学,并且所述命名或结构涵盖一种以上对映体和/或一种以上几何异构体时,所述名称或结构涵盖所述化合物的一种不含对应光学异构体或几何异构体的对映体或几何异构体、所述化合物的外消旋混合物和相对于其对应光学异构体或几何异构体富集一种对映体或几何异构体的混合物。
[0035]
如本文所用,术语“患者”是指动物,如哺乳动物,以及如人。术语“受试者”和“患者”可以互换使用。
[0036]
术语“药学上可接受的载剂”是指不会破坏与其一起调配的化合物的药理活性的无毒的载剂、佐剂或赋形剂。可用于本文所述组合物的药学上可接受的载剂、佐剂或赋形剂包括但不限于离子交换剂、氧化铝、硬脂酸铝、卵磷脂、血清蛋白如人血清白蛋白、缓冲物质如磷酸盐、甘氨酸、山梨酸、山梨酸钾、饱和植物脂肪酸的偏甘油酯混合物、水、盐或电解质,如硫酸鱼精蛋白、磷酸氢二钠、磷酸氢钾、氯化钠、锌盐、胶体二氧化硅、三硅酸镁、聚乙烯吡咯烷酮、纤维素类物质、聚乙二醇、羧甲基纤维素钠、聚丙烯酸酯、蜡、聚乙二醇-聚氧丙烯嵌段聚合物、聚乙二醇和羊毛脂。
[0037]
术语“治疗(treatment/treat/treating)”是指逆转、减轻或抑制如本文所述的疾病或病症或其一种或多种症状的进展。症状消失后,也可以继续治疗例如以延迟复发。
[0038]
疾病、病症和病状在本文中可互换使用。
[0039]
术语“有效量”或“治疗有效量”是指本文所述的能够引起受试者生物或医学反应的化合物的量,例如0.01-100mg/kg体重/天的剂量。术语“受试者”和“患者”可以互换使用,表示需要治疗的哺乳动物,例如陪伴动物(例如狗、猫等)、农场动物(例如牛、猪、马、绵羊、山羊等)和实验室动物(例如大鼠、小鼠、豚鼠等)。通常,受试者是需要治疗的人。
[0040]
术语“抑制(inhibit/inhibition/inhibiting)”包括生物活性或过程的基线活性的降低。
[0041]
本文所述的化合物可以以药学上可接受的盐的形式存在。对于医药用途,本文所述化合物的盐是指无毒的“药学上可接受的盐”。药学上可接受的盐形式包括药学上可接受的酸性/阴离子或碱性/阳离子盐。本文所述化合物的适合的药学上可接受的酸加成盐包括例如无机酸(如盐酸、氢溴酸、磷酸、硝酸和硫酸)和有机酸(如乙酸、苯磺酸、苯甲酸、甲磺酸和对甲苯磺酸)的盐。
[0042]
3.对示例性化合物的描述
[0043]
在第一实施例中,本公开提供式i的化合物:
[0044][0045]
或其药学上可接受的盐,其中变量如以上对于式i所述。
[0046]
在第二实施例中,式i的化合物具有式ii:
[0047][0048]
或其药学上可接受的盐,其中变量如以上对于式i所述。
[0049]
在第三实施例中,式i或式ii的化合物具有式iii:
[0050][0051]
或其药学上可接受的盐,其中变量如以上对于式i所述。
[0052]
在第四实施例中,式i、ii或iii的化合物具有式iv:
[0053][0054]
或其药学上可接受的盐,其中变量如以上对于式i所述。
[0055]
在第五实施例中,式i、ii、iii或iv的化合物中的r
1
是卤基或-s(c
1-c
4
)烷基,其中其余变量如以上对式i所述。
[0056]
在第六实施例中,式i、ii、iii或iv的化合物中的r
4
是卤基或(c
1-c
4
)烷基,其中其余变量如以上对式i或第五实施例所述。
[0057]
在第七实施例中,式i、ii、iii或iv的化合物中的r
5
是(c
1-c
4
)烷基,其中其余变量如以上对式i或第五或第六实施例所述。
[0058]
在第八实施例中,式i、ii、iii或iv的化合物中的r
6
是(c
1-c
4
)烷基,其中其余变量如以上对式i或第五或第六实施例所述。
[0059]
在第九实施例中,式i、ii、iii或iv的化合物中的r
5
和r
6
各自是甲基,其中其余变量如以上对式i或第五或第六实施例所述。
[0060]
在第十实施例中,所述基团
[0061]
和式i、ii、iii或iv的化合物中的nr
5
r
6
围绕环己基反式定向,其中变量如以上对式i或第五、第六、第七、第八或第九实施例所述。
[0062]
在第十一实施例中,所述基团
[0063]
和式i、ii、iii或iv的化合物中的nr
5
r
6
围绕环己基顺式定向,其中变量如以上对式i或第五、第六、第七、第八或第九实施例所述。
[0064]
在第十二实施例中,式i、ii、iii或iv的化合物中的1,3-二氧戊环基的手性中心的立体化学构型是r,其中变量和其余特征如以上对式i或第五、第六、第七、第八、第九、第十或第十一实施例所述。
[0065]
在第十三实施例中,式i、ii、iii或iv的化合物中的1,3-二氧戊环基的手性中心的立体化学构型是s,其中变量和其余特征如上文对式i或第五、第六、第七、第八、第九、第十或第十一实施例所述。
[0066]
化合物的特定实例在范例部分提供,并且作为第十四实施例的一部分包括在本文中。还包括这些化合物的药学上可接受的盐以及中性形式。在一方面,本公开包括本文所述任何化合物的外消旋形式。
[0067]
4.用途、调配和施用:
[0068]
在一些实施例中,本公开提供了包含本文所述化合物或其药学上可接受的衍生物和药学上可接受的载剂的组合物。所提供的组合物中化合物的量能够有效地可测量地调节生物样品或患者体内的组蛋白甲基修饰酶或其突变体。
[0069]
在某些实施例中,本文所述的组合物被配制用于施用于需要此类组合物的患者。本文所述的组合物可以通过口服方式、肠胃外方式、吸入喷雾方式、局部方式、直肠方式、鼻腔方式、口腔方式、阴道方式或通过植入的贮器施用。本文使用的术语“胃肠外”包括皮下、静脉内、肌内、关节内、滑膜内、胸骨内、鞘内、肝内、病变内和颅内注射或输注技术。在一些实施例中,所述组合物通过口服方式、腹膜内方式或静脉内方式施用。本文所述组合物的无菌注射形式可以是水性或含油悬浮液。这些悬浮液可以使用适当的分散剂或湿润剂以及悬浮剂根据本领域中已知的技术进行调配。
[0070]
在一些实施例中,组合物通过口服方式施用。
[0071]
用于任何特定患者的具体剂量和治疗方案将取决于各种因素,包括所采用的具体化合物的活性、年龄、体重、总体健康状况、性别、饮食、施用时间、排泄率、药物组合和治疗医生的判断以及被治疗的特定疾病的严重程度。本文所述组合物的量还将取决于所述组合物中的具体化合物。
[0072]
本文所述的化合物和组合物通常可用于调节一种或多种参与表观遗传调节的酶的活性,特别是ezh1和ezh2,更具体地说是ezh2及其突变体。在一些实施例中,本文描述的
化合物下调或抑制ezh2的活性。在一些实施例中,本文描述的化合物是ezh2活性的拮抗剂。在一些实施例中,本文描述的化合物下调或抑制ezh1的活性。在一些实施例中,本文描述的化合物是ezh1活性的拮抗剂。
[0073]
在一些实施例中,本文所述的化合物和组合物可用于治疗与ezh1或ezh2的过表达和/或ezh2的突变形式(如改变ezh2底物活性的突变形式)的表达相关的疾病和/或病症。对ezh2缺失、错义和移码突变的研究表明,ezh2在如骨髓增生异常综合征(mds)和髓系恶性肿瘤等血液病症中起肿瘤抑制作用(ernst等人,《自然遗传学(nat genet.)》,2010年8月;42(8):722-6;nikoloski et al.,《自然遗传学》,2010年8月;42(8):665-7)。在一些实施例中,本文所述的化合物和组合物可用于治疗与具有y641n、y641c、y641f、y641h、y641s、a677g或a687突变的ezh2的存在相关的疾病和/或病症。在此实施例的一个特定方面,ezh2具有y641n突变。
[0074]
在一些实施例中,本公开提供了治疗患有与ezh1或ezh2的过表达和/或ezh2的突变形式的表达相关的疾病和/或病症的受试者的方法,所述方法包含施用本文所述化合物或其药学上可接受的盐或组合物的步骤。在一些实施例中,上述方法另外包含确定受试者是否过度表达ezh2或表达ezh2的突变形式的初步步骤。
[0075]
在一些实施例中,与ezh2突变形式的存在相关的疾病或病症是人b细胞淋巴瘤。在一些实施例中,与y641n ezh2的存在相关的疾病和/或病症是滤泡性淋巴瘤或弥漫性大b细胞淋巴瘤。在一些实施例中,本文所述的化合物或组合物可用于治疗血液病症,如骨髓增生异常综合征、白血病、贫血和血细胞减少症。sneeringer等人,“野生型加突变型ezh2的协同活性驱动人类b细胞淋巴瘤中组蛋白h3(h3k27)上赖氨酸27的肿瘤相关高甲基化”(coordinated activities of wild-type plus mutant ezh2 drive tumor-associated hypertrimethylation of lysine 27on histone h3(h3k27)in human b-cell lymphomas),sneeringer等人,《美国科学院院刊(proc.natl acad.sci.)》,2010年12月;109(48):20980-20985。
[0076]
在一些实施例中,本文所述的化合物和组合物可用于治疗与细胞增殖相关的疾病和/或病症。在一些实施例中,本文所述的化合物和组合物可用于治疗与细胞周期或dna修复失调相关的疾病和/或病症。在一些实施例中,本文所述的化合物和组合物可用于治疗癌症。
[0077]
在一方面,可通过本文所述的化合物、组合物和方法治疗的癌症包括但不限于:心脏肉瘤:(血管肉瘤、纤维肉瘤、横纹肌肉瘤、脂肪肉瘤)、粘液瘤、横纹肌瘤、纤维瘤、脂肪瘤和畸胎瘤;肺部:支气管肺癌(鳞状细胞癌、未分化小细胞癌、未分化大细胞癌、腺癌)、肺泡(细支气管)癌、支气管腺瘤、肉瘤、淋巴瘤、软骨错构瘤、间皮瘤;胃肠部:食管(鳞状细胞癌、腺癌、平滑肌肉瘤、淋巴瘤)、胃(癌、淋巴瘤、平滑肌肉瘤)、胰(管腺癌、胰岛素瘤、高血糖素瘤、胃泌素瘤、类癌肿瘤、舒血管肠肽瘤)、小肠(腺癌、淋巴瘤、类癌肿瘤、卡波西氏肉瘤、平滑肌瘤、血管瘤、脂肪瘤、神经纤维瘤、纤维瘤)、大肠(腺癌、管状腺瘤、绒毛状腺瘤、错构瘤、平滑肌瘤);泌尿生殖道:肾(腺癌、肾母细胞瘤(wilm's tumor)(肾母细胞瘤(nephroblastoma))、淋巴瘤、白血病)、膀胱和尿道(鳞状细胞癌、移行细胞癌、腺癌)、前列腺(腺癌、肉瘤)、睾丸(精原细胞瘤、畸胎瘤、胚胎癌性细胞、畸胎癌、绒膜癌、肉瘤、间质细胞癌、纤维瘤、纤维腺瘤、腺瘤样瘤、脂肪瘤);肝脏:肝癌(肝细胞癌)、胆管癌、肝母细胞癌、血
管肉瘤、肝细胞腺瘤、血管瘤;骨:骨原性肉瘤(骨肉瘤)、纤维肉瘤、恶性纤维组织细胞瘤、软骨肉瘤、尤因肉瘤、恶性淋巴瘤(网状细胞肉瘤)、多发骨髓瘤、恶性巨细胞瘤脊索瘤、骨软骨瘤(骨软骨外生骨疣)、良性软骨瘤、软骨母细胞瘤、软骨粘液样纤维瘤、骨样骨瘤和巨细胞瘤;神经系统:头骨(骨瘤、血管瘤、肉芽肿、黄色瘤、畸形性骨炎)、脑脊膜(脑膜瘤、脑膜肉瘤、神经胶质过多)、脑(星形细胞瘤、髓母细胞瘤、胶质瘤、室管膜瘤、生殖细胞瘤(松果体瘤)、多形性胶质母细胞瘤、少突胶质瘤、神经鞘瘤、视网膜母细胞瘤、先天性肿瘤)、脊髓神经纤维瘤、脑膜瘤、胶质瘤、肉瘤);妇科学的:子宫(子宫内膜癌)、宫颈(宫颈癌、前肿瘤子宫颈非典型增生)、卵巢(卵巢癌(浆液性囊腺癌、粘液性囊腺癌、透明细胞癌、未分类的癌症)、粒膜细胞肿瘤、塞-莱二氏细胞瘤、无性细胞瘤、恶性畸胎瘤)、阴门(鳞状细胞癌、上皮内癌、腺癌、纤维肉瘤、黑色素瘤)、阴道(透明细胞癌、鳞状细胞癌、葡萄状肉瘤(胚胎性横纹肌肉瘤)、输卵管(癌);血液学的:血液(髓细胞性白血病(急性和慢性)、急性淋巴细胞白血病、慢性淋巴细胞白血病、骨髓增生性疾病、多发骨髓瘤、骨髓增生异常综合征)、何杰金氏病、非何杰金氏淋巴瘤(恶性淋巴瘤);皮肤:恶性黑色素瘤、基底细胞癌、鳞状细胞癌、卡波西氏肉瘤、发育不良性痣、脂肪瘤、血管瘤、皮肤纤维瘤、瘢痕瘤、银屑病;以及肾上腺:成神经细胞瘤。
[0078]
在一方面,通过本文所述的化合物、组合物和方法治疗的癌症选自肾上腺癌、腺泡细胞癌、听神经瘤、肢端豆状黑色素瘤、肢端汗腺瘤、急性嗜酸性粒细胞白血病、急性红系白血病、急性淋巴细胞白血病、急性巨核细胞白血病、急性单核细胞白血病、急性早幼粒细胞白血病、腺癌、腺样囊性癌、腺瘤、腺瘤样牙源性肿瘤、腺鳞癌、脂肪组织肿瘤、肾上腺皮质癌、成人t细胞白血病/淋巴瘤、侵袭性nk细胞白血病、aids相关性淋巴瘤、肺泡横纹肌肉瘤、肺泡软组织肉瘤、成釉细胞纤维瘤、间变性大细胞淋巴瘤、间变性甲状腺癌、血管免疫母细胞性t细胞淋巴瘤、血管平滑肌脂肪瘤、血管肉瘤、星形细胞瘤、非典型畸胎样横纹肌样瘤、b细胞慢性淋巴细胞白血病、b细胞增殖性白血病、b细胞淋巴瘤、基底细胞癌、胆道癌、膀胱癌、胚泡瘤、骨癌、布伦纳瘤(brenner tumor)、棕色瘤(brown tumor)、伯基特淋巴瘤(burkitt's lymphoma)、乳腺癌、脑癌、原位癌、癌肉瘤、软骨瘤、牙骨质瘤、髓样肉瘤、脆骨瘤、脊索瘤、绒毛膜癌、脉络丛乳头状瘤、肾透明细胞肉瘤、颅咽管瘤、皮肤t细胞淋巴瘤、宫颈癌、结肠直肠癌、degos病(degos disease)、促结缔组织增生小圆细胞瘤、弥漫性大b细胞淋巴瘤、胚胎发育不良神经上皮瘤、无性细胞瘤、胚胎癌、内分泌腺肿瘤、内胚层窦瘤、肠病相关t细胞淋巴瘤、食道癌、寄生胎、纤维瘤、纤维肉瘤、滤泡性淋巴瘤、滤泡性甲状腺癌、神经节细胞瘤、胃肠癌、生殖细胞瘤、妊娠绒毛膜癌、巨细胞成纤维细胞瘤、骨巨细胞瘤、神经胶质瘤、多形性胶质母细胞瘤、神经胶质瘤、脑胶质瘤病、胰高血糖素瘤、生殖腺细胞瘤、颗粒细胞瘤、雌、两性母细胞瘤、胆囊癌、胃癌、毛细胞白血病、血管母细胞瘤、头颈癌、血管外皮细胞瘤、血液恶性肿瘤、肝母细胞瘤、肝脾t细胞淋巴瘤(hepatosplenic t-cell lymphoma)、霍奇金氏淋巴瘤、非霍奇金淋巴瘤(non-hodgkin's lymphoma)、侵袭性小叶癌、肠癌、肾癌、喉癌、恶性雀斑样痣、致死性中线癌、白血病、间质细胞瘤、脂肪肉瘤、肺癌、淋巴管瘤、淋巴管肉瘤、淋巴上皮瘤、淋巴瘤、急性淋巴细胞白血病、急性髓细胞白血病、慢性淋巴细胞白血病、肝癌、小细胞肺癌、非小细胞肺癌、malt淋巴瘤、恶性纤维组织细胞瘤、恶性外周神经鞘肿瘤、恶性蝾螈瘤、套细胞淋巴瘤、边缘区b细胞淋巴瘤、肥大细胞白血病、纵隔生殖细胞肿瘤、乳房髓样癌、甲状腺髓样癌、髓母细胞瘤、黑色素瘤、脑膜瘤、默克尔细胞癌、
间皮瘤、转移性尿路上皮癌、苗勒氏混合瘤(mixed mullerian tumor)、粘液瘤、多发性骨髓瘤、肌肉组织肿瘤、蕈样真菌病、粘液样脂肪肉瘤、粘液瘤、粘液肉瘤、鼻咽癌、神经鞘瘤、神经母细胞瘤、神经纤维瘤、神经瘤、结节性黑色素瘤、眼癌、少突星形细胞瘤、少突胶质细胞瘤、嗜酸细胞瘤、视神经鞘脑膜瘤、视神经肿瘤、口腔癌、骨肉瘤、卵巢癌、胰腺癌、乳头状甲状腺癌、副神经节瘤、松果体母细胞瘤、松果体细胞瘤、垂体腺瘤、垂体肿瘤、浆细胞瘤、多胚细胞瘤、前体淋巴母细胞淋巴瘤、原发性中枢神经系统淋巴瘤、原发性渗出性淋巴瘤、原发性腹膜癌、前列腺癌、胰腺癌、咽癌、腹膜假粘液瘤、肾细胞癌、肾髓质癌、视网膜母细胞瘤、横纹肌瘤、横纹肌肉瘤、richter's征转化(richter's transformation)、直肠癌、肉瘤、神经鞘瘤病、精原细胞瘤、睾丸支持细胞瘤、性索-性腺间质瘤、印戒细胞癌、皮肤癌、小蓝圆形细胞瘤、小细胞癌、软组织肉瘤、生长抑素瘤、煤烟疣、脊椎肿瘤、脾边缘区淋巴瘤、鳞状细胞癌、滑膜肉瘤、塞扎里氏病(sezary's disease)、小肠癌、鳞状细胞癌、胃癌、t细胞淋巴瘤、睾丸癌、卵泡膜细胞瘤、甲状腺癌、移行细胞癌、喉癌、脐尿管癌、泌尿生殖系统癌、尿路上皮癌、葡萄膜黑色素瘤、子宫癌、疣状癌、视觉通路胶质瘤、外阴癌、阴道癌、沃尔丹斯特伦巨球蛋白血症(waldenstrom's macroglobulinemia)、沃辛瘤(warthin's tumor)维尔姆斯瘤(wilms'tumor)。
[0079]
在一方面,通过本文所述的化合物、组合物和方法治疗的癌症选自以下腺癌、成人t细胞白血病/淋巴瘤、膀胱癌、母细胞瘤、骨癌、乳腺癌、脑癌、恶性上皮肿瘤、髓样肉瘤、宫颈癌、结肠直肠癌、食道癌、胃肠癌、多形性胶质母细胞瘤、神经胶质瘤、胆囊癌、胃癌、头颈癌、霍奇金氏淋巴瘤、非霍奇金氏淋巴瘤、肠癌、肾癌、喉癌、白血病、肺癌、淋巴瘤、肝癌、小细胞肺癌、非小细胞肺癌、间皮瘤、多发性骨髓瘤、急性髓性白血病(aml)、弥漫性大b细胞淋巴瘤(dlbcl)、眼癌、视神经肿瘤、口腔癌、卵巢癌、垂体瘤、原发性中枢神经系统淋巴瘤、前列腺癌、胰腺癌、咽癌、肾细胞癌、直肠癌、肉瘤、皮肤癌、脊椎肿瘤、小肠癌、胃癌、t细胞淋巴瘤、睾丸癌、甲状腺癌、喉癌、泌尿生殖系统癌、尿路上皮癌、子宫癌、阴道癌和维尔姆斯瘤(wilms'tumor)。
[0080]
在一方面,通过本文所述的化合物、组合物和方法治疗的癌症选自乳腺癌、前列腺癌、结肠癌、肾细胞癌、多形性胶质母细胞瘤癌、膀胱癌、黑色素瘤、支气管癌、淋巴瘤和肝癌。
[0081]
还提供了本文所述的化合物或其药学上可接受的盐或包含所公开的化合物或其药学上可接受的盐的组合物用于制备用于治疗本文所述病状的药剂的用途。还提供了用于治疗本文所述病状的本文所述化合物或其药学上可接受的盐或包含所公开化合物或其药学上可接受的盐的组合物。
[0082]
范例
[0083]
下面的代表性实例旨在帮助说明本发明,并且不旨在也不应所述被解释为限制本发明的范围。
[0084]
中间体的制备
[0085]
中间体1:3-(氨甲基)-6-甲基-4-(甲硫基)吡啶-2(1h)-酮(盐酸盐)
[0086][0087]
步骤1:3-氧代丁-1-烯-1,1-双(硫代酸)钠的合成
[0088]
将叔丁醇钠(16.6g,172mmol)于甲苯(30ml)中的混合物在真空下脱气,并用氮气吹扫(3个循环)。然后在0℃下加入丙酮(5.0g,6.4ml,86mmol),然后缓慢加入二硫化碳(6.6g,5.24ml,86mmol)。将所得混合物在0℃下搅拌4小时,然后过滤。将滤饼在真空下干燥,得到黄色固体状的标题化合物(15.4g,粗品),将其不经进一步纯化用于下一步骤。
[0089]
步骤2:4,4-双(甲硫基)丁-3-烯-2-酮的合成
[0090]
向3-氧代丁-1-烯-1,1-双(硫代酸)钠(15.4g,86.4mmol)于甲醇(90ml)中的溶液中缓慢加入碘甲烷(24.5g,10.7ml,173mmol)。将混合物在70℃下搅拌1小时,然后浓缩至干。加入水(30ml),并且用乙酸乙酯(60ml
×
3)萃取所需产物。将合并的有机层经硫酸钠干燥并在减压下浓缩,得到棕色油状物形式的标题化合物(6.8g,42%产率),将其不经进一步纯化用于下一步骤。lcms[m+h]
+
m/z:计算值:163.0;实验值:163.0。
1
h nmr(400mhz,氯仿-d)δ6.02(s,1h),2.45(s,3h),2.43(s,3h),2.15(s,3h)。
[0091]
步骤3:6-甲基-4-(甲硫基)-2-氧代-1,2-二氢吡啶-3-甲腈的合成
[0092]
向4,4-双(甲硫基)丁-3-烯-2-酮(2.9g,18mmol)和2-氰基乙酰胺(1.5g,18mmol)于叔丁醇(50ml)的溶液中加入叔丁醇钠(1.9g,20mmol)。将混合物在80℃下搅拌12小时(在此阶段进行两批反应并合并)。加入水(20ml),并且用10%盐酸将ph调节到5-6。过滤所得混合物,并且用石油醚(20ml
×
2)洗涤滤饼,然后在真空下干燥滤饼,得到灰白色固体状的标题化合物(4.8g,74%产率),将其不经进一步纯化用于下一步骤。lcms[m+h]
+
m/z:计算值:181.0;实验值:181.0。
1
h nmr(400mhz,二甲亚砜-d
6
)δ6.27(s,1h),2.56(s,3h),2.25(s,3h)。
[0093]
步骤4:3-(氨甲基)-6-甲基-4-(甲硫基)吡啶-2(1h)-酮的合成
[0094]
将6-甲基-4-(甲硫基)-2-氧代-1,2-二氢吡啶-3-腈(3.6g,20mmol)于四氢呋喃(50ml)中的混合物在真空下脱气,并用氮气吹扫(3个循环)。然后在0℃下缓慢加入硼烷二甲基硫化物复合物(10m,8.0ml,80mmol),接着将反应混合物升温至70℃,并搅拌2小时。在将混合物在减压下浓缩之前,在0℃下缓慢加入甲醇(15ml)以淬灭反应,得到浅黄色固体状的标题化合物(3.8g,粗品),将其不经进一步纯化用于下一步骤。lcms[m+h]
+
m/z:计算值:
185.1;实验值:185.0。
[0095]
步骤5:((6-甲基-4-(甲硫基)-2-氧代-1,2-二氢吡啶-3-基)甲基)氨基甲酸叔丁酯的合成
[0096]
向3-(氨甲基)-6-甲基-4-(甲硫基)吡啶-2(1h)-酮(3.6g,20mmol)于四氢呋喃(80ml)的溶液中加入三乙胺(5.9g,8.1ml,59mmol)。将混合物搅拌30分钟,然后加入二碳酸二叔丁酯(6.4g,29mmol),并且在25℃下将反应物搅拌12小时。然后将反应混合物在减压下浓缩至干,然后加入水(35ml),并用石油醚/乙酸乙酯的5:1混合物(30ml
×
3)萃取所需产物。将合并的有机层经硫酸钠干燥并浓缩,得到白色固体状的标题化合物(5.8g,粗品),将其不经进一步纯化用于下一步骤。lcms[m+h]
+
m/z:计算值:285.12;实验值:284.9。
1
h nmr(400mhz,二甲亚砜-d
6
)δ6.05(s,1h),4.03-4.00(m,2h),2.42(s,3h),2.15(s,3h),1.39(s,9h)。
[0097]
步骤6:3-(氨甲基)-6-甲基-4-(甲硫基)吡啶-2(1h)-酮(盐酸盐)的合成
[0098]
向25℃的氯化氢的1,4-二氧六环溶液(4m,100ml,400mmol)中加入((6-甲基-4-(甲硫基)-2-氧代-1,2-二氢吡啶-3-基)甲基)氨基甲酸叔丁酯(5.0g,17.6mmol)。将反应混合物在25℃下搅拌2小时,然后在减压下浓缩至干。将残留物用二氯甲烷(30ml
×
2)和乙酸乙酯(30ml)洗涤,得到黄色固体状的标题化合物(4.5g,粗品,hcl盐),将其不经进一步纯化用于下一步骤。lcms[m+h]
+
m/z:计算值:185.1;实验值:185.0。
1
h nmr(400mhz,d
2
o)δ6.31(s,1h),4.03(s,2h),2.41(s,3h),2.18(s,3h)。
[0099]
实例1:9-氯-2-(反式-4-(二甲氨基)环己基)-2,4-二甲基-6-((6-甲基-4-(甲硫基)-2-氧代-1,2-二氢吡啶-3-基)甲基)-7,8-二氢-[1,3-二氧杂环戊烯并[4,5-g]异喹啉-5(6h)-酮
[0100][0101]
步骤1:6-溴-7-氯-2-(反式-4-(二甲氨基)环己基)-2,4-二甲基苯并[d][1,3]二氧杂环戊烯-5-甲酸甲酯的合成
[0102]
在室温下向2-(反式-4-((叔丁氧基羰基)氨基)环己基)-7-氯-2,4-二甲基苯并[d][1,3]二氧杂环戊烯-5-甲酸甲酯(7g,15.9mmol)(根据专利申请us2017/0073335a1中所述的程序制备)于二氯甲烷(80ml)中的溶液中加入碳酸钾(2.22g,15.9mmol),然后逐滴加入溴(3.25ml,63.6mmol)。将混合物在室温下搅拌30分钟(或直至起始材料完全消耗),然后用硫代硫酸钠饱和溶液淬灭。分离有机层,并且将水层用二氯甲烷萃取三次。将合并的有机层用盐水洗涤,经硫酸钠干燥,过滤并在减压下浓缩,得到固体状的标题化合物(理论产量8g),将其不经进一步纯化用于下一步骤。lcms[m+na]
+
m/z:计算值:540.1;实验值:540.2。
[0103]
步骤2:2-(反式-4-氨基环己基)-6-溴-7-氯-2,4-二甲基苯并[d][1,3]二氧杂环戊烯-5-甲酸甲酯三氟乙酸盐的合成
[0104]
在室温下向6-溴-7-氯-2-(反式-4-(二甲氨基)环己基)-2,4-二甲基苯并[d][1,3]二氧杂环戊烯-5-甲酸甲酯(8g,15.4mmol)于二氯甲烷(31ml)中的溶液中加入三氟乙酸
(7.70ml)。将此混合物在室温下搅拌15分钟,然后在减压下浓缩至干,得到固体状的标题化合物(理论产量8.20g),将其不经进一步纯化用于下一步骤。lcms[m+h]
+
m/z:计算值:418.0;实验值:418.1。
[0105]
步骤3:6-溴-7-氯-2-(反式-4-(二甲氨基)环己基)-2,4-二甲基苯并[d][1,3]二氧杂环戊烯-5-甲酸甲酯的合成
[0106]
在室温下向2-(反式-4-氨基环己基)-6-溴-7-氯-2,4-二甲基苯并[d][1,3]二氧杂环戊烯-5-甲酸甲酯三氟乙酸盐(8.20g,15.4mmol)于二氯甲烷(77ml)中的溶液中加入甲醛(37重量%于水中)(12.3ml,154mmol),然后加入三乙酰氧基硼氢化钠(16.3g,77.0mmol)。将反应物在室温下搅拌15分钟,然后用碳酸氢钠饱和溶液淬灭。分离有机层,并且将水层用二氯甲烷萃取三次。将合并的有机层用盐水洗涤,经硫酸钠干燥,过滤并在减压下浓缩至干。将残留物通过快速色谱法(正相kp-nh柱,梯度为含0至100%乙酸乙酯的庚烷)纯化,得到浅黄色油状物形式的标题化合物(5.8g,历经三个步骤产率为78%)。lcms[m+h]
+
m/z:计算值:446.1;实验值:446.3。
[0107]
步骤4:7-氯-2-(反式-4-(二甲氨基)环己基)-6-(2-乙氧基乙烯基)-2,4-二甲基苯并[d][1,3]二氧杂环戊烯-5-甲酸甲酯的合成
[0108]
将6-溴-7-氯-2-(反式-4-(二甲氨基)环己基)-2,4-二甲基苯并[d][1,3]二氧杂环戊烯-5-甲酸甲酯(4.27g,9.55mmol)、[1,1'-双(二苯基膦基)二茂铁]二氯钯(ii)与二氯甲烷(1.55g,1.91mmol)的络合物、碳酸铯(9.31g,28.6mmol)、1,4-二氧杂环己烷(35ml)和水(5ml)的混合物脱气(四个真空/氮气再填充循环),然后加入2-[(e)-2-乙氧基乙烯基]-4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷(3.78g,19.1mmol)于1,4-二氧杂环己烷(15ml)中的溶液。将所得黑色反应混合物在100℃下加热24小时,然后冷却至室温,用乙酸乙酯稀释并过滤。滤液用水洗涤,并且将水层用乙酸乙酯萃取三次。将合并的有机层用盐水洗涤,经硫酸钠干燥,过滤并在减压下浓缩至干。将残留物通过快速色谱法(正相kp-nh柱,梯度为含0至40%乙酸乙酯的庚烷)纯化,得到浓稠微黄色油状物形式的标题化合物(3.5g,84%产率)。lcms[m+h]
+
m/z:计算值:438.2;实验值:438.3。
[0109]
步骤5:7-氯-2-(反式-4-(二甲氨基)环己基)-2,4-二甲基-6-(2-氧代乙基)苯并[d][1,3]二氧杂环戊烯-5-甲酸甲酯的合成
[0110]
向7-氯-2-(反式-4-(二甲氨基)环己基)-6-((e)-2-乙氧基乙烯基)-2,4-二甲基苯并[d][1,3]二氧杂环戊烯-5-甲酸甲酯(4.4g,10.0mmol)于乙腈(63ml)中的溶液中加入七水合氯化铈(18.6g,50.0mmol)、碘化钠(7.49g,50.0mmol)和水(100μl)。将反应混合物在80℃下搅拌3小时,然后通过硅藻土塞过滤。所得滤液直接用于下一步骤。lcms[m+h]
+
m/z:计算值:410.17;实验值:410.3。
[0111]
步骤6:7-氯-2-(反式-4-(二甲氨基)环己基)-2,4-二甲基-6-(2-氧代乙基)苯并[d][1,3]二氧杂环戊烯-5-甲酸甲酯的合成
[0112]
向7-氯-2-(反式-4-(二甲氨基)环己基)-2,4-二甲基-6-(2-氧代乙基)苯并[d][1,3]二氧杂环戊烯-5-甲酸甲酯于乙腈中的粗溶液(来自先前的步骤)中加入3-(氨基甲基)-6-甲基-4-(甲基硫烷基)-1,2-二氢吡啶-2-酮(游离碱)(3.68g,20.0mmol)和三乙胺(3ml,21.5mmol)。将反应混合物在室温下搅拌5分钟,然后加入氰基硼氢化钠(3.14g,50.0mmol)。将反应物在室温下搅拌5分钟(或直至起始材料完全消耗),然后用碳酸氢钠饱
和溶液淬灭。接下来,将所需产物用二氯甲烷萃取三次。将合并的有机层接着用盐水洗涤,经硫酸钠干燥,过滤且在减压下浓缩至干,得到固体状的标题化合物,其不经进一步纯化即用于下一步骤。lcms[m+h]
+
m/z:计算值:578.24;实验值:578.4。
[0113]
步骤7:9-氯-2-(反式-4-(二甲氨基)环己基)-2,4-二甲基-6-((6-甲基-4-(甲硫基)-2-氧代-1,2-二氢吡啶-3-基)甲基)-7,8-二氢-[1,3]-二氧杂环戊烯并[4,5-g]异喹啉-5(6h)-酮的合成
[0114]
向7-氯-2-(反式-4-(二甲氨基)环己基)-2,4-二甲基-6-(2-氧代乙基)苯并[d][1,3]二氧杂环戊烯-5-甲酸甲酯于二甲亚砜(50ml)中的粗溶液中加入碳酸钾(1.38g,10.0mmol)。将反应混合物在室温下搅拌30分钟(或直至起始材料完全消耗),然后用碳酸氢钠饱和溶液淬灭。接下来,将所需产物用二氯甲烷萃取三次。将合并的有机层接着用盐水洗涤,经硫酸钠干燥,过滤,并在减压下浓缩至干。将残留物通过反相c18柱纯化(梯度为含30%至70%乙腈的水与0.1%三氟乙酸),得到白色固体状的标题化合物,作为外消旋混合物)(1600mg,历经三个步骤产率为29%)。
[0115]
步骤8:(r)-9-氯-2-(反式-4-(二甲氨基)环己基)-2,4-二甲基-6-((6-甲基-4-(甲硫基)-2-氧代-1,2-二氢吡啶-3-基)甲基)-7,8-二氢-[1,3]-二氧杂环戊烯并[4,5-g]异喹啉-5(6h)-酮和(s)-9-氯-2-(反式-4-(二甲氨基)环己基)-2,4-二甲基-6-((6-甲基-4-(甲硫基)-2-氧代-1,2-二氢吡啶-3-基)甲基)-7,8-二氢-[1,3]-二氧杂环戊烯并[4,5-g]异喹啉-5(6h)-酮的分离
[0116]
通过制备sfc[柱:chiralpak ic(内径为250
×
21mm,10μm)解析(r)-9-氯-2-(反式-4-(二甲氨基)环己基)-2,4-二甲基-6-((6-甲基-4-(甲硫基)-2-氧代-1,2-二氢吡啶-3-基)甲基)-7,8-二氢-[1,3]-二氧杂环戊烯并[4,5-g]异喹啉-5(6h)-酮和(s)-9-氯-2-(反式-4-(二甲氨基)环己基)-2,4-二甲基-6-((6-甲基-4-(甲硫基)-2-氧代-1,2-二氢吡啶-3-基)甲基)-7,8-二氢-[1,3]-二氧杂环戊烯并[4,5-g]异喹啉-5(6h)-酮的外消旋混合物(1.6g混合物)。流动相a:co
2
/流动相b:甲醇/二氯甲烷1:1混合物与0.25%异丙胺。等度(70%的流动相a和30%的流动相b)。流动速率:70g/分钟。柱温:25℃]。实例1峰1(优映体):保留时间=4.69分钟。恢复=264mg,33%产率,99.7%ee,>99%纯度(棕褐色固体)。lcms[m+h]
+
m/z:计算值:546.2;实验值:546.3。
1
h nmr(400mhz,氯仿-d)δ12.34(br.s.,1h),6.00(s,1h),4.88(s,2h),3.38-3.28(m,2h),2.83(d,j=5.9hz,2h),2.54(s,3h),2.46-2.25(m,12h),2.03(br.s.,4h),1.83(br.s.,1h),1.62(s,3h),1.27(d,j=8.3hz,5h)。实例1峰2(劣映体):保留时间=5.33分钟。73%ee,97.5%纯度(棕褐色固体)。lcms[m+h]
+
m/z:计算值:546.2;实验值:546.3。
1
h nmr(400mhz,氯仿-d)δ12.86-12.59(m,1h),6.00(s,1h),4.87(s,2h),3.36-3.28(m,2h),2.81(t,j=6.4hz,2h),2.53(s,3h),2.45(s,9h),2.33(s,3h),2.10(br.s.,2h),2.04(dd,j=2.9,8.8hz,2h),1.90-1.81(m,1h),1.62(s,3h),1.41-1.22(m,5h)。
[0117]
实例2:9-氯-2-(反式-4-(二甲氨基)环己基)-2,4-二甲基-6-((6-甲基-4-(甲硫基)-2-氧代-1,2-二氢吡啶-3-基)甲基)-[1,3]-二氧杂环戊烯并[4,5-g]异喹啉-5(6h)-酮
[0118][0119]
向7-氯-2-(反式-4-(二甲氨基)环己基)-6-(2-乙氧基乙烯基)-2,4-二甲基苯并[d][1,3]二氧杂环戊烯-5-甲酸甲酯(5.1g,11.6mmol)(根据实例1步骤4所述的程序制备)于乙腈(110ml)中的溶液中加入七水合氯化铈(21.5g,57.9mmol)、碘化钠(8.67g,57.9mmol)和水(110μl)。将反应混合物在80℃下搅拌3小时,然后通过硅藻土塞过滤。将所得滤液在真空下浓缩,并直接用于下一步骤。将粗混合物溶解于100ml甲醇中,然后加入3-(氨基甲基)-6-甲基-4-(甲基硫烷基)-1,2-二氢吡啶-2-酮盐酸盐(5.96g,23.2mmol)和三乙胺(6.43ml,46.4mmol)。将此混合物在室温下搅拌2小时(在此阶段可以通过lcms观察到标题化合物),然后将氰基硼氢化钠(3.63g,57.9mmol)加入反应物中。将混合物搅拌1小时,然后通过硅藻土过滤。将固体用甲醇(100ml)冲洗,并在减压下浓缩滤液以去除甲醇。将乙酸乙酯(100ml)和碳酸氢钠饱和溶液加入到残留物中,并将所需产物用乙酸乙酯萃取三次。接着将合并的有机层用盐水洗涤,经硫酸钠干燥,过滤,并在减压下浓缩至干,得到含有标题化合物的混合物。将此粗混合物溶解在二甲亚砜(50ml)中,并加入碳酸钾(3.2g,23.2mmol)。将反应混合物在室温下搅拌30分钟,然后加入碳酸氢钠饱和溶液。将所需产物用二氯甲烷萃取三次,并且接着将合并的有机层用盐水洗涤,经硫酸钠干燥,过滤,并在减压下浓缩至干。将残留物通过反相c18柱(梯度为含30至70%乙腈的水与0.1%三氟乙酸)纯化,得到棕褐色固体状的标题化合物(实例2-外消旋混合物)(356mg,5%产率)。lcms[m+h]
+
m/z:计算值:544.2;实验值:544.3。
1
h nmr(400mhz,氯仿-d)δ13.26-13.11(m,1h),7.11(d,j=7.8hz,1h),6.62(s,1h),6.00(s,1h),5.18(s,2h),2.76(s,3h),2.42(s,3h),2.34-2.28(m,9h),2.24(br.s.,1h),2.01(br.s.,3h),1.89-1.82(m,1h),1.66(s,3h),1.33-1.21(m,5h)。
[0120]
通过sfc[chiralpak ad-h柱(内径为250
×
30mm,5μm)将外消旋混合物分离为(r)-9-氯-2-((1r,4r)-4-(二甲氨基)环己基)-2,4-二甲基-6-((6-甲基-4-(甲硫基)-2-氧代-1,2-二氢吡啶-3-基)甲基)-[1,3]-二氧杂环戊烯并[4,5-g]异喹啉-5(6h)-酮和(s)-9-氯-2-((1r,4s)-4-(二甲氨基)环己基)-2,4-二甲基-6-((6-甲基-4-(甲硫基)-2-氧代-1,2-二氢吡啶-3-基)甲基)-[1,3]-二氧杂环戊烯并[4,5-g]异喹啉-5(6h)-酮。流动相a:co2/流动相b:2:5乙醇/水与0.1%氢氧化铵。等度(85%的流动相a和15%的流动相b)。流速:50ml/分钟。柱温:40℃]。保留时间:峰1(劣映体):4.8分钟。峰2(优映体):6.5分钟。峰1:53.8mg,96.90umol,52.72%产率,98%纯度,>99%ee,呈白色固体状。lcms(m+h+)计算值:544.1;实验值:544。1h nmr(400mhz,cd3od)δ6.91(d,j=7.8hz,1h),6.61(d,j=7.5hz,1h),6.20(s,1h),5.18-4.86(m,2h),2.61-2.55(m,3h),2.40-2.31(m,3h),2.23(s,3h),2.21(s,7h),1.92(br d,j=6.5hz,4h),1.87-1.76(m,1h),1.58(s,3h),1.21(br s,4h)。峰2:37.6mg,68.41umol,37.22%产率,99%纯度,97.6%ee,呈白色固体状。lcms(m+h+)计算值:544.2;实验值:544。1h nmr(400mhz,cd3od)δ6.91(d,j=7.5hz,1h),6.61(d,j=7.5hz,1h),6.19
(s,1h),4.98(s,2h),2.59(s,3h),2.38(s,3h),2.22(s,10h),1.93(br d,j=6.5hz,4h),1.82(br s,1h),1.58(s,3h),1.25-1.16(m,4h)。
[0121]
ezh2测定
[0122]
使用ezh2测量抑制剂的ic
50
[0123]
ezh2生化测定(ic
50
):通过将
3
h-sam掺入生物素化的h3肽来评估化合物的效力。具体而言,将含有wt ezh2(内部制备的五聚体复合物)的30pm prc2与450nm sam、450nm 3
h-sam、2μm h3k27me3活化肽(h
2
n-rkqlatkaar(kme3)sapatggvkkp-酰胺)和化合物(与dmso中的10点重复剂量响应滴定一样,最终测定0.8%dmso(v/v))在总体积为12.5μl的50mm tris(ph为8.5)、1mm dtt、0.07mm brij-35、0.1%bsa、0.8%dmso中预温育3-5小时。用生物素化的h3底物肽(h
2
n-rkqlatkaar(kme1)sapatggvkkp-ntpegbiot)作为12.5μl缓冲液中的2μm储备液引发反应,并允许在室温下反应18-22小时。通过加入20μl stop溶液(50mm tris(ph 8.5),200mm edta,2mm sah)完成淬灭。将35μl经过淬灭的溶液转移到链霉亲和素涂覆的flashplate(珀金埃尔默公司(perkinelmer))上,温育1-2小时,洗涤,并在topcount读板仪(topcount reader)(珀金埃尔默公司)中读取。在使用非线性最小二乘四参数拟合的基因数据筛选程序(genedata screener)中计算ic
50
,其中所述四个参数是ic
50
、希尔斜率、转变前基线(0%inh)和转变后基线(100%inh)。
[0124]
海拉(hela)细胞测定中抑制剂的ec
50
测量
[0125]
h3k27me3α海拉测定(alphalisa)。将十种不同剂量的每种试验化合物(在一系列3倍稀释液中)接种在经组织培养物处理的重复384孔的平板(目录号:6007680;马萨诸塞州沃尔瑟姆的珀金埃尔默公司(perkin elmer,waltham,ma))中。将生长于培养物中的海拉细胞胰蛋白酶化,并使用细胞计数器计数(目录号:c10281;纽约大岛的生命技术公司(life technologies,grand island,ny))。在10%dmem(目录号:10569-010,纽约大岛的生命技术公司)中将细胞稀释至每毫升67,000个细胞,并使用384孔的平板的伯腾(biotek)microflo
tm
选择分配器(美国佛蒙特州的伯腾仪器有限公司(biotek instruments,inc.vermont,usa))将15μl(1,000个细胞)接种到每个孔中。将平板在37℃/5%co
2
下温育72小时。一个重复平板被处理用于海拉测定,并且另一个重复平板被处理用于活力。将每孔5μl细胞-组蛋白裂解缓冲液(1x)(目录号:al009f1,马萨诸塞州沃尔瑟姆的珀金埃尔默公司)加入到处理用于alphalisa的平板中,并将这一平板在rt下于平板振荡器上以低速温育30分钟(型号:4625-q,马萨诸塞州沃尔瑟姆的赛默飞世尔科技公司(thermo scientific;waltham,ma))。然后,每孔加入10μl组蛋白萃取缓冲液(目录号:al009f2;马萨诸塞州沃尔瑟姆的珀金埃尔默公司),并将平板在rt下于平板振荡器上以低速温育20分钟。接下来,在每个孔中加入10μl抗k27me3受体微珠和生物素化抗组蛋白h3(c-ter)抗体(稀释至3nm终浓度)的5x混合物(目录号:al118;马萨诸塞州沃尔瑟姆的珀金埃尔默公司)。受体微珠和抗组蛋白h3的稀释是在1x组蛋白检测缓冲液(目录号:al009f3;马萨诸塞州沃尔瑟姆的珀金埃尔默公司)中完成的,所述缓冲液是通过稀释提供的10x储备液来制备。用铝平板密封剂密封这一平板,并在23℃下温育60分钟。接下来,添加10μl链霉亲和素供体微珠(streptavidin donor bead)的5x溶液(目录号:6760002,马萨诸塞州沃尔瑟姆的珀金埃尔默公司)(在1x组蛋白检测缓冲液中最终浓度为20μg/ml),=用铝平板密封剂密封这一平板并在23℃下温育30分钟。然后使用envision-alpha读板仪(envision-alpha reader)(型
号:2104,马萨诸塞州沃尔瑟姆的珀金埃尔默公司)读取此平板。
[0126]
通过向装有含有培养基的细胞的每个孔中加入15μl cell titer glo((目录号:g9241,promega madison,wi))来测定细胞活力。将平板在rt下在平板振荡器上以低速温育15-20分钟。然后使用envision-alpha读板仪(型号:2104,马萨诸塞州沃尔瑟姆的珀金埃尔默公司)读取平板。
[0127]
karpas-422活力测定中抑制剂的gi
50
测量
[0128]
karpas-422细胞系从dsmz(德国布伦瑞克(braunschweig,germany))获得,并使其在rpmi-1640培养基中生长。所有培养基均含有10%胎牛血清(fbs)和1%青霉素/链霉素(英杰公司(invitrogen))。将每孔20k细胞接种到96孔化合物涂覆的板上。每4天将细胞分裂并以原始接种密度(基于dmso孔计数)接种到含有新鲜ezh2抑制剂的平板中。在第8天,通过cell titer-glo荧光细胞活力测定法(promega)评定相对细胞数。使用graphpad prism 5进行曲线拟合,并报告了gi
50
值。数据如表1所示。
[0129]
表1.
[0130]
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询

tips


 商标分类
商标分类  商标转让
商标转让 



