基于饱和脂肪酸和二价铜盐螯合物的纳米材料及制备方法与流程
 2021-02-02 11:02:25|
2021-02-02 11:02:25| 427|
427| 起点商标网
起点商标网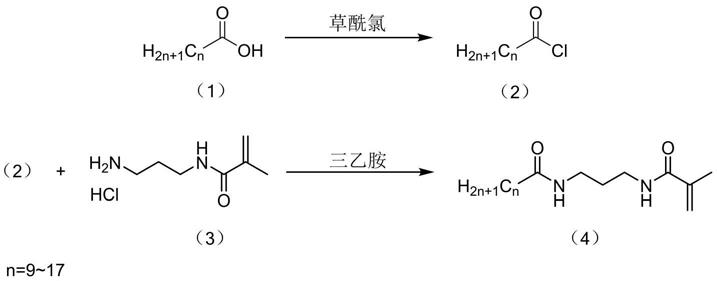
[0001]
本发明属于医药制备领域,特别是涉及基于饱和脂肪酸和二价铜盐螯合物的纳米材料及制备方法。
背景技术:
[0002]
抗生素的过度使用和滥用致使细菌对抗生素的耐药性逐渐增强,已经严重威胁到人类健康。在全世界范围内,每年大约有70万人死于耐药性细菌的感染。如果不采取有效措施,预计到2050年每年将有1000万人死于细菌耐药性感染。2016年联合国召开会议讨论了细菌对抗生素的耐药性问题,并将其视为“最大和最紧迫的全球风险”。尽管人们制备了大量的抗生素备选物,但在过去几十年里,很少有新型的抗生素成功推向市场以满足实际临床要求。因此,迫切需要开发抗生素的替代物质,以应对耐药菌的感染。
[0003]
c10到c18的天然饱和脂肪酸具有成本低廉、生物相容性好以及生物可降解等优势,是一类具有前景的生物材料。其中,以月桂酸为代表的饱和脂肪酸是一种碳链长度中等的饱和脂肪酸,广泛存在于椰树和牛奶中。据报道,月桂酸对革兰氏阳性菌具有选择性杀伤作用,其主要机理是通过破坏革兰氏阳性菌的细胞膜。然而,饱和脂肪酸由于其较高的结晶性,很难被制备成胶体稳定的纳米材料,极大地限制了其在生物医药领域中的应用。此外,尽管月桂酸对革兰氏阳性细菌表现出较强的抗菌活性,但是其对革兰氏阴性细菌的抵抗作用相对较弱。因此,需要将其抗菌活性与其他不易引起耐药性的治疗策略结合来以实现广谱抗菌。
[0004]
近年来,近红外光介导的光热疗法由于其具有较强的组织穿透性和极低的侵袭性,在抗菌治疗领域得到了广泛研究。光热疗法的主要机理是利用光热转换材料吸收近红外光并通过非辐射衰变途径将光能转换为热能,从而引起局部温度升高。局部温度升高将引起细菌细胞膜的松弛和蛋白变性等不可逆损伤,进而导致致病菌的灭活。光热杀菌具有两大好处,一是对革兰氏阳性菌和革兰氏阴性菌均具有杀菌效果,二是不易引起耐药性。在各类光热抗菌剂中,铜盐材料因其低廉的成本和稳定的光热转换性能而备受关注。据报道,铜盐通过催化类芬顿反应进而产生具有强氧化性的羟基自由基(
·
oh),以降解细菌核酸、蛋白以及多糖等物质,从而展现出优异抗菌和抗病毒的能力。然而,水溶性铜盐的光热转换效率低,而且过量摄取游离铜离子,其对健康组织会造成很强的毒副作用。
技术实现要素:
[0005]
本发明的目的是克服现有技术的不足,提供一种基于饱和脂肪酸和二价铜盐螯合物的纳米材料。
[0006]
本发明的第二个目的是提供一种基于饱和脂肪酸和二价铜盐螯合物的纳米材料的制备方法。
[0007]
本发明的第三个目的是提供一种基于饱和脂肪酸和二价铜盐螯合物的纳米材料在制备广谱抗菌药中的应用。
[0008]
本发明的技术方案概述如下:
[0009]
一种基于饱和脂肪酸和二价铜盐螯合物的纳米材料的制备方法,包括如下步骤:
[0010]
1)在保护气体保护下,在0-4℃下将饱和脂肪酸(1)溶解在第一有机溶剂中,加入催化剂和过量的草酰氯,0-4℃下反应;反应结束,减压浓缩,去除第一有机溶剂和过量的草酰氯;得到饱和脂肪酰氯(2);
[0011]
2)将饱和脂肪酰氯溶解于第一有机溶剂中,得到饱和脂肪酰氯溶液;将n-(3-氨基丙基)甲基丙烯酸盐酸盐(3)加入到反应容器中,抽真空并通保护气体,加入干燥的第一有机溶剂使化合物(3)溶解,所述饱和脂肪酰氯溶液和三乙胺加入到反应容器中,在室温下搅拌反应,反应结束,用水淬灭反应,用萃取液萃取、水洗、干燥,得到饱和脂肪酸双键衍生物(4);
[0012]
反应式如下:
[0013][0014]
3)按质量比1:0.1-10:89-98.9的比例,将所述饱和脂肪酸双键衍生物、二价铜盐和与饱和脂肪酸双键衍生物对应碳数的饱和脂肪酸混合,加热,使所述饱和脂肪酸相变成液体,使饱和脂肪酸双键衍生物和二价铜盐溶解,降温,得到固体a;将所述固体a碾成粉末,溶于第二有机溶剂制成a溶液;
[0015]
4)将中性单体aam溶于水制成aam水溶液;
[0016]
将正电荷单体apm溶于水制成apm水溶液;
[0017]
将交联剂mba溶于二甲基亚砜制成mba溶液;
[0018]
将引发剂aps溶于水制成aps水溶液;
[0019]
将所述a溶液、aam水溶液、apm水溶液和mba溶液混合,滴加到相当于a质量18-20倍的水中,加入催化剂temed,超声或涡旋振荡混匀,加入aps水溶液,在0-4℃,聚合反应5-8h,透析或超速离心除去未反应单体和水溶性的副产物,制备得到基于饱和脂肪酸和二价铜盐螯合物的纳米材料;
[0020]
所述a与aam的质量比为1:(2-4);
[0021]
所述apm、aam、mba、temed和aps的摩尔比为(1-3):(10-30):1:(0.8-1.2):(1.6-2.4);
[0022]
所述aam是丙烯酰胺的缩写;
[0023]
所述apm是n-[3-(二甲氨基)丙基]甲基丙烯酰胺的缩写;
[0024]
所述mba是n,n-亚甲基双丙烯酰胺的缩写;
[0025]
所述aps是过硫酸胺的缩写;
[0026]
所述temed是四甲基乙二胺的缩写。
[0027]
保护气体优选为氮气或氩气。
[0028]
优选地,饱和脂肪酸为癸酸(十酸)、月桂酸(十二酸)、豆蔻酸(十四酸)、软脂酸(十六酸)或硬脂酸(十八酸)。
[0029]
第一有机溶剂优选为二氯甲烷、二氧六环、四氢呋喃或乙酸乙酯。
[0030]
催化剂优选为n,n-二甲基甲酰胺,三乙胺或吡啶。
[0031]
萃取液优选为二氯甲烷或乙酸乙酯。
[0032]
第二有机溶剂优选为四氢呋喃,乙醇,甲醇或二甲基亚砜。
[0033]
二价铜盐优选为醋酸铜、氯化铜、硝酸铜或硫酸铜。
[0034]
上述方法制备的基于饱和脂肪酸和二价铜盐螯合物的纳米材料。
[0035]
上述基于饱和脂肪酸和二价铜盐螯合物的纳米材料在制备广谱抗菌药中的应用。
[0036]
有益效果:
[0037]
(1)本发明的一种基于饱和脂肪酸和二价铜盐螯合物的纳米材料通过光热效应引起的局部温度升高、饱和脂肪酸介导的菌膜损伤以及铜离子介导的类芬顿反应等三种模式在体外和体内实现对革兰氏阴性菌和革兰氏阳性菌的协同杀伤,具有广谱、多模式和协同的抗菌能力,抗菌性能极其优异。
[0038]
(2)制备饱和脂肪酸双键衍生物并将其应用于表面聚合中,同时应用表面聚合的方法制备得到了胶体稳定的脂肪酸纳米材料,纳米材料合成步骤简单、产率高且容易纯化。
[0039]
(3)本发明的纳米材料在体内和体外的应用中,展现出极好的抗菌能力。在体外对amp
r e.coli和mrsa的杀菌效率分别高达99.99%和99.9999%。在细菌感染的小鼠模型中,在近红外光照射下,该纳米材料治疗的amp
r e.coli和mrsa感染小鼠几乎完全恢复,与第一天相比,治疗10天后的感染区域分别减少到初始面积的6%和8%,且对其他正常组织器官无明显毒性,展现本发明的纳米材料在实际表皮感染中良好的治疗效果。
附图说明
[0040]
图1是实施例1制备的基于饱和脂肪酸和二价铜盐螯合物的纳米材料的形貌、粒径和表面电位表征以及其紫外吸收光谱、光热性质和光热稳定性测定。
[0041]
(a)显示poly-cu nps形貌的tem图片。
[0042]
(b)poly-cu nps的粒径分布。
[0043]
(c)poly-cu nps的表面电位。
[0044]
(d)poly-cu nps和poly-la nps的紫外可见近红外吸收光谱。
[0045]
(e)poly-cu nps在光密度为1.5w cm-2
激光照射10分钟下,温度的变化。
[0046]
(f)poly-cu nps经多次激光照射后的光热变化。
[0047]
图2是实施例1制备的基于饱和脂肪酸和二价铜盐螯合物的纳米材料的体外抗菌实验。
[0048]
(a)不同实验组培养5小时后在琼脂板上形成的菌落照片。
[0049]
(b)按集落形成单位(cfu)百分比对细菌生存能力进行统计分析。
[0050]
(c)通过tmb在652nm处的吸收比率来评估类芬顿反应生成的
·
oh。
[0051]
(d)不同实验组细菌孵育5h后的sem图像。标尺为1μm,每组重复3次。
[0052]
图3是实施例1制备的基于饱和脂肪酸和二价铜盐螯合物的纳米材料的体内抗菌
实验。
[0053]
(a)实验过程时间线的示意图。
[0054]
(b)感染amp
r e.coli的小鼠皮肤创面照片;标尺为5毫米。
[0055]
(c)感染mrsa的小鼠皮肤创面照片;标尺为5毫米。
[0056]
(d)感染amp
r e.coli的小鼠皮肤感染区域面积,显著性差异
**
p<0.01,
***
p<0.001。
[0057]
(e)感染mrsa的小鼠皮肤感染区域面积,显著性差异
**
p<0.01,
***
p<0.001。
[0058]
(f)用细菌存活率对细菌生存能力进行统计分析。
[0059]
(g)抗菌实验完成后不同分组琼脂板上形成的菌落照片。所有试验每组重复3次。
具体实施方式
[0060]
下面通过具体实施例对本发明作进一步的说明。
[0061]
各实施例中:
[0062]
aam是丙烯酰胺的缩写;
[0063]
apm是n-[3-(二甲氨基)丙基]甲基丙烯酰胺的缩写;
[0064]
mba是n,n-亚甲基双丙烯酰胺的缩写;
[0065]
aps是过硫酸胺的缩写;
[0066]
temed是四甲基乙二胺的缩写。
[0067]
实施例1
[0068]
一种基于饱和脂肪酸和二价铜盐螯合物命名为poly-cu np的制备方法,包括如下步骤:
[0069]
1)在氩气保护下,在0℃下将月桂酸1-1(5g,25mmol)溶解在二氯甲烷中搅拌,加入催化剂(n,n-二甲基甲酰胺,100μl)和过量的草酰氯(2.56ml,30mmol),0℃下反应3h;反应结束,减压浓缩,去除二氯甲烷和过量的草酰氯;得到月桂酰氯2-1;
[0070]
2)将月桂酰氯(120μl,0.5mmol)溶解于二氯甲烷中,得到月桂酰氯溶液;将n-(3-氨基丙基)甲基丙烯酸盐酸盐3(0.1g,0.5mmol)加入到反应容器中,抽真空并通氩气三次后,加入干燥的二氯甲烷(5ml)使化合物3溶解,加入月桂酰氯溶液和三乙胺(210μl,1.5mmol)加入到反应容器中,在室温下搅拌反应10h,反应结束,用水淬灭反应,用二氯甲烷萃取三次、水洗两次、硫酸镁干燥,得到白色固体月桂酸双键衍生物4-1;
[0071]
1
h-nmr(400mhz,cdcl
3
):δ6.73(s,1h),6.11(s,1h),5.77(s,1h),5.35(s,1h),3.42
–
3.22(m,4h),2.20(t,j=7.7hz,2h),1.99(s,3h),1.64(hept,j=6.3hz,4h),1.28(d,j=13.7hz,16h),0.88(t,j=6.6hz,3h).
13
c-nmr(100mhz,cdcl
3
):δ174.29,168.91,139.85,119.87,36.99,35.73,35.70,31.94,29.84,29.63,29.52,29.37,25.94,22.71,18.67,14.14.hrms(esi,m/z,c
19
h
36
n
2
o
2
,[m+h
+
]):calcd,325.2837;found,325.2858.
[0072]
反应式如下:
[0073][0074]
3)按质量比1:5:94的比例,将所述月桂酸双键衍生物、醋酸铜和与月桂酸混合,加热,使所述月桂酸相变成液体,使月桂酸双键衍生物和醋酸铜溶解,降温,得到固体a-1(也称la-cu复合物);将所述固体碾成粉末,溶于四氢呋喃制成la-cu复合物溶液;
[0075]
4)将中性单体aam溶于水制成浓度为200mg ml-1
的aam水溶液;
[0076]
将正电荷单体apm溶于水制成浓度为100mg ml-1
的apm水溶液;
[0077]
将交联剂mba溶于二甲基亚砜制成浓度为100mg ml-1
的mba溶液;
[0078]
将引发剂aps溶于水制成浓度为100mg ml-1
的aps水溶液;
[0079]
将所述la-cu复合物溶液、aam水溶液、apm水溶液和mba溶液混合,滴加到相当于la-cu复合物质量19倍的水中,加入催化剂temed,超声混匀,加入aps水溶液,在4℃,聚合反应5h,透析除去未反应单体和水溶性的副产物,制备得到一种基于饱和脂肪酸(月桂酸)和二价铜盐(醋酸铜)螯合物的纳米材料,命名为poly-cu np;
[0080]
所述la-cu复合物与aam的质量比为1:3;
[0081]
所述apm、aam、mba、temed和aps的摩尔比为1:20:1:0.8:1.6。
[0082]
实施例2
[0083]
一种基于饱和脂肪酸和二价铜盐螯合物的纳米材料的制备方法,包括如下步骤:
[0084]
1)在氮气保护下,在4℃下将癸酸1-2(4.3g,25mmol)溶解在二氧六环中搅拌,加入催化剂(三乙胺,75μl)和过量的草酰氯(2.56ml,30mmol),4℃下反应5h;反应结束,减压浓缩,去除二氧六环和过量的草酰氯;得到癸酰氯2-2;
[0085]
2)将癸酰氯(104μl,0.5mmol)溶解于二氧六环中,得到癸酰氯溶液;将n-(3-氨基丙基)甲基丙烯酸盐酸盐3(0.1g,0.5mmol)加入到反应容器中,抽真空并通氮气三次后,加入干燥的二氧六环(5ml)使化合物3溶解,加入癸酰氯溶液和三乙胺(210μl,1.5mmol)加入到反应容器中,在室温下搅拌反应8h,反应结束,用水淬灭反应,用二氯甲烷萃取三次、水洗两次、硫酸镁干燥,得到白色固体癸酸双键衍生物4-2;
[0086]
3)按质量比1:0.1:98.9的比例,将所述癸酸双键衍生物、氯化铜和与癸酸混合,加热,使癸酸相变成液体,使癸酸双键衍生物和氯化铜溶解,降温,得到固体a-2(也称ca-cu复合物);将所述固体碾成粉末,溶于乙醇制成ca-cu复合物溶液;
[0087]
4)将中性单体aam溶于水制成浓度为200mg ml-1
的aam水溶液;
[0088]
将正电荷单体apm溶于水制成浓度为100mg ml-1
的apm水溶液;
[0089]
将交联剂mba溶于二甲基亚砜制成浓度为100mg ml-1
的mba溶液;
[0090]
将引发剂aps溶于水制成浓度为100mg ml-1
的aps水溶液;
[0091]
将所述ca-cu复合物溶液、aam水溶液、apm水溶液和mba溶液混合,滴加到相当于ca-cu复合物质量20倍的水中,加入催化剂temed,涡旋振荡混匀,加入aps水溶液,在0℃,聚合反应8h,超速离心除去未反应单体和水溶性的副产物,制备得到一种基于饱和脂肪酸(癸酸)和二价铜盐(氯化铜)螯合物的纳米材料;
[0092]
所述ca-cu复合物与aam的质量比为1:2;
[0093]
所述apm、aam、mba、temed和aps的摩尔比为2:10:1:1:2。
[0094]
实验证明,用四氢呋喃替代本实施例的二氧六环,其它同本实施例,制备出一种基于饱和脂肪酸(癸酸)和二价铜盐(氯化铜)螯合物的纳米材料。
[0095]
实验证明,用甲醇替代本实施例的乙醇,其它同本实施例,制备出一种基于饱和脂肪酸(癸酸)和二价铜盐(氯化铜)螯合物的纳米材料。
[0096]
实验证明,用硫酸铜替代本实施例的氯化铜,其它同本实施例,制备出一种基于饱和脂肪酸(癸酸)和二价铜盐(氯化铜)螯合物的纳米材料。
[0097]
实施例3
[0098]
一种基于饱和脂肪酸和二价铜盐螯合物的纳米材料的制备方法,包括如下步骤:
[0099]
1)在氩气保护下,在0℃下将硬脂酸1-3(7.1g,25mmol)溶解在乙酸乙酯中搅拌,加入催化剂(吡啶,110μl)和过量的草酰氯(2.56ml,30mmol),0℃下反应3h;反应结束,减压浓缩,去除乙酸乙酯和过量的草酰氯;得到硬脂酰氯2-3;
[0100]
2)将硬脂酰氯(151μl,0.5mmol)溶解于乙酸乙酯中,得到硬脂酰氯溶液;将n-(3-氨基丙基)甲基丙烯酸盐酸盐3(0.1g,0.5mmol)加入到反应容器中,抽真空并通氩气三次后,加入干燥的乙酸乙酯(5ml)使化合物3溶解,加入硬脂酰氯溶液和三乙胺(210μl,1.5mmol)加入到反应容器中,在室温下搅拌反应10h,反应结束,用水淬灭反应,用乙酸乙酯萃取三次、水洗两次、硫酸镁干燥,得到白色固体硬脂酸双键衍生物4-3;
[0101]
3)按质量比1:10:89的比例,将所述硬脂酸双键衍生物、硝酸铜和与硬脂酸混合,加热,使所述硬脂酸相变成液体,使硬脂酸双键衍生物和硝酸铜溶解,降温,得到固体a-3(也称sa-cu复合物);将所述固体碾成粉末,溶于二甲基亚砜制成sa-cu复合物溶液;
[0102]
4)将中性单体aam溶于水制成浓度为200mg ml-1
的aam水溶液;
[0103]
将正电荷单体apm溶于水制成浓度为100mg ml-1
的apm水溶液;
[0104]
将交联剂mba溶于二甲基亚砜制成浓度为100mg ml-1
的mba溶液;
[0105]
将引发剂aps溶于水制成浓度为100mg ml-1
的aps水溶液;
[0106]
将所述sa-cu复合物溶液、aam水溶液、apm水溶液和mba溶液混合,滴加到相当于sa-cu复合物质量18倍的水中,加入催化剂temed,超声混匀,加入aps水溶液,在0℃,聚合反应6h,透析除去未反应单体和水溶性的副产物,制备得到一种基于饱和脂肪酸(硬脂酸)和二价铜盐(硝酸铜)螯合物的纳米材料;
[0107]
所述sa-cu复合物与aam的质量比为1:4;
[0108]
所述apm、aam、mba、temed和aps的摩尔比为3:30:1:1.2:2.4。
[0109]
实施例4
[0110]
实施例1中合成的纳米材料(poly-cu nps)在近红外区域具有较强的吸收和杰出的光热效应,相比于醋酸铜水溶液,其摩尔消光系数和光热转化效率提升了11倍和3倍,分别为216m-1
cm-1
和35.4%。此外,该纳米材料能够被耐药性革兰氏阴性菌和革兰氏阳性菌摄
入到菌体内部,释放出游离的月桂酸与铜螯合物。月桂酸引起细菌细胞膜的破坏,导致内容物的外流;铜螯合物可以催化细菌内的类芬顿反应,产生大量的
·
oh,降解细菌核酸、蛋白以及多糖等物质。因此,该纳米材料通过光热效应引起局部温度升高、月桂酸介导的细菌膜损伤以及铜离子介导的类芬顿反应三种模式在体外和体内实现对耐药菌的广谱、协同杀伤。在近红外光照射下,制备得到的纳米材料在体外对amp
r e.coli和mrsa的杀菌效果分别高达99.99%和99.9999%。在细菌感染的小鼠模型中,在近红外光照射下,该纳米材料治疗的amp
r e.coli和mrsa感染小鼠几乎完全恢复,与第一天相比,治疗10天后的感染区域分别减少到初始面积的6%和8%,且对其他正常组织器官无明显毒性,展现该纳米材料在实际表皮感染中良好的治疗效果。
[0111]
实施例1制备的(poly-cu nps)利用透射电子显微镜(tem)观测其形貌(图1a),结果显示该纳米材料呈球形结构。动态光散射测量粒径(dls)范围,发现纳米材料范围在50-300nm之间(图1b),表面电位为+11.6mv(图1c)。由于细菌表面带负电,正电荷的纳米材料会更容易结合到细菌表面并引发后续摄取步骤。作为对照,我们按照实施例1的方法合成了没有醋酸铜的纳米材料,命名为poly-la nps。对poly-cu nps和poly-la nps的紫外-可见吸收光谱进行测定,发现poly-cu nps在808nm处有明显吸收,而poly-la nps基本无吸收(图1d)。为评价poly-cu nps在808nm激光照射下的光热效应,取300μl poly-cu nps(5mg ml-1
)于24孔板中,用光密度为1.5w cm-2
的808nm激光器对其照射10分钟,用红外相机监测其温度变化,温度升高了25℃(图1e)。此外,对纳米材料连续照射五个循环,发现最高温度无明显降低,表明纳米材料具有良好的光稳定性(图1f)。这些实验数据表明,poly-cu nps具有良好的光热性质。
[0112]
实验证明,实施例2、3制备的一种基于饱和脂肪酸和二价铜盐螯合物的纳米材料杀菌效果及光稳定性、光热性质与实施例1相似。
[0113]
实施例5
[0114]
为了系统性评价poly-cu nps对amp
r e.coli和mrsa两种耐药菌的体外多模态抑菌效果,分别设置了六组实验进行抗菌效果测试。这六组实验对象分别是:
[0115]
细菌/磷酸盐缓冲液(blank);
[0116]
细菌/磷酸盐缓冲液/近红外光照射(blank+nir);
[0117]
细菌/poly-la nps(poly-la);
[0118]
细菌/poly-la nps/近红外光照射(poly-la+nir);
[0119]
细菌/poly-cu nps(poly-cu);
[0120]
细菌/poly-cu nps/近红外光照射(poly-cu+nir)。
[0121]
将细菌孵育5h后,采用经典平板计数法进行细菌菌落计数。如图2a,b所示,近红外光照射后amp
r e.coli和mrsa细菌菌落的数量均无明显降低,表明近红外光照射对细菌的生长几乎没有影响。同样,近红外光照射对poly-la nps也没有影响。然而,相比于对照组,poly-la nps孵育过的amp
r e.coli细菌菌落数量减少到54%-57%,而mrsa的菌落数量急剧减少,为对照组的0.8%-1.3%,这是由于月桂酸对革兰氏阳性菌的选择性杀伤作用。poly-cu nps使amp
r e.coli细菌菌落数量减少到30%,使mrsa的菌落数量减少到0.3%,细菌菌落的进一步降低可能是由铜螯合物催化的类芬顿反应产生过量的羟基自由基所致。此外,poly-cu nps与细菌孵育再经近红外光照射后具有极强的抗菌活性,对amp
r e.coli和
mrsa的杀菌效果分别高达99.99%和99.9999%。为了证明poly-cu nps通过类芬顿反应催化产生羟基自由基(
·
oh),利用比色探针33
’
,5,5
’-
四甲基联苯胺(tmb)来检测生成的
·
oh。tmb的氧化产物在652nm处具有特征吸收,因此利用652nm处的吸收强度定性反应
·
oh的产生。如图2c所示,空白实验组与poly-la nps与细菌和tmb孵育5h后,吸收强度均无明显增加。然而,poly-cu nps和tmb与amp
r e.coli和mrsa孵育后,吸收强度比率分别增加了64和32倍,表明poly-cu nps中的铜离子能够介导类芬顿反应的发生。这些结果表明,在月桂酸介导的膜损伤效应、铜离子介导的类芬顿反应以及光热效应的协同作用下,实现了对耐药性革兰氏阳性菌与革兰氏阴性菌异常强大的杀菌作用。利用扫描电镜(sem)对处理后的细菌形态进行了表征,从图2d可以看出,无论是在有或无近红外光照射的情况下,amp
r e.coli和mrsa的细胞膜结构都较为完整,菌体较为光滑。poly-la nps处理过的细菌开始出现了细胞膜的塌陷、撕裂甚至融合。在没有nir照射的情况下,poly-cu nps处理过的细菌结构进一步被破坏,近红外光照射后,细菌结构严重破坏,主要表现为大量细胞碎片的产生以及细胞膜的撕裂和融合。这些实验结果表明,poly-cu nps具有广谱、多模式和协同抗菌的效果。
[0122]
纳米材料的抗菌治疗效果在细菌感染的小鼠模型中被进一步评估。首先在小鼠背上创建一个直径为1cm的圆形皮肤伤口,然后接种amp
r e.coli和mrsa进行细菌感染。将小鼠随机分为六组,按照体外抗菌实验中描述的相同材料进行处理(实验时间线见图3a)。对于近红外光照组的小鼠,为避免过高的温度对正常组织和器官造成的损伤,将温度控制在47℃左右。在整个治疗窗期(10天)动态监测感染区域的愈合过程。如图3b,c,d,e所示,随着时间的推移,感染区域面积逐渐减少,但不同治疗组间愈合速度差异显著。对照组不论有无近红外光照射,在第10天感染amp
r e.coli和mrsa的小鼠感染面积减少到约40%。细菌/poly-la nps,细菌/poly-la nps/近红外光照射,细菌/poly-cu nps三组小鼠受感染区域恢复到大约20%-25%。近红外光照射过的poly-cu nps组小鼠的感染面积几乎完全愈合,amp
r e.coli和mrsa的小鼠感染面积分别减少到6%和8%,这表明poly-cu nps有极好的治疗效果。如图3d,g所示。在体内抗菌实验完成后,我们进一步通过平板计数法对感染区域进行菌落定量计数来评价抗菌效果。如图3f,g,整体抗菌趋势与体外抗菌试验相似,近红外光照射过的poly-cu nps组在琼脂板上没有观测到菌落。这些结果均表明poly-cu nps在体内和体外都具有极其优异的抗菌能力。
[0123]
实验证明,实施例2、3制备的一种基于饱和脂肪酸和二价铜盐螯合物的纳米材料对amp
r e.coli和mrsa两种耐药菌的体外多模态抑菌效果,与实施例1相似。
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询

tips


 商标分类
商标分类  商标转让
商标转让 



