柑橘黄化脉明病毒RT-RPA检测的特异引物、试剂盒和方法与流程
 2021-02-02 10:02:27|
2021-02-02 10:02:27| 333|
333| 起点商标网
起点商标网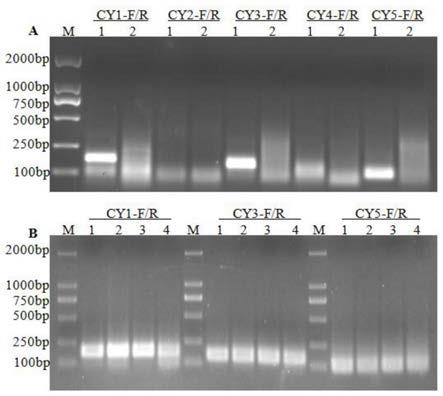
柑橘黄化脉明病毒rt-rpa检测的特异引物、试剂盒和方法
技术领域
[0001]
本发明涉及病毒检测技术领域,具体涉及一种柑橘黄化脉明病毒rt-rpa检测的特异引物、试剂盒和方法。
背景技术:
[0002]
柑橘黄脉病是由柑橘黄化脉明病毒(citrusyellow vein clearing virus,cyvcv)引起的一种新发虫传病害。cyvcv能够侵染绝大多数柑橘种类,柠檬和酸橙受感染后,叶片黄化、扭曲、明脉,叶脉背面呈水渍状,造成大量减产,部分杂柑和温州蜜柑受侵染后表现为叶片卷曲等症状,甜橙在实验条件下也可表现脉明等症状。柑橘黄脉病于1988年首次在巴基斯坦发现,2003年alshami通过电子显微镜观察到了弯曲的丝状病毒颗粒,并将其病原命名为柑橘黄化脉明病毒。2009年,我国首次在云南发现该病,随后zhou等人对中国11个主要柑橘种植省份检测调查,发现该病在9个省份已广泛分布。由于cyvcv可通过带毒接穗远距离传播,并可通过虫传和污染农具等高效传播,近几年来该病流行呈加速态势,严重威胁柑橘产业,尤其是柠檬产业发展。早期检测和应用脱毒苗木是有效防止此病为害的重要方法,因此建立简便快速、有效的cyvcv检测方法能为柑橘黄脉病的防控提供重要的技术支持。
[0003]
cyvcv属于α线性病毒科(alphaflexiviridae)印度柑橘病毒属(mandarivirus)的正义单链rna病毒。cyvcv基因组由7529个核苷酸组成,包含6个开放阅读框(open reading frame,orf)。cyvcv可通过嫁接、绣线菊蚜(a.spiraecola)和柑橘粉虱(dialeurodes citri)等在柑橘之间传播,还可以通过机械摩擦接种到苋色藜(c.amaranticolor)、昆诺藜(c.quinoa)、菜豆(phaseolus vulgaris)和豇豆(vigna unguiculata)等草本植株。在以往cyvcv的检测技术中,指示植物检测法、电子显微镜检测法、血清学检测法和核酸分子检测技术等大多都具有操作复杂、检测时间长、需要复杂实验仪器、对实验操作者要求较高等一些问题。
[0004]
逆转录重组酶聚合酶扩增(reverse transcription-recombinase polymerase amplification,rpa)是一种新型等温核酸扩增技术,该技术的原理主要模仿t4噬菌体的核酸复制机制,依赖重组酶和单链结合蛋白和链置换聚合酶在恒温条件下实现与模板的特异性识别和扩增,其目标产物可通过凝胶电泳或添加特异性探针通过试纸条呈现。由于具有快速、灵敏、操作简便等特点,该技术现已广泛应用多种动植物病害的检测。目前,国内外尚未有利用rt-rpa对cyvcv进行检测的报道。
技术实现要素:
[0005]
本发明的目的是针对上述问题,提供一种柑橘黄化脉明病毒rt-rpa检测的特异引物、试剂盒和方法。
[0006]
本发明为了实现其目的,采用的技术方案是:
[0007]
一种柑橘黄化脉明病毒rt-rpa检测的特异引物组,所述特异引物组为cy1-f/r或
者cy3-f/r或者cy5-f/r,其核苷酸序列如下所示:
[0008]
cy1-f:5
’-
gtcactaactccatagctaaccctaaacagac-3
’
,
[0009]
cy1-r:5
’-
gttgagatcttcgttcgctccaataatatcag-3
’
,
[0010]
cy3-f:5
’-
gtctaccgacgacaacaagggcaaacaacc-3
’
,
[0011]
cy3-r:5
’-
tacgcttttcgatgggctcttggttttcct-3
’
,
[0012]
cy5-f:5
’-
gccctaacgacacgaccccgaaacctatcc-3
’
,
[0013]
cy5-r:5
’-
gtgatacgcttttcgatgggctcttggttt-3
’
。
[0014]
一种柑橘黄化脉明病毒rt-rpa检测试剂盒,包含上述的特异引物组,还包含探针cy1-probe,所述探针cy1-probe的序列为:5
’-
[6-fam]ctatcgggaaagcttgggtccgcatcttg[thf]acatcgatcctg ccaac-c3 spacer-3
’
。
[0015]
优选地,所述cy1-r的5
’
端添加抗原标记biotin进行修饰。
[0016]
优选地,所述试剂盒还包含植物总rna提取试剂盒、rt-rpa扩增反应试剂、阴性对照、阳性对照。
[0017]
一种柑橘黄化脉明病毒的rt-rpa检测方法,包括如下步骤:
[0018]
1)提取待测样品rna;
[0019]
2)利用提取的样品rna进行rt-rpa反应,rt-rpa反应采用权利要求1中所述的特异引物或者权利要求2所述的试剂盒;
[0020]
3)rt-rpa反应完成后对反应产物进行检测,检测到目标扩增对象的即为阳性样品。
[0021]
优选地,rt-rpa反应的反应体系为:2μm的上\下游引物各2μl,2μm的探针0.2μl,样品rna2μl,rt-rpa扩增反应试剂。
[0022]
上述技术方案中,rt-rpa反应条件为:反应温度为37~44℃,反应时间为20~50分钟。
[0023]
优选地,rt-rpa反应条件为:反应温度为39℃,反应时间为30分钟。
[0024]
优选地,所述步骤3)中rt-rpa反应完成后对反应产物进行检测,检测方法为将扩增产物进行琼脂糖凝胶电泳分析,或者,扩增产物采用hybridetect试纸条判断结果。
[0025]
进行琼脂糖凝胶电泳分析时检测到177bp的条带,或者采用试纸条检测时质控线和测试线均显色,即表明待测样品是阳性样品。
[0026]
本发明的有益效果是:首次将rt-rpa技术应用于柑橘黄化脉明病毒的检测,建立了cyvcv的rt-rpa检测体系。该体系与柑橘衰退病毒、柑橘裂皮类病毒、柑橘碎叶病毒、柑橘黄龙病菌、温州蜜柑萎缩病毒等常见柑橘病原均无交叉反应,特异性强。本申请所建立的rt-rpa检测方法灵敏度与rt-pcr相当,不需要实时荧光pcr仪,也不需要设计rt-lamp设计复杂的引物,反应温度更低,操作也更为简洁,反应时长缩短了约一半。同时通过在反应体系中加入特异性探针,增强了rt-rpa检测的特异性。可以将rt-rpa技术与lfd技术相结合,检测结果可使用试纸条呈现,更加直观、简明。同时,rt-rpa所需反应温度更低,甚至仅靠人体体温即能完成反应,这也促进了该技术在基层的推广使用。
附图说明
[0027]
图1是柑橘黄化脉明病毒rt-rpa检测引物筛选电泳结果,其中,m:标准分子量;图
a:1:阳性样品,2:ddh2o;图b:1:嫩叶,2:嫩皮,3:老叶,4:老皮。
[0028]
图2是rt-rpa扩增产物的序列比对结果。
[0029]
图3是rt-rpa检测柑橘黄化脉明病毒反应时间筛选,其中,图a为电泳检测,图b为试纸条检测。
[0030]
图4是rt-rpa检测柑橘黄化脉明病毒反应温度筛选,其中,图a为电泳检测,图b为试纸条检测。
[0031]
图5是柑橘黄化脉明病毒的rt-rpa检测特异性结果,其中,图a为电泳检测,图b为试纸条检测;m:标准分子量,1:柑橘黄化脉明病毒,2:柑橘衰退病毒,3:柑橘叶斑驳病毒,4:柑橘碎叶病毒,5:柑橘裂皮病类病毒,6:柑橘鳞皮病毒,7:温州蜜柑萎缩病毒,8柑橘溃疡病菌,9:柑橘黄龙病菌,10:正对照,11:负对照。
[0032]
图6是柑橘黄化脉明病毒rt-rpa和rt-pcr的检测灵敏度结果,其中,图a为rt-pcr电泳检测,图b为rt-rpa电泳检测,图c为rt-rpa试纸条检测;m:标准分子量,10-0~10-7:稀释倍数。
[0033]
图7是部分田间柑橘样品的rt-rpa及rt-pcr检测结果,其中,图a为rt-pcr电泳检测,图b为rt-rpa电泳检测,图c为rt-rpa试纸条检测;m:标准分子量,1-2:沃柑,3-7:爱媛38;8:正对照,9:负对照。
具体实施方式
[0034]
下面结合实施例对本发明作进一步说明,但并不因此而限制本发明。
[0035]
下述实施例中的实验方法,如无特别说明,均为常规方法。
[0036]
实施例1
[0037]
1材料与方法
[0038]
1.1试验材料
[0039]
1.1.1供试材料
[0040]
本试验所使用的感染了柑橘黄化脉明病毒、柑橘叶斑驳病毒(citrus leafblotch virus,clbv)、柑橘衰退病毒(citrus tristeza virus,ctv)、柑橘碎叶病毒(citrus tatterleafvirus,ctlv)、柑橘裂皮病类病毒(citrus exocortis viroid,cevd)、柑橘鳞皮病毒(citruspsorosis virus,cpv)、温州蜜柑萎缩病毒(satsuma dwarfvirus,sdv)和柑橘黄龙病菌(candidatus liberibacter asiaticus,clas)和柑橘溃疡病菌(xanthomonas citri ssp.citri,xcc)的柑橘材料及健康柑橘材料,均由西南大学柑桔研究所脱毒中心提供。田间检测样品采于柑桔研究所展示园和母本园。
[0041]
1.1.2主要试剂与仪器
[0042]
trizol reagent(ambion)(货号:15596-026)、rt-rpa核酸扩增试剂(基础型)(杭州众测生物科技有限公司)(货号:s003zc)、rt-rpa-nfo核酸扩增试剂(试纸条型)(杭州众测生物科技有限公司)(货号:s006zc),hybridetect试纸条(安普未来公司)(货号:wlfs8201)、prime scripttm one step rt-pcr kit ver.2(takara公司)(货号:rr055b,包含prime script 1step enzyme,2
×
1step buffer),nanodrop2000分光光度计(thermo)、pcr仪(biometra tgradient)、水平电泳槽(sub-cell gtwide mini,biorad)、凝胶成像仪(立德赛)。
[0043]
1.2试验方法
[0044]
1.2.1样品总rna制备
[0045]
取50~100mg待测样品的叶片,按照trizol说明书的方法提取毒源植株的总rna,琼脂凝胶电泳检测rna完整性,用分光光度计测定浓度和纯度,将纯度良好的样品核酸保存与-80℃冰箱备用。
[0046]
1.2.2引物筛选以及探针设计
[0047]
利用clc软件对已报道的cyvcv基因组序列(genbank登录号:mg878869、kx156740、kx156738、kp313240、kp313242)进行比对,寻找保守区段,按照rt-rpa引物设计原则:引物长度30-35bp,无二级结构和单碱基重复序列,扩增片段大小100-200bp,通过primer premier 5软件设计引物5对:cy1-f/r、cy2-f/r、cy3-f/r、cy4-f/r、cy5-f/r(如表1所示)。
[0048]
用rt-rpa(基础型)试剂盒进行引物筛选试验。以感染cyvcv阳性样本的核酸为模板,清水为对照,进行rt-rpa反应,根据结果进行筛选。rt-rpa反应体系(总体积:50μl):在反应管中依次加入试剂盒a buffer 41.5μl,上下游引物(10μmol
·
l-1
)各2μl,核酸2μl,充分混匀,再加入试剂盒b buffer 2.5μl,充分振荡混匀,瞬时离心10s,置于42℃金属浴上反应30min。rpa反应结束后,向反应物中加入等体积的苯酚:氯仿:异戊醇25﹕24﹕1溶液50μl,轻轻涡旋,充分混匀,10000rpm离心2min,吸取5μl上清液进行琼脂糖凝胶电泳,观察电泳结果,选出最佳引物对。
[0049]
针对筛选出的最佳引物进行修饰以及设计对应探针。下游引物的5
’
端添加抗原标记biotin进行修饰。探针设计原则:探针序列不与引物识别序列重叠,长度在46-52nt之间,内部无二级结构和连续的重复碱基,探针的5
’
端用抗原标记物fam基团修饰,将距5
’
端30bp处的碱基替换为碱基类似物四氢呋喃(tetrahydrofuran,thf),探针3'端用聚合酶延伸阻断基团c3-spacer进行修饰。
[0050]
表1本试验所用引物
[0051]
[0052][0053]
注:rt-rpa:reverse transcription-recombinase polymerase amplification,逆转录重组酶聚合酶扩增;rt-pcr:reverse transcription-polymerase chainreaction,逆转录聚合酶链反应。
[0054]
1.2.3反应产物测序鉴定
[0055]
选出的引物用rt-rpa反应扩增出的产物经琼脂糖电泳分离后,切取目的条带,使用胶回收试剂盒纯化切胶产物,送往擎科公司测序,将测序结果与参考基因序列进行比对,确定反应扩增产物是否为目的片段。
[0056]
1.2.4 rt-rpa体系建立及优化
[0057]
利用rt-rpa-nfo(试纸条型)试剂盒,修饰后的优选引物以及探针优化反应体系。设置6个反应时间梯度:5、10、15、20、30、40min和8个反应梯度温度:37、38、39、40、40、42、43、44℃,根据电泳和试纸条检测结果,筛选出最佳反应时间和温度,建立rt-rpa检测体系。
[0058]
rt-rpa-nfo(试纸条型)扩增反应体系(总体积:50μl):在反应管中依次加入abuffer41.5μl,修饰后的上下游引物(2μmol
·
l-1
)各2μl,探针(2μmol
·
l-1
)0.2μl,核酸2μl,b buffer 2.5μl。反应结束后,向反应物中加入等体积苯酚:氯仿:异戊醇25﹕24﹕1溶液50μl,混匀离心后,吸取5μl上清液进行琼脂糖凝胶电泳,再吸取5μl上清液于干净的离心管中,加入95μl去离子水稀释二十倍,将hybridetect试纸条插入插入离心管中,约一分钟后判读结果,根据电泳结果和试纸条检测结果,选出最佳反应时间和反应温度,最终确定最佳反应体系。
[0059]
hybridetect试纸条结果判读方法:1.当质控线(control line)呈蓝色或红色,且测试线(test line)呈红色,结果判定为阳性;2.试纸条质控线呈蓝色,检测区没有条带,结果判定为阴性;3.质控线和检测区均未出现条带,表示所使用试纸条失效、损坏或操作有误,检测结果无效。
[0060]
1.2.5特异性检测
[0061]
提取仅携带cyvcv、ctv、clbv、ctlv、cevd、cpv、sdv、clas、xcc的柑橘样品以及健康样品总核酸,采用优化后的方法分别进行检测,根据电泳结果和试纸条检测结果,以确定该检测方法的特异性。
[0062]
1.2.6灵敏度检测
[0063]
将提取的阳性样品总核酸按10倍梯度稀释,以原液和10-1
、10-2
、10-3
、10-4
、10-5
、10-6
、10-7
稀释液作为模板,平行使用rt-rpa和rt-pcr进行检测,比较两种方法的检测灵敏度。rt-rpa反应体系同1.2.4,rt-pcr检测使用一步法rt-pcr试剂盒参照陈洪明的方法及引物,检测反应体系(总体积:10μl)以及程序:prime script 1step enzyme 0.4μl,2
×
1step buffer 5μl,上下游引物(10μmol
·
l-1
)各0.2μl,ddh
2
o 3.2μl,模板1μl;50℃反转录30min,
94℃预变性3min,94℃变性30s,58℃解链30s,72℃延伸30s,循环35次,72℃后延伸5min,4℃保存。
[0064]
1.2.7适用性检测
[0065]
以西南大学柑桔研究所内随机采摘的9个柑橘品种共45株样品为检测对象,应用所建立的rt-rpa检测方法进行cyvcv的检测,平行进行cyvcv的rt-pcr检测。通过比较两种方法的检测结果,评价rt-rpa检测方法的适用性。
[0066]
2结果
[0067]
2.1 rt-rpa检测体系建立及优化
[0068]
2.1.1引物筛选
[0069]
以感染cyvcv阳性样本的核酸为模板,分别使用设计的5对rt-rpa引物进行扩增。结果显示,引物cy1-f/r、cy3-f/r、cy5-f/r均能扩增出单一明亮的条带(图1a)。为进一步筛选最佳检测引物,取感染了cyvcv阳性植株不同部位(嫩叶、嫩皮、老叶、老皮)的样品抽提总核酸,分别用三对引物进行检测,结果也均扩增出单一的目的条带。其中cy1-f/r条带更明亮更清晰(图1b),说明cy1-f/r扩增效果更好。对cy1-r的5
’
端添加抗原标记biotin进行修饰,设计了对应探针cy1-prob(46bp)进行后续实验(表1)。
[0070]
2.1.2扩增产物鉴定
[0071]
将利用引物cy1-f/r扩增出的产物测序,测序结果与参考基因序列的比对结果显示,该产物长度为177bp,与目标cyvcv基因片段长度一致,与参考序列的同源性为100.00%(图2),说明rt-rpa扩增产物为目标cyvcv片段。
[0072]
2.1.3反应体系优化
[0073]
检测结果表明,在所设置反应时间梯度:5、10、15、20、30、40min下,随反应时间增加,电泳条带亮度逐渐增加,在20min、30min、40min和50min时,条带亮度无明显差异(图3a),但试纸条检测时反应时间为20min时,测试区条带不明显,当反应时间达到30min后,试纸条测试区条带变化无明显差异(图3b),故选择反应时间为30min。rt-rpa反应温度优化:设置反应梯度温度37、38、39、40、40、42、43和44℃,均能扩增出单一条带,试纸条测试区均出现红色条带,随着温度升高,电泳条带亮度增加,但随着温度的继续增加,电泳条带开始变暗,39℃时条带最明亮(图4a、图4b))但是纸条无明显变化,故选择39℃为最适反应温度。
[0074]
2.2 rt-rpa检测体系评价
[0075]
2.2.1特异性检测
[0076]
利用所建立的柑橘黄脉病毒rt-rpa检测体系分别对仅感染了cyvcv、ctv、cevd、ctlv、clbv、cpv、sdv、xcc和clas的样品进行检测。电泳和试纸条结果均显示,只有感染了cyvcv的样品检测呈阳性,而感染其它8种柑橘病害的样品均检测呈阴性(图5a、5b))。这表明所建立的cyvcv rt-rpa检测体系与其他柑橘病原无交叉反应,特异性强。
[0077]
2.2.2灵敏度检测
[0078]
将cyvcv检测为阳性的样品总核酸进行10倍梯度浓度稀释,将原液及其梯度稀释液分别进行rt-rpa和rt-pcr反应。电泳和试纸条检测结果均显示,当总核酸稀释至10-4
时,两种方法均仍能检测出cyvcv(图6a、6b),当总核酸稀释至10-5
时rt-rpa和rt-pcr电泳检测仍有微弱条带,但是试纸条测试区无条带(图6c),表明两种检测方法的检测灵敏度相当。
[0079]
2.2.3适用性检测
[0080]
田间随机采集9个不同品种共45个柑橘样品,分别进行rt-pcr和rt-rpa检测。rt-pcr和所建立的rt-rpa法检均测出37个阳性样品(图7a,图7b、图7c),检出率为82.2%(结果见表2),两种检测方法检测结果相同,表明该方法检测效果良好,检测效果稳定可靠。
[0081]
表2不同柑橘品种的rt-rpa及rt-pcr检测
[0082][0083][0084]
3结论
[0085]
本申请首次将rt-rpa技术应用于柑橘黄化脉明病毒的检测,结合侧向流层析试纸条,建立了cyvcv的rt-rpa检测体系。该体系与柑橘衰退病毒、柑橘裂皮类病毒、柑橘碎叶病毒、柑橘黄龙病菌、温州蜜柑萎缩病毒等常见柑橘病原均无交叉反应,特异性强。检测灵敏度与rt-pcr灵敏度一致,并且对田间样品检测的结果稳定可靠,适用性良好。本申请所建立的rt-rpa检测方法灵敏度与rt-pcr相当,不需要实时荧光pcr仪,也不需要设计rt-lamp设计复杂的引物,反应温度更低,操作也更为简洁,反应时长缩短了约一半。同时通过在反应体系中加入特异性探针,增强了rt-rpa检测的特异性。本申请将rt-rpa技术与lfd技术相结合,检测结果可使用试纸条呈现,更加直观、简明。同时,rt-rpa所需反应温度更低,甚至仅靠人体体温即能完成反应,这也促进了该技术在基层的推广使用。因而,本申请所建立rt-rpa检测方法与rt-lamp和实时荧光rt-pcr相比也具有一定优势。
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询

tips


 商标分类
商标分类  商标转让
商标转让 



