一种食管癌和/或胃癌分子标志物Lnc5q31.1、引物、试剂盒及应用的制作方法
 2021-02-02 10:02:37|
2021-02-02 10:02:37| 347|
347| 起点商标网
起点商标网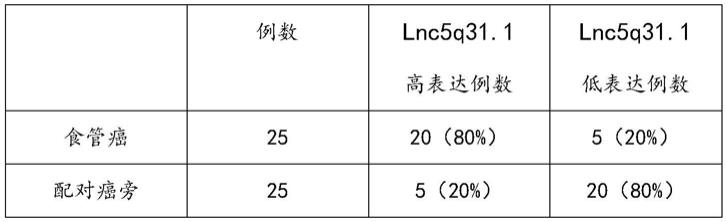
一种食管癌和/或胃癌分子标志物lnc5q31.1、引物、试剂盒及应用
技术领域
[0001]
本发明属于医学检测技术领域,尤其涉及一种食管癌和/或胃癌分子标志物lnc5q31.1、引物、试剂盒及应用。
背景技术:
[0002]
全球范围内,食管癌的发病率位于第七位,死亡率位居第六位。在我国,食管癌也是常见的恶性肿瘤之一,食管癌的预后差,5年生存率仅为15%-25%,且早期症状不典型,临床上缺乏简单有效的早期诊断方法,多数患者确诊时已属进展期,超过50%的病人已无法外科手术治疗。因此,新的早期诊断标志物的发现将有助于食管癌的防治。
[0003]
胃癌在全球范围内发病率位于第五位,死亡率位于第三位。研究显示,胃癌的5年生存率约20%,tnm分期i期和ii期患者的5年生存率高于70%,因而,胃癌早期诊断标志物的筛选有助于胃癌的早期诊断和预后评估,有利于降低胃癌的死亡率。
[0004]
肿瘤的发生发展是多因素参与的复杂过程,包括遗传学和表观遗传学异常。表观遗传学是指不依赖于dna序列改变的可遗传的基因表达变化的学科,主要包括dna甲基化、组蛋白修饰和非编码rna调控。研究发现,非编码rna的调控在肿瘤发生发展中具有重要作用,如非编码的转录产物可以参与到细胞分裂、分化等生命活动,具有重要的生物学功能。非编码rna包括小非编码rna和长非编码rna(lncrna)两大部分。根据长度和生源分类,小非编码rna包括mirna、sirna、pirna等。长非编码rna是长度大于200nt并且不能编码功能性蛋白的一类转录本。研究显示,长链非编码rna不仅参与到细胞增殖、细胞周期、细胞衰老和凋亡等生物学过程,而且也参与到了基因组不稳定性、dna损伤修复、染色体修饰、转录调控、转录后调控等重要的生物学过程,在肿瘤的发生发展中发挥重要的作用。hotair是近些年研究非常成熟的长链非编码rna,研究显示hotair在多种恶性肿瘤如乳腺癌、结肠癌、肝癌、甲状腺、食管癌、胰腺癌等中表达上调。其他作用非常相似的长链非编码rna,例如pvt1,pcat-1,ccat1等,表达与肿瘤呈现正相关性。而且越来越多的lncrna被鉴定,lncrna功能机制的多样性也逐渐被揭示。例如在前列腺癌、肺癌、乳腺癌中高表达的lncrna snhg1,主要通过结合成熟的mirma调节下游靶基因的表达。这类长链非编码rna被称为cerna。lee et al.描述了一个dna损伤修复相关的长链非编码rna,norad,通过隔离pumilio蛋白家族来维持基因组稳定性。norad的表达缺失,pumilio蛋白就可以抑制有丝分裂、dna修复和dna复制。lncrna研究中,crispr干扰技术平台的发展,发现了大量生长必须的非编码rna,其中约90%的lncrna表现出了细胞类型的特异性。然而,与食管癌和/或胃癌发生发展相关的lncrna的研究尚少,对于食管癌和/或胃癌发生发展相关的长链非编码rna的鉴定和研究,可能为临床研究提供重要的癌症早期检测的标志物和治疗的靶点。
技术实现要素:
[0005]
有鉴于此,本发明的目的在于提供一种食管癌和/或胃癌分子标志物及其应用,具
有操作简便、稳定性好、灵敏度高的特点。
[0006]
为了实现上述发明目的,本发明提供了以下技术方案:
[0007]
本发明提供了一种食管癌和/或胃癌分子标志物,所述的分子标志物为长非编码rnalnc5q31.1,所述长非编码rnalnc5q31.1的核苷酸序列如seq id no:1所示。
[0008]
本发明还提供了一种上述分子标志物在制备检测、诊断或治疗食管癌和/或胃癌产品中的应用。
[0009]
优选的,所述述产品为用于食管癌和/或胃癌检测的芯片或试剂盒。
[0010]
优选的,所述检测为根据所检测对象的生物样本中的rnalnc5q31.1表达水平来判断对象中食管癌和/或胃癌的疾病状况。
[0011]
本发明还提供了一种用于检测或诊断食管癌和/或胃癌的产品,所述产品包括检测上述分子标志物表达的试剂。
[0012]
优选的,所述试剂包括检测上述分子标志物表达量时使用的pcr扩增引物。
[0013]
优选的,所述引物序列如seq id no:2和seq id no:3所示。
[0014]
本发明还提供了一种用于检测或诊断食管癌和/或胃癌的试剂盒,包括上述引物,以及rna提取试剂、反转录试剂、rt-pcr试剂。
[0015]
本发明还提供了一种利用上述引物序列进行rt-pcr的方法,包括如下反应条件:95℃预变性5min,95℃变性30s,64℃退火30s,72℃延伸30-60s,3个循环;95℃变性30s,61℃退火30s,72℃延伸30-60s,3个循环;95℃变性30s,58℃退火30s,72℃延伸30-60s,3个循环;95℃变性30s,55℃退火30s,72℃延伸30-60s,26个循环;72℃延伸5min。
[0016]
优选的,所述rt-pcr方法中反应体系按体积份数计由模板5份、10μmol/μl的引物对4份、2
×
taqpcr mastermix 25份和ddh
2
o 16份组成,所述引物对的上、下游引物体积份数比为1:1。
[0017]
与现有技术相比,本发明技术方案具有如下有益效果:
[0018]
本发明首次发现长非编码rna lnc5q31.1在食管癌和胃癌组织中表达上调,为食管癌和/或胃癌的检测、诊断和治疗提供了一种新的分子标志物。本发明还首次提供了一种检测被检测对象生物样本中lnc5q31.1表达水平的特异性半定量rt-pcr的引物对,特异性强,同时建立了一个稳定的半定量rt-pcr反应体系和理想的半定量rt-pcr反应条件,使检测灵敏度高、特异性好、稳定性高,只需通过琼脂糖凝胶电泳条带是否出现206bp的扩增条带以及扩增条带的宽度及亮度便可判断被检测对象中食管癌和/或胃癌的疾病状况,操作简便。因此,应用本发明引物及产品来检测被检测对象生物样本中lnc5q31.1的表达水平可作为食管癌及胃癌诊断、疗效观察、预后判断、残留病灶及复发检测等的有力手段,操作简便,稳定性好,灵敏度高,具有深远的临床意义和推广性。
附图说明
[0019]
图1为运用本发明所述引物在9株食管癌细胞系中检测lnc5q31.1的表达水平,gapdh为内参,ddh
2
o为体系对照;
[0020]
图2为运用本发明所述引物对14例食管癌患者的食管癌及配对癌旁组织中检测lnc5q31.1的表达水平,gapdh为内参,ddh
2
o为体系对照;
[0021]
图3为运用本发明所述引物在13株胃癌癌细胞系中检测lnc5q31.1的表达水平,
gapdh为内参,ddh
2
o为体系对照;
[0022]
图4为运用本发明所述引物对7例胃癌患者的胃癌组织及配对的癌旁组织中检测lnc5q31.1的表达水平,gapdh为内参,ddh
2
o为体系对照;
[0023]
图5为运用本发明所述引物检测不同浓度食管癌细胞系kyse70 cdna样本中lnc5q31.1的表达水平。
具体实施方式
[0024]
本发明提供了一种食管癌和/或胃癌分子标志物,所述的分子标志物为长非编码rnalnc5q31.1,所述长非编码rnalnc5q31.1的核苷酸序列如seq id no:1所示。
[0025]
本发明还提供了一种上述分子标志物在制备检测、诊断或治疗食管癌和/或胃癌产品中的应用。本发明具体的为根据所检测对象的生物样本中的rnalnc5q31.1表达水平来判断对象中食管癌和/或胃癌的疾病状况,本发明对于生物样本的种类没有特殊限定,优选的为组织。
[0026]
本发明还提供了一种用于检测或诊断食管癌和/或胃癌的产品,所述产品包括检测上述分子标志物表达的试剂。本发明对于所述产品的种类没有特殊限定,采用本领域常规用于检测或诊断食管癌和/或胃癌的产品均可,优选的为芯片或试剂盒。本发明检测上述分子标志物表达的试剂包括检测上述分子标志物表达量时使用的pcr扩增引物;本发明对于所述检测上述分子标志物表达量时使用的pcr扩增引物的序列优选的如seq id no:2和seq id no:3所示,具体如下:
[0027]
lnc5q31.1-f(上游引物):gagtgatctctatcaccagtgact;lnc5q31.1-r(下游引物):ttcagagaacagcttcattctgtg。
[0028]
本发明还提供了一种用于检测或诊断食管癌和/或胃癌的试剂盒,包括上述引物,以及rna提取试剂、反转录试剂、rt-pcr试剂。
[0029]
本发明对所述rna提取试剂、反转录试剂、rt-pcr试剂的来源没有特殊限定,采用本领域常规市售产品即可;在本发明具体实施过程中,所述的rna提取试剂购自life,货号15596026;所述的反转录试剂购自thermo fisher scientific,货号k1622,所述的rt-pcr试剂购自real-times公司,货号rtc3104。在本发明中,所述的试剂盒优选的还包括阳性对照和阴性对照,所述阳性对照为食管癌细胞系kyse70的cdna,所述阴性对照为双蒸水。本发明对于食管癌细胞系kyse70的cdna的来源没有特殊限定,采用本领域常规技术手段获得或市售产品均可。
[0030]
本发明还提供了一种利用上述引物序列进行rt-pcr的方法,包括如下反应条件:95℃预变性5min,95℃变性30s,64℃退火30s,72℃延伸30-60s,3个循环;95℃变性30s,61℃退火30s,72℃延伸30-60s,3个循环;95℃变性30s,58℃退火30s,72℃延伸30-60s,3个循环;95℃变性30s,55℃退火30s,72℃延伸30-60s,26个循环;72℃延伸5min。
[0031]
在本发明中,对于rt-pcr所需的仪器、试剂、用具等的来源没有特殊限定,采用本领域常规市售产品即可。在本发明中,所述rt-pcr的反应条件优选为95℃预变性5min,95℃变性30s,64℃退火30s,72℃延伸40s,3个循环;95℃变性30s,61℃退火30s,72℃延伸40s,3个循环;95℃变性30s,58℃退火30s,72℃延伸40s,3个循环;95℃变性30s,55℃退火30s,72℃延伸40s,26个循环;72℃延伸5min。本发明对于rt-pcr反应体系没有特殊限定,优选的,
按体积份数计由模板5份、10μmol/μl的引物对4份、2
×
taqpcrmastermix 25份和ddh
2
o 16份组成,所述引物对的上、下游引物体积份数比为1:1,本发明对于2
×
taqpcr mastermix和ddh
2
o的来源没有特殊限定,采用本领域常规市售产品即可。
[0032]
下面结合实施例对本发明提供的技术方案进行详细的说明,但是不能把它们理解为对本发明保护范围的限定。
[0033]
实施例1
[0034]
1)模板的制备
[0035]
rna的制备:收集kyse70、kyse140、kyse150、kyse410、kyse30、kyse510、kyse520、colo 680n共9株食管癌细胞系样本,应用trizol法分别提取上述样本的总rna,使用nanodrop 2000确定其含量和纯度,od260/od280的值均在1.8-2.1之间,0.8-1%的琼脂糖凝胶电泳鉴定总rna质量。
[0036]
cdna合成:按照revertaidfirst strand cdna synthesis kit(thermo)试剂盒的操作进行反转录,最后反应体系用去离子水稀释到100μl,25μl体系的半定量rt-pcr实验中使用2.5μl cdna样本。
[0037]
2)半定量rt-pcr(在对目的基因以及内参基因进行半定量rt-pcr时,均以ddh
2
o为空白对照,用于评估pcr体系是否存在污染,若ddh
2
o检测结果为阴性,则说明pcr体系及结果可信)
[0038]
以lnc5q31.1半定量rt-pcr引物对和内参基因gapdh引物对进行扩增的pcr反应体系,以总体积25μl计,包括:
[0039]
模板(cdna):2.5μl
[0040]
半定量rt-pcr引物(10μmol/μl):上、下游引物各1μl
[0041]
2
×
taqpcr mastermix(real time):12.5μl;
[0042]
ddh
2
o:8μl
[0043]
其中扩增lnc5q31.1的上游引物序列为lnc5q31.1-f(5
’-
gagtgatctctatcaccagtgact-3
’
),下游引物序列为lnc5q31.1-r(5
’-
ttcagagaacagcttcattctgtg-3
’
);扩增gapdh的上游引物序列为gapdh-f(5
’-
gaccacagtccatgccatcac-3
’
),下游引物序列为gapdh-r(5
’-
gtccaccaccctgttgctgta-3
’
)。
[0044]
扩增条件:
[0045]
目的基因lnc5q31.1扩增程序如下:
[0046]
95℃5min
[0047]
95℃30s
→
64℃30s
→
72℃40s,3个循环;
[0048]
95℃30s
→
61℃30s
→
72℃40s,3个循环;
[0049]
95℃30s
→
58℃30s
→
72℃40s,3个循环;
[0050]
95℃30s
→
55℃30s
→
72℃40s,26个循环;
[0051]
72℃5min。
[0052]
内参基因gapdh扩增程序如下:
[0053]
95℃5min;
[0054]
95℃30s
→
63℃30s
→
72℃40s,25个循环;
[0055]
75℃5min。
[0056]
3)pcr反应产物的检测
[0057]
将pcr产物进行2%琼脂糖凝胶电泳,紫外透射分析仪检测并拍照记录,结果如图1所示,7株食管癌细胞系均出现206bp大小的条带,测序得目的基因pcr产物的核苷酸序列如seq id no:4所示,内参基因gapdh pcr产物的核苷酸序列如seq id no:5所示。
[0058]
实施例2
[0059]
与实施例1的区别仅在于收集的是14例食管癌患者的食管癌组织及配对的癌旁组织,其中ec1-ec14分别是14例食管癌患者的食管癌组织,en1-en14为相对应的14例食管癌患者的癌旁组织,其他步骤均与实施例1相同。结果如图2所示,12例食管癌患者的食管癌组织均出现条带,相比于癌旁组织的条带,食管癌组织所对应的条带亮且宽,所以食管癌组织中标志物lnc5q31.1高表达,癌旁组织中标志物lnc5q31.1低表达,测序得目的基因pcr产物大小均为206bp。
[0060]
实施例3
[0061]
与实施例1的区别仅在于收集的是13株胃癌细胞系样本,其他步骤均与实施例1相同。结果如图3所示,8株胃癌细胞系均出现条带,测序得目的基因pcr产物大小均为206bp。
[0062]
实施例4
[0063]
与实施例1的区别仅在于收集的是7例胃癌患者的胃癌组织及配对的癌旁组织,其中gc1-gc7分别是7例胃癌患者的胃癌组织,gn1-gn7为相对应的7例胃癌患者的癌旁组织,其他步骤均与实施例1相同。结果如图4所示,5例胃癌患者的胃癌组织均出现条带,相比于癌旁组织的条带,胃癌组织所对应的条带亮且宽,所以胃癌组织中标志物lnc5q31.1高表达,癌旁组织中标志物lnc5q31.1低表达,测序得目的基因pcr产物大小均为206bp。
[0064]
由上述实施例1-4可知,本发明利用半定量rt-pcr引物对,以组织样本提取总rna后反转录获得的cdna样本为模板进行pcr扩增,如果标志物长非编码rnalnc5q31.1有表达,则会产生206bp大小的片段;如果标志物长非编码rnalnc5q31.1表达缺失,则不产生扩增产物。基于此可知,本发明所述引物对特异性强。
[0065]
实施例5
[0066]
选取食管癌细胞系kyse70制备的cdna样本与ddh
2
o按比例混合,使食管癌细胞系kyse70的cdna样本的浓度依次为100%,50%,5%,1%,0.5%,0%,其余步骤与实施例1相同,利用半定量rt-pcr引物对检测lnc5q31.1的表达水平,结果如图5所示,表明利用本发明中检测lnc5q31.1表达的特异性引物对及反应体系、条件,其灵敏度可达到0.5%,灵敏度高。
[0067]
实施例6
[0068]
取25例食管癌患者的食管癌组织及配对癌旁组织,其中配对癌旁组织,是取自同一个癌症患者的癌组织的周边癌旁组织,应用实施例1所述半定量rt-pcr法检测标志物lnc5q31.1的表达量,检测结果见表1:
[0069]
表1:25例食管癌患者食管癌组织及配对癌旁组织的标志物表达量
[0070][0071]
在相同实验条件下,本发明利用半定量rt-pcr法比较了同一食管癌患者的癌组织和癌旁组织中标志物lnc5q31.1的表达量,以条带的强弱为主要判别标准,如图2所示,对于第1例食管癌患者的癌组织ec1和癌旁组织en1样本而言,ec1样本中的检测条带明显强于en1的条带(条带宽且亮或利用灰度值比较),则认为lnc5q31.1在这例标本中的癌组织明显高于癌旁组织,则认为是lnc5q31.1高表达例数,反之为低表达例数。通过表1可以看出:利用本发明所述标志物、特异性引物对、半定量rt-pcr方法,在25例食管癌组织中有80%的组织为lnc5q31.1高表达例数,检出率为80%。
[0072]
实施例7
[0073]
取20例胃癌患者的胃癌组织及配对癌旁组织,其中配对癌旁组织,是取自同一个癌症患者的癌组织的周边癌旁组织,属于没有癌变的组织,可以作为同一患者的癌组织的对照组织。应用实施例1所述半定量rt-pcr法检测标志物lnc5q31.1的表达量,检测结果见表2:
[0074]
表2:20例胃癌患者胃癌组织及配对癌旁组织的标志物表达量
[0075][0076]
在相同实验条件下,本发明利用半定量rt-pcr法比较了同一胃癌患者的癌组织和癌旁组织中标志物lnc5q31.1的表达量,以条带的强弱为主要判别标准,如图4所示,对于第1例胃癌患者的癌组织gc1和癌旁组织gn1样本而言,gc1样本中的检测条带明显强于gn1的条带(条带宽且亮或利用灰度值比较),则认为lnc5q31.1在这例标本中的癌组织明显高于癌旁组织,则认为是lnc5q31.1高表达例数,反之为低表达例数。通过表2可以看出:利用本发明所述标志物、特异性引物对、半定量rt-pcr方法,在20例食管癌组织中有50%的组织为lnc5q31.1高表达例数,检出率为50%。
[0077]
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询

tips


 商标分类
商标分类  商标转让
商标转让 


