引物组及小麦抗旱性的鉴定方法与流程
 2021-02-02 10:02:45|
2021-02-02 10:02:45| 455|
455| 起点商标网
起点商标网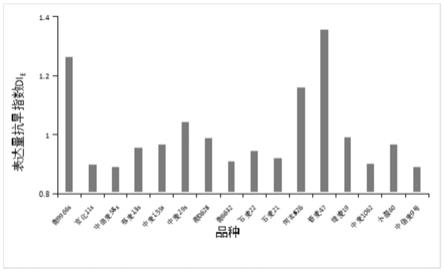
[0001]
本发明涉及小麦抗旱性技术领域,尤其涉及一种引物组及小麦抗旱性的鉴定方法。
背景技术:
[0002]
目前,世界上有许多重要的粮食作物,小麦就是这些作物当中最重要的一种之一,它有着适合种植范围区域比较广泛,可以存放的时间比较长久等优点。小麦作为我国人民最重要的口粮之一,它的种植面积和产量提高等产业发展对于我们国家的粮食安全储存和社会稳定发展有着非常重要的直接影响。而且在最近几年中,在全世界范围内的水资源短缺的问题一天比一天严重,非常严重的影响了绝大多数的植物的健康成长,并且极大的制约了粮食产物在农业生产上的增长和提高。根据统计,世界范围内干旱和半干旱地区大约占全球的土地总面积的36%,大约占耕地面积的43%,而世界上基本有70%的小麦种植分布在干旱和半干旱地区。目前干旱问题已经成为小麦生长发育面临的主要非生物逆境挑战,小麦对干旱胁迫的应答结果基本反应在地上生物量的变化方面,因此,研究分析小麦地上生物量对干旱胁迫的反应机制,不仅对小麦生长发育过程与作物产量影响的相关研究有着十分重要的理论意义,而且对制定小麦在不同气候及土壤水分条件下耕作栽培的措施以及对干旱等其他逆境胁迫的预防也有着很好的现实意义。
[0003]
现有技术已经公开了多种鉴定小麦抗旱性的方法,主要的方法有:
[0004]
田间直接鉴定法:在作物的不一样的生长发育阶段,对其生长的形态特征进行鉴定,如株高,叶宽,叶面积等。但该方法存在着较多缺点,如鉴定时所需要的时间相对比较长、受到的环境因素的制约较多,特别是在年际间降水变化幅度较大时,研究的数据结果难以重复等。
[0005]
人工模拟环境法:是指在经过人工搭建的干旱棚、生长箱或着人工气候室里,通过调控土壤、空气中的含水量的多少,来人为造成实验所需的干旱胁迫环境,并在干旱棚、生长箱或着人工气候室里研究小麦的生长发育过程、生理生化过程和产量结果的变化来评价小麦的抗旱性能。但是这种方法需要一定的专业的设备,能耗花费相对较大,而且在这种方法下创造的干旱胁迫环境与自然条件下田间生产具有一定的差异性,导致实验结果与田间直接鉴定的结果有一定差异。
[0006]
生理生化指标鉴定:作物的抗旱性鉴定主要是通过鉴定叶片水分相关的指标、质膜透性和酶活性等进行的,但是,通常情况下这些理化指标会因生长环境、生育时期的不同而发生改变,也容易因所用试剂及人为操作带来误差。最后所得数据会与田间鉴定有一定的误差。
[0007]
分子生物学鉴定法:在现代分子生物学的基础上,利用相关的分子标记构建饱和的分子遗传图谱,并对小麦的抗旱基因进行定位,利用分子标记进行小麦抗旱品种的选择,但是标记的多态性频率很低,单个qtl对表型差异影响小,上位性效应很难进行评估等原因,利用分子标记辅助选择还需进行深一步研究。因此,迫切需要建立新技术和发现新的标
记物来解决这些问题。
技术实现要素:
[0008]
有鉴于此,本发明提供了一种引物组及小麦抗旱性的鉴定方法,本发明提供的鉴定方法采用qrt-pcr鉴定,方法简单、结果准确、鉴定范围广且效率高。
[0009]
本发明提供了一种引物组,包括:seq id no.1所示的上游引物和seq id no.2所示的下游引物。
[0010]
上游引物:5
’-
ggtggtgaattgggctttgg
[0011]
下游引物:5
’-
tgccacttgtcatcgccttt
[0012]
本发明提供的引物组用于采用qrt-pcr方法检测小麦抗旱基因tashsp16.9,有效实现对小麦抗旱性的鉴定。
[0013]
本发明还提供了一种小麦抗旱性的鉴定方法,包括以下步骤:
[0014]
以上述技术方案所述的引物组作为引物,分别对干旱胁迫处理后的待测小麦和未进行干旱胁迫处理的待测小麦进行qrt-pcr检测,分别获得实验组小麦抗旱基因表达量和对照组小麦抗旱基因表达量;
[0015]
根据公式1计算待测小麦抗旱系数:
[0016]
待测小麦抗旱系数dc
e
=实验组小麦抗旱基因表达量
÷
对照组小麦抗旱基因表达量;(公式1);
[0017]
根据公式2获得待测小麦的抗旱性:
[0018]
di
e
=(待测小麦抗旱系数dce
×
实验组小麦抗旱基因表达量)
÷
所有待测小麦品种进行干旱胁迫处理后抗旱基因表达量的平均数。
[0019]
本发明将待测小麦种子在铺有蛭石的育苗盘中进行种植,在苗期进行干旱胁迫处理,使蛭石的含水量低于20%;同时设置正常浇水的对照组。干旱胁迫处理后,以小麦植株顶部叶片作为待测样品进行qrt-pcr检测。
[0020]
在一个实施例中,所述待测小麦生长至三叶期进行干旱胁迫处理。
[0021]
在一个实施例中,进行干旱胁迫处理7天后,分别对干旱胁迫处理后的待测小麦叶片和未进行干旱胁迫处理的待测小麦叶片进行qrt-pcr检测。
[0022]
在一个实施例中,所述干旱胁迫处理具体为控制待测小麦生长基质的含水量低于20%。
[0023]
在一个实施例中,所述qrt-pcr检测具体包括:
[0024]
提取待测小麦叶片的总rna,逆转录形成cdna,以所述cdna为模板进行qrt-pcr检测;
[0025]
所述检测的反应体系的总体积为20μl,包括2μl的cdna模板,0.5μl的上游引物、0.5μl的下游引物,10μl的荧光染料和7μl无菌水。
[0026]
在一个实施例中,所述qrt-pcr检测的条件为:第一步预变性:95℃3min;第二步扩增:95℃ 5s,60℃ 30s,30个循环。
[0027]
在一个实施例中,所述荧光染料sybr green mix荧光染料。
[0028]
在对待测小麦进行qrt-pcr检测时,分别获得实验组小麦抗旱基因表达量和对照组小麦抗旱基因表达量。该抗旱基因表达量为相对表达量,其=待测目的基因ct值-待测内
参基因ct值。
[0029]
本发明以如上所述的引物组对待测小麦进行qrt-pcr检测,分别获得实验组待测小麦抗旱基因的ct值和对照组待测小麦抗旱基因的ct值;
[0030]
本发明以u6作为内参基因,采用市售的试剂盒对待测小麦进行qrt-pcr检测,分别获得实验组待测小麦内参基因的ct值和对照组待测小麦内参基因的ct值。
[0031]
然后根据实验组待测小麦抗旱基因的ct值、对照组待测小麦抗旱基因的ct值、实验组待测小麦内参基因的ct值和对照组待测小麦内参基因的ct值获得实验组小麦抗旱基因表达量和对照组小麦抗旱基因表达量,其中,实验组小麦抗旱基因表达量=实验组待测小麦抗旱基因的ct值-实验组待测小麦内参基因的ct值;对照组小麦抗旱基因表达量=对照组待测小麦抗旱基因的ct值-对照组待测小麦内参基因的ct值;
[0032]
再根据公式1计算待测小麦抗旱系数:
[0033]
待测小麦抗旱系数dc
e
=实验组小麦抗旱基因表达量
÷
对照组小麦抗旱基因表达量;(公式1);
[0034]
最后根据公式2获得待测小麦的抗旱性:
[0035]
di
e
=(待测小麦抗旱系数dc
e
×
实验组小麦抗旱基因表达量)
÷
所有待测小麦品种进行干旱胁迫处理后抗旱基因表达量的平均数。
[0036]
本发明中,所有待测小麦品种的数量优选为10~20种。
[0037]
在一个实施例中,所有待测小麦品种的数量为16种。
[0038]
获得di
e
后,依据di
e
对小麦品种抗旱能力进行评价,其中di
e
≥1.3为极抗旱(hr),di
e
为1.01~1.29为强抗旱(r);di
e
为0.91~1.10为中等抗旱(mr);di
e
为0.70~0.90为弱抗(s);di
e
≤0.70为极弱抗旱(hs)。
[0039]
本发明采用qrt-pcr检测方法对小麦抗旱性进行鉴定,对小麦品种在苗期生长过程中进行干旱胁迫,同时设置对照组,提取小麦植株的总rna,并对其中抗旱基因表达量进行检测,获得表达量抗旱指数di
e
;利用di
e
表达量抗旱指数对小麦进行抗旱性能评价。这样可实现对小麦抗旱性的快速准确鉴定,为小麦抗旱性筛选提供技术支持。
[0040]
本发明提供的方法具有以下优点:
[0041]
(1)方法简单,能够单一的通过荧光定量pcr技术鉴定小麦的抗旱性,不需要和其他性状和指标结合;
[0042]
(2)鉴定准确,本方法利用抗旱基因表达量抗旱指数di
e
与不同小麦品种产量抗旱指数id达到极显著正相关,与目前经常被采用的田间直接鉴定法得出的鉴定结果基本一致;
[0043]
(3)鉴定范围较广,不仅可以鉴定小麦杂交种,也可鉴定小麦自交系。
[0044]
(4)鉴定效率高,可在小麦苗期鉴定,基于抗旱基因建立的小麦荧光定量pcr抗旱性检测方法将为鉴定小麦的抗旱性提供先进技术手段。且从播种到鉴定结束大约需要20天,1年可完成多个批次的抗旱鉴定。
附图说明
[0045]
图1为各小麦品种的小麦表达量抗旱指数di
e
。
具体实施方式
[0046]
实施例1
[0047]
本发明以衡9966s,京化11s,中信麦58s,邢麦13s,中麦155s,中麦29s,衡0628,衡6632,石麦22,石麦21,河农826,晋麦47,捷麦19,中麦1062,小偃60,中麦9号等16个品种作为待测小麦品种进行抗旱性鉴定,具体方法如下:
[0048]
将待测小麦播种于铺有蛭石的育苗盘中,在小麦植株生长至3叶期时进行干旱胁迫处理,同时设置对照组,干旱胁迫处理为使蛭石含水量为10%,对照组中蛭石含水量为30%;
[0049]
干旱胁迫处理7天后,采用trizol试剂提取小麦植株顶部叶片的总rna,具体方法参见trizol总rna抽提试剂盒说明书;
[0050]
将总rna进行逆转录形成cdna具体方法如下:cdna第一链合成rna按照700ng反转录,在冰浴的pcr管中加入以下试剂:总rna,1μl random primer p(dn)
6
,1μl dntp mix(终浓度0.5mm),rnase-free ddh
2
o至14.5μl;混匀后离心5s,然后60℃温浴5min后,冰浴2min,再次离心3s;再次冰浴后,加入4μl 5x rt buffer,0.5μl thermo scientific ribolock rnase inhibitor(20u)和1μl maxima reverse transcriptase(200u),混匀离心5s,在pcr仪上按照以下条件进行反转录:25℃,5min;60℃30min;90℃,3min,获得cdna模板;
[0051]
以如下所示的上游引物和下游引物作为引物组,
[0052]
上游引物:5
’-
ggtggtgaattgggctttgg
[0053]
下游引物:5
’-
tgccacttgtcatcgccttt
[0054]
对上述cdna模板进行qrt-pcr检测,分别获得实验组待测小麦抗旱基因的ct值和对照组待测小麦抗旱基因的ct值,所述检测的反应体系的总体积为20μl,包括2μl的cdna模板,0.5μl的上游引物、0.5μl的下游引物,10μl的sybr green mix荧光染料和7μl无菌水;所述qrt-pcr检测的条件为:第一步预变性:95℃3min;第二步扩增:95℃5s,60℃ 30s,30个循环;
[0055]
以u6作为内参基因,采用u6检测试剂盒分别对上述cdna模板进行qrt-pcr检测分别获得实验组待测小麦内参基因的ct值和对照组待测小麦内参基因的ct值;
[0056]
根据实验组待测小麦抗旱基因的ct值、对照组待测小麦抗旱基因的ct值、实验组待测小麦内参基因的ct值和对照组待测小麦内参基因的ct值获得实验组小麦抗旱基因表达量和对照组小麦抗旱基因表达量,其中,实验组小麦抗旱基因表达量=实验组待测小麦抗旱基因的ct值-实验组待测小麦内参基因的ct值;对照组小麦抗旱基因表达量=对照组待测小麦抗旱基因的ct值-对照组待测小麦内参基因的ct值;
[0057]
根据公式1计算待测小麦抗旱系数:
[0058]
待测小麦抗旱系数dc
e
=实验组小麦抗旱基因表达量
÷
对照组小麦抗旱基因表达量;(公式1);
[0059]
根据公式2获得待测小麦的抗旱性:
[0060]
di
e
=(待测小麦抗旱系数dc
e
×
实验组小麦抗旱基因表达量)
÷
所有小麦品种进行干旱胁迫处理后抗旱基因表达量的平均数。
[0061]
其中,所有小麦品种进行干旱胁迫处理后抗旱基因表达量的平均数为本实施例16种小麦品种进行干旱胁迫处理后抗旱基因表达量的平均数。
[0062]
依据di
e
对小麦品种抗旱能力进行评价,其中di
e
≥1.3为极抗旱(hr),di
e
为1.01~1.29为强抗旱(r);di
e
为0.91~1.10为中等抗旱(mr);di
e
为0.70~0.90为弱抗(s);di
e
≤0.70为极弱抗旱(hs)。
[0063]
结果参见图1和表1,表1为各小麦品种的小麦表达量抗旱指数di
e
及其抗旱能力,图1为各小麦品种的小麦表达量抗旱指数di
e
。
[0064]
表1各小麦品种的小麦表达量抗旱指数di
e
及其抗旱能力
[0065][0066]
由表1可知,本发明提供的方法利用抗旱基因表达量抗旱指数di
e
与不同小麦品种产量抗旱指数id达到极显著正相关,与目前经常被采用的田间直接鉴定法得出的鉴定结果基本一致。
[0067]
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应
视为本发明的保护范围。
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询

tips


 商标分类
商标分类  商标转让
商标转让 



