一种外周血单个核细胞的分离方法与流程
 2021-02-02 09:02:27|
2021-02-02 09:02:27| 394|
394| 起点商标网
起点商标网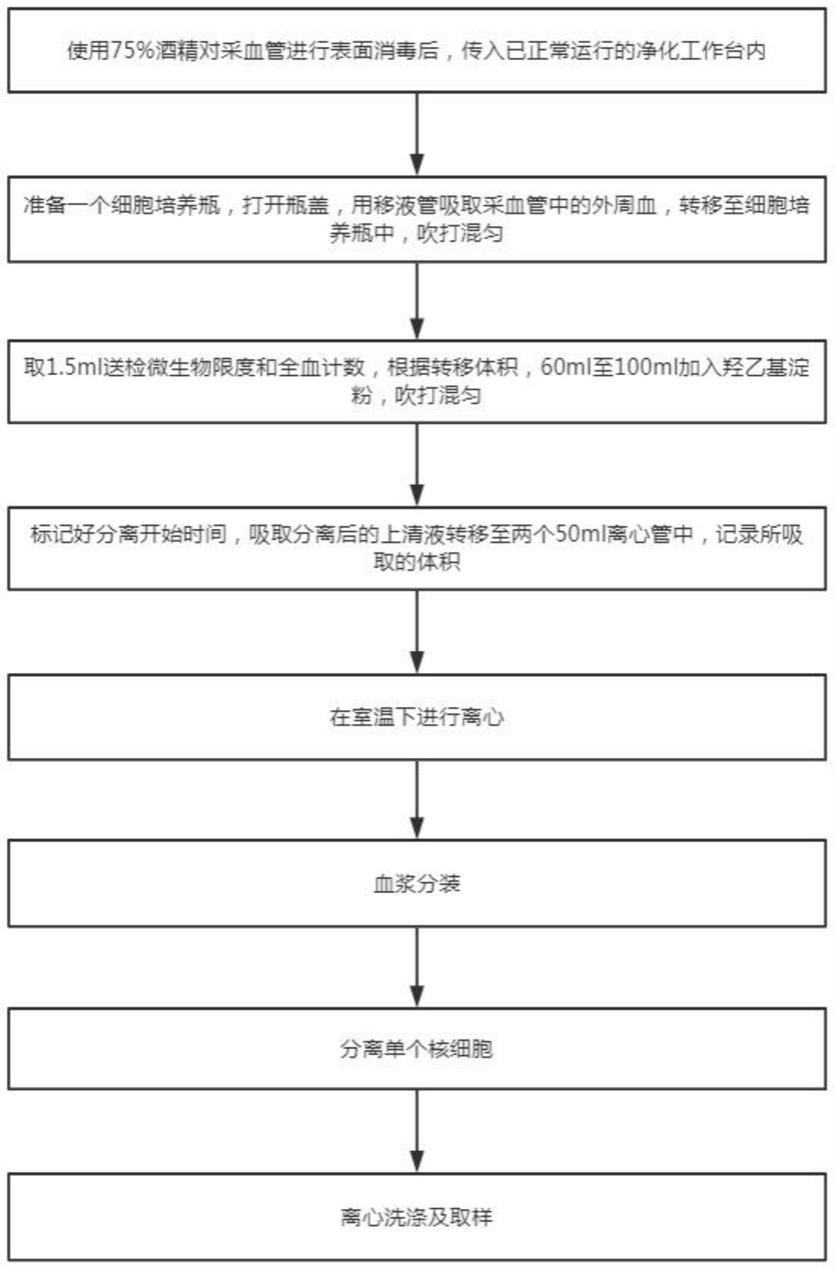
[0001]
本发明涉及细胞分离技术领域,特别涉及一种外周血单个核细胞的分离方法。
背景技术:
[0002]
细胞治疗是近几年兴起的疾病治疗新技术,是指利用某些具有特定功能的细胞的特性,采用生物工程方法获取和或通过体外扩增、特殊培养等处理后,使这些细胞具有增强免疫、杀死病原体和肿瘤细胞、促进组织器官再生和机体康复等治疗功效,从而达到治疗疾病的目的。
[0003]
细胞治疗以其良好的疗效,副作用小,更个体化、个性化等独特的优势,为一些难治性疾病的治疗,提供了一种选择,有时甚至是最后的选择。在当前和今后很长的历史阶段,细胞治疗都将在临床治疗中担当重要的角色,二十一世纪将是细胞治疗发挥重要作用的时代。
[0004]
在免疫细胞治疗中,一般采用羟乙基淀粉(hydroxyethyl starch,hes)离心沉淀法或ficoll密度梯度离心法分离外周血单个核细胞(pbmc)。采用羟乙基淀粉离心沉淀法虽然在操作上比较简便,但是细胞分离的效果不佳,得到的细胞纯度难以满足要求,有较多的血小板、红细胞及粒细胞等。而采用ficoll密度梯度离心法,红细胞、粒细胞比重大,离心后沉于管底;淋巴细胞和单核细胞的比重小于或等于分层液比重,离心后漂浮于分层离液的液面上,也可有少部分细胞悬浮在分离层液中,吸取分离层液液面的白膜层细胞,就可从外周血中分离得到单个核细胞。这个方法所得到的细胞纯度较好,但是对样本体积上的要求有一定的限制,如果样本体积超过50ml,分离的效果会大大降低;而且对操作上的要求比较高,如果操作不够谨慎,分离得到的细胞在数量和纯度上都会有较大影响。此外,不同的离心力与离心时间对细胞分离的效果也有较大影响,采用不同的离心参数分离出来的细胞,纯度和活力都有很大的差异。
技术实现要素:
[0005]
本发明的主要目的是结合羟乙基淀粉沉淀以及ficoll密度梯度离心法,对pbmc的分离方法进行改进,尤其对于大体积(>50ml)的血液样本分离更具优势。
[0006]
为实现上述目的,本发明提出的外周血单个核细胞的分离方法,包括以下步骤:
[0007]
s10:外周血分离:
[0008]
s101:使用75%酒精对采血管或采血袋进行表面消毒后,传入已正常运行的净化工作台内;
[0009]
s102:准备一个t75细胞培养瓶,打开瓶盖,用移液管吸取采血管中的外周血,转移至t75细胞培养瓶中,吹打混匀;
[0010]
s103:取1.5ml送检微生物限度和全血计数,根据转移体积,60ml至100ml加入20ml羟乙基淀粉,吹打混匀;
[0011]
s104:标记好分离开始时间,时间达30分钟,吸取分离后的上清液转移至两个50ml
离心管中,记录所吸取的体积;
[0012]
s105:在室温下进行离心。
[0013]
优选地,还包括以下步骤:
[0014]
s20:血浆分装:
[0015]
s201:离心后的外周血上清液(即血浆)用移液管轻轻吸出转移到50ml离心管中,并进行标记;
[0016]
s202:取20ml血浆分装至5个4.5ml冻存管中,每管4ml,多余废弃;
[0017]
s203:封口,贴标签后转移至冻存盒,将冻存盒置于4℃冰箱暂存;
[0018]
s204:将冰箱暂存后的血浆转移至-80℃冰箱或液氮暂存罐中暂存。
[0019]
优选地,还包括以下步骤:
[0020]
s30:分离单个核细胞:
[0021]
s301:离心后的每管细胞沉淀使用0.9%氯化钠注射液进行稀释,定容至30ml,并吹打混匀;
[0022]
s302:将稀释后的细胞沉淀缓慢铺加至2个分离液管中,每管添加30ml,保持分离液与稀释血液界面清晰,并进行标记;
[0023]
s303:将离心机降速,然后进行离心。
[0024]
优选地,还包括以下步骤:
[0025]
s40:第一次离心洗涤:
[0026]
s401:离心结束后,吸取单个核细胞层至2个50ml离心管中,每个离心管使用0.9%氯化钠注射液定容至50ml,吹打混匀,标记;
[0027]
s402:室温下进行离心。
[0028]
优选地,还包括以下步骤:
[0029]
s50:第二次离心洗涤及取样:
[0030]
离心结束后,弃上清,将细胞沉淀合并到1个离心管,并使用0.9%氯化钠注射液定容至50ml,吹打混匀,取样0.5ml检测细胞数量和细胞活率,标记。
[0031]
优选地,在所述的s105中,离心机的离心力为900g,离心时间为15min。
[0032]
优选地,在所述的s203中,血浆在冰箱暂存的时间为12h。
[0033]
优选地,在所述的s301中,稀释比例为全血体积与稀释后体积比等于1:1。
[0034]
优选地,在所述的s303中,离心机设置为1档、600g,室温离心15min;
[0035]
优选地,在所述的s402中,离心机的离心力设置为600g,离心时间为10min。
[0036]
本发明公开的外周血单个核细胞的分离方法,针对大容量血液样本的分离特点,先用羟乙基淀粉沉淀法去除大部分的红细胞,然后在空气中自然沉降,再用ficoll密度梯度离心法对单个核细胞进行进一步纯化,从而得到纯度超过95%,活力超过90%的pbmc。相比没有在空气中自然沉降的方法,获得的细胞活力和纯度更高。
附图说明
[0037]
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以
根据这些附图示出的结构获得其他的附图。
[0038]
图1为本发明实施例提供的一种外周血单个核细胞的分离方法流程图。
[0039]
本发明目的的实现、功能特点及优点将结合实施例,参照附图做进一步说明。
具体实施方式
[0040]
下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明的一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
[0041]
需要说明,本发明实施例中所有方向性指示(诸如上、下、左、右、前、后
……
)仅用于解释在某一特定姿态(如附图所示)下各部件之间的相对位置关系、运动情况等,如果该特定姿态发生改变时,则该方向性指示也相应地随之改变。
[0042]
另外,在本发明中涉及“第一”、“第二”等的描述仅用于描述目的,而不能理解为指示或暗示其相对重要性或者隐含指明所指示的技术特征的数量。由此,限定有“第一”、“第二”的特征可以明示或者隐含地包括至少一个该特征。另外,各个实施例之间的技术方案可以相互结合,但是必须是以本领域普通技术人员能够实现为基础,当技术方案的结合出现相互矛盾或无法实现时应当认为这种技术方案的结合不存在,也不在本发明要求的保护范围之内。
[0043]
在本发明实施例中,参照图1,该外周血单个核细胞的分离方法,包括以下步骤:
[0044]
s10:外周血分离:
[0045]
s101:使用75%酒精对采血管或采血袋进行表面消毒后,传入已正常运行的净化工作台内;
[0046]
s102:准备一个t75细胞培养瓶,打开瓶盖,用移液管吸取采血管中的外周血,转移至t75细胞培养瓶中,吹打混匀。
[0047]
使用时应先将移液管洗净,自然沥干,用待量取的溶液润洗2-3次,用右手拇指及中指捏住管颈标线以上的地方。左手拿像皮球轻轻将溶液吸上,眼睛注意上升的液面。t75细胞培养瓶倾斜30
°
,移液管直立,管下端紧靠t75细胞培养瓶内壁,稍松开食指,让溶液沿瓶壁慢慢流下,全部溶液流完后需等15s后再拿出移液管,以便使附着在管壁的部分外周血得以流出。
[0048]
在进行吹打时,吹打用的培养基不能太少,避免产生气泡,因为在传代的时候,急速的反复吹打肯定容易产生泡沫,这对细胞不利,所以我们要尽量避免。而且吸管每次打出液体后立刻深入液面下吸取液体。
[0049]
s103:取1.5ml送检微生物限度和全血计数,根据转移体积,60ml至100ml加入20ml羟乙基淀粉,吹打混匀;在吹打时尽量选用较大口的吸管,吸液时先将吸管内空气排空,再深入液面以下吸液,吹打细胞时,尽量沿着壁吹出液体,操作轻柔,就可最大程度避免泡沫的产生。
[0050]
s104:标记好分离开始时间,时间达30分钟,提高血浆的活性,然后吸取分离后的上清液转移至两个50ml离心管中,记录所吸取的体积;
[0051]
s105:在室温下进行离心,离心机的离心力为900g,离心时间为15min。
[0052]
进一步地,还包括以下步骤:
[0053]
s20:血浆分装:
[0054]
s201:离心后的外周血上清液(即血浆)用移液管轻轻吸出转移到50ml离心管中,并进行标记;
[0055]
s202:取20ml血浆分装至5个4.5ml冻存管中,每管4ml,多余废弃;
[0056]
s203:封口,贴标签后转移至冻存盒,将冻存盒置于4℃冰箱暂存,箱暂存的时间为12h。
[0057]
s204:将冰箱暂存后的血浆转移至-80℃冰箱或液氮暂存罐中暂存。
[0058]
在本实施例中,提高pbmc分离效果的关键之一是在保证分离得到的pbmc细胞的活力及数量的前提下,减少血小板、红细胞及粒细胞等杂细胞的比例,提高pbmc细胞的纯度。首先使用羟乙基淀粉沉淀,在空气中自然沉降后,再采用ficoll密度梯度离心的分离方法,得到纯度和活力都较高的pbmc。
[0059]
进一步地,还包括以下步骤:
[0060]
s30:分离单个核细胞:
[0061]
s301:离心后的每管细胞沉淀使用0.9%氯化钠注射液进行稀释,定容至30ml(稀释比例为全血体积与稀释后体积比等于1:1。),并吹打混匀;
[0062]
s302:将稀释后的细胞沉淀缓慢铺加至2个分离液管中,每管添加30ml,保持分离液与稀释血液界面清晰,并进行标记;
[0063]
s303:将离心机降速,然后进行离心。离心机设置为设置为1档、600g,室温离心15min。
[0064]
进一步地,还包括以下步骤:
[0065]
s40:第一次离心洗涤:
[0066]
s401:离心结束后,吸取单个核细胞层至2个50ml离心管中,每个离心管使用0.9%氯化钠注射液定容至50ml,吹打混匀,标记;
[0067]
s402:室温下进行离心,离心机设置为600g,离心时间为10min。
[0068]
进一步地,还包括以下步骤:
[0069]
s50:第二次离心洗涤及取样:
[0070]
离心结束后,弃上清,将细胞沉淀合并到1个离心管,并使用0.9%氯化钠注射液定容至50ml,吹打混匀,取样0.5ml检测细胞数量和细胞活率,标记。
[0071]
本发明对大容量血液样本的分离特点,先用羟乙基淀粉沉淀法去除大部分的红细胞,然后在空气中自然沉降,再用ficoll密度梯度离心法对单个核细胞进行进一步纯化,从而得到纯度超过95%,活力超过90%的pbmc。相比没有在空气中自然沉降的方法,获得的细胞活力和纯度更高。
[0072]
以上所述仅为本发明的优选实施例,并非因此限制本发明的专利范围,凡是在本发明的发明构思下,利用本发明说明书及附图内容所作的等效结构变换,或直接/间接运用在其他相关的技术领域均包括在本发明的专利保护范围内。
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询

tips


 商标分类
商标分类  商标转让
商标转让 



