一种芳杂环修饰的萘酰亚胺衍生物及其制备方法和用途与流程
 2021-02-02 09:02:00|
2021-02-02 09:02:00| 342|
342| 起点商标网
起点商标网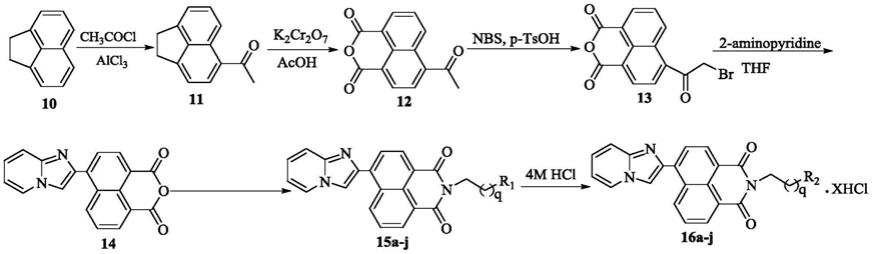
[0001]
本发明属于药物化学领域,涉及一种芳杂环修饰的萘酰亚胺衍生物及其制备方法和用途。
背景技术:
[0002]
癌症是全球死亡率最高的疾病,《世界癌症报告》预测全球癌症病例至2025年将达到1900万人。对于癌症的治疗一般有外科手术治疗、放射治疗、化学治疗、生物治疗。目前,化学药物治疗在癌症治疗中扮演着最重要的角色之一。
[0003]
萘酰亚胺类化合物具有广泛的生物活性,多个萘酰亚胺衍生物具有抗肿瘤活性,代表性药物氨萘菲特、米托萘胺等均曾进入临床研究阶段,但均因如骨髓抑制、剂量限制、血液毒性以及其不可预知的毒副作用最终未能成功上市。
[0004]
氨基噻唑、咪唑并吡啶等芳香杂环作为具有生理活性和药理活性的结构片段受到较多关注。噻唑类化合物广泛存在于自然界,因具有不同的生物活性及人体的低毒性,在医药及药物合成方面具有广泛应用。咪唑并吡啶是典型的含氮杂环化合物,广泛的存在于天然产物和药物中。咪唑并吡啶及其衍生物被广泛应用于新药物研发领域,具有良好的抗癌、抗病毒、解热、镇痛等药理活性。目前,已有多种包含咪唑并吡啶骨架的药物被应用到临床上。作为一种具有较好生物活性的药物分子结构框架,它使许多含有该片段的药物具有丰富多样的药理活性,尤其在肿瘤治疗方面具有显著功效。因此,咪唑并吡啶骨架结构单元越来越受到广泛的关注,成为有机化学家和药物化学家的研究热点。
技术实现要素:
[0005]
为了克服现有技术的不足,本发明的目的之一在于提供一种芳杂环修饰的萘酰亚胺衍生物,该化合物对肿瘤细胞具有较好的抑制活性。
[0006]
本发明的目的之二在于提供合成该化生物的制备方法。
[0007]
本发明的目的之三在于提供该化合物在制备抗肿瘤药物中的应用。
[0008]
本发明的目的之一采用如下技术方案实现:
[0009]
一种芳杂环修饰的萘酰亚胺衍生物,结构通式为-:
[0010][0011]
其中r为咪唑并吡啶基团或氨基噻唑基团,r
2
为多胺链、氨基、叔胺基、羟基、吡咯烷基或吗啉基,x取0至4的整数,q取1、2或3;
[0012]
进一步地,r为咪唑并吡啶时,所述化合物具有结构通式
ⅰ-
1:
[0013][0014]
其中r
2
选自
[0015]
中的任一种,其中n取1或2,k取2。
[0016]
进一步地,r为氨基噻唑时,所述化合物具有结构通式
ⅰ-
2:
[0017][0018]
其中r
2
选自
[0019]
中的任一种,其中n取1或2,k取2。
[0020]
本发明的目的之二通过如下技术方案实现:
[0021]
通式
ⅰ-
1所示的化合物的合成方法,包括以下步骤:
[0022][0023]
(1)将化合物10加入到反应容器中,以三氯化铝为催化剂,与乙酰氯的二氯甲烷溶液反应得到化合物11;
[0024]
(2)将步骤(1)得到的化合物11在醋酸做溶剂的条件下与重铬酸钾回流得到化合物12;
[0025]
(3)将步骤(2)得到的化合物12在乙腈和nbs中常温搅拌15min,然后与甲基苯磺酸回流反应得到化合物13;
[0026]
(4)将步骤(3)得到的化合物13与邻氨基吡啶在四氢呋喃中常温搅拌12h得到化合物14;
[0027]
(5)将步骤(4)得到的化合物14与含氮化合物反应得到化合物15a-j;
[0028]
(6)将步骤(5)得到的化合物15a-j在无水乙醇中与4m盐酸反应,得到具有通式
ⅰ-
1结构的芳杂环修饰的萘酰亚胺衍生物16a-j。
[0029]
优选地,部分含氮化合物(或boc酸酐保护)的合成路线如下:
[0030][0031]
通式i-2所示的化合物的合成方法,包括以下步骤:
[0032][0033]
(1)将化合物10加入到反应容器中,以三氯化铝为催化剂,与乙酰氯的二氯甲烷溶液反应得到化合物11;
[0034]
(2)将步骤(1)得到的化合物11在醋酸做溶剂的条件下与重铬酸钾回流得到化合物12;
[0035]
(3)将步骤(2)得到的化合物12在乙腈和nbs中常温搅拌15min,然后与甲基苯磺酸回流反应得到化合物13;
[0036]
(4)将步骤(3)得到的化合物13在和硫脲反应得到化合物17;
[0037]
(5)将步骤(4)得到的化合物17与含氮化合物反应得到化合物18a-h;
[0038]
(6)将步骤(5)得到的化合物18a-h在无水乙醇中与4m盐酸反应,得到具有通式i-2结构的芳杂环修饰的萘酰亚胺衍生物19a-h。
[0039]
本发明的目的之三是提供芳杂环修饰的萘酰亚胺衍生物在制备抗肿瘤药物中的应用。
[0040]
进一步地,提供芳杂环修饰的萘酰亚胺衍生物在制备治疗人结肠癌、肝癌、乳腺癌的药物中的应用。
[0041]
相比现有技术,本发明的有益效果在于:
[0042]
本发明提供一种芳杂环修饰的萘酰亚胺衍生物,骨架新颖,高效低毒,对肿瘤细胞具有较好的抑制活性。本发明还提供了上述化合物的制备方法,以萘酰亚胺为原料,在其母体萘环上分别引入活性基团咪唑并吡啶、氨基噻唑,合成新的芳杂环修饰的萘酰亚胺类药效团,并以多胺链修饰,涉及合成了一类咪唑并吡啶、氨基噻唑芳杂环修饰的萘酰亚胺衍生物。该化合物保留了萘酰亚胺抗肿瘤活性的同时,也兼具了咪唑并吡啶、氨基噻唑的特性,改善了原有分子的生物学活性,提高了目标分子的抗肿瘤活性。本发明还提供了上述合物在制备抗肿瘤药物中应用,对人结肠癌细胞、人肝癌细胞、人乳腺癌细胞具有一定的抑制活性,显示出良好的开发潜力。
具体实施方式
[0043]
下面,结合具体实施方式,对本发明做进一步描述,需要说明的是,在不相冲突的前提下,以下描述的各实施例之间或各技术特征之间可以任意组合形成新的实施例。
[0044]
实施例1
[0045]
6-[1-(咪唑并[1,2-a]吡啶)]-2-{4-[4-(4-氨基丁基)-氨基丁基]-氨基丁基}-1h-苯并异喹啉-1,3(2h)-二酮四盐酸盐(16a)的合成
[0046][0047]
(1)取1.0g(6.5mmol)化合物10与无水alcl
3 1.29g(9.7mmol)置于100ml圆底烧瓶中,加入干燥的二氯甲烷作为反应溶剂,常温搅拌15min后,冰浴条件下缓慢滴加乙酰氯0.48ml(6.8mmol)的二氯甲烷溶液,滴毕常温反应30min。2小时后倒入冰水中,二氯甲烷萃取有机层,无水硫酸钠干燥,减压浓缩,石油醚:乙酸乙酯=10:1柱分离纯化得化合物11;
[0048]
(2)取2.2g(7.5mmol)步骤(1)得到的化合物11,k
2
cr
2
o
7
·
2h
2
o 6.6g(22.0mmol)于20ml冰醋酸中回流2h,冷至室温后倒入冰水中,抽滤水洗得化合物12。
[0049]
(3)取1.20g(5.0mmol)步骤(2)得到的化合物12,加入nbs 890mg(5.0mmol)置于100ml圆底烧瓶中,加入适量乙腈作为反应溶剂,常温搅拌15min后,加入对甲苯磺酸1.90g(10.0mmol),回流反应5h,反应原料反应完毕后,蒸干,硅胶柱分离提纯得淡黄色固体产物13。产率75.5%。
[0050]
(4)取638mg(2.0mmol)步骤(3)得到的化合物13,邻氨基吡啶188mg(2.0mmol)加入到100ml的圆底烧瓶中,以四氢呋喃作为反应溶剂,常温搅拌12h,不断有黄色固体析出,体系由澄清的淡黄色溶液变为黄色浑浊液,抽滤得到黄色固体产物14,产率50%。
[0051]
(5)取314mg(1.0mmol)步骤(4)得到的化合物14置于100ml的圆底烧瓶中,加入
8.24(m,3h),8.03-7.94(m,1h),7.84(dd,j=9.0,3.0hz,2h),7.68(t,j=9.0hz,1h),7.50(t,j=6.0hz,1h),4.07(t,j=7.5hz,2h),3.22-3.13(m,6h),2.29-1.90(m,4h).
13
c nmr(75mhz,deuterium oxide)δ164.60,164.25,140.43,134.56,131.92,131.67,131.38,130.57,130.50,128.78,128.70,128.48,127.86,127.17,122.04,121.04,117.73,114.88,111.88,45.44,44.63,37.46,36.51,24.22,23.73.esi-ms m/z:428.41[m-3hcl+1]
+
.elemental analysis for c
25
h
28
cl
3
n
5
o
2
·
3.2h
2
o:c,50.51;h,5.83;n,11.78;found:c,50.56;h,5.92;n,11.62.
[0064]
实施例4
[0065]
6-[1-(咪唑并[1,2-a]吡啶)]-2-(3
--
氨基丙基)-1h-苯并异喹啉-1,3(2h)-二酮二盐酸盐(16d)的合成
[0066][0067]
除第(5)步中用丙二胺代替5a外,其它合成及提纯方法同实施例1。产率55%。
[0068]
1
h nmr(300mhz,deuterium oxide)δ8.67(d,j=9.0hz,1h),8.39(s,1h),8.32-8.20(m,3h),7.94(ddd,j=9.0,6.0,3.0hz,1h),7.88-7.77(m,2h),7.64(t,j=9.0hz,1h),7.47(t,j=6.0hz,1h),4.04(t,j=7.5hz,2h),3.08(t,j=7.5hz,2h),2.03(p,j=6.0hz,2h).13c nmr(75mhz,deuterium oxide)δ164.67,164.33,140.47,134.48,131.89,131.80,131.33,130.55,128.76,128.66,128.44,127.88,127.20,122.07,121.08,117.69,114.84,111.90,37.44,37.18,25.32.esi-ms m/z:371.35[m-2hcl+1]
+
.elemental analysis for c
22
h
20
cl
2
n
4
o
2
·
0.4ch
3
ch
2
oh:c,59.31;h,4.89;n,12.13;found:c,59.44;h,5.01;n,12.14.
[0069]
实施例5
[0070]
6-[1-(咪唑并[1,2-a]吡啶)]-2-(2-二甲氨基乙基)-1h-苯并异喹啉-1,3(2h)-二酮二盐酸盐(16e)的合成
[0071][0072]
除第(5)步中用n,n-二甲基乙二胺代替5a外,其它合成及提纯方法同实施例1。产率84%。
[0073]
1h nmr(300mhz,deuterium oxide)δ8.71(d,j=9.0hz,1h),8.45(s,1h),8.39(s,1h),8.36(s,1h),8.34(s,1h),7.97(dd,j=3.0,6.0,15.0hz,1h),7.90-7.83(m,2h),7.72(t,j=9.0hz,1h),7.50(td,j=6.0,3.0hz,1h),4.42(t,j=9.0hz,2h),3.50(t,j=6.0hz,2h),3.02(s,6h).13c nmr(75mhz,deuterium oxide)δ164.77,164.44,140.52,134.58,132.17,131.79,131.74,130.91,130.83,128.97,128.73,128.51,128.22,127.47,122.06,121.03,117.75,114.95,111.93,55.24,43.33,35.43,esi-ms m/z:385.34[m-2hcl+1]
+
.elemental analysis for c
23
h
22
cl
2
n
4
o
2
·
1.2h
2
o:c,57.68;h,5.13;n,11.70;found:c,
57.83;h,5.16;n,11.56.
[0074]
实施例6
[0075]
6-[1-(咪唑并[1,2-a]吡啶)]-2-(2-二甲氨基丙基)-1h-苯并异喹啉-1,3(2h)-二酮二盐酸盐(16f)的合成
[0076][0077]
除第(5)步中用n,n-二甲基丙胺代替5a外,其它合成及提纯方法同实施例1。产率67%。
[0078]
1
h nmr(300mhz,deuterium oxide)δ8.67(d,j=6.0hz,1h),8.38(s,1h),8.32-8.11(m,3h),8.03-7.88(m,1h),7.80(dd,j=9.0,3.0hz,2h),7.61(t,j=9.0hz,1h),7.47(t,j=6.0hz,1h),4.01(s,2h),3.25(s,2h),2.91(s,6h),2.09(t,j=7.5hz,2h).
13
c nmr(75mhz,deuterium oxide)δ164.54,164.23,140.50,134.54,131.86,131.79,131.35,130.58,128.78,128.69,128.46,127.87,127.19,122.02,121.04,117.73,114.87,111.93,55.29,42.80,37.35,22.79.esi-ms m/z:399.35[m-2hcl+1]
+
.elemental analysis for c
24
h
24
cl
2
n
4
o
2
·
h
2
o:c,58.90;h,5.36;n,11.45;found:c,58.98;h,5.58;n,11.42.
[0079]
实施例7
[0080]
6-[1-(咪唑并[1,2-a]吡啶)]-2-(3-二乙基氨基丙基)-1h-苯并异喹啉-1,3(2h)-二酮二盐酸盐(16g)的合成
[0081][0082]
除第(5)步中用n,n-二乙基丙二胺代替5a外,其它合成及提纯方法同实施例1。产率72%。
[0083]
1
h nmr(75mhz,deuterium oxide)δ8.68(d,j=6.0hz,1h),8.40(s,1h),8.33-8.19(m,3h),8.01-7.92(m,1h),7.87-7.78(m,2h),7.63(t,j=7.5hz,1h),7.51-7.46(m,1h),4.02(t,j=6.0hz,2h),3.30-3.22(m,6h),2.14-2.04(m,2h),1.30(t,j=7.5hz,6h).
13
c nmr(75mhz,deuterium oxide)δ164.41,164.10,140.49,134.46,131.77,131.32,130.59,130.53,128.73,128.64,128.41,127.80,127.13,121.93,120.96,117.67,114.83,111.91,49.23,47.33,37.55,22.11,8.12.esi-ms m/z:427.39[m-2hcl+1]
+
.elemental analysis for c
26
h
28
cl
2
n
4
o
2
·
3.5h
2
o:c,55.52;h,6.27;n,9.96;found:c,55.56;h,6.07;n,9.85.
[0084]
实施例8
[0085]
6-[1-(咪唑并[1,2-a]吡啶)]-2-(3-吡咯烷基丙基]-1h-苯并异喹啉-1,3(2h)-二酮二盐酸盐(16h)的合成
[0086][0087]
除第(5)步中用化合物9a代替5a外,其它合成及提纯方法同实施例1。产率53%。
[0088]
1
h nmr(300mhz,deuterium oxide)δ8.66(d,j=6.0hz,1h),8.38(s,1h),8.30-8.17(m,3h),8.00-7.87(m,1h),7.80(dd,j=9.0,3.0hz,2h),7.61(t,j=9.0hz,1h),7.46(t,j=7.5hz,1h),4.01(t,j=7.5hz,2h),3.70-3.63(m,2h),3.28(t,j=9.0hz,2h),3.11-3.02(m,2h),2.20-1.90(m,6h).
13
c nmr(75mhz,deuterium oxide)δ164.53,164.21,140.47,134.44,131.80,131.31,130.57,130.50,128.74,128.63,128.39,127.87,127.17,122.02,121.03,117.64,114.81,111.88,54.12,52.47,37.44,24.07,22.55.esi-ms m/z:425.35(m-2hcl+1)
+
.elemental analysis for c
26
h
26
cl
2
n
4
o
2
·
h
2
o:c,60.59;h,5.48;n,10.87;found:c,60.54;h,5.66;n,10.77.
[0089]
实施例9
[0090]
6-[1-(咪唑并[1,2-a]吡啶)]-2-(3-吗啉基丙基)-1h-苯并异喹啉-1,3(2h)-二酮二盐酸盐(16i)的合成
[0091][0092]
除第(5)步中用化合物7代替5a外,其它合成及提纯方法同实施例1。产率49%。
[0093]
1
h nmr(300mhz,deuterium oxide)δ8.54(d,j=9.0hz,1h),8.26(s,1h),8.18-8.03(m,3h),7.81(ddd,j=9.0,6.0,3.0hz,1h),7.69-7.66(m,2h),7.49(t,j=9.0hz,1h),7.35(t,j=6.0hz,1h),4.07-3.83(m,4h),3.71(t,j=12.0hz,2h),3.43(d,j=12.0hz,2h),3.24-2.95(m,4h),2.04-1.94(m,2h).
13
c nmr(75mhz,deuterium oxide)δ164.45,164.13,140.44,134.46,131.80,131.71,131.30,130.54,130.50,128.72,128.62,128.38,127.81,127.12,121.96,120.96,117.65,114.81,111.86,63.69,54.74,51.68,37.42,21.84.esi-ms m/z:441.38(m-2hcl+1)
+
.elemental analysis for c
26
h
26
cl
2
n
4
o
3
·
3.2h
2
o:c,54.68;h,5.72;n,9.81;found:c,54.79;h,5.85;n,9.77.
[0094]
实施例10
[0095]
6-[1-(咪唑并[1,2-a]吡啶)]-2-(3-羟基丙基)-1h-苯并异喹啉-1,3(2h)-二酮(16i)的合成
[0096][0097]
除第(5)步中用化合物3-氨基丙醇代替5a外,其它合成及提纯方法同实施例1。产
率66%。
[0098]
1
h nmr(300mhz,dmso-d6)δ9.41(d,j=9.0hz,1h),8.60-8.48(m,4h),8.16(d,j=9.0hz,1h),7.92-7.61(m,2h),7.34(s,1h),6.99(s,1h),4.55(s,1h),4.10(s,2h),3.40(s,2h),1.80(s,2h).
13
c nmr(75mhz,dmso-d6)δ163.94,163.63,145.28,143.06,137.97,133.70,131.08,130.80,129.12,128.68,127.91,127.66,127.54,126.24,122.72,121.57,117.46,114.14,113.34,59.48,38.04,31.44.esi-ms m/z:372.34[m+1]
+
.elemental analysis for c
22
h
17
n
3
o
3
:c,71.15;h,4.61;n,11.31;found:c,70.99;h,4.60;n,11.34.
[0099]
实施例11
[0100]
6-[4-(2-氨基噻唑)]-2-{4-[4-(4-氨基丁基)-氨基丁基]-氨基丁基}-1h-苯并异喹啉-1,3(2h)-二酮四盐酸盐(19a)的合成
[0101][0102]
(1)至(3)步合成过程同实施例1;
[0103]
(4)取1.60mg(5.0mmol)步骤(3)得到的化合物13,硫脲380mg(5.0mmol)置于100ml的圆底烧瓶中,加入适量乙腈作为反应溶剂,55℃反应6h,溶液由淡黄色浑浊液变为黄色浑浊液,抽滤得到黄色固体产物17,产率56%;
[0104]
(5)取296mg(1.0mmol)步骤(4)得到的化合物17置于100ml的圆底烧瓶中,加入1.25mmol胺链5a,加入适量dmf作为反应溶剂,回流反应5h,反应由黄色溶液变为橙红色溶液,原料反应完毕后蒸干溶剂,硅胶柱分离提纯得橙黄色固体化合物18a,收率45%-57%。3.95(s,2h),3.09-3.00(m,10h),1.84-1.58(m,12h).
[0105]
(6)将步骤(5)得到的18a(0.5mmol)溶于适量乙醇中,搅拌下滴加4m的盐酸乙醇溶液,室温搅拌至有大量固体析出,抽滤,滤饼用无水乙醚洗涤,干燥滤饼得到化合物19a。产率:39%。
[0106]
1
h nmr(300mhz,deuterium oxide)δ8.24
–
8.09(m,3h),7.68(d,j=8.60hz,1h),7.53(t,j=7.24hz,1h),7.03(s,1h),3.88(t,j=7.5hz,2h),3.22
–
2.98(m,6h),1.92
–
1.54(m,8h).
13
c nmr(75mhz,dmso-d6)δ169.66,163.96,163.64,133.03,131.49,130.78,129.37,128.46,128.02,122.75,122.42,109.11,46.77,46.23,46.15,38.27,25.28,24.35,23.58,22.96,22.81.esi-ms m/z:509.45[m-4hcl+1]
+
.elemental analysis for c
27
h
40
cl
4
n
6
o
2
s
·
2.8h
2
o:c,46.00;h,6.52;n,11.92;found:c,45.81;h,6.28;n,11.71.
[0107]
实施例12
[0108]
6-[4-(2-氨基噻唑)]-2-[4-(4-氨基丁基)-氨基丁基]-1h-苯并异喹啉-1,3(2h)-二酮三盐酸盐(19b)的合成
[0109][0110]
除第(2)步中用化合物3c代替5a外,其它合成及提纯方法同实施例11。产率:66%。
[0111]
1
h nmr(300mhz,deuterium oxide)δ8.26
–
8.08(m,3h),7.66(d,j=9.0hz,1h),7.52(t,j=7.5hz,1h),7.05(s,1h),3.88(t,j=7.5hz,2h),3.22
–
2.98(m,6h),1.92
–
1.54(m,8h).13c nmr(75mhz,deuterium oxide)δ170.50,164.61,164.29,135.70,132.81,131.59,130.48,128.08,127.98,127.07,121.67,120.92,108.98,47.16,46.84,39.75,38.76,24.18,23.90,23.16,22.74.esi-ms m/z:438.42[m-3hcl+1]
+
.elemental analysis for c
23
h
30
cl
3
n
5
o
2
s
·
h
2
o:c,48.90;h,5.71;n,12.40;found:c,48.93;h,5.88;n,12.37.
[0112]
实施例13
[0113]
6-[4-(2-氨基噻唑)]-2-[3-(3-氨基丙基)-氨基丙基]1h-苯并异喹啉-1,3(2h)-二酮三盐酸盐(19c)的合成
[0114][0115]
除第(2)步中用化合物3a代替5a外,其它合成及提纯方法同实施例11。产率:56%。
[0116]
1
h nmr(300mhz,deuterium oxide)δ8.41
–
8.26(m,3h),7.79(d,j=7.5hz,1h),7.69(t,j=9.0hz,1h),7.11(s,1h),4.10(t,j=6.0hz,2h),3.24
–
3.05(m,6h),2.19
–
1.95(m,2h).
13
c nmr(75mhz,dmso-d6)δ170.06,164.00,163.69,134.75,132.51,131.57,130.62,129.30,128.77,128.32,122.92,122.76,45.24,44.15,37.69,36.39,24.88,23.95.esi-ms m/z:410.37[m-3hcl+1]
+
.elemental analysis for c
21
h
26
cl
3
n
5
o
2
s
·
1.6h
2
o:c,46.05;h,5.37;n,12.79;found:c,46.12;h,5.46;n,12.71.
[0117]
实施例14
[0118]
6-[4-(2-氨基噻唑)]-2-[2-(2-二甲基氨基)
–
乙基]1h-苯并异喹啉-1,3(2h)-二酮二盐酸盐(19d)的合成
[0119][0120]
除第(2)步中用化合物n,n-二甲基乙二胺代替5a外,其它合成及提纯方法同实施例11。产率:82%。
[0121]
1
h nmr(300mhz,deuterium oxide)δ8.31-8.18(m,3h),7.74(d,j=6.0hz,1h),7.59(t,j=6.0hz,1h),7.09(s,1h),4.36(t,j=6.0hz,2h),3.48(t,j=6.0hz,2h),3.02(s,6h).
13
c nmr(75mhz,deuterium oxide)δ170.54,164.77,164.44,135.23,135.11,
133.05,131.98,130.85,128.41,128.23,128.11,127.36,121.62,120.80,109.07,55.24,43.34,35.39.esi-ms m/z:367.32(m-2hcl+1)
+
.elemental analysis for c
19
h
20
cl
2
n
4
o
2
s
·
1.3h
2
o:c,49.31;h,4.92;n,12.11;found:c,49.17;h,5.09;n,12.11.
[0122]
实施例15
[0123]
6-[4-(2-氨基噻唑)]-2-[3-(3-二乙基氨基)
–
丙基]1h-苯并异喹啉-1,3(2h)-二酮二盐酸盐(19e)的合成
[0124][0125]
除第(2)步中用化合物n,n-二乙基丙二胺代替5a外,其它合成及提纯方法同实施例11。产率:79%。
[0126]
1
h nmr(300mhz,deuterium oxide)δ7.94(dd,j=3.0,6.0hz,2h),7.84(d,j=9.0hz,1h),7.50(d,j=9.0hz,1h),7.26(t,j=9.0hz,1h),6.93(s,1h),3.81(t,j=6.0hz,2h),3.22(m,6h),1.97(m,2h),1.26(t,j=9.0hz,6h).
13
c nmr(75mhz,deuterium oxide)δ170.33,163.92,163.70,135.01,132.49,131.22,130.40,127.81,127.71,127.51,126.64,121.03,120.30,109.32,49.16,47.29,37.49,22.03,8.15.esi-ms m/z:409.34[m-2hcl+1]
+
.elemental analysis for c
22
h
26
cl
2
n
4
o
2
s
·
3.4h
2
o:c,48.69;h,6.09;n,10.32;found:c,48.77;h,6.19;n,10.32.
[0127]
实施例16
[0128]
6-[4-(2-氨基噻唑)]-2-[4-吡咯烷基)
–
丁基]-1h-苯并异喹啉-1,3(2h)-二酮二盐酸盐(19f)的合成
[0129][0130]
除第(2)步中用化合物9b代替5a外,其它合成及提纯方法同实施例11。产率:43%。
[0131]
1
h nmr(300mhz,deuterium oxide)δ8.29
–
8.13(m,1h),8.12
–
8.01(m,2h),7.61(d,j=9.0hz,1h),7.47(t,j=7.5hz,1h),7.00(s,1h),3.86(t,j=7.5hz,2h),3.61-3.69(m,2h),3.32
–
3.20(m,2h),3.15
–
3.01(m,2h),2.17-2.08(m,2h),2.02-1.97(m,2h),1.86
–
1.72(m,2h),1.66-1.61(m,2h).
13
c nmr(75mhz,dmso-d6)δ163.95,163.63,132.78,131.55,130.73,129.35,128.63,128.37,128.19,122.76,122.69,109.16,53.94,53.40,39.58,25.17,23.29,23.03.esi-ms m/z:421.35[m-2hcl+1]
+
.elemental analysis for c
23
h
26
cl
2
n
4
o
2
s
·
2.4h
2
o:c,51.47;h,5.78;n,10.44;found:c,51.50;h,5.80;n,10.32.
[0132]
实施例17
[0133]
6-[4-(2-氨基噻唑)]-2-[3-(3-二乙基氨基)
–
丙基]1h-苯并异喹啉-1,3(2h)-二酮二盐酸盐(19g)的合成
[0134][0135]
除第(2)步中用化合物7代替5a外,其它合成及提纯方法同实施例11。产率:43%。
[0136]
1
h nmr(300mhz,deuterium oxide)δ8.20(d,j=9.0hz,1h),8.13(dd,j=7.5,6.0hz,2h),7.64(d,j=6.0hz,1h),7.48(t,j=9.0hz,1h),6.98(s,1h),4.12(d,j=12.0hz,2h),4.00(t,j=7.5hz,2h),3.83(t,j=12.0hz,2h),3.55(d,j=15.0hz,2h),3.42
–
3.11(m,4h),2.11(p,j=7.5hz,2h).
13
c nmr(75mhz,deuterium oxide)δ170.35,164.72,164.43,137.79,134.17,131.97,131.53,130.62,128.11,127.80,127.68,127.17,121.17,120.71,109.30,63.73,54.79,51.71,37.39,21.89.esi-ms m/z:423.33[m-2hcl+1]
+
.elemental analysis for c
22
h
24
cl
2
n
4
o
3
s
·
2.2h
2
o:c,49.39;h,5.35;n,10.47;found:c,49.58;h,5.46;n,10.40.
[0137]
实施例18
[0138]
6-[4-(2-氨基噻唑)]-2-[3-(3-二乙基氨基)
–
丙基]1h-苯并异喹啉-1,3(2h)-二酮盐酸盐(19h)的合成
[0139][0140]
除第(2)步中用化合物3-氨基丙醇代替5a外,其它合成及提纯方法同实施例11。产率:65%。
[0141]
1
h nmr(300mhz,dmso-d6)δ8.63(d,j=9.0hz,1h),8.51(t,j=7.5hz,2h),7.98(d,j=6.0hz,1h),7.89(t,j=7.5hz,1h),7.24(s,1h),4.09(dd,j=9.0,6.0hz,2h),3.49(t,j=6.0hz,2h),1.78(p,j=6.0hz,2h).13c nmr(75mhz,dmso-d6)δ170.11,163.75,163.43,138.74,134.56,132.35,131.48,130.51,129.34,128.83,128.31,128.19,123.05,122.82,109.14,59.34,38.18,31.28.esi-ms m/z:354.31[m-hcl+1]
+
.elemental analysis for c
18
h
16
cln
3
o
3
s
·
0.2ch
3
ch
2
oh:c,55.38;h,4.34;n,10.53;found:c,55.02;h,4.43;n,10.66.试验例1
[0142]
生物活性评价
[0143]
(1)化合物体外抑制肿瘤细胞生长活性测定:选择实施例1-18制备的化合物,分别取对数生长期的mda-mb-231(乳腺癌细胞)、hct-116(人癌细胞)、hepg2(人肝癌细胞)三种肿瘤细胞株,以每孔5000-8000个细胞埋入96孔板,90μl/孔。培养24h后,加入已知浓度的样品,对每个细胞株,每个浓度都有四个复孔,在37℃,5%co
2
条件下培养48h后,加mtt50μl,继续培养4h后弃上清,每孔加入100μl dsmo,轻轻振荡15min,用酶标仪在570nm波长处测其吸光度a值。按公式(肿瘤细胞生长抑制率(%)=(od对照-od实验)/(od对照-od空白)
×
100%)计算被测物不同对肿瘤细胞生长的抑制率,实验重复三次。结果见表1。
[0144]
表1各化合物对不同肿瘤细胞的生长抑制活性
[0145][0146][0147]
由表1可知,本发明提供的芳杂环修饰的萘酰亚胺衍生物两个系列的化合物对肿瘤细胞株hct-116、hepg2和mda-mb-231具有一定的抑制活性。如化合物16a、16c、16e、19a、19c等抑制活性较好,对以上三种肿瘤细胞的抑制率较高,例如化合物16c在低浓度(10μm)和高浓度(30μm)时,对hct-116、hepg2和mda-mb-231三种肿瘤细胞株的抑制率均远高于阳性对照氨萘菲特。本发明提供的化合物16a、16c、16e,在低浓度(10μm)时,对hepg2和mda-mb-231肿瘤株的抑制率均高于氨萘菲特;化合物16b、16c、16d、16e在高浓度(30μm)时,对三种肿瘤细胞株hct-116、hepg2和mda-mb-231的抑制率均高于氨萘菲特。化合物19a在低浓度(10μm)和高浓度(30μm)时,对肿瘤细胞株mda-mb-231的抑制活性高于氨萘菲特,化合物19c在高浓度(30μm)时,对hct-116、hepg2和mda-mb-231三种肿瘤细胞株的抑制率均远高于阳性对照氨萘菲特。
[0148]
综上,本发明提供的芳杂环修饰的萘酰亚胺衍生物对肿瘤细胞株hct-116、hepg2和mda-mb-231具有一定的抑制活性,显示出良好的开发潜力,可作为潜在的抗肿瘤药物先导物进一步开发,为抗肿瘤药物的发展提供了新方向。
[0149]
上述实施方式仅为本发明的优选实施方式,不能以此来限定本发明保护的范围,本领域的技术人员在本发明的基础上所做的任何非实质性的变化及替换均属于本发明所要求保护的范围。
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询

tips


 商标分类
商标分类  商标转让
商标转让 



