一种双酶级联催化合成手性噁唑烷酮类化合物的方法与流程
 2021-02-02 09:02:23|
2021-02-02 09:02:23| 412|
412| 起点商标网
起点商标网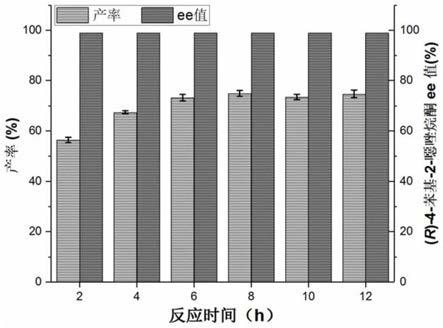
[0001]
本发明属于生物催化方法及应用技术领域,特别涉及一种双酶级联催化合成手性噁唑烷酮类化合物的方法。
背景技术:
[0002]
手性噁唑烷酮类化合物是一类重要手性砌块,广泛用于医药化工产品的合成,如公布号为cn111164071a,cn108976222a,cn109384700a,cn110372624a,cn110128473a,cn111471041a,cn110878079a,cn109810038a等等的专利。特别地,手性噁唑烷酮类化合物是一类新型的治疗细菌性感染的抗菌药物,可抑制蛋白质合成的起始阶段,并且很少出现交叉耐药性。2000年4月,第一个噁唑烷酮类抗生素利奈唑胺(linezolid)在美国批准上市,用于治疗多重耐药革兰氏阳性菌引起的感染。利奈唑胺随后被证实是治疗革兰氏阳性菌引起的严重感染的一个重要抗生素药物。2014年6月,美国fda批准另一种手性噁唑烷酮类抗生素特地唑胺(tedizolid)上市,用于治疗皮肤感染。此外,重磅抗凝血药物利伐沙班(rivaroxaban)也含有的重要手性噁唑烷酮骨架。此外,仍有许多药物通过手性噁唑烷酮进行合成(cn110291093a,cn107459501b,cn107353305a,cn107033095b,cn109311865a),因而开发相应的手性噁唑烷酮中间体合成技术在医药工业领域具有重要的应用意义。
[0003]
传统制备手性噁唑烷酮的合成技术通常以手性的1,2-氨基醇、氮杂环丙烷和环氧化物为起始原料,原料成本高,合成工艺复杂,反应条件苛刻。2005年dick b.janssen报道了利用来源于agrobacterium radiobacter ad1的卤醇脱卤酶hhec催化环氧化合物与氰酸盐反应合成5-取代噁唑烷酮化合物(organic letters 10.12(2008):2417-2420)。该方法利用消旋的环氧化合物为起始原料,通过动力学拆分获得手性5-取代噁唑烷酮类化合物,但该合成工艺的最大理论收率为50%。此外,反应结束后,未被拆分的手性环氧底物和手性噁唑烷酮产物同时存在于反应体系中,增加了后续分离纯化成本。前期,我们公开一种利用来源于ilumatobacter coccineus菌株的卤醇脱卤酶重组菌,提供了一种生物催化环氧化合物合成4-取代噁唑烷酮类化合物的方法(cn109593069a)。该工艺虽然为4-取代噁唑烷酮类化合物的合成提供了有效策略,但由于使用的卤醇脱卤酶的立体选择性不佳,无法获得手性的4-取代噁唑烷酮类化合物。
技术实现要素:
[0004]
本发明意在克服上述酶催化工艺的缺陷,通过生物级联工艺设计,提供一种双酶级联催化合成手性噁唑烷酮类化合物的方法。
[0005]
本方案中的一种双酶级联催化合成手性噁唑烷酮类化合物的方法,以烯烃和氰酸盐为原料,利用苯乙烯单加氧酶和卤醇脱卤酶两种生物催化剂,通过一锅一步转化合成手性噁唑烷酮类化合物。
[0006]
本发明通过生物级联工艺设计,以烯烃和氰酸盐为起始原料,构建了双酶一锅一步催化合成手性噁唑烷酮类化合物。该工艺出发原料廉价,反应条件温和,反应操作简便,
反应理论产率可达100%,实际收率为37%-70%,更重要的是获得手性噁唑烷酮产物的光学纯度高达99%。
[0007]
进一步,所述烯烃和氰酸盐以及两种所述生物催化剂是一次性投入反应器,进行一锅一步催化合成。两种酶催化的反应之间无不利影响。
[0008]
进一步,所述的烯烃为苯乙烯类化合物。
[0009]
进一步,所述的氰酸盐为氰酸钠或氰酸钾。
[0010]
进一步,所述苯乙烯单加氧酶和卤醇脱卤酶是以大肠杆菌为宿主重组表达而得。
[0011]
优选的,本发明的一种双酶级联催化合成手性噁唑烷酮类化合物的方法,通过以下式(1)获得手性噁唑烷酮类化合物:
[0012][0013]
进一步,所述的苯乙烯单加氧酶来自pseudomonas sp.vlb120菌株,两条多肽链的氨基酸序列在ncbi数据库的登录号分别为aac23718.1和aac23719.1。
[0014]
优选的,通过共表达质粒petduet-1在大肠杆菌中重组表达所述苯乙烯单加氧酶。
[0015]
进一步,通过重组苯乙烯单加氧酶工程菌发酵获得发酵细胞,并以此作为苯乙烯单加氧酶生物催化剂进行转化反应。
[0016]
进一步,所使用卤醇脱卤酶来自ilumatobacter coccineus菌株,氨基酸序列在ncbi登陆号为ban03849.1。
[0017]
优选的,通过共表达质粒pcdfduet-1在大肠杆菌中重组表达卤醇脱卤酶;
[0018]
进一步,通过重组卤醇脱卤酶工程菌发酵获得发酵细胞,并以此作为卤醇脱卤酶生物催化剂进行转化反应。
[0019]
进一步,所述一锅一步催化合成的反应条件为:氰酸盐与烯烃的摩尔比为8:1~1:1之间;反应时间为6~24小时;重组苯乙烯单加氧酶大肠杆菌的细胞浓度为5~20g dcw/l;重组卤醇脱卤酶大肠杆菌的细胞浓度为5~20g dcw/l;ph为6.0~9.0的缓冲溶液;反应温度为25~45℃;烯烃的浓度为0~50mmol/l。dcw表示干细胞重量。
[0020]
进一步,所述一锅一步催化合成的反应条件为:氰酸盐与烯烃的摩尔比为4:1;反应时间为8-12小时;重组苯乙烯单加氧酶大肠杆菌的细胞浓度为5g dcw/l;重组卤醇脱卤酶大肠杆菌的细胞浓度为10g dcw/l;ph为8.0的磷酸盐缓冲溶液;反应温度为30℃;烯烃的浓度为10mmol/l。
附图说明
[0021]
图1为苯乙烯单加氧酶stya基因的克隆示意图;
[0022]
图2为苯乙烯单加氧酶styb基因的克隆示意图;
[0023]
图3为(r)-4-苯基-2-噁唑烷酮不对称合成反应时间比较。
具体实施方式
[0024]
本发明用下列实施例来进一步说明本发明,但本发明的保护范围并不限于下列实施例。
[0025]
前期准备:苯乙烯单加氧酶工程菌的构建
[0026]
为了表述方便,将苯乙烯单加氧酶的两条多肽链aac23718.1和aac23719.1的编码基因分别命名为stya和styb。
[0027]
通过dna分离试剂盒分离提取含有目标基因的pet28b-stya质粒,选择具有两个克隆位点的petduet-1作为表达载体并通过nco-和hind-双酶切连接,将stya目的基因插入petduet-1载体的第一个克隆位点mcs i,实验实施示意图如附图1所示。
[0028]
双酶切反应体系如下:
[0029][0030]
酶切反应2小时后通过dna回收试剂盒分别回收stya和载体的dna片段,回收的片段通过t4 dna连接酶进行连接反应,连接反应体系如下:
[0031][0032]
连接反应在16℃的金属浴反应过夜后,产物采用热激法转化导入感受态细胞大肠杆菌dh5α中。在转化后的感受态细胞中加入600μl的lb培养基,随后放入恒温培养箱于150rpm、37℃的条件下复苏一小时。用移液枪移取300μl复苏的菌液至含有100μg/ml amp抗性的lb固体培养基上,用玻璃涂布器将菌液均匀地涂布在培养基表面,平板放置于恒温培养箱于30℃的条件下静置培养16小时。随机挑取平板上的大肠杆菌单菌落10个,每个菌落挑取一半放于含50μl无菌水的无菌的1.5ml离心管,然后分别在金属浴下于95℃热裂解20分钟。以载体第一个位点的通用引物petup1/duetdown1为引物,分别对挑取的10个单菌落进行菌落pcr反应。菌落pcr反应体系和扩增程序如下:
[0033]
菌落pcr反应体系
[0034][0035]
菌落pcr扩增程序
[0036][0037]
进一步,反应结果由dna凝胶电泳反应验证。挑取菌落pcr结果为阳性的单菌落分别用5ml含100μg/ml amp抗性的lb液体培养基于250rpm、37℃的条件培养16小时。分别移取1ml菌液至冻存管并送生工公司测序。根据测序结果,选择确定含有petduet-stya的dh5α重组菌。
[0038]
用含有100μg/ml amp抗性的lb固体培养基划线培养含有petduet-stya的dh5α重组菌,挑取单菌落用5ml含100μg/ml amp抗性的lb液体培养基培养过夜,质粒抽提试剂盒分离提取petduet-stya,并以此作为下一轮克隆的载体。
[0039]
提取含有styb基因的重组质粒pet28b-styb,通过限制性内切酶位点nde
ꢀⅰ
和xho
ꢀⅰ
将目标基因styb插入载体petduet-stya的第二个克隆位点mcs ii,实验实施示意图如附图2所示。双酶切反应体系如下:
[0040]
stya-styb的大肠杆菌bl21(de3),即为苯乙烯单加氧酶基因工程菌。
[0050]
(r)-4-苯基-2-噁唑烷酮合成反应时间比较
[0051]
以苯乙烯为底物,以重组的苯乙烯单加氧酶和卤醇脱卤酶工程菌发酵诱导获得的菌体为生物催化剂,在50ml反应容器中进行反应。通过取样hplc分析,监测反应进程。具体实施方案如下:向5ml磷酸缓冲溶液(100mm,ph=8.5)加入底物苯乙烯至终浓度为10mm,加入氰酸钠至终浓度为40mm,并加入苯乙烯单加氧酶和卤醇脱卤酶重组细胞分别至终浓度为5g dcw/l和5g dcw/l。反应瓶在空气摇床中进行反应,反应温度为30℃,转速为200rpm。共设置18个反应,分别在2h、4h、6h、8h、10h和12h对反应进行取样分析。每个反应时间取三个平行反应样品进行分析,向反应液中加入含有内标物3-苯基丙腈,5mm的乙酸乙酯,按体积比1:1进行萃取,分离的有机相通过hplc分析,并计算产物(r)-4-苯基-2-噁唑烷酮的产率和ee。反应结果如附图3所示,反应8小时后可以获得75%的分析产率和>99%的ee值。
[0052]
实施例1(r)-4-苯基-2-噁唑烷酮的制备
[0053]
制备反应在250ml反应瓶中进行,向50ml磷酸缓冲溶液(100mm,ph=8.5)加入底物苯乙烯至终浓度为10mm,加入氰酸钠至终浓度为40mm,并加入苯乙烯单加氧酶和卤醇脱卤酶重组细胞分别至终浓度为5g dcw/l和5g dcw/l。反应瓶在空气摇床中进行反应,反应温度为30℃,转速为200rpm,反应12h。反应结束用100ml乙酸乙酯萃取3次,分离合并有机相,浓缩后通过硅胶柱层析进行分离纯化,获得目标产物(r)-4-苯基-2-噁唑烷酮。表征数据:60%产率,ee值>99%。
1
h nmr(400mhz,cdcl
3
)δ7.52-7.24(m,5h),6.67(s,1h),4.94(t,j=8.0hz,1h),4.70(t,j=8.6hz,1h),4.13(m,1h).
13
c nmr(100mhz,cdcl
3
)δ160.3,139.7,129.2,128.8,126.1,72.6,56.4.
[0054]
实施例2(r)-4-(4-氟苯基)-噁烷-2-酮的制备:
[0055]
制备反应在250ml反应瓶中进行,向50ml磷酸缓冲溶液(100mm,ph=8.5)加入底物4-氟苯乙烯至终浓度为10mm,加入氰酸钠至终浓度为40mm,并加入苯乙烯单加氧酶和卤醇脱卤酶重组细胞分别至终浓度为5g dcw/l和5g dcw/l。反应瓶在空气摇床中进行反应,反应温度为30℃,转速为200rpm,反应12h。反应结束用100ml乙酸乙酯萃取3次,分离合并有机相,浓缩后通过硅胶柱层析进行分离纯化,获得目标产物4-(4-氟苯基)-恶噁烷-2-酮。62%产率,ee值>99%,
1
h nmr(400mhz,cdcl
3
)δ7.26(m,2h),7.03(t,j=8.5hz,2h),6.84(s,1h),4.92(t,j=7.5hz,1h),4.66(t,j=8.6hz,1h),4.19-4.03(m,1h),
13
c nmr(100mhz,cdcl
3
)δ162.7(d,j=246.1hz,1c),160.2,135.4(d,j=3.1hz,1c),127.8(d,j=8.3hz,2c),116.0(d,j=21.6hz,2c),72.5,55.7.
[0056]
实施例3(r)-4-(4-氯苯基)-噁烷-2-酮的制备:
[0057]
制备反应在250ml反应瓶中进行,向50ml磷酸缓冲溶液(100mm,ph=8.5)加入底物4-氯苯乙烯至终浓度为10mm,加入氰酸钠至终浓度为40mm,并加入苯乙烯单加氧酶和卤醇脱卤酶重组细胞分别至终浓度为5g dcw/l和5g dcw/l。反应瓶在空气摇床中进行反应,反应温度为30℃,转速为200rpm,反应12h。反应结束用100ml乙酸乙酯萃取3次,分离合并有机相,浓缩后通过硅胶柱层析进行分离纯化,获得目标产物4-(4-氯苯基)-恶噁烷-2-酮。61%产率,ee值>99%,
1
h nmr(400mhz,cdcl
3
)δ7.51(d,j=8.2hz,2h),7.25(d,j=6.8hz,2h),6.84(s,1h),4.93(t,j=7.2hz,1h),4.70(t,j=8.4hz,1h),4.10(t,j=6.6hz,1h),
13
c nmr(100mhz,cdcl
3
)δ160.2,138.2,134.6,129.4,127.5,72.4,55.8.
[0058]
实施例4(r)-4-(4-溴苯基)-噁烷-2-酮的制备:
[0059]
制备反应在250ml反应瓶中进行,向50ml磷酸缓冲溶液(100mm,ph=8.5)加入底物4-溴苯乙烯至终浓度为10mm,加入氰酸钠至终浓度为40mm,并加入苯乙烯单加氧酶和卤醇脱卤酶重组细胞分别至终浓度为5g dcw/l和5g dcw/l。反应瓶在空气摇床中进行反应,反应温度为30℃,转速为200rpm,反应12h。反应结束用100ml乙酸乙酯萃取3次,分离合并有机相,浓缩后通过硅胶柱层析进行分离纯化,获得目标产物4-(4-溴苯基)-恶噁烷-2-酮。66%产率ee值>99%,
1
h nmr(400mhz,cdcl
3
)δ7.51(d,j=8.2hz,2h),7.19(d,j=8.3hz,2h),6.70(s,1h),4.92(t,j=7.6hz,1h),4.70(t,j=8.6hz,1h),4.15-4.05(m,1h),
13
c nmr(100mhz,cdcl
3
)δ160.2,138.7,132.4,127.8,122.7,72.3,55.9.
[0060]
实施例5(r)-4-(4-甲基苯基)-噁烷-2-酮的制备:
[0061]
制备反应在250ml反应瓶中进行,向50ml磷酸缓冲溶液(100mm,ph=8.5)加入底物4-甲基苯乙烯至终浓度为10mm,加入氰酸钠至终浓度为40mm,并加入苯乙烯单加氧酶和卤醇脱卤酶重组细胞分别至终浓度为5g dcw/l和5g dcw/l。反应瓶在空气摇床中进行反应,反应温度为30℃,转速为200rpm,反应12h。反应结束用100ml乙酸乙酯萃取3次,分离合并有机相,浓缩后通过硅胶柱层析进行分离纯化,获得目标产物4-(4-甲基苯基)-恶噁烷-2-酮。66%产率,ee值>94%,
1
h nmr(400mhz,cdcl
3
)δ7.19(m,4h),6.51(s,1h),4.90(t,j=7.8hz,1h),4.67(t,j=8.6hz,1h),4.12(t,j=7.9hz,1h),2.34(s,3h),
13
c nmr(100mhz,cdcl
3
)δ160.2,138.6,136.7,129.8,126.0,72.7,56.2,21.2.
[0062]
实施例6 4-(3-氟苯基)-噁烷-2-酮的制备:
[0063]
制备反应在250ml反应瓶中进行,向50ml磷酸缓冲溶液(100mm,ph=8.5)加入底物3-氟苯乙烯至终浓度为10mm,加入氰酸钠至终浓度为40mm,并加入苯乙烯单加氧酶和卤醇脱卤酶重组细胞分别至终浓度为5g dcw/l和5g dcw/l。反应瓶在空气摇床中进行反应,反应温度为30℃,转速为200rpm,反应12h。反应结束用100ml乙酸乙酯萃取3次,分离合并有机相,浓缩后通过硅胶柱层析进行分离纯化,获得目标产物4-(3-氟苯基)-恶噁烷-2-酮。63%产率,ee值>99%,
1
h nmr(400mhz,cdcl
3
)δ7.40-7.31(m,1h),7.10(d,j=7.9hz,1h),7.03(m,2h),6.79(s,1h),5.00(t,j=8.0hz,1h),4.72(t,j=8.7hz,1h),4.13(dd,j=8.5,6.9hz,1h),
13
c nmr(100mhz,cdcl
3
)δ163.2(d,j=246.5hz,1c),160.2,142.3(d,j=6.8hz,1c),131.0(d,j=8.3hz,1c),121.7(d,j=2.9hz,1c),115.8(d,j=21.1hz,1c),113.1(d,j=22.4hz,1c),72.3,56.0(d,j=1.9hz,1c).
[0064]
实施例7(r)-4-(3-氯苯基)-噁烷-2-酮的制备
[0065]
制备反应在250ml反应瓶中进行,向50ml磷酸缓冲溶液(100mm,ph=8.5)加入底物3-氯苯乙烯至终浓度为10mm,加入氰酸钠至终浓度为40mm,并加入苯乙烯单加氧酶和卤醇脱卤酶重组细胞分别至终浓度为5g dcw/l和5g dcw/l。反应瓶在空气摇床中进行反应,反应温度为30℃,转速为200rpm,反应12h。反应结束用100ml乙酸乙酯萃取3次,分离合并有机相,浓缩后通过硅胶柱层析进行分离纯化,获得目标产物4-(3-氯苯基)-恶噁烷-2-酮。64%产率,ee值>99%,
1
h nmr(400mhz,cdcl
3
)δ7.36-7.27(m,3h),7.23-7.16(m,1h),6.93(s,1h),4.93(t,j=8.0hz,1h),4.69(t,j=8.8hz,1h),4.10(dd,j=8.6,6.8hz,1h),
13
c nmr(100mhz,cdcl
3
)δ160.2,141.8,135.1,130.6,128.9,126.3,124.2,72.3,55.9.
[0066]
实施例8(r)-4-(3-溴苯基)-噁烷-2-酮的制备:
[0067]
制备反应在250ml反应瓶中进行,向50ml磷酸缓冲溶液(100mm,ph=8.5)加入底物3-溴苯乙烯至终浓度为10mm,加入氰酸钠至终浓度为40mm,并加入苯乙烯单加氧酶和卤醇脱卤酶重组细胞分别至终浓度为5g dcw/l和5g dcw/l。反应瓶在空气摇床中进行反应,反应温度为30℃,转速为200rpm,反应12h。反应结束用100ml乙酸乙酯萃取3次,分离合并有机相,浓缩后通过硅胶柱层析进行分离纯化,获得目标产物4-(3-溴苯基)-恶噁烷-2-酮。56%产率,ee值>99%,
1
h nmr(400mhz,cdcl
3
)δ7.47(s,2h),7.29-7.18(m,2h),6.33(s,1h),4.91(t,j=7.2hz,1h),4.71(t,j=8.5hz,1h),4.13(t,j=7.3hz,1h),
13
c nmr(100mhz,cdcl
3
)δ160.0,142.0,132.0,130.9,129.3,124.7,123.3,72.4,55.9.
[0068]
实施例9(r)-4-(3-甲基苯基)-噁烷-2-酮的制备:
[0069]
制备反应在250ml反应瓶中进行,向50ml磷酸缓冲溶液(100mm,ph=8.5)加入底物3-甲基苯乙烯至终浓度为10mm,加入氰酸钠至终浓度为40mm,并加入苯乙烯单加氧酶和卤醇脱卤酶重组细胞分别至终浓度为5g dcw/l和5g dcw/l。反应瓶在空气摇床中进行反应,反应温度为30℃,转速为200rpm,反应12h。反应结束用100ml乙酸乙酯萃取3次,分离合并有机相,浓缩后通过硅胶柱层析进行分离纯化,获得目标产物4-(3-甲基苯基)-恶噁烷-2-酮。70%产率,ee值>99%,
1
h nmr(400mhz,cdcl
3
)δ7.25(m,1h),7.11(m,3h),6.34(s,1h),4.89(t,j=8.1hz,1h),4.68(t,j=8.7hz,1h),4.14(dd,j=8.5,6.9hz,1h),2.34(s,3h),
13
c nmr(100mhz,cdcl
3
)δ160.1,139.6,139.1,129.6,129.1,126.7,123.2,72.7,56.4,21.5.
[0070]
实施例10(r)-4-(2-氟苯基)-噁烷-2-酮的制备:
[0071]
制备反应在250ml反应瓶中进行,向50ml磷酸缓冲溶液(100mm,ph=8.5)加入底物2-氟苯乙烯至终浓度为10mm,加入氰酸钠至终浓度为40mm,并加入苯乙烯单加氧酶和卤醇脱卤酶重组细胞分别至终浓度为5g dcw/l和5g dcw/l。反应瓶在空气摇床中进行反应,反应温度为30℃,转速为200rpm,反应12h。反应结束用100ml乙酸乙酯萃取3次,分离合并有机相,浓缩后通过硅胶柱层析进行分离纯化,获得目标产物4-(2-氟基苯基)-恶噁烷-2-酮。37%产率,ee值>99%ee,
1
h nmr(400mhz,cdcl
3
)δ7.42(t,j=7.6hz,1h),7.32(m,1h),7.19(t,j=7.5hz,1h),7.07(t,j=9.0hz,1h),6.84(s,1h),5.26(t,j=8.0hz,1h),4.80(t,j=8.8hz,1h),4.19(dd,j=8.4,6.6hz,1h),
13
c nmr(100mhz,cdcl
3
)δ160.34,160.2(d,j=245.3hz,1c),130.2(d,j=8.2hz,1c),127.0(d,j=13.0hz,1c),126.8(d,j=3.8hz,1c),124.9(d,j=3.5hz,1c),115.8(d,j=20.8hz,1c),71.5(d,j=2.0hz,1c),50.5(d,j=4.2hz,1c).
[0072]
实施例11(4r,5s)-5-甲基-4-苯基-噁烷-2-酮的制备:
[0073]
制备反应在250ml反应瓶中进行,向50ml磷酸缓冲溶液(100mm,ph=8.5)加入底物反式β甲基苯乙烯-至终浓度为10mm,加入氰酸钠至终浓度为40mm,并加入苯乙烯单加氧酶和卤醇脱卤酶重组细胞分别至终浓度为5g dcw/l和5g dcw/l。反应瓶在空气摇床中进行反应,反应温度为30℃,转速为200rpm,反应12h。反应结束用100ml乙酸乙酯萃取3次,分离合并有机相,浓缩后通过硅胶柱层析进行分离纯化,获得目标产物(4r,5s)-5-甲基-4-苯基-噁烷-2-酮。68%产率,ee值>99%ee,
1
h nmr(400mhz,cdcl
3
)δ7.43-7.29(m,3h),7.21(d,j=7.5hz,2h),6.61(s,1h),5.03-4.92(m,1h),4.90(d,j=8.1hz,1h),0.90(d,j=6.4hz,3h),
13
c nmr(100mhz,cdcl
3
)δ160.2,136.7,128.8,128.6,126.9,77.2,59.9,16.6。
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询

tips


 商标分类
商标分类  商标转让
商标转让 



