一种低病毒用量的CAR-T制备方法与流程
 2021-02-02 09:02:16|
2021-02-02 09:02:16| 336|
336| 起点商标网
起点商标网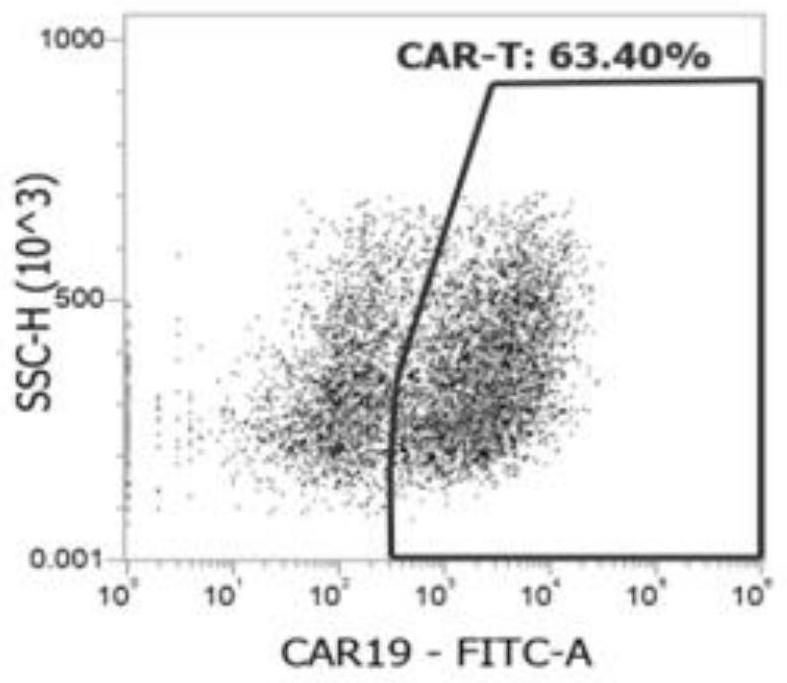
一种低病毒用量的car-t制备方法
技术领域
[0001]
本发明涉及免疫学和分子生物学技术领域,尤其涉及一种低病毒用量的car-t制备方法。
背景技术:
[0002]
过继性免疫细胞治疗是当前生物医药领域新型的抗肿瘤治疗手段。该方法主要通过将患者自体细胞提取后,经体外进行活化,修饰,培养和扩增后,再回输至患者体内,从而到达治疗肿瘤的目的。car-t,即嵌合抗原受体修饰性t细胞是一种具有靶向性的过继性免疫细胞治疗方法。该技术通过利用基因修饰的方法改造t细胞基因组,使其表达可识别肿瘤特异性抗原的car受体,进而突破原始t细胞抗肿瘤的mhc限制性,使t细胞直接杀伤肿瘤。例如cd19特异性car-t细胞已经在急性b淋巴细胞白血病和b细胞淋巴瘤的治疗方面取得了突破性进展,并实现了临床应用。但是目前的病毒转染car-t技术依旧面临着诸多挑战,目前大部分病毒转染car-t技术依旧是病毒用量高且转染率比较低。
技术实现要素:
[0003]
本发明的目的在于解决现有技术中病毒转染car-t技术依旧是病毒用量高且转染率比较低的技术问题,提供一种低病毒用量的car-t制备方法。
[0004]
本发明提供的技术方案如下:
[0005]
一种低病毒用量的car-t制备方法,其特征在于,是将分选活化得到的cd3+t细胞进行慢病毒转染。
[0006]
优选的,所述cd3+t细胞来源于人外周血单核细胞。
[0007]
优选的,所述外周血单核细胞已进行冻存处理。
[0008]
一种低病毒用量的car-t制备方法,包括如下步骤:
[0009]
day 1,进行冻存外周血单核细胞的复苏;
[0010]
day 2,所述外周血单核细胞复苏一日后,进行cd3+t细胞的分选活化,磁珠与t细胞共孵育进行激活;
[0011]
day 3,取沉降的细胞团离心,重悬后通过添加转染剂进行慢病毒转染;
[0012]
day 4,转染过夜后,离心除去含转染试剂及病毒的培养基,添加新鲜培养基重悬并计数,调整细胞密度调整并继续培养;
[0013]
day 5,更换新鲜培养基,维持细胞密度,继续培养2天。
[0014]
day 7,各组细胞计数,更换培养基继续培养,取样检测。
[0015]
优选的,步骤day 2中所述磁珠用量为2e+07,细胞密度维持3.1e+06/ml。
[0016]
优选的,所述步骤day 3所述转染剂的为聚合阳离子转染试剂,用量为8ug/ml。
[0017]
优选的,所述聚合阳离子转染试剂为ploybrene转染试剂。
[0018]
优选的,所述聚合阳离子转染试剂为hitransg病毒转染试剂。
[0019]
优选的,所述步骤day4和day5中所述细胞密度为1.0e+06/ml。
[0020]
优选的,所述细胞数均为活细胞数。
[0021]
通过采用上述技术方案,达到的技术效果如下:
[0022]
本发明方法简单,利用较低量的慢病毒量进行转染且转染率较高,节省了病毒的用量且最终阳性率较高。
附图说明
[0023]
图1是实施例1的转染阳性率结果图;
[0024]
图2是实施例2的转染阳性率结果图;
[0025]
图3是对照例的转染阳性率结果图。
具体实施方式
[0026]
一种低病毒用量的car-t制备方法,其特征在于,是将分选活化得到的cd3+t细胞进行慢病毒转染。
[0027]
优选的,所述cd3+t细胞来源于人外周血单核细胞。
[0028]
优选的,所述外周血单核细胞已进行冻存处理。
[0029]
一种低病毒用量的car-t制备方法,包括如下步骤:
[0030]
day 1,进行冻存外周血单核细胞的复苏;
[0031]
day 2,所述外周血单核细胞复苏一日后,进行cd3+t细胞的分选活化,磁珠与t细胞共孵育进行激活;
[0032]
day 3,取沉降的细胞团离心,重悬后通过转染剂进行慢病毒转染;
[0033]
day 4,转染过夜后,离心除去含转染试剂及病毒的培养基,添加新鲜培养基重悬并计数,调整细胞密度调整并继续培养;
[0034]
day 5,更换新鲜培养基,维持细胞密度,继续培养2天。
[0035]
day 7,各组细胞计数,更换培养基继续培养,取样检测。
[0036]
优选的,步骤day 2中所述磁珠用量为2e+07,细胞密度维持3.1e+06/ml。
[0037]
优选的,所述步骤day 3所述转染剂的为聚合阳离子转染试剂,用量为8ug/ml。
[0038]
优选的,所述聚合阳离子转染试剂为ploybrene转染试剂。
[0039]
优选的,所述聚合阳离子转染试剂为hitransg病毒转染试剂。
[0040]
优选的,所述步骤day4和day5中所述细胞密度为1.0e+06/ml。
[0041]
优选的,所述细胞数均为活细胞数。
[0042]
为了更进一步理解本发明技术方案,现结合实例予以说明。
[0043]
实施例1
[0044]
day 1,进行冻存pbmc(人外周血单核细胞)细胞的复苏,1管,细胞计数活率为91%,细胞数为5.1e+07;
[0045]
day 2,复苏一日后,进行cd3+t细胞的分选活化,磁珠用量2e+07,获得的细胞活率为95%,收获细胞数为1.3e+07,磁珠与t细胞共孵育进行激活,细胞密度维持3.1e+06/ml;
[0046]
day 3,细胞收集至15ml离心管,大部分细胞团块因为附着磁珠,会迅速沉降,从而与上层较小团块以及未成团细胞分离,取沉降的细胞团离心,重悬后检测,细胞活率则为90%,获得细胞数8.5e+06。通过ploybrene转染剂进行慢病毒转染,ploybrene转染剂用量
为8ug/ml,转染细胞数为0.5e+07,病毒数为1.5e+07;
[0047]
day 4,转染过夜后,离心除去含转染试剂及病毒的培养基,添加新鲜培养基重悬并计数,细胞密度调整为1.0e+06/ml并继续培养;
[0048]
day 5,各组细胞更换新鲜培养基,维持细胞密度1.0e+06/ml,继续培养。
[0049]
day 7,各组细胞计数,更换培养基继续培养,取样进行流式细胞转染试剂检测。
[0050]
所述细胞数均为活细胞数。
[0051]
结果如图1所示。
[0052]
实施例2
[0053]
day 1,进行冻存pbmc(人外周血单核细胞)细胞的复苏,1管,细胞计数活率为92%,细胞数为5.1e+07;
[0054]
day 2,复苏一日后,进行cd3+t细胞的分选活化,磁珠用量2e+07,获得的细胞活率为96%,收获细胞数为1.3e+07,磁珠与t细胞共孵育进行激活,细胞密度维持3.1e+06/ml;
[0055]
day 3,细胞收集至15ml离心管,大部分细胞团块因为附着磁珠,会迅速沉降,从而与上层较小团块以及未成团细胞分离,取沉降的细胞团离心,重悬后检测,细胞活率则为92%,获得细胞数8.5e+06。通过hitransg病毒转染试剂进行慢病毒转染,hitransg病毒转染试剂用量为8ug/ml,转染细胞数为0.5e+07,病毒数为1.5e+07;
[0056]
day 4,转染过夜后,离心除去含转染试剂及病毒的培养基,添加新鲜培养基重悬并计数,细胞密度调整为1.0e+06/ml并继续培养;
[0057]
day 5,各组细胞更换新鲜培养基,维持细胞密度1.0e+06/ml,继续培养。
[0058]
day 7,各组细胞计数,更换培养基继续培养,取样进行流式细胞转染试剂检测。
[0059]
所述细胞数均为活细胞数。
[0060]
结果如图2所示。
[0061]
对照例
[0062]
对照例中不使用转染剂,其他与实施例1步骤相同。
[0063]
结果如图3所示。
[0064]
从图1图2可以看出,实施例1和实施例2转染率较好,分别为63.40%和65.07%,对照例中转染率只有49.30%。本发明实施例不仅转染率高,病毒用量少,病毒数仅为1.5e+07。
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询

tips


 商标分类
商标分类  商标转让
商标转让 



