两种新的环状二苯基庚烷类化合物及其制备方法和用途与流程
 2021-02-02 09:02:24|
2021-02-02 09:02:24| 295|
295| 起点商标网
起点商标网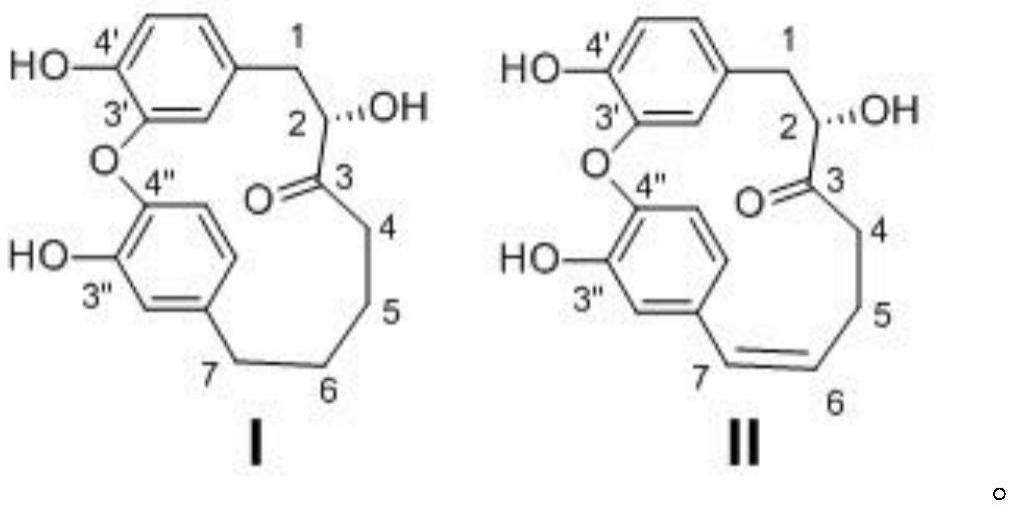
[0001]
本发明涉及环状二苯基庚烷类化合物,具体涉及从化香树的树皮中提取、分离纯化得到的两种新的环状二苯基庚烷类化合物,同时涉及该两种化合物的制备方法及神经保护作用。
背景技术:
[0002]
化香树(platycarya strobilacea)是胡桃科(juglandaceae)化香树属落叶小乔木,又名花木香、还香树、栲香、栲蒲、板香树、化树、花龙树等。化香树在我国分布面积广泛,产于黄河流域以及以南地区,如鄂、赣、粤、黔等地;日本及朝鲜半岛也有分布。《中华本草》和《中药大辞典》记载化香树果序其性味为辛、温,具有清热解毒、活血化瘀、清肿排脓、通窍止痛的功效,广泛用于治疗鼻窦炎、鼻咽炎;以化香树叶为原料生产加工制成的虫茶中含有多种对人体有益的成分,包括氨基酸、多酚类、黄酮类和多糖类成分。化香树树皮、根皮、叶和果序均含鞣质,作为提制栲胶的原料,树皮亦能剥取纤维,叶可作农药,根部及老木含有芳香油,种子可榨油。
[0003]
研究表明,化香树的化学成分,其根、树皮、叶、果序中含量最大的是没食子单宁(gallotannins)和鞣花单宁(ellagitannins),后续的研究还发现了黄酮类、倍半萜类等化合物。值得注意的是日本学者(tanaka et al.,1998)曾从该植物的树皮中分离报道了一个环状二苯基庚烷类化合物,命名为(platycarynol),结构式如下,
[0004][0005]
二苯基庚烷类化合物分为直连型和环状型两大类,该类化合物目前已从包括胡桃科、槭树科、姜科、猕猴桃科、桦木科、橄榄科、木麻黄科、豆科、杨梅科的多种植物中分离鉴定500多个。现代药理学研究表明,二苯基庚烷类化合物具有肿瘤细胞抑制、抗炎、雌激素、抗淀粉样变、止吐等重要的医药活性。因此发现该类型化合物的新颖结构和新的生物活性成为当前研究的热点。
技术实现要素:
[0006]
本发明的目的是,针对上述现有技术的不足,提供一种两种新的环状二苯基庚烷类化合物,是从化香树树皮中分离制备得到,并具有神经保护作用。
[0007]
为达上述目的,本发明采用的技术方案为:具有下述式(i)和式(ii)的环状二苯基庚烷类化合物:
[0008][0009]
本发明同时提供上述两种环状二苯基庚烷类化合物的制备方法,该方法步骤如下:
[0010]
a、取化香树树皮干燥,粉碎,用乙醇浸提,将提取液浓缩去除乙醇至浸膏状,将浸膏加水悬浮,悬浮液依次用石油醚、乙酸乙酯进行萃取,得乙酸乙酯萃取物;
[0011]
上述提及的用乙醇浸提时,乙醇的体积百分数为70%-95%,加入量为每1kg化香树树皮粉加1.0-1.4l乙醇,温度为常温。
[0012]
上述提及的悬浮液依次用石油醚、乙酸乙酯进行萃取是悬浮液先用等体积的石油醚萃取,弃除石油醚层,水层再用等体积的乙酸乙酯萃取。
[0013]
b、将乙酸乙酯萃取物用正相硅胶柱进行层析,采用二氯甲烷-甲醇系统进行梯度洗脱,收集二氯甲烷:甲醇的体积比为90:10时洗脱得到的组份;
[0014]
上述的二氯甲烷-甲醇系统的体积比为100:0-50:50。
[0015]
c、将该组份用十八烷基键合的反相硅胶柱分离,用体积百分浓度为50%的甲醇水溶液进行等度洗脱,洗脱剂用量为10个柱体积,每个柱体积洗脱液收集为一份,收集第5个柱体积的洗脱液,将洗脱液减压浓缩得浸膏;
[0016]
d、将步骤c的浸膏上凝胶柱层析进行分离纯化,得到晶体状混合物;
[0017]
上述用凝胶柱层析进行分离纯化时是以纯甲醇作为洗脱剂,凝胶柱采用填料sephadex lh-20。
[0018]
e、将晶体混合物用高效液相色谱分离,得到如下式(i)和式(ii)的单体化合物;
[0019][0020]
上述提及的用高效液相色谱分离时,洗脱剂为体积百分浓度为50%的甲醇水溶液,检测波长为紫外uv254nm。
[0021]
本发明同时提供上述式(i)或式(ii)所述的环状二苯基庚烷类化合物在制备神经保护的药物中的应用。
[0022]
本发明还提供上述式(i)和式(ii)的环状二苯基庚烷类化合物在制备神经保护的药物中的应用。
[0023]
本发明从化香树(platycarya strobilacea)的树皮中提取、分离纯化得到的两种
化合物为首次报道,是结构新颖的环状二苯基庚烷类化合物,体外试验证明该两种化合物对皮质酮(cort)诱导的神经细胞损伤具有保护作用,可作为开发神经保护药物的先导化合物。
附图说明
[0024]
图1是式(i)的单体化合物立体结构确证测定的ecd计算值与测试值。
[0025]
图2是式(ii)的单体化合物立体结构确证测定的ecd计算值与测试值。
[0026]
图3是本发明对皮质酮(cort)诱导的神经细胞损伤试验结果比较图。
[0027]
图中:化合物i为式(i)的单体化合物,化合物ii为式(ii)的单体化合物;
[0028]
注:与模型组(阴性对照)比较(经f检验,t检验),*p<0.05,**p<0.01,***p<0.001。
具体实施方式
[0029]
下面结合实施例进一步说明本发明的实质性内容,但并不以此限定本发明保护范围。
[0030]
实施例1两种单体化合物的制备及结构鉴定
[0031]
制备:取45℃烘干的化香树的树皮12.5kg粉碎,用体积百分数为95%的乙醇常温浸提3次(乙醇每次用量15l),每次48h,合并提取液,将提取液减压浓缩至无醇味的浸膏1.8kg,将浸膏用4升水进行超声溶解悬浮,悬浮液先用等体积石油醚萃取,水层再用等体积乙酸乙酯萃取,3次后合并萃取液,减压浓缩萃取液后分别得到石油醚层浸膏35.0g、乙酸乙酯层浸膏95.0g。将乙酸乙酯层浸膏进一步用正相硅胶柱(100-200目)层析,采用二氯甲烷-甲醇系统(体积比为100:0-50:50)进行梯度洗脱,收集二氯甲烷:甲醇的体积比为90:10时洗脱得到的组份;将该组分用十八烷基键合的反相硅胶柱进一步分离,用体积百分浓度为50%的甲醇水溶液等度洗脱,洗脱剂用量为10个柱体积,收集第5个柱体积的洗脱液,减压浓缩后经tlc检测(tlc体系:氯仿/甲醇9:1展开,uv254nm,rf=0.45),可得主点浸膏,该浸膏进一步通过凝胶柱(填料sephadex lh-20)层析,以甲醇洗脱,得到晶体状混合物。该晶体混合物再经高效液相色谱柱(型号:ymc-pack ods-a column/250mm
×
10mm i.d.;s-5μm)分离,分离条件为:体积百分浓度为50%的甲醇水洗脱结合紫外uv254nm检测,得到27.9mg单体化合物1和8.0mg单体化合物2。
[0032]
上述两种单体化合物的结构鉴定:
[0033]
单体化合物1:熔点183℃,旋光[α]=+143.33(c=0.06,meoh);高分辨质谱显示m/z:327.1234[m-h]-,核磁共振氢谱碳谱见下表1;该化合物的立体结构确证通过ecd测定数据(meoh):δε(nm)=-20.71(207),+67.18(226),+20.25(283)(见图1)。
[0034]
单体化合物2:熔点194℃,旋光[α]=+103.33(c=0.12,meoh);高分辨质谱显示m/z:325.1073[m-h]-,核磁共振氢谱碳谱见下表1;该化合物的立体结构确证通过ecd测定数据(meoh):δε(nm)=-20.71(207),+67.18(226),+20.25(283)(见图2)。
[0035]
表1两种单体化合物的氢谱碳谱核磁共振数据
[0036][0037]
注:括号外数值代表化学位移,括号中字母d、dd、s、m代表质子耦合类型,j代表耦合常数;
1
h nmr(600mhz,cd
3
od);
13
c nmr(150mhz,cd
3
od)。
[0038]
上述单体化合物1和单体化合物2的结构式如下:
[0039][0040]
实施例2式(i)和式(ii)的两种单体化合物的神经保护药理作用试验
[0041]
一、实验材料
[0042]
desipramine(dim)购自北京市普京康利科技有限公司,皮质酮(cort)购自sigma,dmem高糖培养基、胎牛血清(fbs)、pbs购自bi,pc12低分化细胞购自中国科学院昆明动物研究所细胞库,蔡司显微镜,thermo酶标仪;测试化合物包括:式(i)和式(ii)的单体化合物,以及三个结构类似物a,b,c(结构式见下),化合物终浓度是20μm,每个浓度各做3个重复。
[0043][0044]
二、试验方法
[0045]
1.pc12低分化细胞采用dmem+10%fbs+100u/ml双抗的培养基进行培养,培养箱温度37℃,5%co
2
;
[0046]
2.当pc12低分化细胞长至合适数量时,取pc12低分化细胞,胰酶消化,制成细胞悬液;
[0047]
3.将细胞悬液吸至15ml离心管中,800rpm,5min;
[0048]
4.离心结束后,离心管用酒精消毒后拿进超净台,将上清倒入废液缸;
[0049]
5.加入新的完全培养基5ml,用移液器吹打十次,尽量吹散细胞,但不能太用力;
[0050]
6.取0.02ml细胞悬液,加入到细胞计数板中,上机计数;
[0051]
7.将细胞浓度调整至1
×
10
5
cells/ml,加入96孔板,每孔0.1ml,放入细胞培养箱培养;
[0052]
8.24小时后,将原培养基吸出,然后加入新的培养基,加入待测化合物;
[0053]
9.实验设计:各组设计各做3个重复,
[0054]
空白对照(blank):不加cort、dim,只有细胞和终浓度为0.1%的dmso;
[0055]
阴性对照组:含终浓度为150μm cort和终浓度为0.1%的dmso;
[0056]
阳性对照组:含终浓度为10μm dim、终浓度为150μm cort和终浓度为0.1%的dmso;
[0057]
化合物处理组:各测试化合物终浓度20μm(含dmso,dmso终浓度为0.1%),和终浓度为150μm cort(化合物组在神经损伤保护实验之前,先进行了单独加入细胞的mts实验,检测是否有细胞毒性)。
[0058]
10.细胞放入细胞培养箱中继续培养;
[0059]
11.每天观察细胞情况,在加入化合物48h后,用mts法测吸光值,计算存活率(每个孔吸光值/blank孔吸光值的平均值)。
[0060]
三、试验结果
[0061]
1.实验过程中无异常情况,无污染,细胞正常生长。
[0062]
2.实验结果见图3及下表2:
[0063]
表2试验结果表
[0064]
[0065]
由图3和表2可知,化合物(i)(式(i)的单体化合物)和化合物(ii)(式(ii)的单体化合物)在20μμ时,对皮质酮诱导的神经细胞损伤有非常显著的保护作用(p<0.05),而三个结构类似物(a、b、c)对皮质酮诱导的神经细胞损伤基本无保护作用。
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询

tips


 商标分类
商标分类  商标转让
商标转让 



