核酸分子的制作方法
 2021-02-02 09:02:41|
2021-02-02 09:02:41| 322|
322| 起点商标网
起点商标网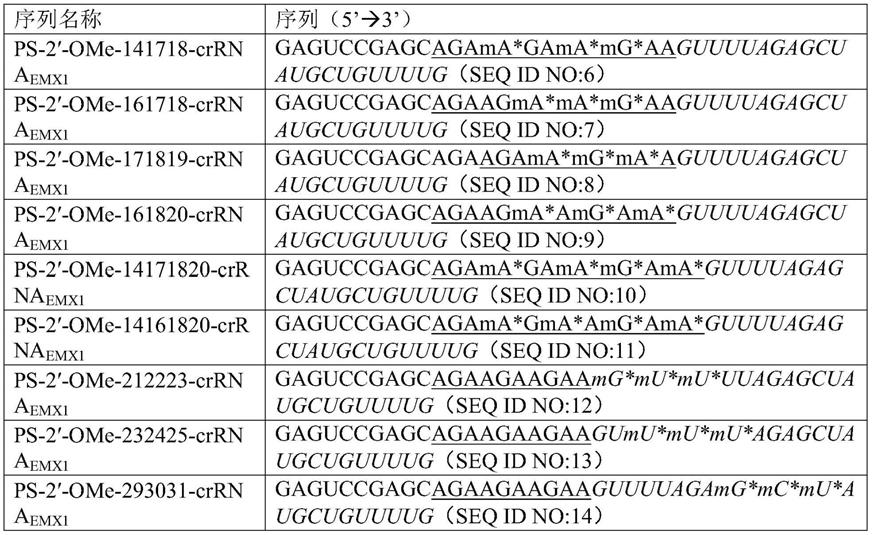
[0001]
本发明涉及生物化学领域,具体地涉及核酸分子、基因编辑系统、制备核酸分子的方法、基因编辑方法。
背景技术:
[0002]
rna在生物体内发挥着转录、翻译、调控基因表达等多种功能,对生物体的几乎一切生命活动至关重要。在结构上rna同dna相似,由碱基、五碳糖和磷酸骨架组成,只比dna在五碳糖上多了2
’-
oh。这一结构上的小小区别,一方面给rna本身带来了不利,使其结构不稳定容易发生水解断裂,同时使其容易被很多核酸酶识别而降解,但从另一方面来说,正是这结构上的区别使大自然在生物进化过程中赋予rna更多的功能角色。
[0003]
crispr-cas9基因编辑技术利用向导rna(guide rna)来介导核酸酶(cas9)到达dna靶点,并对目标靶点进行特异性的切割。cas9核酸酶有两个酶切功能结构域:ruvc和hnh,分别作用于底物dna的两条链,当这两个结构域被激活时,cas9在底物dna上产生双链断裂(double strand breaks,dsbs)。细胞通过nhej的修复会在dsb处造成indel效应(insertion and deletion),进而造成基因的移码突变而达到基因敲除的目的。此外,还可以通过同源重组等方式对基因进行精确编辑。
[0004]
与持续激活型crispr-cas9基因编辑系统相比,刺激响应型crispr-cas9基因编辑可对基因编辑进行时间和空间上的更好控制,同时给脱靶留下更小的时间窗口,从而降低脱靶效率。
[0005]
因此开发一种可以通过响应刺激来改变核酸分子状态的核酸分子,在基因编辑及药物制造等领域都非常重要。
技术实现要素:
[0006]
在本发明的第一方面,本发明提出了一种核酸分子。根据本发明的实施例,所述核酸分子包括:主链,所述主链中含有核糖核苷酸;和修饰基团,所述修饰基团与所述主链相连,并且所述修饰基团可以被活性氧脱除。根据本发明实施例的核酸分子具有两种形式,一种形式为携带有修饰基团的形式,另一种形式为不携带修饰基团。修饰基团连接在核酸分子的核糖核苷酸上,当核酸分子所处的环境中无活性氧,或者活性氧的含量低时,核酸分子以携带修饰基团的形式存在;当核酸分子所处的环境中的活性氧成分达到一定阈值时,核酸分子上的修饰基团被脱除,核酸分子以不带修饰基团的形式存在。
[0007]
根据本发明的实施例,上述核酸分子还可进一步包括如下附加技术特征至少之一:
[0008]
根据本发明的实施例,所述修饰基团包括选自硼酸频呐醇酯和苯硼酸的至少之一。发明人经过大量实验发现,硼酸频呐醇酯和苯硼酸可以连接于核酸分子上,对核酸分子进行修饰,并且连接于核酸分子上的硼酸频呐醇酯和苯硼酸可以在高浓度活性氧的作用下脱除,进而形成可以响应高浓度活性氧的核酸分子。
[0009]
根据本发明的实施例,所述修饰基团经由连接子连接到所述核酸分子的磷酸骨架上。发明人经过反复的实验发现,修饰基团经过连接子连接于核糖核苷酸的磷酸骨架上更稳定。
[0010]
根据本发明的实施例,所述连接子包括选自含硫基团和含硒基团的至少之一。发明人经过反复研究发现,硫或者硒替代核糖核苷酸磷酸骨架上的氧可以作为连接子,进而使修饰基团连接在核糖核苷酸上。使用硫或者硒代核糖核苷酸磷酸骨架上的氧不影响核酸分子的重要结构,也不会影响核酸分子的生物学功能。
[0011]
根据本发明的实施例,所述连接子为硫代磷酸酯和硒代磷酸酯。根据本发明实施例的核酸分子,使用硫或者硒代替核糖核苷酸骨架上的氧进而形成硫代磷酸酯结构,此种修饰简单易得,商业化的固相合成即可满足需求,成本低廉。
[0012]
根据本发明的实施例,至少一部分所述核糖核苷酸的2
’-
oh被保护基团保护。发明人经过大量的实验与反复研究,核糖核苷酸的2
’-
oh需要被保护基团保护之后,修饰基团才可以与核糖核苷酸形成稳定结构,否则被修饰基团修饰的核糖核苷酸会攻击修饰基团,使结构不稳定,需要注意的是,保护基团选用常规的核糖核苷酸2
’-
oh保护基团都可以,其目的在于封闭2
’-
oh,使其不能攻击修饰基团。
[0013]
根据本发明的实施例,所述保护基团包括2
’-
ome、2
’-
f、2
’-
moe和lna的至少之一。根据本发明实施例的方法,使用2
’-
ome、2
’-
f、2
’-
moe和lna均可以保护核糖核苷酸的2
’-
oh,使修饰基团与核糖核苷酸的连接更稳定,发明人发现,2
’-
ome、和2
’-
moe在本发明中的效果更好一些。
[0014]
根据本发明的实施例,所述活性氧包括选自h2o2、超氧阴离子、一氧化氮和羟基自由基的至少之一。根据本发明的实施例,高浓度h2o2可以更好地脱除修饰基团,核糖核苷酸上修饰的苯硼酸频呐醇酯或者苯硼酸对高浓度h2o2响应,进行1,6消除,进而从核糖核苷酸上脱除;在低浓度h2o2或者不存在h2o2的情况下,苯硼酸频呐醇酯或者苯硼酸修饰会稳定连接于核糖核苷酸上,不会进行脱除。
[0015]
根据本发明的实施例,所述核酸分子为rna,优选为grna。发明人发现,所述核酸分子可以为任何带有核糖核苷酸的分子,如信使rna(mrna)、转运rna(trna)、核糖体rna(rrna)、小干扰rna(sirna)和反义rna(asrna)等,当所述核酸分子为grna时,其可以应用于基因编辑系统,进而形成刺激响应型基因编辑系统。
[0016]
根据本发明的实施例,所述修饰基团与所述grna活性区中所述至少一部分所述核糖核苷酸相连,所述活性区为种子区域,所述种子区域与核酸靶点结合。根据本发明实施例的核酸分子,所述活性区为grna的第11位到第20位的核糖核苷酸位点(编号基于核酸分子从5
’
到3
’
核苷酸的顺序确定),该区域的位点与靶标核酸的靶点结合,进而引导cas蛋白对cas蛋白的目标核酸进行切割。
[0017]
根据本发明的实施例,所述grna呈可注射,或者所述grna是以脂质、溶液形式呈现的。根据本发明实施例的核酸分子可以经过细胞显微注射、转染等方式进入细胞内;可以经过皮下注射、腹腔注射、静脉注射、肌肉注射等形式进入动物体内,所述动物为人、小鼠、猴子、大鼠等哺乳动物或者非哺乳动物;可以经过注射、孵育等方式进入植物体内,所述植物为水稻、玉米、拟南芥、小麦等。需要注意的是,所述grna也可以在体外溶液中发挥作用。
[0018]
在本发明的第二方面,本发明提出了一种基因编辑系统。根据本发明的实施例,所
述基因编辑系统包括:在本发明的第一方面所提出的核酸分子。根据本发明实施例的基因编辑系统利用在本发明的第一方面所提出的核酸分子能够对高浓度活性氧响应的特性,在高浓度活性氧的环境下可以发挥核酸分子的生物学活性,进而对目标基因进行编辑,在低浓度活性氧或者不存在活性氧的情况下,核酸分子被修饰基团封闭,不可以发挥生物学功能。
[0019]
根据本发明的实施例,上述基因编辑系统还可进一步包括如下附加技术特征至少之一:
[0020]
根据本发明的实施例,所述基因编辑系统进一步包括:cas蛋白,所述cas蛋白以dna、rna、多肽和蛋白质至少之一的形式存在,所述cas蛋白包括选自cas9、cas12a、cas12b和cas13至少之一。根据本发明实施例的基因编辑系统利用cas蛋白对其目标核酸进行切割,进而达到对目标核酸进行编辑的目的。
[0021]
根据本发明的实施例,所述基因编辑系统进一步包括:志愿分子,所述志愿分子以dna和rna至少之一的形式存在。根据本发明实施例的基因编辑系统,利用志愿分子作为模板,在目标核酸被切割之后,以志愿分子作为模板进行核酸的损伤修复,进而改变目标核酸的序列。
[0022]
在本发明的第三方面,本发明提出了一种制备在本发明第一方面所提出的核酸分子的方法。根据本发明的实施例,所述方法包括:提供待修饰核酸分子,所述待修饰核酸分子中含有核糖核苷酸;使所述核酸分子与修饰基团相连。根据本发明实施例的方法,利用固相合成的方法,将带有硫代磷酸酯及2
’-
oh保护基团的核糖核苷酸单体合成为核酸分子,将核酸需要注意的是,如果希望在核酸分子的特定区域或者特定位点连接修饰基团,则只需要在特定区域或特定位点使用带有硫代磷酸酯及2
’-
oh保护基团的核糖核苷酸单体,其他区域或者其他位点则使用普通核苷酸,进而达到在特定区域或者特定位点连接修饰基团的目的。借助固相合成的方法简单易行,成本低廉。
[0023]
根据本发明的实施例,上述方法还可进一步包括如下附加技术特征至少之一:
[0024]
根据本发明的实施例,所述核酸分子是通过化学合成或者生物合成方式提供的。根据本发明实施例的方法,可以通过化学合成的方法,先合成带有硫代磷酸酯及2
’-
oh保护基团的核糖核苷酸单体,再利用单体合成核酸分子;也可以通过生物合成的方式,利用dna转录成rna,再对所生成的rna加入连接子,保护rna的2
’-
oh,加上修饰基团。
[0025]
在本发明的第四方面,本发明提出了一种基因编辑方法。根据本发明的实施例,所述方法包括:向待编辑的核酸靶点,提供在本发明第二方面所提出的基因编辑系统;使所述核酸分子在活性氧的作用下,去除所述修饰基团,以便在所述核酸靶点进行基因编辑。根据本发明的基因编辑方法,针对待编辑的核酸靶点设计所述核酸分子主链,并在核酸分子的活性区域加上修饰基团。在低浓度活性氧或者无活性氧的情况下,核酸分子的生物活性区域被修饰基团修饰,无法引导核酸编辑蛋白对目标核酸进行剪切等操作;在高浓度活性氧的条件下,核酸分子上的修饰基团被脱除,恢复生物活性,可以发挥其向导rna的作用,使目标核酸被核酸编辑蛋白剪切。
[0026]
根据本发明的实施例,上述方法还可进一步包括如下附加技术特征至少之一:
[0027]
根据本发明的实施例,所述活性氧是通过注射、孵育、生物体自身代谢提供。发明人发现,无论是通过技术手段外加给生物体的活性氧,还是生物体自身代谢异常导致细胞
内过量的活性氧,均可以脱除所述核酸分子的修饰基团。
附图说明
[0028]
图1为根据本发明实施例的保护基团对2
’-
oh的保护示意图;
[0029]
图2为根据本发明实施例的rna与br-bo反应的变性page表征结果;
[0030]
图3为根据本发明实施例的rna-bo对不同浓度h2o2的响应;
[0031]
图4为根据本发明实施例的rna上修饰bo的反应路径(rna-bo的生成)及其对h2o2的响应脱除示意图;
[0032]
图5为根据本发明实施例的对crispr-cas9基因编辑体系的crrna进行ps-2
’-
ome修饰的位点筛选示意图和结果,其中a为根据本发明实施例的对crispr-cas9基因编辑体系的crrna进行ps-2
’-
ome修饰的位点筛选示意图,b为对crispr-cas9基因编辑体系的crrna进行ps-2
’-
ome修饰的位点筛选的tide结果,c为对crispr-cas9基因编辑体系的crrna进行ps-2
’-
ome修饰的位点筛选的t7ei结果。
[0033]
图6为根据本发明实施例的经ps-2
’-
ome修饰后的emx1 crrna上的bo修饰和h2o2响应脱除,其中(a)为ps-2
’
ome-emx1 crrna(*141718)的h2o2上的bo修饰和h2o2响应脱除结果,(b)为ps-2
’
ome-emx1 crrna(*161718)的h2o2上的bo修饰和h2o2响应脱除结果,(c)为ps-2
’
ome-emx1 crrna(*161820)的h2o2上的bo修饰和h2o2响应脱除结果,(d)为ps-2
’
ome-emx1 crrna(*14161820)的h2o2上的bo修饰和h2o2响应脱除结果;
[0034]
图7为根据本发明实施例的ps-2
’
ome-emx1 crrna(*141718)与br-bo反应及经h2o2处理后的esi质谱表征,其中(a)为ps-2
’
ome-emx1 crrna(*141718),(b)为ps-2
’
ome-emx1 crrna(*141718)与br-bo反应的产物ps-2
’
ome-emx1 crrna(*141718)-bo,(c)为ps-2
’
ome-emx1 crrna(*141718)-bo经高浓度h2o2处理后的产物;
[0035]
图8为根据本发明实施例的ps-2
’
ome-emx1 crrna(*141718)-bo介导crispr-cas9体系的h2o2刺激响应体外切割;
[0036]
图9为根据本发明实施例的在293t-cas9细胞中的h2o2刺激响应crispr-cas9基因编辑结果;
[0037]
图10为根据本发明实施例的在293t细胞中的h2o2刺激响应crispr-cas9基因编辑结果;
[0038]
图11为根据本发明实施例的ps-2
’
f-emx1 crrna(*141718)与br-bo反应前后的变性page表征结果。
具体实施方式
[0039]
下面详细描述本发明的实施例,所述实施例的示例在附图中示出。下面通过参考附图描述的实施例是示例性的,旨在用于解释本发明,而不能理解为对本发明的限制。
[0040]
在本发明的第一方面,本发明提出了一种核酸分子。根据本发明的实施例,所述核酸分子包括:主链,所述主链中含有核糖核苷酸;和修饰基团,所述修饰基团与所述主链相连,并且所述修饰基团可以被活性氧脱除。根据本发明实施例的核酸分子上携带修饰基团,所述修饰基团只可以特异性地被高浓度活性氧脱除,具有高度选择性。根据被修饰的核苷酸位点,在不存在活性氧或者活性氧浓度低的情况下,可以有针对性地封闭核酸分子相应
的生物学功能,而在高浓度活性氧的情况下,可以脱除修饰基团,并恢复核酸分子相应的生物学功能,但是,脱除修饰基团的核酸分子在生物体内环境中不可以转变为携带修饰的核酸分子。需要注意的是,被修饰的核苷酸为核糖核苷酸。
[0041]
根据本发明的实施例,所述修饰基团包括选自硼酸频呐醇酯和苯硼酸的至少之一。
[0042]
根据本发明的实施例,所述修饰基团经由连接子连接到所述核酸分子的磷酸骨架上。根据本发明的具体实施例,将苄溴苯硼酸频呐醇酯或者苄溴苯硼酸与待修饰的核酸分子进行反应,反应条件为在水溶液体系或者水与有机溶剂混合体系中,反应过程加入一定的缓冲液,包括但不限于磷酸盐缓冲、碳酸盐缓冲、mes(4-吗啉乙磺酸)缓冲、hepes(羟乙基哌嗪乙硫磺酸)缓冲等。有机溶剂用于彻底溶解有机反应物,包括但不限于dmf、dmso、乙醇、乙腈等所有有机溶剂。ph可在4-10之间,反应温度可为10℃-80℃,核酸分子的反应浓度为10nm-1mm,溴化物的反应浓度为100μm-100mm,反应时间为1分钟及以上。需要注意的是,也可以使用氯代物或者碘代物替代苄溴苯硼酸频呐醇酯或者苄溴苯硼酸,发明人经过试验发现,苄溴苯硼酸频呐醇酯或者苄溴苯硼酸效果更好。
[0043]
根据本发明的实施例,至少一部分所述核糖核苷酸的2
’-
oh被保护基团保护。发明人经过大量的实验与反复研究,核糖核苷酸的2
’-
oh需要被保护基团保护之后,修饰基团才可以与核糖核苷酸形成稳定结构,否则被修饰基团修饰的核糖核苷酸会攻击修饰基团,使结构不稳定,需要注意的是,保护基团选用常规的核糖核苷酸2
’-
oh保护基团都可以,其目的在于封闭2
’-
oh,使其不能攻击修饰基团。
[0044]
根据本发明的实施例,所述保护基团包括2
’-
ome、2
’-
f、2
’-
moe和lna的至少之一。根据本发明实施例的方法,使用2
’-
ome、2
’-
f、2
’-
moe和lna均可以保护核糖核苷酸的2
’-
oh,使修饰基团与核糖核苷酸的连接更稳定,2
’-
ome、2
’-
f、2
’-
moe和lna对2
’-
oh的保护效果示意图参考附图1,发明人发现,2
’-
ome、和2
’-
moe在本发明中的效果更好一些。
[0045]
根据本发明的实施例,所述活性氧包括选自h2o2、超氧阴离子、一氧化氮和羟基自由基的至少之一。根据本发明的实施例,高浓度h2o2可以更好地脱除修饰基团,核糖核苷酸上修饰的苯硼酸频呐醇酯或者苯硼酸对高浓度h2o2响应,进行1,6消除,进而从核糖核苷酸上脱除;在低浓度h2o2或者不存在h2o2的情况下,苯硼酸频呐醇酯或者苯硼酸会稳定连接于核糖核苷酸上,不会进行脱除。发明人发现,h2o2在核酸分子所述的环境中达到50μm时即可认为该环境为高h2o2浓度的环境,会使苯硼酸频呐醇酯或者苯硼酸脱除;苯硼酸频呐醇酯或者苯硼酸的脱除与h2o2的浓度有关,在h2o2的浓度越高时,苯硼酸频呐醇酯或者苯硼酸的脱除越容易,并且苯硼酸频呐醇酯或者苯硼酸的脱除也与被修饰的核糖核苷酸位点的数量有关,当被修饰的核糖核苷酸位点越多,即苯硼酸频呐醇酯或者苯硼酸越多所需要的h2o2的浓度越高。
[0046]
根据本发明的具体实施例,以一段简单的20个碱基的rna序列为例:5
’-
gaguccgagcagaagaagaa-3
’
(seq id no:1),当保持天然rna序列形式(5
’-
gaguccgagcagaagaagaa-3
’
)时,20nt rna与苄溴苯硼酸(br-bo)反应后,跑变性page胶,反应前后无明显区别;当对rna进行1个硫代磷酸酯(ps)修饰后,20nt rna(1ps):5
’-
gaguccgagc*agaagaagaa-3
’
(seq id no:2),其中,“c*”代表此位点上具有ps修饰,变性page表征结果仍表明,br-bo无法连接到rna上;当对rna进行ps修饰,同时对其2
’-
oh进行保
region进行化学修饰会对crrna的介导活性有较大影响。在emx1 crrna的141718(即14、17、18三个位点进行3个ps-2
’-
ome修饰)、161820(即16、18、20三个位点进行3个ps-2
’-
ome修饰)、161718(即16、17、18三个位点进行3个ps-2
’-
ome修饰)、14161820(即14、16、18、20四个位点进行4个ps-2
’-
ome修饰)进行ps-2
’-
ome修饰、212223(即21、22、23三个位点进行3个ps-2
’-
ome修饰)、232425(即23、24、25三个位点进行3个ps-2
’-
ome修饰)。
[0054]
在含dmem、10%fbs及双抗的培养基中培养可持续稳定表达cas9蛋白的293t-cas9细胞,当细胞长到约70%汇合度时,对细胞进行传代并铺板至48孔板。铺板时所用的培养基为含10%fbs的dmem(不含双抗)。约20h后,当48孔板中的细胞长到约70%汇合度时,对细胞进行转染。转染试剂采用life technologies的rnaimax(rnaimax),转染方法参照rnaimax的产品说明书并稍作修改。将20pmol emx1 crrna(不同位点进行ps-2
’-
ome修饰,见表1)、20pmol tracrrna混合于15μl opti-mem培养基中,混合均匀,室温孵育2min;同时,将1μl rnaimax混合于15μl opti-mem培养基中,混合均匀,室温孵育2min。将上述rna溶液和rnaimax混合均匀,室温孵育5-10min后,加入48孔板的孔中。转染48h后,用试剂盒提取经转染处理的细胞的基因组dna(gdna),并以之为模板,分别以emx1 fw和emx1 rv正反向引物进行pcr扩增,得到一段dsdna,用tide(tracking of indels by decomposition)和t7ei(t7 endonuclease i)两种方法对基因编辑的indel进行表征,计算indel,结果如图5b、图5c所示,在emx1crrna的141718(即14、17、18三个位点进行3个ps-2
’-
ome修饰)、161820(即16、18、20三个位点进行3个ps-2
’-
ome修饰)、161718(即16、17、18三个位点进行3个ps-2
’-
ome修饰)、14161820(即14、16、18、20四个位点进行4个ps-2
’-
ome修饰)进行ps-2
’-
ome修饰后,crispr-cas9的基因编辑能力仍能保留。其中emx1crrna(*141718)介导的基因编辑效率稍有提高,而emx1 crrna(*212223)或者emx1crrna(*232425)则无法介293t细胞中发生crispr-cas9基因编辑。
[0055]
表1:不同位点ps-2
’-
ome修饰的序列
[0056][0057]
根据本发明的实施例,引物emx1 fw及引物emx1 rv序列如下所示:
[0058]
emx1 fw:5
’-
aaaaccacccttctctctggc-3
’
(seq id no:15);
[0059]
emx1 rv:5
’-
ggagattggagacacggagag-3
’
(seq id no:16)。
[0060]
实施例2:用ps后修饰的方法将bo修饰到emx1 crrna上
[0061]
实验方法:在水和有机溶剂混合体系中,ps修饰的rna(同时2
’-
oh用2
’-
ome、2'-f、2
’-
moe或lna等保护)和苄溴硼酸化合物(br-bo)作为反应物,两反应物溶解于ph在4-10之间的缓冲体系,如磷酸盐缓冲、mes(4-吗啉乙磺酸)缓冲、hepes(羟乙基哌嗪乙硫磺酸)缓冲等。加入有机溶剂,以彻底溶解br-bo,rna的反应浓度为10nm-1mm,溴化物的反应浓度为100μm-100mm,在10℃-60℃下反应0.5h-200h。反应完可通过超滤器(amicon)去除过量的小分子,对产物进行纯化,也可以对反应混合物进行变性page,然后对产物进行切胶回收、纯化。可通过变性聚丙烯酰胺凝胶电泳(page)和q-tof-ms对产物进行表征和验证。
[0062]
在emx1 crrna(*141718)、emx1 crrna(*161820)、emx1 crrna(*161718)和emx1crrna(*14161820)进行bo修饰,将上述4种20μl 100μm的emx1 crrna分别与20μl100mm pbs(ph 6.0)、20μl dmf、20μl溶解于dmf中的50mm bo-br混合均匀,室温摇晃反应48h。用amicon10k和h2o清洗反应产物8次。所得rna-bo用uv260进行浓度测定,而后用变性page及esi质谱进行表征,结果分别如图6、图7,图11所示。结果显示,对于这几种在人细胞中有介导活性的emx1 crrna(ps-2
’-
ome),bo均可被成功修饰。
[0063]
实施例3:emx1 crrna-bo的h2o2诱导脱除
[0064]
将实施例2中的4种ps-2
’
ome-emx1 crrna-bo(也可以是ps-2
’
f-rna-bo、ps-2
’
ome-rna-bo或ps-lna-rna-bo)溶解于nebbuffer
tm 3.1(20mm hepes,100mm nacl,5mm mgcl2,0.1mm edta,ph 6.5),并向其中加入一定浓度的h2o2(10μm-1000μm),混合均匀后置于pcr仪中37℃反应1h。反应产物用15%变性page进行表征:将5pmol rna与等体积的上样缓冲液(8m尿素、0.03%溴酚蓝、二甲苯腈蓝ff)混合均匀后上样于15%变性page胶(29:1monomer to bis ratio、8m尿素)上,用1xmops buffer(40mm mops,ph 7.0,10mm乙酸钠,1mm edta)进行垂直电泳。电泳完后,将page胶取下,浸泡在1xsyber gold染料中10min,而后用凝胶成像仪进行成像,结果如图6所示,其中图6(a)、图6(b)、图6(c)、图6(d)分别为ps-2
’
ome-emx1 crrna(*141718)、ps-2
’
ome-emx1 crrna(*161718)、ps-2
’
ome-emx1 crrna(*161820)、ps-2
’
ome-emx1crrna(*14161820)的h2o2上的bo修饰和h2o2响应脱除结果,4种ps-2
’
ome-emx1crrna-bo都可以成功响应h2o2,在h2o2的作用下脱除bo。
[0065]
实施例4:基于grna上bo修饰的h2o2刺激响应crispr-cas9体系体外切割
[0066]
实验方法:以grna(含有/不含bo)、cas9、h2o2为反应物,rna的反应浓度为10nm-1mm,cas9的反应浓度为100nm-1mm,h2o2的反应浓度为10μm-1mm,在37℃下反应0.1h-50h。反应产物用琼脂糖凝胶电泳进行表征。
[0067]
用基因组提取试剂盒提取293t-cas9细胞的gdna,以之为模板,同时分别以emx1 fw和emx1 rv为正反向引物进行pcr扩增,pcr产物用胶提取试剂盒(omega)进行纯化,得到emx1 dsdna。用uv260对emx1 dsdna进行浓度测定并以之作为体外切割反应的底物。将1μl 1μm emx1 crrna(*141718)、1μl 1μm emx1 crrna(*141718)-bo、1μl 1μm tracrrna、0.5μl 1μm cas9、1μl不同浓度h2o2进行不同组合,再与1μl 30nm dsdna底物、24.5μl h2o以及1μl 10xnebuffer
tm
3.1缓冲液混合于pcr管并置于pcr仪中37℃孵育1h。反应产物用1.5%琼脂糖凝胶电泳进行鉴定。结果如图8所示,ps-2
’
ome-emx1 crrna(*141718)-bo在无h2o2刺激时,
无法联合tracrrna介导cas9对emx1 dsdna进行切割,随着体系中h2o2浓度升高,其对ps-2
’
ome-emx1crrna(*141718)-bo上的bo脱除效率增大,cas9对底物的切割效率随之增大,当h2o2浓度达到25μm时,经37℃反应1h后,体系中的emx1 dsdna被完全切割。
[0068]
实施例5:293t-cas9细胞中基于grna上bo修饰的h2o2刺激响应crispr-cas9基因编辑体系
[0069]
实验方法:用脂质体或纳米颗粒等转染试剂将cas9质粒或cas9 mrna或cas9蛋白以及grna(含有/不含bo)转染至细胞中。当转染的是cas9质粒时,5-20h后再向细胞中转入grna;当转染的是cas9 mrna时,0-10h后再向细胞中转入grna;当转染的是cas9蛋白时,grna和cas9先在体外形成复合体rnp,然后一起转染。为了诱导细胞产生高ros环境,转染grna前1-20h,向细胞中加入50μm-1mm h2o2。转染48h后,用试剂盒提取经转染处理的细胞的基因组dna(gdna),并以之为模板,进行pcr扩增,得到一段dsdna,继而进行t7ei分析或tide分析,计算indel。
[0070]
293t-cas9细胞的培养及转染试剂和方法参照实施实例一。将cas9质粒或cas9 mrna或cas9蛋白以分别与emx1 crrna(*141718)、emx1 crrna(*141718)-bo转染至细胞中转染前10min,向培养基中加入h2o2,终浓度为100μm。转染48h后,用试剂盒提取经转染处理的细胞的基因组dna(gdna),并以之为模板,分别以emx1 fw和emx1 rw为正反向引物进行pcr扩增,得到一段dsdna,继而进行t7ei分析,计算indel。结果如图9所示,emx1 crrna(*141718)-bo在正常培养基培养的293t-cas9中的indel约为2%,而在含100μm h2o2培养基中,emx1 crrna(*141718)-bo可导致约21%的indel。
[0071]
实施例6:hek293t细胞中基于grna上bo修饰的h2o2刺激响应crispr-cas9基因编辑体系
[0072]
hek293t细胞的培养及铺板方法参照实施实例一。当48孔板上的细胞的汇合度约70%时,用1μllipofectamine
tm
messengermax
tm
向每孔细胞中转入125ng cas9 mrna,置于培养箱中培养4h。4h后,向培养基中加入h2o2,至终浓度为100μm。接下来的转染和基因编辑效率测试参照实施实例五进行,将emx1 native crrna、emx1 crrna(*141718)、emx1 crrna(*141718)-bo、emx1 crrna(*14161820)、emx1 crrna(*14161820)-bo进行不同组合转染进细胞中。结果如图10所示,emx1 crrna(*141718)-bo在正常培养基培养的hek 293t中的indel约为2%,而在含100μm h2o2培养基中,emx1 crrna(*141718)-bo可导致约7%的indel。emx1 crrna(*14161820)-bo在正常培养基培养的hek 293t中的indel约为0.5%,而在含100μm h2o2培养基中,emx1 crrna(*14161820)-bo可导致约5%的indel。
[0073]
此外,术语“第一”、“第二”仅用于描述目的,而不能理解为指示或暗示相对重要性或者隐含指明所指示的技术特征的数量。由此,限定有“第一”、“第二”的特征可以明示或者隐含地包括至少一个该特征。在本发明的描述中,“多个”的含义是至少两个,例如两个,三个等,除非另有明确具体的限定。
[0074]
在本说明书的描述中,参考术语“一个实施例”、“一些实施例”、“示例”、“具体示例”、或“一些示例”等的描述意指结合该实施例或示例描述的具体特征、结构、材料或者特点包含于本发明的至少一个实施例或示例中。在本说明书中,对上述术语的示意性表述不必须针对的是相同的实施例或示例。而且,描述的具体特征、结构、材料或者特点可以在任一个或多个实施例或示例中以合适的方式结合。此外,在不相互矛盾的情况下,本领域的技
术人员可以将本说明书中描述的不同实施例或示例以及不同实施例或示例的特征进行结合和组合。
[0075]
尽管上面已经示出和描述了本发明的实施例,可以理解的是,上述实施例是示例性的,不能理解为对本发明的限制,本领域的普通技术人员在本发明的范围内可以对上述实施例进行变化、修改、替换和变型。
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询

tips


 商标分类
商标分类  商标转让
商标转让 



