环状半缩醛化合物的制造方法与流程
 2021-02-02 08:02:46|
2021-02-02 08:02:46| 464|
464| 起点商标网
起点商标网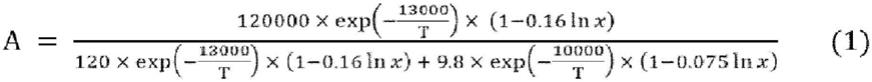
[0001]
本发明涉及环状半缩醛化合物的制造方法。
背景技术:
[0002]
使不饱和化合物与氢和一氧化碳反应来制造醛的方法被称为加氢甲酰化反应(或羰基合成反应),在工业上是有用的。在加氢甲酰化反应中,通常使用钴化合物、铑化合物作为催化剂。
[0003]
将具有不饱和键的醇加氢甲酰化来制造环状半缩醛化合物是公知的,报道了许多例子。例如,已知将烯丙醇(专利文献1)、甲基烯丙醇(专利文献2)或3-甲基-3-丁烯-1-醇(专利文献3)加氢甲酰化,合成各自对应的环状半缩醛化合物的方法。
[0004]
但是,作为催化剂而使用的过渡金属催化剂通常价格昂贵,存在通过单次蒸发等操作将环状半缩醛化合物与催化剂成分分离,将催化剂再利用的情况。例如,在专利文献4中记载了,在将烯烃性化合物加氢甲酰化来制造醛时,通过使用耐热性高的特定的双亚磷酸酯化合物作为配体,即使在反应产物的分离工序中也不会发生分解
·
变质而稳定地存在,能够将反应产物分离后的反应液直接再循环至醛制造用反应器。
[0005]
现有技术文献
[0006]
专利文献
[0007]
专利文献1:日本特开平5-320087号公报
[0008]
专利文献2:日本特开平9-52888号公报
[0009]
专利文献3:日本特开昭62-201881号公报
[0010]
专利文献4:日本特开平11-130720号公报
技术实现要素:
[0011]
发明要解决的课题
[0012]
在上述专利文献1~3所公开的环状半缩醛化合物的制造方法中,其收率尚有改善的余地。另外,上述加氢甲酰化反应中生成的环状半缩醛化合物大多缺乏稳定性,所得到的反应混合液中容易含有大量的高沸点成分,而如果反应混合液含有大量这样的高沸点成分,则通过单次蒸发等从反应混合液中分离目标环状半缩醛化合物时,其回收率变差。特别是在如上述那样再利用催化剂的情况下,如果在反应混合液中大量含有高沸点成分,则随着再利用的次数增加,高沸点成分的含量也变多,上述回收率进一步变差,因此这样的高沸点成分的生成也成为妨碍催化剂再利用的原因。因此,要求抑制反应混合液中的高沸点成分。
[0013]
鉴于上述问题,本发明的目的在于提供能够抑制高沸点成分的生成,并且在温和的条件下简便且收率良好地制造环状半缩醛化合物的方法。
[0014]
用于解决课题的手段
[0015]
本发明人等发现,通过在将具有不饱和键的特定的醇加氢甲酰化来制造特定的环
状半缩醛化合物时采用特定的反应条件,能够解决上述课题,并基于该见解进一步进行反复研究,从而完成了本发明。
[0016]
即,本申请公开涉及以下内容。
[0017]
[1]一种制造方法,其特征在于,是通过在第8族~第10族的过渡金属化合物、亚磷酸三酯配体和碱的存在下,使由下述通式(i)表示的具有不饱和键的醇(以下,有时称为“不饱和醇(i)”)、一氧化碳和氢反应来制造由下述通式(ii)表示的半缩醛化合物(以下,有时称为“环状半缩醛化合物(ii)”)的方法,由下述式(1)表示的a值为0.0~4.0,由下述式(2)表示的b值为0.6~1.0。
[0018]
[化学式1]
[0019][0020]
(通式(i)中,r1~r5各自独立地表示选自氢原子、任选具有取代基的碳原子数1~6的烷基和任选具有取代基的碳原子数6~12的芳基中的1种。n表示1或2。)
[0021]
[化学式2]
[0022][0023]
(通式(ii)中,r1~r5和n如上所述。)
[0024]
[数学式1]
[0025][0026]
[数学式2]
[0027][0028]
(式(1)和(2)中,t表示反应温度(k),x表示反应体系内的碱的浓度(mm)(其中,x≤500),[m]表示反应体系内的来自于第8族~第10族的过渡金属化合物的第8族~第10族的过渡金属原子的浓度(mm),t在间歇反应中表示反应时间(hr),在连续反应中表示滞留时间(hr)。)
[0029]
[2]根据[1]中记载的制造方法,其中,上述第8族~第10族的过渡金属化合物为铑化合物。
[0030]
[3]根据[1]或[2]中记载的制造方法,其中,在上述通式(i)中,r1和r2为氢原子。
[0031]
[4]根据[1]~[3]中任一项记载的制造方法,其中,由上述通式(i)表示的具有不饱和键的醇为甲基烯丙醇或3-甲基-3-丁烯-1-醇。
[0032]
[5]根据[1]~[4]中任一项记载的制造方法,其中,上述亚磷酸三酯配体为亚磷酸三芳基酯。
[0033]
[6]根据[1]~[4]中任一项记载的制造方法,其中,上述亚磷酸三酯配体由下述通式(iii)表示。
[0034]
[化学式3]
[0035][0036]
(通式(iii)中,r6和r7各自独立地表示选自氢原子和任选具有取代基的碳原子数1~6的烷基中的1种。)
[0037]
[7]根据[1]~[6]中任一项记载的制造方法,其中,上述碱为叔胺。
[0038]
发明的效果
[0039]
根据本发明,提供能够抑制高沸点成分的生成,并且在温和的条件下简便且收率良好地制造环状半缩醛化合物的方法。
具体实施方式
[0040]
在用于制造环状半缩醛化合物(ii)的本发明的方法中,在第8族~第10族的过渡金属化合物、亚磷酸三酯配体和碱的存在下,使不饱和醇(i)、一氧化碳和氢反应(以下,有时将该反应称为“加氢甲酰化反应”)。并且,在本发明的方法中,由下述式(1)表示的a值为0.0~4.0,由下述式(2)表示的b值为0.6~1.0。
[0041]
[数学式3]
[0042][0043]
[数学式4]
[0044][0045]
上述式(1)和式(2)中,t表示反应温度(k),x表示反应体系内的碱的浓度(mm)(其中,x≤500),[m]表示反应体系内的来自于第8族~第10族的过渡金属化合物的第8族~第10族的过渡金属原子的浓度(mm),t在间歇反应中表示反应时间(hr),在连续反应中表示滞留时间(hr)。
[0046]
·
a值和b值
[0047]
由上述式(1)表示的a值与环状半缩醛化合物(ii)的选择率相关,存在a值越低则环状半缩醛化合物(ii)的选择率越高的趋势。在本发明中,a值需要在0.0~4.0的范围内,由此,能够抑制反应混合液中所含的高沸点成分的生成。如果a值超过4.0,则反应混合液中
所含的高沸点成分的含量变多,催化剂的再利用可能变得困难。从这样的观点考虑,优选a值为3.5以下,更优选为3.0以下,进一步优选为2.5以下,特别优选为2.2以下。
[0048]
a值是反应温度t(单位:k)与反应体系内的碱的浓度x(单位:mm)的函数。例如,如果提高反应温度t,则a值变大,如果提高碱的浓度x,则a值变小。
[0049]
由上述式(2)表示的b值与不饱和醇(i)的转化率相关,存在b值越高则不饱和醇(i)的转化率越高的趋势。在本发明中,b值需要为0.6~1.0,由此,能够抑制反应混合液中所含的高沸点成分的生成,并且收率良好地得到目标环状半缩醛化合物(ii)。如果b值小于0.6,则不饱和醇(i)的转化率降低,目标环状半缩醛化合物(ii)的收率降低。从这样的观点考虑,优选b值为0.70以上,更优选为0.75以上,进一步优选为0.80以上。
[0050]
b值是反应温度t(单位:k)、反应体系内的碱的浓度x(单位:mm)、反应体系内的来自于第8族~第10族的过渡金属化合物的第8族~第10族的过渡金属原子的浓度[m](单位:mm)以及反应时间或滞留时间t(单位:hr)的函数。例如,如果提高反应温度t、反应体系内的来自于第8族~第10族的过渡金属化合物的第8族~第10族的过渡金属原子的浓度[m],则b值变大。另外,延长反应时间或滞留时间t,b值也容易变大。另一方面,如果提高反应体系内的碱的浓度x,则b值有变小的趋势。
[0051]
需要说明的是,在上述式(1)和(2)中,在反应温度不恒定的情况下,将各反应温度以时间加权的平均值作为反应温度t即可。例如,在温度t1(k)下反应2小时之后在温度t2(k)下反应1小时的情况下,将其平均值(t1
×
2+t2
×
1)/3作为反应温度t即可。同样地,在反应体系内的碱的浓度x和/或反应体系内的来自于第8族~第10族的过渡金属化合物的第8族~第10族的过渡金属原子的浓度[m]不恒定的情况下,分别将各浓度以时间加权的平均值作为这些浓度x或浓度[m]即可。另外,间歇反应中的反应时间t通常相当于加氢甲酰化反应所需的总时间,在中途中断反应的情况下,将除去该中断的时间的实际的反应时间的总计时间作为反应时间t即可,对于连续反应中的滞留时间t也是同样。
[0052]
·
环状半缩醛化合物(ii)
[0053]
通过本发明的制造方法得到的环状半缩醛化合物(ii)由下述通式(ii)表示。
[0054]
[化学式4]
[0055][0056]
通式(ii)中,r1~r5各自独立地表示选自氢原子、任选具有取代基的碳原子数1~6的烷基和任选具有取代基的碳原子数6~12的芳基中的1种。n表示1或2。需要说明的是,在n为2的情况下,存在的多个r4和r5分别可以彼此相同,也可以不同。
[0057]
作为碳原子数1~6的烷基,例如可举出甲基、乙基、丙基、异丙基、丁基、异丁基、仲丁基、叔丁基、戊基、己基、环戊基、环己基等。其中,从反应活性的观点考虑,优选甲基、乙基,更优选甲基。
[0058]
作为碳原子数6~12的芳基,例如可举出苯基、甲苯基、1-萘基、2-萘基等。其中,优选苯基。
[0059]
作为碳原子数1~6的烷基和碳原子数6~12的芳基任选具有的取代基,例如可举出羟基;甲氧基、乙氧基、丙氧基、丁氧基、异丁氧基、仲丁氧基、叔丁氧基、环戊氧基、环己氧基、2-甲氧基乙氧基、2-乙氧基乙氧基、呋喃基、四氢呋喃基、四氢吡喃基、苯氧基、苄氧基、联苯氧基、萘氧基等烷氧基或醚基;乙酰基、苯甲酰基等酮基;甲酰基等醛基;羧酸基及其金属盐;乙酰氧基、苯甲酰氧基等酰氧基;甲氧基羰基氧基、苯氧基羰基氧基等碳酸酯基;氰基;甲基硫基、苯基硫基等硫醚基;甲基亚磺酰基、苯基亚磺酰基等亚砜基;甲基磺酰基、苯基磺酰基等磺酰基;磺酸基及其金属盐;三甲基甲硅烷基、三苯基甲硅烷基等甲硅烷基;二甲基膦基、二丁基膦基、二苯基膦基等膦基;氧代二甲基膦基、氧代二丁基膦基、氧代二苯基膦基等氧化膦基;膦酸基及其金属盐;氯基、溴基等卤素基团等。
[0060]
作为环状半缩醛化合物(ii)的具体例,可举出2-羟基四氢呋喃、2-羟基-4-甲基四氢呋喃、2-羟基-3-甲基四氢呋喃、2-羟基-3,3-二甲基四氢呋喃、2-羟基-3-乙基四氢呋喃、2-羟基-4-乙基四氢呋喃、2-羟基-3-苯基四氢呋喃、2-羟基-4-苯基四氢呋喃、2-羟基四氢吡喃、2-羟基-3-甲基四氢吡喃、2-羟基-4-甲基四氢吡喃、2-羟基-5-甲基四氢吡喃等。
[0061]
·
不饱和醇(i)
[0062]
本发明中使用的不饱和醇(i)由下述通式(i)表示。
[0063]
[化学式5]
[0064][0065]
通式(i)中,r1~r5各自独立地表示选自氢原子、任选具有取代基的碳原子数1~6的烷基和任选具有取代基的碳原子数6~12的芳基中的1种。n表示1或2。需要说明的是,在n为2的情况下,存在的多个r4和r5分别可以彼此相同,也可以不同。
[0066]
作为碳原子数1~6的烷基,可举出与作为上述通式(ii)中的r1~r5所表示的碳原子数1~6的烷基而例示的烷基相同的烷基。其中,从反应活性的观点考虑,优选甲基、乙基,更优选甲基。
[0067]
作为碳原子数6~12的芳基,可举出与作为上述通式(ii)中的r1~r5所表示的碳原子数6~12的芳基而例示的芳基相同的芳基。其中,优选苯基。
[0068]
作为碳原子数1~6的烷基和碳原子数6~12的芳基任选具有的取代基,可举出与作为上述通式(ii)中的r1~r5所表示的碳原子数1~6的烷基和碳原子数6~12的芳基任选具有的取代基而例示的取代基相同的取代基。
[0069]
在上述通式(i)中,从反应活性的观点考虑,优选r1和r2为氢原子。在上述通式(i)中,优选r3为任选具有取代基的碳原子数1~6的烷基,更优选为不具有取代基的碳原子数1~6的烷基,进一步优选为甲基。在上述通式(i)中,优选r4和r5为氢原子。
[0070]
作为不饱和醇(i)的具体例,可举出烯丙醇、甲基烯丙醇、2-丁烯-1-醇、3-甲基-2-丁烯-1-醇、2-戊烯-1-醇、2-乙基-2-丙烯-1-醇、3-苯基-2-丙烯-1-醇、2-苯基-2-丙烯-1-醇、3-丁烯-1-醇、3-戊烯-1-醇、3-甲基-3-丁烯-1-醇、2-甲基-3-丁烯-1-醇。其中,从反应活性的观点考虑,优选甲基烯丙醇、3-甲基-3-丁烯-1-醇,更优选甲基烯丙醇。
[0071]
·
第8族~第10族的过渡金属化合物
[0072]
本发明中使用的第8族~第10族的过渡金属化合物是含有周期表第8族~第10族的过渡金属的化合物,其本身可以具有加氢甲酰化反应的催化能力,也可以是后述的亚磷酸三酯配体进行配位等而作为加氢甲酰化反应的催化剂发挥功能的化合物。作为第8族~第10族的过渡金属化合物,例如可举出铑化合物、钴化合物、钌化合物、铱化合物等。从反应活性的观点考虑,优选铑化合物、钴化合物,特别优选铑化合物。
[0073]
作为铑化合物,可以使用具有加氢甲酰化反应的催化能力,或者在加氢甲酰化反应条件下变化为具有加氢甲酰化反应的催化能力的任意的铑化合物。作为该铑化合物的具体例,例如可举出rh4(co)
12
、rh6(co)
16
、rh(acac)(co)2、氧化铑、氯化铑、乙酰丙酮铑、乙酸铑等。这些铑化合物可以使用市售品,也可以使用硝酸铑、硫酸铑、三氯化铑、氧化铑等无机铑化合物;乙酸铑等铑有机酸盐;铑的各种盐、羰基化合物等并通过公知的方法进行合成。
[0074]
在进行加氢甲酰化反应时,第8族~第10族的过渡金属化合物的浓度以该过渡金属化合物中所含的第8族~第10族的过渡金属原子换算,优选设定为0.01~0.30mm的低浓度的浓度范围,更优选设定为0.02~0.15mm的范围。
[0075]
·
亚磷酸三酯配体
[0076]
本发明中使用的亚磷酸三酯配体没有特别限制,但从反应活性的观点考虑,优选亚磷酸三芳基酯,更优选由下述通式(iii)表示的亚磷酸三酯配体。
[0077]
[化学式6]
[0078][0079]
通式(iii)中,r6和r7各自独立地表示选自氢原子和任选具有取代基的碳原子数1~6的烷基中的1种。需要说明的是,存在的多个r6和r7分别可以彼此相同,也可以不同,优选彼此相同。
[0080]
作为碳原子数1~6的烷基,可举出与作为上述通式(ii)中的r1~r5所表示的碳原子数1~6的烷基而例示的烷基相同的烷基。作为碳原子数1~6的烷基任选具有的取代基,可举出与作为上述通式(ii)中的r1~r5所表示的碳原子数1~6的烷基和碳原子数6~12的芳基任选具有的取代基而例示的取代基相同的取代基。从反应活性的观点考虑,r6和r7分别优选任选具有取代基的碳原子数1~6的烷基,更优选不具有取代基的碳原子数1~6的烷基,进一步优选甲基、叔丁基、乙基。
[0081]
作为上述亚磷酸三酯配体的具体例,例如可举出三(2-甲基苯基)亚磷酸酯、三(2,6-二甲基苯基)亚磷酸酯、三(2-异丙基苯基)亚磷酸酯、三(2-苯基苯基)亚磷酸酯、三(2-叔
丁基苯基)亚磷酸酯、三(2-叔丁基-5-甲基苯基)亚磷酸酯、三(2,4-二叔丁基苯基)亚磷酸酯、三(2-叔丁基-4-甲基苯基)亚磷酸酯、双(2-甲基苯基)(2-叔丁基苯基)亚磷酸酯、双(2-叔丁基苯基)(2-甲基苯基)亚磷酸酯等。其中,从工业上实施本发明的方面考虑,优选三(2-叔丁基-4-甲基苯基)亚磷酸酯、三(2-叔丁基苯基)亚磷酸酯、三(2-叔丁基-5-甲基苯基)亚磷酸酯、三(2,4-二叔丁基苯基)亚磷酸酯。
[0082]
需要说明的是,亚磷酸三酯配体可以仅使用1种,也可以并用2种以上。
[0083]
相对于第8族~第10族的过渡金属化合物中所含的第8族~第10族的过渡金属1原子优选以磷原子换算在10~200摩尔倍的范围内使用亚磷酸三酯配体。如果亚磷酸三酯配体的使用量为上述下限以上,则能够提高加氢甲酰化反应中的选择率,并且从反应混合液中蒸发分离产物时可以抑制催化剂的热老化,能够抑制催化活性的降低。另外,如果亚磷酸三酯配体的使用量为上述上限以下,则能够抑制加氢甲酰化反应的速度降低。
[0084]
·
碱
[0085]
在本发明中,通过在碱的存在下进行加氢甲酰化反应,能够抑制高沸点成分的生成,提高目标环状半缩醛化合物(ii)的收率。作为碱,例如可举出氢氧化钠、氢氧化钾、碳酸钠、碳酸钾、碳酸氢钠、碳酸氢钾等无机碱;叔胺、吡啶化合物、喹啉化合物、咪唑化合物等有机碱。其中,优选有机碱,更优选叔胺。
[0086]
作为叔胺,例如可举出三乙胺、三丙胺、三辛胺、二甲基苄基胺、二甲基环己胺、甲基二环己胺、二甲基辛胺、二甲基十二烷基胺等单胺;四甲基乙二胺、四甲基丙二胺、四甲基六亚甲基二胺、三亚乙基二胺、双(二甲基氨基乙基)醚、n,n
’-
二甲基哌嗪、四甲基甲苯二胺等二胺;五甲基二亚乙基三胺等三胺等。叔胺可以具有烷基、芳基、环烷基、羟基烷基等取代基,例如可以为甲基二乙醇胺、三乙醇胺、甲基二异丙醇胺、三异丙醇胺等氨基醇。优选叔胺为单胺、氨基醇,更优选三辛胺、三乙醇胺。
[0087]
作为吡啶化合物,例如可举出吡啶、甲基吡啶、二甲基吡啶、苯基吡啶、烟酸等。作为喹啉化合物,例如可举出喹啉、异喹啉、甲基喹啉、苯基喹啉等。作为咪唑化合物,例如可举出咪唑、n-甲基咪唑、1,2-二甲基咪唑、1-异丁基-2-甲基咪唑、1-苄基-2-甲基咪唑、苯并咪唑等。
[0088]
碱只要在进行不饱和醇(i)的加氢甲酰化反应之前添加到反应液中即可,具体的添加方法没有特别限制。对于碱而言,除了考虑反应结果以外,还要考虑制造成本等,在a值和b值满足本发明的规定的范围内,以反应体系内的碱的浓度成为500mm(毫摩尔/升)以下的方式使用即可,优选以成为200mm以下的方式使用,更优选以成为150mm以下的方式使用,可以设为80mm以下,进一步可以设为50mm以下,另外,优选以成为1mm以上的方式使用,更优选以成为5mm以上的方式使用,可以设为10mm以上、20mm以上、进一步可以设为30mm以上。通过使反应体系内的碱的浓度为上述上限以下,能够更有效地抑制反应速度的降低,另外,通过为上述下限以上,能够更有效地抑制高沸点成分的生成。
[0089]
·
加氢甲酰化反应
[0090]
加氢甲酰化反应的反应温度优选60~150℃的范围,更优选70~120℃的范围,进一步优选80~110℃的范围。如果反应温度为60℃以上,则反应速度变大,另一方面,如果反应温度为150℃以下,则容易维持催化剂的稳定性。另外,反应时间(在连续反应中为滞留时间)优选为2~12小时,更优选为3~6小时。
[0091]
一氧化碳和氢例如可以以它们的混合气体的形式使用。在该混合气体中,作为进入气体组成,氢/一氧化碳的摩尔比可以从1/5~5/1的范围中选择。需要说明的是,反应体系中可以少量存在对加氢甲酰化反应非活性的气体,例如甲烷、乙烷、丙烷、氮、氦、氩等。
[0092]
反应压力也取决于反应温度,优选为5~20mpag(表压)的范围,更优选为7~15mpag的范围,进一步优选为8~10mpag的范围。如果反应压力为5mpag以上,则能够提高加氢甲酰化反应中的环状半缩醛化合物(ii)的选择率。另一方面,从反应中使用的装置和操作性的观点考虑,将反应压力保持在20mpag以下来实施反应在工业上是有利的。反应可以在搅拌型反应槽或气泡塔型反应槽中以间歇方式或连续方式进行。
[0093]
加氢甲酰化反应可以在不存在溶剂的条件下实施,也可以在非活性的溶剂的存在下进行。作为该溶剂,例如可举出乙醇、丁醇、乙二醇等醇;己烷、庚烷、辛烷等饱和脂肪族烃;苯、甲苯、二甲苯、枯烯、假枯烯、乙苯等芳香族烃;四氢呋喃等醚等。
[0094]
通过加氢甲酰化反应生成的环状半缩醛化合物(ii)例如可以通过使反应混合液在减压下蒸发而与催化剂分离。然后,使用蒸馏等公知的方法将通过蒸发得到的包含环状半缩醛化合物(ii)的馏分进行纯化,从而能够分离出环状半缩醛化合物(ii)。
[0095]
需要说明的是,可以将蒸发残渣中所含的第8族~第10族的过渡金属化合物(可以是配位有亚磷酸三酯配体的过渡金属化合物)的全部或一部分再次循环至加氢甲酰化反应从而再使用。特别是由于铑化合物极其昂贵,所以铑化合物的循环再使用在工业上是有利的。
[0096]
在加氢甲酰化反应后得到的反应混合液中,除了存在目标环状半缩醛化合物(ii)以外,还可以存在未反应原料、溶剂、低沸点或高沸点的副产物等。在此,低沸点的副产物是指沸点低于目标环状半缩醛化合物(ii)的化合物,例如可举出通过作为原料的不饱和醇(i)的氢化而生成的饱和醇、通过异构化而生成的醛化合物等。另外,高沸点的副产物是指沸点高于目标环状半缩醛化合物(ii)的化合物,例如可举出半缩醛与醇反应而生成的缩醛化合物等。
[0097]
通常,高沸点的副产物具有高粘性的情况较多,在如上述那样将蒸发残渣中所含的第8族~第10族的过渡金属化合物(可以是配位有亚磷酸三酯配体的过渡金属化合物)的全部或一部分再次循环至加氢甲酰化反应而再使用的情况下等,如果还基于目标环状半缩醛化合物的回收率的观点,则优选高沸点的副产物的含量尽可能低。
[0098]
根据本发明的环状半缩醛化合物(ii)的制造方法,通过使上述的式(1)和式(2)所规定的a值和b值在上述范围内,能够抑制反应混合液中所含的特定的高沸点成分的生成,因此催化剂的再利用变得容易。由此,能够更简便且收率良好地制造目标环状半缩醛化合物(ii)。
[0099]
实施例
[0100]
以下,通过实施例具体说明本发明,但本发明不受这些例子任何限定。需要说明的是,在本实施例中,气相色谱分析和高效液相色谱分析在以下条件下进行,环状半缩醛化合物(ii)的收率或高沸点的副产物的生成量通过基于标准曲线法的内标法求出。
[0101]
[气相色谱分析的条件]
[0102]
分析设备:gc-2014(株式会社岛津制作所制)
[0103]
检测器:fid(氢火焰离子化型检测器)
[0104]
柱:db-wax(长度30m,膜厚0.25μm,内径0.25mm)(agilent technologies株式会社制)
[0105]
分析条件:injection(注射)温度:250℃,detection(检测)温度:250℃
[0106]
升温条件:50℃(保持2分钟)
→
(以8℃/分钟升温)
→
160℃(保持5分钟)
→
(以15℃/分钟升温)
→
240℃(保持5分钟)
[0107]
[高效液相色谱分析的条件]
[0108]
检测器:差示折射率(ri)检测器
[0109]
柱:chemcosorb 5si(4.6mm
×
250mm)(株式会社chemco plus制)
[0110]
洗脱液:四氢呋喃/己烷=1/1(vol/vol)
[0111]
流速:1ml/分钟
[0112]
<实施例1>
[0113]
在氮气氛下,制备使作为亚磷酸三酯配体的三(2-叔丁基-4-甲基苯基)亚磷酸酯2.8g(5.4mmol)和作为第8族~第10族的过渡金属化合物的rh(acac)(co)215.5mg(0.060mmol)溶解于甲苯150ml而成的混合溶液(以下,将其称为“催化剂液a”)。
[0114]
在氮气氛下,向具备气体导入口和取样口的内容积100ml的电磁搅拌式高压釜中加入3.0ml的催化剂液a和作为碱的三乙醇胺0.89g(6.0mmol)、作为不饱和醇(i)的甲基烯丙醇49g(0.68mol)(以下,将其称为“反应原液a”)。此时的反应原液a中的rh浓度为0.02mm,亚磷酸三酯配体的浓度为1.8mm,碱(三乙醇胺)的浓度为100mm。
[0115]
将高压釜内用一氧化碳:氢=1:1(摩尔比)的混合气体控制为5mpag之后,一边搅拌一边历时30分钟进行升温,使高压釜内的温度达到110℃。接下来,升压至总压为9.8mpag之后,使其反应5小时,得到反应混合液。反应中,始终供给一氧化碳:氢=1:1(摩尔比)的混合气体,使反应体系内的压力保持恒定。a值为1.9,b值为0.77。
[0116]
用气相色谱来分析所得到的反应混合液,结果甲基烯丙醇的转化率为99%,作为环状半缩醛化合物(ii)的2-羟基-4-甲基四氢呋喃的收率为87%。
[0117]
<参考例>
[0118]
将实施例1中得到的反应混合液的一部分浓缩,蒸馏除去沸点低于环状半缩醛化合物(ii)(2-羟基-4-甲基四氢呋喃)的化合物,将残渣用硅胶色谱纯化。展开剂使用乙酸乙酯/己烷=1/1(vol/vol)的混合溶剂。由此得到特定的高沸点的副产物(以下,称为高沸点成分i)。使用高沸点成分i通过液相色谱对实施例1中得到的反应混合液进行分析,结果含有1.0质量%的高沸点成分i。
[0119]
<实施例2和比较例1、2>
[0120]
将碱(三乙醇胺)的浓度、反应温度和反应时间变更为表1所示那样,除此以外,在与实施例1同样的条件下进行甲基烯丙醇的加氢甲酰化反应。将此时的a值、b值和反应结果示于表2。
[0121]
[表1]
[0122]
表1
[0123][0124]
[表2]
[0125]
表2
[0126][0127]
*1:将通过单次蒸发从反应混合液中除去环状半缩醛化合物(ii)之后的包含rh催化剂的残渣作为催化剂再利用,进一步进行4次(总计5次)加氢甲酰化反应之后进行单次蒸发时的环状半缩醛化合物(ii)的回收率
[0128]
需要说明的是,该回收率按照以下的基准进行评价。
[0129]
a:90%以上
[0130]
b:80%以上且小于90%
[0131]
c:小于80%
[0132]
可知在a值和b值满足本发明的规定的实施例1和2中,甲基烯丙醇的转化率高,环状半缩醛化合物(ii)的收率也高。另外,可知高沸点成分i的生成量少,再利用催化剂之后进行单次蒸发时的环状半缩醛化合物(ii)的回收率高。另一方面,可知在b值不满足本发明的规定的比较例1中,甲基烯丙醇的转化率低至32%,环状半缩醛化合物(ii)的收率也低至28%。另外,可知在a值不满足本发明的规定的比较例2中,高沸点成分i的生成量高达3.7质量%,将催化剂再利用之后进行单次蒸发时的环状半缩醛化合物(ii)的回收率低。
[0133]
<实施例3>
[0134]
在氮气氛下,制备使作为亚磷酸三酯配体的三(2-叔丁基-4-甲基苯基)亚磷酸酯16.9g(32mmol)和作为第8族~第10族的过渡金属化合物的rh(acac)(co)292.9mg(0.36mmol)溶解于甲苯150ml而成的混合溶液(以下,将其称为“催化剂液b”)。
[0135]
在氮气氛下,向具备气体导入口、取样口、进料泵和气液分离管的内容积100ml的电磁搅拌式高压釜中加入3.0ml的催化剂液b和作为碱的三乙醇胺90mg(0.60mmol)、作为不饱和醇(i)的甲基烯丙醇49g(0.68mol)(以下,将其称为“反应原液b”)。此时的反应原液b中的rh浓度为0.12mm,亚磷酸三酯配体的浓度为11mm,碱(三乙醇胺)的浓度为10mm。
[0136]
将高压釜内用一氧化碳:氢=1:1(摩尔比)的混合气体控制为5mpag之后,一边搅拌一边历时30分钟进行升温,使高压釜内的温度达到90℃。接下来,将总压升压至9mpag之后,使其反应1小时。反应中,始终供给一氧化碳:氢=1:1(摩尔比)的混合气体,使反应体系内的压力保持恒定。
[0137]
接下来,将催化剂液b、甲基烯丙醇和三乙醇胺分别以0.75ml/hr、12.3g/hr、
22.5mg/hr的速度进料,以反应器内的液体保持60ml的方式使反应混合液从反应器馏出到气液分离管中从而得到反应混合液。此时的滞留时间为4小时。另外,a值为2.4,b值为0.88。
[0138]
用气相色谱来分析所得到的反应混合液,结果甲基烯丙醇的转化率为78%,作为环状半缩醛化合物(ii)的2-羟基-4-甲基四氢呋喃的收率为70%。另外,含有1.3质量%的高沸点成分i。
[0139]
<比较例3>
[0140]
将亚磷酸三酯配体(三(2-叔丁基-4-甲基苯基)亚磷酸酯)的浓度、rh浓度、碱(三乙醇胺)的浓度和反应温度变更为如表3所示,除此以外,在与实施例3同样的条件下进行甲基烯丙醇的加氢甲酰化反应。将此时的a值、b值和反应结果示于表4。
[0141]
[表3]
[0142]
表3
[0143][0144]
[表4]
[0145]
表4
[0146][0147]
*2:将通过单次蒸发从反应混合液中除去环状半缩醛化合物(ii)之后的包含rh催化剂的残渣作为催化剂再利用,进一步进行4次(总计5次)加氢甲酰化反应之后进行单次蒸发时的环状半缩醛化合物(ii)的回收率
[0148]
需要说明的是,该回收率按照以下的基准进行评价。
[0149]
a:90%以上
[0150]
b:80%以上且小于90%
[0151]
c:小于80%
[0152]
可知在a值和b值满足本发明的规定的实施例3中,甲基烯丙醇的转化率高,环状半缩醛化合物(ii)的收率也高。另外,可知高沸点成分i的生成量少,再利用催化剂之后进行单次蒸发时的环状半缩醛化合物(ii)的回收率高。另一方面,在a值不满足本发明的规定的比较例3中,高沸点成分i的生成量高达5.5质量%,将催化剂再利用之后进行单次蒸发时的环状半缩醛化合物(ii)的回收率低。
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询

tips


 商标分类
商标分类  商标转让
商标转让 



