一株诱变嘴突凸脐蠕孢菌及其在防治千金子中的应用的制作方法
 2021-02-02 08:02:20|
2021-02-02 08:02:20| 418|
418| 起点商标网
起点商标网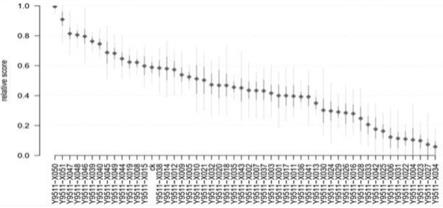
y9511-x050,保藏编号为gdmcc no:60804,于2019年10月8日保藏于广东省广州市先烈 中路100号大院59号楼5楼的广东省微生物菌种保藏中心(简称gdmcc)。
[0011]
本发明还提供一种上述诱变嘴突凸脐蠕孢菌的孢子。
[0012]
所述的诱变嘴突凸脐蠕孢菌的孢子的制备方法,包括如下步骤:将诱变嘴突凸脐蠕孢菌 接种到pda培养基上,于28℃~30℃下进行培养,然后过滤去除菌丝,得到诱变嘴突凸脐 蠕孢菌的孢子。
[0013]
所述的培养的温度优选为28℃。
[0014]
所述的培养的时间优选为14天。
[0015]
所述的过滤为用纱布进行过滤;优选为用四层纱布进行过滤。
[0016]
所述的诱变嘴突凸脐蠕孢菌或所述的诱变嘴突凸脐蠕孢菌的孢子在制备生物除草剂中的 应用。
[0017]
所述的草为千金子属杂草;优选为水稻田千金子。
[0018]
一种用于千金子生物防治的生物制剂,其活性成分为上述诱变嘴突凸脐蠕孢菌和/或上述 诱变嘴突凸脐蠕孢菌的孢子。
[0019]
所述的生物制剂中诱变嘴突凸脐蠕孢菌的孢子的浓度为105~107孢子/ml;优选为106孢 子/ml。
[0020]
所述的生物制剂中还可以含有农药学上可以接受的载体;所述的载体包括乳化剂和水等。
[0021]
所述的乳化剂优选为吐温80。
[0022]
所述的乳化剂在所述生物制剂中的浓度为体积百分比0.5
‰
。
[0023]
所述的诱变嘴突凸脐蠕孢菌,诱变嘴突凸脐蠕孢菌的孢子,和/或用于千金子生物防治的 生物制剂在防治千金子中的应用。
[0024]
本发明相对于现有技术具有如下的优点及效果:
[0025]
(1)为了解决现有技术中化学防治存在的污染环境、不安全的问题,本发明提供一种诱 变嘴突凸脐蠕孢菌菌株y9511-x050,该菌株是从水稻田千金子叶片上分离的y9511菌株通 过化学诱变得到的,对水稻安全无害,且对千金子具有防治作用,在运用中具有安全性,适 用于稻田千金子的生物防治。
[0026]
(2)使用方法简单实用:将嘴突凸脐蠕孢菌y9511-x050制成水乳剂,工艺简单实用。
[0027]
(3)防治效果显著且稳定:嘴突凸脐蠕孢菌y9511-x050菌株孢子悬液对处于二叶一心 时期的千金子具有显著地防除效果,盆栽试验病情指数达99%以上。
附图说明
[0028]
利用附图对发明创造作进一步说明,但附图中的实施例不构成对本发明创造的任何限制, 对于本领域的普通技术人员,在不付出创造性劳动的前提下,还可以根据以下附图获得其它 的附图。
[0029]
图1是本发明的嘴突凸脐蠕孢菌株y9511经化学诱变后,通过考虑四个指标相同的权重, 利用最大主成分排序并将序数将序数一一映射,筛选最佳诱变菌株。
[0030]
图2是本发明的嘴突凸脐蠕孢菌菌株y9511-x050与出发菌株y9511的孢子形态图;
其 中,图a为嘴突凸脐蠕孢菌菌株y9511;图b为嘴突凸脐蠕孢菌菌株y9511-x050。
[0031]
图3是本发明的嘴突凸脐蠕孢菌菌株y9511-x050与出发菌株y9511的菌丝形态图;其 中,图a为嘴突凸脐蠕孢菌株y9511;图b为嘴突凸脐蠕孢菌菌株y9511-x050。
[0032]
图4是本发明的嘴突凸脐蠕孢菌菌株y9511-x050与出发菌株y9511的菌落形态图;其 中,图a为嘴突凸脐蠕孢菌菌株y9511;图b为嘴突凸脐蠕孢菌菌株y9511-x050。
[0033]
图5是本发明的嘴突凸脐蠕孢菌菌株y9511-x050与出发菌株y9511的对水稻安全性图; 其中,图a为嘴突凸脐蠕孢菌菌株y9511;图b为嘴突凸脐蠕孢菌菌株y9511-x050。
具体实施方式
[0034]
结合以下实施例对本发明作进一步描述。
[0035]
下面结合实施例对本发明作进一步详细的描述,但本发明的实施方式不限于此。除非特 别说明,本发明采用的试剂、方法和设备为本技术领域常规试剂、方法和设备。除非特别说 明,本发明所用试剂、培养基等均可通过市售获得;其中:
[0036]
pda培养基配方为:马铃薯葡萄糖琼脂(pda)40.1g,5g琼脂,用1l水溶解。
[0037]
马铃薯蔗糖液体培养基配方为:取马铃薯250g,冷水煮沸后用纱布过滤,获得滤液,定 容至1000ml。
[0038]
实施例1嘴突凸脐蠕孢菌菌株的诱变筛选
[0039]
一、嘴突凸脐蠕孢菌的诱变最佳时间筛选
[0040]
用取样器挑取平板上培养了5d,菌落周边长势较旺盛处的嘴突凸脐蠕孢菌y9511的菌丝 体,接入装有适量玻璃珠的马铃薯蔗糖液体培养基中,28℃摇床培养48h,转速200r/min。 取出后,吸取10ml菌液于无菌研磨器中充分研磨,即获得菌丝体悬液。取0.2mol/l ph4.6的 醋酸缓冲液2ml于试管中,加入1ml菌丝体悬液后摇匀,立即加入1ml 0.2mol/l亚硝酸钠溶 液混合均匀,使亚硝酸的处理浓度为0.05mol/l,室温下分别作用5min、10min、15min、20min、 25min、30min、35min、40min,时间到后加入0.07mol/l ph 8.6na2hpo4溶液2ml以终止反 应,分别吸取不同处理的菌液0.1ml涂布于pda平板,每组4个平行样,以未经化学诱变的菌 丝悬浮液作对照,28℃黑暗条件下培养至少3d(天)后,计算其致死率,以免菌落长大后,菌 丝体相互交联影响计数,并根据致死率确定较优诱变时间范围。待最佳诱变时间范围内的菌落 长出后,用无菌玻璃打孔器沿菌落外缘长势旺盛处取等量菌块,转接于pda平板中心位置, 选育出51个菌株,编号为y9511-x001、y9511-x002、y9511-x003
……
y9511-x049、 y9511-x050、y9511-x051。
[0041]
表1化学诱变最佳时间范围与死亡率的关系
[0042][0043]
注:表中数据为平均值
±
标准误,不同大小写字母代表具有显著性差异p<0.05(下同)。
[0044]
如表1,当化学诱变时间为20min时,诱变致死率为75%(诱变致死率在70%-80%之间, 为最佳致死率),故选择20min为最佳诱变时间。
[0045]
二、高致病力诱变嘴突凸脐蠕孢菌菌株的筛选
[0046]
通过分析初始菌株与诱变菌株四个指标:1、在平板上生长第1d-第4d菌落直径;2、第 14d产孢量;3、离体叶片病斑大小;4、第7d病情指数。挑选生长快、产孢多(与)、感病 快、病斑大的菌株,接种斜面。斜面4℃保藏,以备复筛。
[0047]
菌落直径:用尺子测量(表2,3,4,5);
[0048]
产孢量:血球计数器在显微镜下测量孢子数(表6);
[0049]
离体叶片病斑大小:在离体叶片上接种孢子悬液3d后测量病斑大小(表7);
[0050]
病情指数:将51个诱变株在pda上培养14天后,用0.5
‰
(v/v)的吐温80水溶液从培养 皿中洗下,再用四层纱布滤除菌丝得到孢子悬液,配制孢子悬浮液的浓度为1.0
×
106孢子/ml (用血球计数板计数),喷于两至三叶一心期的活体千金子上,用出发菌株作为对照,将处 理过的活体千金子保湿培养48h后,再移入温室中生长,每个处理4次重复。7d后分级并调 查发病情况,最后计算病情指数并记录,作为菌株活体致病力的测定结果。如表8所示(表 中仅列出致病力显著高于出发菌株的数据)。
[0051]
千金子病害分级标准:
[0052]
0级:全株无病,叶片上无斑点;
[0053]
1级:仅有小的针尖大小的褐点;
[0054]
2级:全株叶片上有较大褐点,并有约1~2mm的典型或椭圆形坏死病斑均匀分布在叶 片上,大约占叶面积2%;
[0055]
3级:全株有典型病斑,侵染面积小于10%;
[0056]
4级:全株有典型病斑,侵染面积约占10%~50%;
[0057]
5级:全株有典型病斑,侵染面积约占51%~75%;
[0058]
6级:全株有典型病斑,全部叶片死亡。
[0059][0060]
式中,i表示病级,n表示植株发病为i级的株数,n表示调查总株 数,6表示植株发病最高级。表2出发菌株与51个诱变菌株在pda培养基上第1d的菌落 生长差异性显著分析
[0061]
注:表中数据为平均值
±
标准误,不同大小写字母代表具有显著性差异p<0.05。
[0062]
表2出发菌株与51个诱变菌株在pda培养基上第1d的菌落生长差异性显著分析
[0063][0064]
注:表中数据为平均值
±
标准误,不同大小写字母代表具有显著性差异p<0.05。
[0065]
表3出发菌株与51个诱变菌株在pda培养基上第2d的菌落生长差异性显著分析
[0066][0067]
注:表中数据为平均值
±
标准误,不同大小写字母代表具有显著性差异p<0.05。
[0068]
表4出发菌株与51g诱变菌株在pda培养基上第3d的菌落生长差异性显著分析
[0069][0070]
注:表中数据为平均值
±
标准误,不同大小写字母代表具有显著性差异p<0.05。
[0071]
表5出发菌株与51个诱变菌株在pda培养基上第4d的菌落生长差异性显著分析
[0072][0073]
注:表中数据为平均值
±
标准误,不同大小写字母代表具有显著性差异p<0.05。
[0074]
表6出发菌株与51个诱变菌株第14d产孢量差异性显著分析
[0075][0076]
注:表中数据为平均值
±
标准误,不同大小写字母代表具有显著性差异p<0.05。
[0077]
表7出发菌株与51个诱变菌株对千金子离体叶片致病力测定
[0078][0079]
注:表中数据为平均值
±
标准误,不同大小写字母代表具有显著性差异p<0.05。
[0080]
表8出发菌株与51个诱变菌株对活体千金子的病情指数(室内测定)
[0081][0082]
注:表中数据为平均值
±
标准误,不同大小写字母代表具有显著性差异p<0.05。
[0083]
根据诱变之后菌株的4项指标:菌落直径、产孢量、离体叶片病斑大小、病情指数的综 合考量,筛选出性状最佳的菌株。对于上述4项指标,我们考虑相同的权重。因为各项指标 的分布存在差异并且不是均等(uniform)分布,我们计算各项指标的序数(即秩,rank)来 进行之后更多的分析。由于各项指标之间存在显著的相关性(correlation),我们采用主成分 分析(principal component analysis,pca)的方法来找到最大主成分,并且以此衡量菌株性 状的优劣。我们为菌株的4项指标的最大主成分排序并将序数一一映射(mapping)到(0,1) 分数区间,则此分数越靠近1的菌株性状越好。为了检查各次观测值与最终分数之间的敏感 性(sensitivity),我们用蒙特卡罗方法(monte carlo,mc,method)对各观测值在其生物 学合理的数值范围内进行扰动(perturbation)。检查菌株最终分数的稳定性,并产生95%置 信区间(95%ci)。
[0084]
实施例2嘴突凸脐蠕孢菌菌株y9511-x050的遗传稳定性
[0085]
将筛选出的嘴突凸脐蠕孢菌的突变菌株转接到斜面上,待突变菌生长3~4天后,将其再 转接到新鲜pda培养基上培养,以此作为第1代;重复以上步骤直到第10代,测定每一代 菌株的菌落生长直径(第4d)、产孢量(第14d)以及喷药后第7d对千金子的病情指数(表 9)。
[0086]
表9嘴突凸脐蠕孢y9511-x050的遗传稳定性
[0087][0088]
注:表中数据为平均值
±
标准误,不同大小写字母代表具有显著性差异p<0.05。
[0089]
如表9所示,嘴突凸脐蠕孢菌菌株y9511-x050经过10代传代培养后,每一代的菌落直 径长度稳定;分生孢子产量没有出现退化,基本保持稳定;对千金子有较好的抑制效果(方 法同实施例1病情指数调查),且病情指数没有出现退化的情况下。综上结果表明,诱变嘴 突凸脐蠕孢菌菌株y9511-x050具有很好的遗传稳定性。
[0090]
实施例3嘴突凸脐蠕孢菌菌株鉴定
[0091]
一、嘴突凸脐蠕孢菌菌株y9511-x050的形态特征
[0092]
(1)采用培养皿培养法,将菌株y9511和y9511-x050接种于pda培养基上,28℃培 养,待组织长出菌落后,进行单孢分离,挑取单菌落在pda培养基上纯化,用于分类鉴定。 挑取纯化好的菌株于有适量无菌水的载玻片上,在显微镜线观察菌株形态,以出发菌株y9511 作为对照,其孢子及菌丝形态如图2和图3所示,从图2a、图3a中可以看到,y9511菌丝体 灰褐色至黑褐色,不规则分枝,分生孢子为50-120
×
12-22μm,多隔膜,隔膜大多6-15个,顶 端屈膝状延伸,较中下部略粗,长喙状,两端钝圆且两端颜色较浅,脐点周围和顶端。从图2b、图3b中可以看到,与y9511不同的是,y9511-x050分生孢子为50-122
×
10-22μm,且菌 丝与分生孢子较原始菌株y9511颜色更深。
[0093]
(2)挑取纯化好的菌株于新的pda培养基上,28℃培养14天,观察菌丝落形态及菌落 颜色,如图4a、4b。嘴突凸脐蠕孢菌y9511和y9511-x050菌落圆形,铺展,有气生菌丝, 初期菌丝为白色后变为灰褐色至黑褐色,7d左右开始产孢,随时间的推移菌落中央孢子逐渐 增多直至向边缘扩散,菌落边缘依旧为灰褐色;菌落背面也是灰黑色。不同的是y9511的气 生菌丝较长,而y9511-x050的气生菌丝较短。
[0094]
二、嘴突凸脐蠕孢菌菌株y9511-x050的分子生物学鉴定
[0095]
(1)基因组dna的提取按sk8259(真菌)试剂盒操作。
[0096]
(2)pcr扩增
[0097]
pcr反应体系:
[0098]
试剂体积(μl)template(基因组dna 20~50ng/μl)0.5
10
×
buffer(with mg
2+
)2.5dntp(各2.5mm)1酶0.2its1或its1(10um)0.5its2或its2(10um)0.5加双蒸h2o至25
[0099]
pcr循环条件:
[0100][0101]
(3)使用引物
[0102]
its1:5
’-
agaagtcgtaacaaggtttccgtagg-3
’
;
[0103]
its2:5
’-
gctgcgttcttcatcgatgc-3
’
;
[0104]
以及
[0105]
brn1:5
’-
gccaacatcgcaaacatgg-3
’
;
[0106]
brn2:5
’-
gcaagcagcaccgtcaataccaat-3
’
。
[0107]
以菌株y9511和y9511-x050的基因组dna为模板,对其its、brn序列进行扩增,分 别扩增到长度为257bps,860bps和268bps,860bps,将菌株的扩增序列上传到ncbi网站进 行blast比对分析,结果表明菌株y9511-050的its和brn基因序列与嘴突凸脐蠕孢 (exserohilumrostratum)的同源性均为99.40%。通过对菌株y9511的分生孢子和菌丝形态观 察,以及分子鉴定结果,鉴定该菌株为嘴突凸脐蠕孢。我们将序列数据上传至genbank并获 得登录号:bankit 2272786(seq1mn587722)。
[0108]
将所述菌株命名为嘴突凸脐蠕孢y9511-x050,于2019年10月8日保藏于广东省广州市 先烈中路100号大院59号楼5楼的广东省微生物菌种保藏中心(简称gdmcc),保藏编号 为gdmcc no:60804。
[0109]
实施例4嘴突凸脐蠕孢菌菌株y9511-x050对水稻的安全性
[0110]
1、y9511-x050菌株孢子悬液制备
[0111]
将y9511-x050菌株接种到9cm的含有pda培养基的培养皿中,在28℃下培养14天,用 0.5
‰
(v/v)的吐温80水溶液从培养皿中洗下,再过四层纱布滤除菌丝得到孢子悬液,配制 孢子悬浮液的浓度为106孢子/ml。
[0112]
2、培养试验用水稻
[0113]
水稻品种为软华优6100(购于广东华农大种业有限公司),在28℃的恒温培养箱中
培育 到种子出苗,然后移栽至盆中,每盆移4株水稻,4次重复,置于室外生长。
[0114]
3、试验方法
[0115]
用上述配置的孢子悬浮液喷施水稻,同时用出发菌株和用未喷任何菌液仅用含吐温的水 (吐温水溶液的浓度为0.5
‰
(v/v))处理的水稻为对照(喷施量均为80ml/m2)。将处理 过的活体水稻保湿培养至少48h后,再移入温室中生长,每个处理4次重复。7d后分级并调 查发病情况,按处理后植株叶片病害程度的不同将病害分级赋值。
[0116]
水稻不同病害程度分级参照陈勇(2001)的分级标准,具体水稻病害分级标准如下:
[0117]
0级:水稻无病害,用ns表示;
[0118]
1级:水稻叶片有病斑但不超过整片叶的1/2,用hs表示;
[0119]
2级:水稻全叶枯死,用s表示。
[0120]
4、试验结果:
[0121]
通过上述试验,测定了菌株y9511和y9511-x050对于水稻的安全性,试验结果见表10 和图5,结果表明菌株y9511-x050和菌株y9511均不侵染水稻。试验表明诱变菌株 y9511-x050和菌株y9511运用于水田时,其寄主范围专一。
[0122]
表10高致病力诱变菌株对水稻的安全性(室内)测定
[0123][0124]
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制, 其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应 为等效的置换方式,都包含在本发明的保护范围之内。
[0125]
最后应当说明的是,以上实施例仅用以说明本发明的技术方案,而非对本发明保护范围 的限制,尽管参照较佳实施例对本发明作了详细地说明,本领域的普通技术人员应当理解, 可以对本发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的实质和范围。
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询

tips


 商标分类
商标分类  商标转让
商标转让 



