一种帕拉米韦杂质M及其制备方法和用途与流程
 2021-02-02 08:02:31|
2021-02-02 08:02:31| 51|
51| 起点商标网
起点商标网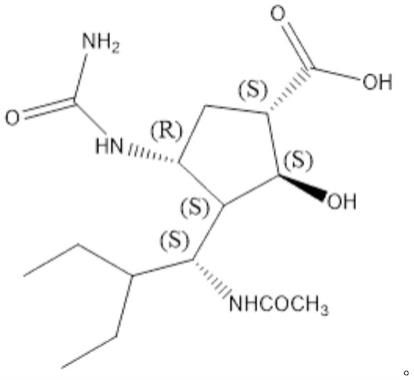
一种帕拉米韦杂质m及其制备方法和用途
技术领域
[0001]
本发明属于药物化学领域,具体地涉及一种帕拉米韦杂质m及其制备方法和用途。
背景技术:
[0002]
帕拉米韦,化学名称为:(1s,2s,3s,4r)-3-[(s)-1-乙酰氨基-2-乙基丁基]-4-胍基-2-羟基环戊烷-1-羧酸;是一种以流感病毒表面糖蛋白神经氨酸酶为作用靶点的神经氨酸酶抑制剂,是首款获批的作为单次静脉注射使用的神经氨酸酶抑制剂。帕拉米韦适用于年龄在18岁及以上患有急性无并发症流感并仅有两天流感症状的患者,现有临床试验数据证明其对甲型流感和乙型流感有效。
[0003]
根据国际公认的药品注册要符合人用药品注册技术国际协调会(ich) 及欧洲药典等的要求,其对药物中杂质需要进行严格控制,ich要求对原料药在合成,精制和储存过程中最有可能产生的实际存在的和潜在的杂质进行概述,如不对这些杂质进行严格控制,可能对人体产生严重的毒副作用。可见杂质的研究对药品质量和患者安全用药有着重要的意义。
[0004]
目前,已知的帕拉米韦的杂质包括杂质1-9:
[0005][0006]
通过对帕拉米韦的杂质研究过程中,发现了帕拉米韦杂质m,未见其他文献中有关该杂质的相关报道。
技术实现要素:
[0007]
本发明的目的,帕拉米韦杂质m是帕拉米韦制备过程中产生的杂质,同时,目前未有文献报道对该杂质进行研究和合成,通过控制该杂质在制备过程中的含量,有利于用药的安全性。
[0008]
本发明采用的技术方案为:一种帕拉米韦杂质m,其结构式如(i)式所示:
[0009][0010]
一种帕拉米韦杂质m的制备方法,包括如下步骤:
[0011]
a、帕拉米韦在碱性溶液中反应,搅拌,反应温度为10~100℃,反应时间为2-10h,得到反应液;
[0012]
b、将上述反应液用酸调ph=3~4,有固体析出,抽滤得到帕拉米韦杂质m;反应式如下:
[0013][0014]
优选的,所述碱性溶液为碱的水溶液,所述碱为氢氧化钠、氨水、碳酸钠、碳酸氢钠、磷酸氢二钠中的一种。
[0015]
优选的,所述碱性溶液为氢氧化钠水溶液,所述氢氧化钠水溶液的浓度为1~5mol/l。
[0016]
优选的,所述氢氧化钠水溶液的浓度为1mol/l。
[0017]
优选的,所述帕拉米韦与1mol/l氢氧化钠溶液的重量体积比为1:10~1:100,单位为kg:l。
[0018]
优选的,所述帕拉米韦与1mol/l氢氧化钠溶液的重量体积比为1:15,单位为kg:l。
[0019]
优选的,所述步骤b中调ph的酸为盐酸、硫酸、柠檬酸、酒石酸、磷酸、醋酸、甲酸等无机或有机酸水溶液。
[0020]
帕拉米韦杂质m的用途,帕拉米韦杂质m在帕拉米韦原料药或制剂的质量控制中作为对照品的用途。
[0021]
本发明获得的有益效果为:通过对帕拉米韦杂质的研究,本发明获得了一种全新
的帕拉米韦的杂质m,通过对其进行质谱测定,其相应分子量为329.40,纯度达到95.0%以上,可作为杂质研究的对照品用于帕拉米韦含量测定,可有效保障帕拉米韦的用药安全。
附图说明
[0022]
图1为本发明帕拉米韦杂质m的hplc谱图;
[0023]
图2为本发明帕拉米韦杂质m的质谱图;
[0024]
图3为本发明帕拉米韦杂质m的氢谱图。
具体实施方式
[0025]
下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。
[0026]
在本申请实施案例中,所用仪器型号如下:
[0027]
核磁共振仪:bruker-600mhz核磁共振仪(溶剂为d2o,tms为内标);质谱仪:岛津2020,离子化方式:esi(+)。
[0028]
hplc仪器:高效液相agilent 1260,dad检测器;条件:用十八烷基硅烷键合硅胶为固定相,以acn:水=70:30为流动相a;以50mmol/l磷酸氢二钾(ph=4.8)溶液为流动相b,进行梯度洗脱,流速1.0ml/min,检测波长210nm,色谱条件如表1:
[0029]
表1
[0030]
t(min)流动相a(%)流动相b(%)0100051000308515451000551000
[0031]
实施例1
[0032]
将5g帕拉米韦加入到1mol/l氢氧化钠溶液150ml,升温至70℃搅拌4h,停止搅拌,得到反应液;加1mol/l盐酸250ml调ph约3~4,有大量固体析出,抽滤得到帕拉米韦杂质m。(收率78.1%,hplc纯度:99.856%,见图1;[m+h]+ 峰330.47,见图2;hnmr见图3)。
[0033]
图3hnmr解析如下:1hnmr(500mhz,dmso)δ(ppm)0.829~ 0.858(m,1h,-ch),0.83~0.86(m,6h,-ch3),1.092~1.24or1.009~1.032 (m,2h,-ch2),1.24~1.30or0.90~1.04(m,2h,-ch2),1.88~1.92 (m,1h,-ch),2.22~2.27&1.46~1.52(m,2h,-ch2),2.45~ 2.47(m,1h,-ch),4.09~4.10(s,1h,-ch),3.83~3.84 (s,1h,-ch),4.14~4.17(s,1h,-ch)。
[0034]
图1的hplc图谱的具体情况如表2:
[0035]
表2
[0036]
名称出峰时间(min)面积含量(%)峰宽(sec)峰高n/a20.0670.0170.019nd0.081n/a20.6800.1130.1250.3500.462杂质m33.32090.26699.8560.416336.430
[0037]
实施例2
[0038]
将5g帕拉米韦加入到2mol/l氢氧化钠溶液150ml,升温至80℃搅拌6h,停止搅拌,得到反应液;加1mol/l盐酸400ml调ph约3~4,有大量固体析出,抽滤得到帕拉米韦杂质m。(收率70.1%,hplc纯度:94.8%)。
[0039]
以上所述,仅为本发明较佳的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本发明揭露的技术范围内,根据本发明的技术方案及其发明构思加以等同替换或改变,都应涵盖在本发明的保护范围之内。
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
相关标签: 药品
 热门咨询
热门咨询

tips


 商标分类
商标分类  商标转让
商标转让 


